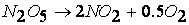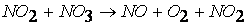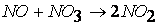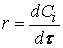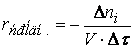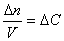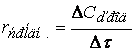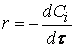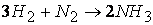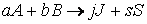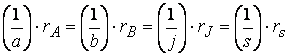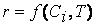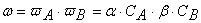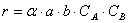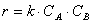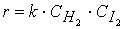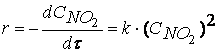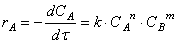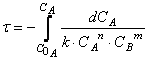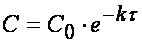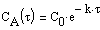Для чего нужен порядок реакции
ПОРЯДОК РЕАКЦИИ
Химические реакции редко протекают в одну стадию, как их принято записывать в учебниках химии. В обычной одностадийной записи уравнений химических реакций указывается только начальное и конечное состояние системы, что является, по существу символическим выражением материального баланса (закона сохранения вещества). В действительности реакция обычно протекает через ряд промежуточных стадий, причем скорость реакции определяется скоростью наиболее медленной стадии.
В тех случаях, когда реакция протекает в одну стадию (такая реакция называется элементарным химическим процессом), порядок реакции ni по данному веществу i совпадает со стехиометрическим коэффициентом данного вещества в химическом уравнении. Алгебраическая сумма показателей степеней n = n1 + n2 есть суммарный порядок реакции.
Общий порядок элементарной химической реакции равен сумме стехиометрических коэффициентов веществ, вступающих в реакцию, или, другими словами, числу молекул, участвующих в реакции.
Например, рассмотрим распад перекиси водорода, согласно уравнению реакции,
должен протекать как реакция второго порядка, на самом деле порядок этой реакции изменяется в зависимости от условий ее проведения и может быть первым или дробным. Последнее, таким образом, указывает на то, что реакция протекает через различные промежуточные стадии.
В применении к гетерогенным процессам различают истинный и кажущийся порядок реакции. Истинный порядок – порядок реакции относительно концентрации компонента участвующего на поверхности твердой фазы. Кажущийся порядок – порядок реакции зависит от соотношения между объемной и поверхностной концентрациями. Кинетическому уравнению с этой точки зрения отвечает кажущийся порядок. Величина наблюдаемого (кажущегося) на опыте порядка реакции может зависеть от условий эксперимента.
Например, если опыт проводится в избытке одного из компонентов, таким образом изменение его концентрации и влияние на скорость будет незаметным. Тогда nкаж = 0 по данному компоненту.
Порядок реакции
Порядок реакции указывает конкретную зависимость скорости реакции от концентрации реагентов. Он представляет собой постоянную, которую можно определить только экспериментально и может быть положительным или отрицательным, целым или дробным. Различают формальный и истинный порядок.
Истинный порядок или молекулярность реакции определяется числом молекул, принимающих участие в элементарном химическом взаимодействии. При этом число молекул образующихся веществ не имеет значения, так как молекулярность реакции определяется только числом молекул реагирующих веществ.
В зависимости от молекулярности, различают следующие типы реакций:
Мономолекулярные, в которых только один вид молекул претерпевает превращение, причем стехиометрический коэффициент в уравнении равен единице, например А ® В;
Бимолекулярные, в которых принимают участие два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент равен двум), например 2А ® В, или А + В ® С.
Реакции более высокой молекулярности не обнаружены.
Различают полный и частный порядки реакции. Показатель степени при концентрации вещества в уравнении скорости выражает частный порядок реакции по данному веществу. Сумма показателей степени при концентрациях определяет полный порядок реакции. Так, согласно закону действующих масс, в общем случае можно записать выражение для скорости реакции:
Формальный порядок или равен истинному (молекулярности) или в большинстве случаев меньше истинного порядка реакции. Причины расхождения между порядком реакции и ее молекулярностью могут быть различные. Во-первых, иногда, при условии большого избытка одного из реагирующих веществ по сравнению с другими, его концентрация остается практически неизменной в ходе реакции. В таком случае порядок реакции получается на единицу меньше, чем следовало бы ожидать по стехиометрическому уравнению. Во-вторых, часто реакция протекает по сложному механизму в несколько стадий, и общая скорость реакции определяется скоростью наиболее медленной стадии. Порядок в этом случае равен молекулярности самой медленной стадии реакции.
Формальный порядок зависит от условий протекания реакции. Меняя их, можно изменить формальный порядок (например, изменением концентрации или давления) и таким образом управлять ходом процесса.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Полезное
Смотреть что такое «ХИМИЧЕСКАЯ КИНЕТИКА И ХИМИЧЕСКОЕ РАВНОВЕСИЕ» в других словарях:
Химическое равновесие — Химическое равновесие состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая обратная реакция равны между собой. Для системы, находящейся в химическом… … Википедия
Химическая кинетика — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА — рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы… … Энциклопедия Кольера
Кинетика химическая — Химическая кинетика или кинетика химических реакций раздел химии, изучающий механизмы протекания химических реакций, порядок химической реакции, а также закономерности протекания химических реакций во времени. Содержание 1 Скорость химической… … Википедия
ХИМИЯ ФИЗИЧЕСКАЯ — раздел химии, в котором изучаются химические свойства веществ на основе физических свойств составляющих их атомов и молекул. Современная физическая химия широкая междисциплинарная область, граничащая с различными разделами физики, биофизики и… … Энциклопедия Кольера
ФИЗИЧЕСКАЯ ХИМИЯ — раздел химии, в котором изучаются химические свойства веществ на основе физических свойств составляющих их атомов и молекул. Современная физическая химия широкая междисциплинарная область, граничащая с различными разделами физики, биофизики и… … Энциклопедия Кольера
ТЕРМОДИНАМИКА — раздел прикладной физики или теоретической теплотехники, в котором исследуется превращение движения в теплоту и наоборот. В термодинамике рассматриваются не только вопросы распространения теплоты, но и физические и химические изменения, связанные … Энциклопедия Кольера
ХИМИЯ АНАЛИТИЧЕСКАЯ — наука о методах определения химического состава веществ. Химический анализ буквально пронизывает всю нашу жизнь. Его методами проводят скрупулезную проверку лекарственных препаратов. В сельском хозяйстве с его помощью определяют кислотность почв… … Энциклопедия Кольера
Коновалов, Дмитрий Петрович — В Википедии есть статьи о других людях с именем Коновалов, Дмитрий. Дмитрий Петрович Коновалов Дата рождения: 10 (22) марта 1856(1856 03 22) Место рождения … Википедия
Коновалов Дмитрий Петрович — Дмитрий Петрович Коновалов Дмитрий Петрович Коновалов (10 (22) марта 1856, село Ивановцы Екатеринославской губернии (ныне Днепропетровская область) 6 января 1929, Ленинград) выдающийся русский, советский химик, метролог, специалист в области… … Википедия
Д.Г.НАРЫШКИН
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Возможности компьютерной математики
при исследовании поведения химических систем во времени
МОСКОВСКИЙ ЭНЕРГЕТИЧЕСКИЙ ИНСТИТУТТУ)
ВВЕДЕНИЕ 3
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
1.1. Скорость реакции
1.2. Влияние концентрации на скорость реакции
1.3. Молекулярность и порядок реакции
1.4. Прямая и обратная задача химической кинетики
1.5. Реакция первого порядка
1.6. Реакции второго порядка
1.7. Реакции других порядков
1.8. Методы определения порядка реакции
2. Сложные реакции
2.1. Кинетика обратимых реакций
2.2 Параллельные реакции
2.3 Последовательные реакции
2.4 Метод квазистационарных концентраций
3. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
3.1.Уравнение Аррениуса
3.2. Связь энергии активации с тепловым эффектом реакции
3.3. Связь между скоростью реакции и равновесием
4. КИНЕТИКА ГЕТЕРОГЕННЫХ РЕАКЦИЙ
4.1. Общие понятия
4.2. Макрокинетика. Внешнедиффузионная область
4.3. Макрокинетика. Внутридиффузионное торможение
5. КИНЕТИКА РЕАКЦИЙ В ОТКРЫТЫХ СИСТЕМА
5.1. Химические реакторы.
5.2. Реакторы идеального смешения.
5.3. Реакторы идеального вытеснения.
5.4. Обратимые химические реакции в реакторах
в реакторах смешения и вытеснения.
7. Заключение
8. Рекомендуемая литература
ВВЕДЕНИЕ
Термодинамический метод изучения химических реакций позволяет сделать вывод о принципиальной возможности исследуемого процесса в тех или иных условиях и о глубине его протекания.
При постоянстве давления и температуры самопроизвольное протекание процесса возможно только в направлении уменьшения энергии Гиббса.
Условие 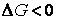
Это обстоятельство связано с тем, что 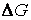
Однако химические реакции могут протекать с самыми различными скоростями – от взрывных до очень медленных, протекающих в течение многих месяцев и лет. Даже одна и та же реакция, протекающая на различных катализаторах, может иметь скорости, различающиеся во много раз.
В некоторых случаях необходимо увеличить скорость реакции, в других наоборот, уменьшить. Таких примеров можно привести множество.
Поэтому изучение скорости протекания химических процессов (а это и составляет задачу кинетики) чрезвычайно важно.
Для рационального проведения химических реакций необходимо уметь управлять ими, знать зависимости скорости от различных параметров.
По кинетике издано очень много учебной и методической литературы. Но все эти книги и учебные пособия написаны так, что хочется спросить: «Какое, милые, тысячелетье на дворе?»
Современные системы компьютерной математики позволяют дать быстрый, и что, пожалуй, главное, наглядный прогноз относительно поведения химической системы во времени.
Поэтому, отвечая на естественный вопрос – чем предлагаемое учебное пособие отличается от множества других, можно ответить: настоящее пособие имеет цель продемонстрировать эффективность применения математического пакета Mathcad для решения задач химической кинетики.
Специальные химические дисциплины, такие как термодинамика и кинетика, достаточно математизированы, и часто решение химической задачи вызывает у студентов значительные трудности, связанные с математикой – довольно часто это приводит к тому, что приходится сознательно упрощать задачу.
Пособие иллюстрирует богатейшие возможности, которые открывает применение компьютерной математики перед исследователем для анализа поведения химических систем во времени.
В этом отношении математические пакеты становятся практически незаменимыми элементами обучения, позволяющими сделать акцент на содержательном анализе полученных результатов.
Знаком >>>>>> в тексте пособия отмечен переход к Mathcad документу для интерактивного расчета.
1. ОБЩИЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКОЙ КИНЕТИКИ
1.1. Скорость реакции
Х имическая кинетика – наука о скоростях и закономерно-стях протекания химических процессов во времени.
Химическая кинетика изучает механизм протекания процесса, т.е. те промежуточные стадии, состоящие из элементарных актов, через которые система переходит из начального состояния в конечное.
Химическая кинетика изучает скорости этих стадий и факторы, влияющие на их скорость.
Уравнение химической реакции показывает начальное состояние системы (исходные вещества) и её конечное состояние (продукты реакции), но не отражает механизма процесса. Однако путь перехода системы из начального в конечное состояние может быть достаточно сложным и «извилистым».
Так, например, реакция
протекает по следующему механизму:
Изучить кинетику реакции – значит показать, как реально протекает исследуемая реакция, её механизм, получить зависимость, связывающую скорость реакции с факторами, влияющими на неё.
Различают два типа химических реакций: гомогенные и гетерогенные.
К гомогенным относят реакции, у которых и исходные вещества и продукты реакции находятся в одной фазе. Взаимодействие веществ в таких реакциях происходит по всему объёму.
К гетерогенным реакциям относят реакции, протекающие на границе раздела фаз.
Пусть протекает реакция
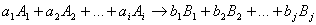
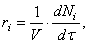
где V – объём реакционной зоны, Ni – количество i –го вещества.
Если реакция протекает изохорически, т.е. объём во время реакции не меняется, то, поскольку концентрация и объём связаны соотношением
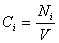
скорость реакции можно определить как изменение концентрации вещества во времени
Ранее мы определили скорость химической реакции как изменение числа молей реагирующих веществ в единицу времени в единице объема, т. е.
где 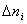
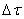
Таким образом определяется средняя скорость реакции для заданного интервала времени.
Если объем в процессе реакции постоянен, то
где 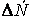
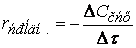
(скорость всегда положительна, а 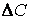
Если интервал времени 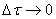
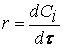
Размерность скорости: моль/(л·с).
Не только знак, но и абсолютное значение скорости зависит от того, по какому из участников реакции она измерена.
Так, например, при протекании реакции
скорость, с которой уменьшается концентрация водорода во время процесса, в три раза больше скорости убывания концентрации азота и в полтора раза выше скорости возрастания концентрации аммиака.
Следовательно, для реакции
скорости по компонентам реакции будут связаны соотношением:
Экспериментально установлено, что скорость реакции зависит от природы реагирующих веществ, их концентрации (или давления), температуры, т.е.
Раскрытие этой зависимости и составляет одну из задач кинетики.
1.2. Влияние концентрации на скорость реакции
Подход к выяснению зависимости скорости реакции от концентрации реагирующих веществ можно иллюстрировать следующим положением теории вероятностей: вероятность одновременного осуществления независимых событий равна произведению вероятностей каждого из них.
Для того чтобы произошло химическое взаимодействие, например, реакция
необходимо, но не достаточно, столкновение реагирующих молекул А и В, т.е. одновременное нахождение их в определённой точке реакционного пространства.
Вероятность ω нахождения молекулы для каждого из веществ прямо пропорциональна количеству молекул в единице объёма, т.е. его концентрации:
Тогда вероятность того, что обе молекулы будут одновременно находиться в одной точке пространства, т.е. что они столкнутся, равна
Численное значе ние k выражает скорость реакции, когда концентрации реагирующих веществ равны 1 моль/л.
Пусть протекает химическая реакция:
aA + bB + … → продукты.
Тогда зависимость скорости реакции от концентрации можно выразить соотношением
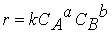
Полученное выражение называют законом действия масс.
1.3. Молекулярность и порядок реакции
Число молекул, вступающих в реакцию, определяют молекулярность реакции.
Так, если в реакцию вступает одна молекула, то такая реакция называется молекулярной реакцией. Если в реакции участвуют две молекулы (безразлично, одинаковые или нет), то такая реакция называется бимолекулярной. Встречаются также тримолекулярные реакции.
Реакции более высокой степени молекулярности крайне редки из–за малой вероятности одновременного столкновения большого числа молекул.
Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул.
Так, например, рассмотренная выше реакция
протекает по следующему механизму:
вторая стадия (медленная)
Определить такие стадии – значит определить механизм, или путь реакции.
Скорость всей реакции определяется скоростью её наиболее медленной стадии, которая и определяет механизм.
Поэтому закон действующих масс справедлив только для таких элементарных стадий.
Молекулярность реакции легко определить в случае простых реакций, протекающих в одну стадию. В большинстве же случаев довольно трудно найти молекулярность реакции.
Поэтому вводится понятие порядка реакции, который можно найти из кинетических уравнений, полученных экспериментально.
Порядок реакции по данному веществу равен степени, в которой концентрация данного вещества входит в уравнение скорости реакции.
Сумма показателей степеней, в которых концентрация всех исходных веществ входит уравнение скорости реакции, равна порядку реакции в целом. Порядок химической реакции по веществу совпадает со стехиометрическим коэффициентом реакции лишь в очень простых реакциях, например в реакции синтеза йодистого водорода:
Порядок этой реакции по водороду (первый) и йоду (первый) равны стехиометрическими коэффициентами, а общий порядок реакции (второй) равен сумме стехиометрических коэффициентов в уравнении скорости реакции
В подавляющем большинстве случаев порядок реакции по веществу отличается от стехиометрических коэффициентов уравнения реакции для этого вещества.
Соответственно общий порядок реакции обычно не равен сумме стехиометрических коэффициентов уравнения реакции.
при температурах, меньших 298К, протекает по следующему механизму:
первая стадия процесса: NO 2 + NO 2 ® NO 3 + NO
вторая стадия процесса: NO 3 + CO ® CO 2 + NO 2,
причем лимитирующей, т.е. скорость определяющей стадией является первая стадия процесса:
Тогда, согласно первому постулату химической кинетики, который утверждает, что скорость всей реакции равна скорости его самой медленной стадии, можно записать:
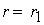
где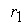
Согласно второму постулату химической кинетики, который утверждает, что скорость элементарной (одностадийной) реакции пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам, получим зависимость скорости реакции
от концентрации реагирующих веществ:
Обратите внимание, что скорость реакции
Уравнение, выражающее зависимость скорости реакции от концентрации каждого вещества, называют кинетическим уравнением реакции в дифференциальной форме.
К сожалению, кинетическое уравнение реакции может быть получено только при её экспериментальном изучении и не может быть выведено из стехиометрического уравнения.
1.4. Прямая и обратная задача химической кинетики
Определение на основании экспериментальных данных о зависимости концентраций от времени проведения процесса параметров кинетического уравнения – порядка реакции и значения константы скорости – составляет так называемую обратную задачу химической кинетики.
Знание кинетического уравнения реакции в дифференциальной форме позволяет определить время достижения некоторой заданной концентрации реагирующего вещества (или продукта реакции).
Пусть, например, протекает реакция
aA + bB + … → продукты,
кинетическое уравнение которой:
Тогда время достижения некоторой концентрации вещества А можно определить, интегрируя кинетическое уравнение реакции в дифференциальной форме:
Решая дифференциальное уравнение
можно получить зависимость концентрации реагирующего вещества (или продукта реакции) от времени проведения процесса – так называемых кинетических кривых.
Определение – на основании феноменологической модели процесса – концентраций реагентов от времени проведения реакции составляет прямую задачу химической кинетики.
Отметим сразу, что аналитически не всегда удаётся решить дифференциальное уравнение, особенно в случае сложной кинетики.
1.5. Реакция первого порядка
Реакция первого порядка может быть записана в общем виде:
Примером такой реакции может служить реакция разложения диметилового эфира:
Кинетическое уравнение реакции первого порядка можно представить дифференциальным уравнением
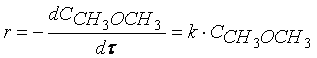
Тогда время t достижения некоторой концентрации диметилового эфира CH 3 OCH 3 можно определить, интегрируя соотношение (1.5):
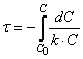
где С и C 0 – концентрация CH 3 OCH 3 в момент времени t и t =0.
Интегрирование приводит к выражению
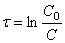


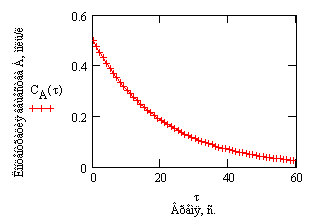
Из (1.7) следует, что концентрация исходного вещества со временем изменяется по экспоненциальному закону:
Проиллюстрируем изменение концентрации в зависимости от времени на примере реакции первого порядка
с начальной концентрацией 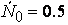


Рис.1. Зависимость концентрации
и, в логарифмических координатах, согласно зависимости