Далибра и хумира в чем разница
Далибра ® (Dalibra)
Владелец регистрационного удостоверения:
Лекарственная форма
Форма выпуска, упаковка и состав препарата Далибра ®
Раствор для п/к введения опалесцирующий, светло-коричневого цвета.
| 0.8 мл | |
| адалимумаб | 40 мг |
Фармакологическое действие
Повышенные концентрации ФНОα также обнаруживаются в псориатических бляшках. При бляшечном псориазе лечение адалимумабом может привести к уменьшению толщины бляшек и уменьшению инфильтрата в клетках воспаления. Взаимосвязь данного клинического эффекта адалимумаба с механизмом его действия не установлена. Адалимумаб модулирует также биологические ответные реакции, которые индуцируются или регулируются ФНОα, включая изменения содержания молекул адгезии, вызывающих миграцию лейкоцитов.
У больных ревматоидным артритом адалимумаб вызывает быстрое снижение концентраций острофазных показателей воспаления (С-реактивного белка и СОЭ) и сывороточных концентраций цитокинов (интерлейкин-6). Уменьшение содержания С-реактивного белка также наблюдалось у пациентов с ювенильным идиопатическим артритом или болезнью Крона. Кроме того, отмечается снижение сывороточной активности матриксных металлопротеиназ (ММП-1 и ММП-3), вызывающих ремоделирование тканей, которое лежит в основе разрушения хряща.
Фармакокинетика
Адалимумаб всасывается и распределяется медленно и достигает Cmax примерно через 5 дней. Абсолютная биодоступность при однократном п/к введении 40 мг адалимумаба составляет 64%.
У пациентов с болезнью Крона, которые получают адалимумаб в стартовой дозе 160 мг на 0 неделе и последующую дозу 80 мг на 2-й неделе, Cmax активного вещества достигается на 2-й и 4-й неделе и составляет примерно 12 мкг/мл.
Vd при однократном в/в введении составляет от 4.7 до 6 л, что указывает на практически одинаковое распределение адалимумаба в крови и во внесосудистых жидкостях.
Концентрация адалимумаба в синовиальной жидкости больных ревматоидным артритом составляет от 31 до 96% от сывороточной.
Css адалимумаба при п/к введении в дозе 40 мг 1 раз в 2 недели у больных ревматоидным артритом в конце интервала дозирования составляет около 5 мкг/мл (без одновременного приема метотрексата) и 8-9 мкг/мл (на фоне одновременного применения метотрексата). При увеличении дозы адалимумаба в интервале 20 мг, 40 мг и 80 мг 1 раз в 2 недели и 1 раз в неделю п/к отмечено почти линейное увеличение сывороточных концентраций адалимумаба в конце интервала дозирования.
При применении адалимумаба в дозе 40 мг при монотерапии 1 раз в 2 недели средняя Cmin адалимумаба у пациентов с псориазом составила 5 мкг/мл.
У пациентов с болезнью Крона Css составляет приблизительно 7 мкг/мл и наблюдается на 24-й и 56-й неделях поддерживающей терапии с применением адалимумаба в дозе 40 мг 1 раз в 2 недели.
Адалимумаб выводится медленно, клиренс обычно не превышает 12 мл/ч. T1/2 составляет, в среднем, 2 недели и варьирует от 10 до 20 дней.
Отмечена тенденция к возрастанию клиренса адалимумаба в зависимости от массы тела и наличия антител к адалимумабу.
Показания активных веществ препарата Далибра ®
Взрослые
Среднетяжелый и тяжелый активный ревматоидный артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами).
Активный анкилозирующий спондилит.
Тяжелый аксиальный спондилоартрит без рентгенологически подтвержденного анкилозирующего спондилита, но при наличии объективных признаков воспаления по повышенному уровню СРБ и/или данным МРТ, при отсутствии адекватного ответа на лечение НПВП или их непереносимости.
Активный псориатический артрит (в режиме монотерапии или в комбинации с метотрексатом или другими базисными противовоспалительными препаратами).
Хронический бляшечный псориаз (среднетяжелой и тяжелой степени), псориаз ногтей, когда показана системная терапия.
Активный гнойный гидраденит (acne inversa) средней или тяжелой степени тяжести у взрослых пациентов при отсутствии адекватного ответа на стандартную системную терапию.
Болезнь Крона (среднетяжелой или тяжелой степени): при неадекватном ответе на традиционную терапию, а также непереносимости или противопоказаниях к традиционной терапии; при неэффективности (или снижении эффективности) или непереносимости инфликсимаба.
Язвенный колит среднетяжелой и тяжелой степени при неадекватном ответе на традиционную терапию, включая кортикостероиды и/или 6-меркаптопурин или азатиоприн, а также при непереносимости или противопоказаниях к традиционной терапии.
Неинфекционный увеит (промежуточный, задний и панувеит) у взрослых при неадекватном ответе на терапию ГКС, в ситуациях, когда необходимо ограничение дозы или отмена ГКС, а также, когда терапия ГКС противопоказана.
Болезнь Бехчета (интестинальная форма) у пациентов при отсутствии адекватного ответа на стандартную терапию.
Дети
Ювенильный идиопатический артрит у пациентов от 2 лет в режиме монотерапии или в комбинации с метотрексатом.
Активный энтезит-ассоциированный артрит у пациентов в возрасте от 6 лет и старше при отсутствии адекватного ответа на терапию стандартными препаратами или их непереносимости.
Хронический бляшечный псориаз (тяжелой степени) у детей с 4 лет при неадекватном ответе на местную терапию или фототерапию, а также у пациентов, которым местная терапия и фототерапия противопоказаны.
Болезнь Крона (среднетяжелой или тяжелой степени) у пациентов от 6 лет и старше при неадекватном ответе на традиционную терапию (включая полное энтеральное питание и ГКС и/или иммуносупрессоры), а также непереносимости или противопоказаниях к традиционной терапии.
Неинфекционный передний увеит у детей от 2 лет при неадекватном ответе на стандартную терапию или когда стандартная терапия не подходит таким пациентам.
Активный гнойный гидраденит (acne inversa) средней или тяжелой степени тяжести у детей от 12 лет при отсутствии адекватного ответа на стандартную системную терапию.
Язвенный колит среднетяжелой и тяжелой степени у детей от 5 лет при неадекватном ответе на традиционную терапию, включая кортикостероиды и/или 6-меркаптопурин или азатиоприн, а также при непереносимости или противопоказаниях к традиционной терапии.
Режим дозирования
Разовая доза для детей в зависимости от массы тела и показаний составляет 20-80 мг. Схема лечения также зависит от показаний.
Побочное действие
Противопоказания к применению
Повышенная чувствительность к адалимумабу.
Детский возраст до 18 лет (кроме пациентов от 2 лет с ювенильным идиопатическим артритом, пациентов от 6 лет с болезнью Крона (среднетяжелой или тяжелой степени), пациентов от 6 лет с активным энтезит-ассоциированным артритом, пациентов от 4 лет с хроническим бляшечным псориазом, пациентов от 12 лет с активным гнойным гидраденитом, пациентов от 2 лет с неинфекционным передним увеитом, пациентов от 5 лет с язвенным колитом среднетяжелой и тяжелой степени).
Инфекционные заболевания, в т.ч. туберкулез.
Совместный прием с антагонистами ФНО или другими генноинженерными биологическими противоревматическими препаратами (например, анакинра и абатацепт).
Сердечная недостаточность средней тяжести или тяжелой степени III-IV ФК по классификации NYHA).
Рецидивирующие инфекции в анамнезе; носительство вируса гепатита В; злокачественные новообразования, в т.ч. в анамнезе; сердечная недостаточность легкой степени тяжести (I-II ФК по классификации NYHA); демиелинизирующие заболевания нервной системы, в т.ч. в анамнезе; пациенты старше 65 лет.
Применение при беременности и кормлении грудью
Применение адалимумаба во время беременности может повлиять на иммунный ответ у новорожденных. Применять адалимумаб во время беременности следует только при очевидной необходимости.
Адалимумаб может проникать через плаценту в сыворотку крови новорожденных детей от женщин, которые получали препарат во время беременности. Следовательно, у этих детей может быть повышен риск развития инфекции. Младенцам, которые подвергались воздействию адалимумаба внутриутробно, не рекомендуется введение живых вакцин в течение 5 месяцев после последней инъекции адалимумаба у матери во время беременности.
Пользу грудного вскармливания для развития и здоровья ребенка следует рассматривать с учетом клинической необходимости лечения адалимумабом у матери и вероятности развития побочных эффектов вследствие воздействия адалимумаба на ребенка, находящегося на грудном вскармливании, или по причине сопутствующего заболевания матери.
Применение у детей
Противопоказание: детский возраст до 18 лет (кроме пациентов от 2 лет с ювенильным идиопатическим артритом, пациентов от 6 лет с болезнью Крона (среднетяжелой или тяжелой степени), пациентов от 6 лет с активным энтезит-ассоциированным артритом, пациентов от 4 лет с хроническим бляшечным псориазом, пациентов от 12 лет с активным гнойным гидраденитом, пациентов от 2 лет с неинфекционным передним увеитом, пациентов от 5 лет с язвенным колитом среднетяжелой и тяжелой степени).
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста старше 65 лет. Коррекция дозы не требуется.
Особые указания
С осторожностью применять при рецидивирующих инфекциях в анамнезе, носительстве вируса гепатита В, злокачественных новообразованиях (в т.ч. в анамнезе), при сердечной недостаточности, демиелинизирующих заболеваниях нервной системы (в т.ч. в анамнезе), пациентам старше 65 лет.
До начала терапии адалимумабом все пациенты должны быть обследованы на предмет как активной, так и на неактивной (латентной) туберкулезной инфекции. Если диагностирован активный туберкулез, нельзя начинать терапию адалимумабом. В том случае, если диагностирован латентный туберкулез, следует проводить противотуберкулезную профилактику до начала лечения адалимумабом. Противотуберкулезная терапия до начала лечения адалимумабом также должна назначаться тем пациентам, которые были подвержены факторам риска туберкулеза, даже при отрицательной туберкулиновой пробе. Решение о проведении противотуберкулезной терапии у таких пациентов должно приниматься только с учетом риска, как скрытой туберкулезной инфекции, так и риска проведения противотуберкулезной терапии. Лечение назначается фтизиатром.
Пациенты должны быть тщательно обследованы по поводу инфекционных заболеваний до, во время и после лечения адалимумабом.
Применение адалимумаба не следует начинать у пациентов с активными инфекционными заболеваниями, включающими хронические или очаговые инфекции, до купирования инфекции. У пациентов, посещавших места с эндемичными микозами, такими как гистоплазмоз, кокцидиоидомикоз или бластомикоз, риск и целесообразность терапии адалимумабом следует оценивать до начала терапии.
Пациенты, у которых развилось инфекционное заболевание во время лечения адалимумабом, должны быть выявлены и полностью обследованы. Применение адалимумаба должно быть приостановлено, если у пациента развивается серьезное инфекционное осложнение или сепсис, при этом соответствующая антибактериальная и противогрибковая терапия должна проводиться до излечения инфекционного заболевания.
Применение антагонистов ФНО связано с риском реактивации вируса гепатита В (ВГВ) у пациентов, которые являются хроническими носителями этого вируса. У пациентов, у которых развивается реактивация ВГВ, применение адалимумаба следует приостановить, и должна быть начата эффективная противовирусная терапия с соответствующим поддерживающим лечением.
Все пациенты, и в особенности пациенты, ранее получавшие продолжительную терапию иммунодепрессантами или ПУВА-терапию псориаза, должны обследоваться на наличие не связанного с меланомой рака кожи, который развился до или во время лечения адалимумабом.
Если возникает анафилактическая реакция или другие серьезные аллергические реакции, следует немедленно прекратить введение адалимумаба и назначить соответствующую противоаллергическую терапию.
При подтвержденных значительных гематологических нарушениях лечение адалимумабом следует приостановить.
Пациентам с ювенильным артритом рекомендуется по возможности пройти полную вакцинацию в соответствии с текущим календарем профилактических прививок до начала терапии адалимумабом. Пациенты, принимающие адалимумаб, могут получать сопутствующую вакцинацию, за исключением живых вакцин.
Лечение адалимумабом может приводить к формированию аутоиммунных антител. Влияние длительного лечения на развитие аутоиммунных заболеваний не изучено. Если у пациента развиваются симптомы, предполагающие волчаночноподобный синдром в результате лечения адалимумабом, следует прекратить применение адалимумаба.
Частота возникновения серьезных инфекций среди пациентов старше 65 лет, получавших адалимумаб, была выше, чем у пациентов моложе 65 лет. 12% от общего числа пациентов, принимавших адалимумаб, было старше 65 лет и приблизительно 2.5% было старше 75. Адалимумаб следует применять с осторожностью у пациентов пожилого возраста в связи с высокой вероятностью возникновения инфекционных заболеваний.
Использование в педиатрии
Эффективность и безопасность применения адалимумаба доказана только для лечения идиопатического ювенильного артрита у детей и подростков в возрасте от 4 лет до 17 лет и болезни Крона (среднетяжелой или тяжелой степени) у пациентов в возрасте от 6 лет и старше.
Лекарственное взаимодействие
Образование антител было ниже при одновременном применении адалимумаба с метотрексатом по сравнению с монотерапией. Введение адалимумаба без метотрексата приводило к повышению образования антител, ускорению клиренса и снижению эффективности адалимумаба.
Противопоказано применять адалимумаб в комбинации с анакинрой, с абатацептом.
Что лучше: Хумира или Далибра
Хумира
Далибра
Исходя из данных исследований, Хумира лучше, чем Далибра. Поэтому мы советуем выбрать его.
Активные вещества одинаковые. Поэтому выбирайте исходя из цены
Сравнение эффективности Хумиры и Далибры
У Хумиры эффективность больше Далибры – это означает, что способность лекарственного вещества оказывать максимально возможное действие разное.
Например, если терапевтический эффект у Хумиры более выраженный, то у Далибры даже в больших дозах добиться данного эффекта невозможно.
Также скорость терапии – показатель быстроты терапевтического действия у Хумиры и Далибры тоже разное, как и биодоступность – количество лекарственного вещества, доходящее до места его действия в организме. Чем выше биодоступность, тем меньше его потерь будет при усвоении и использовании организмом.
Сравнение безопасности Хумиры и Далибры
Безопасность препарата включает множество факторов.
При этом у Хумиры она выше, чем у Далибры. Важно, где метаболизируется препарат: лекарственные вещества выделяются из организма либо в неизмененном виде, либо в виде продуктов их биохимических превращений. Метаболизм протекает спонтанно, но чаще всего задействует основные органы, такие как печень, почки, лёгкие, кожу, мозг и другие. При оценивании метаболизма у Хумиры, также как и у Далибры мы смотрим, какой орган является метаболизирующим и наколько критично действие на него.
Соотношение риска к пользе – это когда назначение лекарственного препарата нежелательно, но оправдано при определенных условиях и обстоятельствах, с обязательным соблюдением осторожности применения. При этом у Хумиры рисков при применении меньше, чем у Далибры.
Также при рассчете безопасности учитывается проявляются ли только аллергические реакции или же возможная дисфункция основных органов. В прочем как и обратимость последствий от использования Хумиры и Далибры.
Сравнение противопоказаний Хумиры и Далибры
Исходя из инструкции. Количество противопоказаний у Хумиры достаточно схоже с Далиброй и составляет малое количество. Это и перечень симптомов с синдромами, и заболевания, различные внешних и внутренние условия, при которых применение Хумиры и Далибры может быть нежелательным или недопустимым.
Сравнение привыкания у Хумиры и Далибры
Как и безопасность, привыкание тоже включает множество факторов, которые необходимо учитывать при оценивании препарат.
Так совокупность значения таких параметров, как «cиндром отмены» и «развитие резистентности», у Хумиры достаточно схоже со аналогичными значения у Далибры. Синдром отмены – это патологическое состояние, возникающее после прекращения поступления в организм веществ, вызывающих привыкание или зависимость. А под резистентностью понимают изначальную невосприимчивость к препарату, этим она отличается от привыкания, когда невосприимчивость к препарату развивается в течение определенного периода времени. Наличие резистентности можно констатировать лишь в том случае, если была сделана попытка увеличить дозу препарата до максимально возможной. При этом у Хумиры значения «синдрома отмены» и «резистентности» достотачно малое, впрочем также как и у Далибры.
Сравнение побочек Хумиры и Далибры
Побочки или нежелательные явления – это любое неблагоприятное с медицинской точки зрения событие, возникшее у субъекта, после введения препарата.
У Хумиры состояния нежелательных явлений почти такое же, как и у Далибры. У них у обоих количество побочных эффектов малое. Это подразумевает, что частота их проявления низкая, то есть показатель сколько случаев проявления нежелательного эффекта от лечения возможно и зарегистрировано – низкий. Нежелательное влияние на организм, сила влияния и токсическое действие у Хумиры схоже с Далиброй: как быстро организм восстановиться после приема и восстановиться ли вообще.
Сравнение удобства применения Хумиры и Далибры
Это и подбор дозы с учетом различных условий, и кратность приемов. При этом важно не забывать и про форму выпуска препарата, ее тоже важно учитывать при составлении оценки.
Удобство применения у Хумиры примерно одинаковое с Далиброй. При этом они не являются достаточно удобными для применения.
Рейтинг препаратов составлен опытными фармацевтами, изучающий международные исследования. Отчет сгенерирован автоматически.
Дата последнего обновления: 2021-02-25 11:13:00
Биоаналоги в лечении ревматических болезней: pro et contra
Генно-инженерные биологические препараты (ГИБП) в настоящее время достаточно широко применяются для лечения многих ревматических болезней, в том числе ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, системных васкулитов и др. Чаще всего их используют в качестве препаратов второй линии в случае неэффективности или плохой переносимости стандартных базисных противовоспалительных препаратов. Основным препятствием к более частому назначению ГИБП является их высокая стоимость, которая приводит к увеличению затрат на лечение и экономического бремени для системы здравоохранения. Частичным решением этой проблемы является создание экономически более привлекательных биоаналогов ГИБП, которое стало возможным после завершения срока патентов на некоторые оригинальные препараты. Однако следует учитывать, что ГИБП, в отличие от синтетических лекарственных средств (“малых молекул”), характеризуются сложным и многоэтапным процессом производства, что определяет строгие требования к их разработке и регистрации. Чтобы гарантировать не менее высокую эффективность и безопасность биоподобных препаратов по сравнению с оригинальными, потенциальные биоаналоги следует тщательно изучать не только в доклинических, но и рандомизированных контролируемых клинических исследованиях. Сбор данных о безопасности и эффективности биоаналога необходимо продолжать и после его регистрации и внедрения в клиническую практику. В статье обсуждаются результаты клинических исследований российских биоаналогов ритуксимаба, инфликсимаба и адалимумаба, которые были одобрены для применения при ревматических заболеваниях.
Генно-инженерные биологические препараты (ГИБП) применяются в ревматологии на протяжении двух десятилетий. За это время список их значительно пополнился и продолжает расширяться (ингибиторы фактора некроза опухоли [ФНО]-α, В-лимфоцитов, рецепторов интерлейкина-6, костимуляции Т-лимфоцитов, интерлей кинов-12/23, интерлейкина-17, интерлейкина-1), как и показания к применению. Последние сегодня включают не только ревматоидный артрит, но и многие другие ревматические заболевания, в том числе редкие. К настоящему времени у некоторых ГИБП закончился срок патентной защиты, в связи с чем начался процесс регистрации их аналогов. На сегодняшний день в Российской Федерации для лечения ревматических заболеваний были одобрены биоаналоги инфликсимаба (инфликсимаб, BIOCAD, Россия, и Фламмэгис, Celltrion Pharm, Республика Корея), ритуксимаба (Ацеллбия, BIOCAD, Россия) и адалимумаба (Далибра, BIOCAD, Россия.)
Современные принципы разработки биоаналогов
Появление более дешевых биоаналогов приводит к снижению затрат для системы здравоохранения, в том числе за счет падения цен на оригинальные ГИБП, что позволяет охватить лечением большее число пациентов. Например, в одном исследовании было показано, что появление биоаналогов на американском рынке в течение ближайшего десятилетия позволит сократить расходы бюджета более чем на 44 млрд долларов при условии, что стоимость биоподобных препаратов будет на 35% ниже оригинальных ГИБП [1]. Однако очевидно, что сокращение затрат не должно происходить в ущерб эффективности и безопасности лечения ГИБП. В связи с этим в литературе последних лет активно обсуждаются требования к процессу регистрации биоаналогов, в частности необходимость в проведении рандомизированных клинических исследований для подтверждения их сопоставимых эффективности и безопасности по сравнению с оригинальным ГИБП 4. Если подобные исследования не проводились, то препарат предлагается считать “предполагаемой копией» (intended copy) референтного ГИБП, а не биоаналогом.
ГИБП, применяющиеся для лечения ревматических заболеваний, представляют собой сложные белковые молекулы (моноклональные антитела, циркулирующие рецепторы, гибридные молекулы), которые производятся с помощью генно-инженерного метода и, в отличие от низкомолекулярных препаратов, не являются точными копиями оригинальных веществ. Это связано с тем, что даже незначительные изменения процесса производства белковых молекул могут привести к изменению их биологической активности и/или иммуногенности и, соответственно, безопасности и эффективности [3]. Свойства белков могут зависеть и от трудно воспроизводимых посттрансляционных изменений, таких как гликозилирование, окисление, метилирование и/или деаминирование [5].
В последние годы Всемирная организация здравоохранения (ВОЗ) и регуляторные органы Европейского Союза и США предложили определения биоаналогов. Например, ВОЗ считает таковыми биотерапевтические препараты, которые по качеству, безопасности и эффективности подобны зарегистрированным референтным препаратам [6]. В определении Европейского агентства по лекарствам (ЕМА) и сходном определении Евразийской экономической комиссии указано, что подобие биоаналога референтному препарату по параметрам качества, биологической активности, безопасности и эффективности должно быть подтверждено при всестороннем исследовании сопоставимости [7,8]. В определении Американского управления по контролю качества пищевых продуктов и лекарств (FDA) отмечается возможность незначительных различий в клинически неактивных компонентах между биоаналогом и зарегистрированным в США оригинальным ГИБП при отсутствии клинически значимых различий по безопасности, чистоте и активности [9].
Сегодня большинство экспертов сходятся во мнении, что регистрация биоаналога должна производиться на основании результатов не только доклинических, но и клинических исследований 3 фазы, предполагающих прямое сравнение потенциального биоаналога с оригинальным ГИБП (рис. 1) [2,5]. Таким образом, фактически программа разработки биоаналога в значительной степени соответствует таковой оригинального препарата за исключением отсутствия необходимости в проведении исследований 2 фазы, предполагающих изучение режимов введения и выбор оптимальных доз препарата. Регуляторные органы Европы и США, а также Евразийская экономическая комиссия считают целесообразным придерживаться пошагового подхода при изучении биоаналогов 8. При этом объем и характер доклинических и клинических исследований зависят от результатов, полученных на предыдущем этапе. Следует отметить, что необходимо учитывать все полученные данные, а не отдавать предпочтение тому или иному аспекту. Цель любых исследований – выявление потенциальных различий между биоаналогом и оригинальным ГИБП и установление клинического значения различий, если, конечно, таковые будут обнаружены [2].
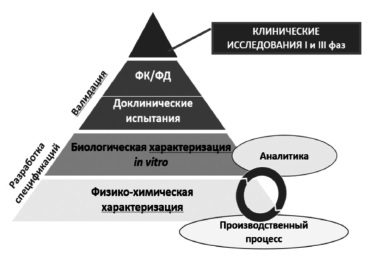
В доклинических исследованиях изучают аминокислотную последовательность, физико-химические свойства, показатели качества белков, подтверждают сопоставимость серий биоаналога и оригинального ГИБП по различным характеристикам, таким как наличие заряженных изоформ, гликозилирование и другие посттрансляционные изменения, составу примесей [8]. Ключевое значение имеет сравнение функциональных свойств ГИБП, таких как связывание моноклональных антител с антигеном-мишенью или Fc-рецепторами, антителозависимая клеточная и комплементзависимая цитотоксичность, активация комплемента [8]. Методы анализа должны быть достаточно чувствительными для выявления различий зависимости активности от концентрации между биоподобным и референтным препаратами. Это означает, что в доклинических исследованиях важно не просто показать наличие у белка определенного свойства, а доказать, что по соответствующему показателю он не отличается от оригинального ГИБП, т.е. является биоподобным.
Такая же цель преследуется в клинических исследованиях, в которых изучают фармакокинетическую и фармакодинамическую эквивалентность биоаналога и оригинального ГИБП (границы сопоставимости по первичным параметрам обычно составляют 80-125%) и подтверждают их сопоставимые клиническую эффективность и безопасность.
Как указано выше, необходимым этапом разработки биоаналога является подтверждение его сопоставимости с оригинальным ГИБП в рандомизированном контролируемом исследовании 3 фазы, которое следует проводить в наиболее “чувствительной» выборке пациентов [2]. Такие исследования должны быть достаточно продолжительными, чтобы изучить сохранение достигнутого ответа в отдаленные сроки и безопасность и иммуногенность более длительной терапии. Одно вре менно сопоставление результатов лечения в более ранние сроки, например, через 8-12 недель, позволяет сравнить скорость действия препаратов сравнения [10]. Выбор критериев эффективности в сравнительных клинических исследованиях должен быть научно обоснованным. При оценке эффективности необходимо свести к минимуму роль факторов, которые зависят от пациента и заболевания.
Любые белки обладают иммуногенностью, т.е. могут вызывать образование антител, в том числе нейтрализующих, которые нивелируют эффективность лечения ГИБП. По иммуногенности биоаналоги могут гипотетически отличаться от оригинальных препаратов, особенно если в процессе их производства используются иные экспрессирующие конструкции, которые могут привести к модификации свойств биологического препарата [8]. Соответственно, при проведении сравнительного клинического исследования необходимо определять общую частоту образования антител и частоту образования как связывающих, так и особенно нейтрализующих антител, а также их влияние на эффективность ГИБП. Изучение иммуногенности более информативно у пациентов, которым ранее не проводилась терапия ГИБП [11]. В идеале они также не должны получать сопутствующую терапию иммуносупрессивными препаратами. Необходимо учитывать, что иммуногенность ГИБП может зависеть от дозы ГИБП, генетических факторов, особенностей заболевания [2]. Например, в сравнительных клинических исследованиях оригинального инфликсимаба и его биоаналога частота антител к инфликсимабу у пациентов с ревматоидным артритом, получавших инфликсимаб в дозе 3 мг/кг и метотрексат, была выше, чем у больных анкилозирующим спондилитом, которым проводили терапию одним инфликсимабом в дозе 5 мг/кг [12,13].
Экстраполяция показаний к применению биоаналого
Нужно ли подтверждать биоподобие биоаналога и референтного препарата по каждому показанию к применению? Некоторые специалисты считают необходимым проводить рандомизированные клинические исследования по каждому зарегистрированному показанию [14,15]. Однако подобная практика представляется чрезмерной. По мнению группы экспертов, если на этапе доклинических исследований доказана эквивалентность качественных и функциональных характеристик, а в рандомизированном клиническом исследовании подтверждена сопоставимость клинической эффективности и безопасности биоаналога оригинальному препарату по крайней мере по одному показанию, то полученные данные могут быть экстраполированы на другие показания, по которым биоаналог не изучался [2]. Данная практика правомочна в отношении тех показаний, при которых механизм действия одинаков. Так, многие ГИБП в ревматологии применяются по различным показаниям, например, ингибиторы ФНО-α используют для лечения ревматоидного артрита, анкилозирующего спондилита, псориатического артрита, а также псориаза и воспалительных заболеваний кишечника. Cпециально изучать фармакокинетические свойства или клиническую эффективность биоаналогов ингибиторов ФНО-α у пациентов со всеми заболеваниями, которые служат показаниями к их применению, не имеет особого смысла, учитывая однотипную роль ФНО-α в иммуновоспалительном процессе [2]. Однако некоторые ГИБП, например, ритуксимаб, используются у пациентов не только с ревматическими, но и онкологическими заболеваниями, что может потребовать проведения отдельных фармакокинетических исследований, учитывая потенциальные различия мишень-опосредованного клиренса.
В настоящее время экстраполяция показаний для биоаналогов стала общемировой практикой, которая позволяет производителю не только сократить затраты на клинические исследования и обеспечить препарату более привлекательную стоимость, но и быстрее внедрить его в клиническую практику.
Переключение пациентов с оригинального препарата на биоаналог
Применение биоаналогов в качестве первого ГИБП получает все большее распространение, так как подобная практика увеличивает доступность современных методов лечения для пациентов и ограничивает рост затрат системы здравоохранения. Однако для практикующего специалиста остро стоит вопрос о возможности переключения пациентов с оригинальных ГИБП на биоаналоги. Этот вопрос изучался в клинических исследованиях 18 и затрагивается в последних международных рекомендациях по ревматоидному артриту [20] и анкилозирующему спондилиту [21]. В клинической практике можно встретить следующие ситуации, связанные с переключениями между референтным препаратом и его биоаналогом.
Российская практика разработки и применения биоаналогов
С 2017 г. в Российской Федерации по ревматическим показаниям зарегистрировано 3 биоаналога ГИБП российского производства: ритуксимаб (Ацеллбия, BIOCAD), инфликсимаб (Инфликсимаб, BIOCAD) и адалимумаб (Далибра, BIOCAD). Разработка и полный цикл локального производства российских биоаналогов позволили выпустить на рынок препараты высокого качества по более конкурентной цене. Ниже мы приводим краткий обзор клинических исследований данных биоподобных препаратов.
Через 24 недели после начала лечения частота улучшения по критериям ACR20 в группе пациентов, получавших биоаналог ритуксимаба, составила 84,1% (95% доверительный интервал [ДИ] 74,8–90,5), а в группе сравнения – 87,0% (95% ДИ 77,7–92,8). Разница между группами была недостоверной (р=0,773) [23]. На втором этапе исследования, когда изучались результаты переключения пациентов, ранее получавших лечение референтным препаратом, на биоаналог, и наоборот, не было отмечено изменений эффективности, безопасности и иммуногенности терапии.
В Российской Федерации зарегистрированные показания к применению референтного ритуксимаба и его биоаналога в ревматологии включают в себя не только ревматоидный артрит, но и АНЦА-ассоциированные васкулиты – гранулематоз с полиангиитом и микроскопический полиангиит. Регистрационное исследование препарата Ацеллбия у пациентов с АНЦА-ассоциированными васкулитами не проводилось, т.е. это показание было зарегистрировано на основании опыта изучения оригинального ГИБП и принципа экстраполяции. Следует отметить, что эффективность и безопасность Ацеллбии были показаны в ретроспективном исследовании у 42 больных АНЦА-ассоциированным васкулитом, выполненном на базе Клиники им. Е.М. Тареева (Москва) [25].
Биоаналог инфликсимаба (Инфликсимаб). Российский биоаналог Инфликсимаб (BCD-055) был зарегистрирован в Российской Федерации на основании результатов двух клинических исследований 3 фазы: ASART-2 (анкилозирующий спондилит) и LIRA (ревматоидный артрит). Биоаналог сравнивали с референтным препаратом Ремикейд® (“МСД Фармасьютикалс»).
В международное многоцентровое, рандомизированное, двойное слепое клиническое исследование ASART2 были включены 199 пациентов с анкилозирующим спондилитом, которых рандомизировали на две группы в соотношении 2:1. Им назначали BCD-055 или Ремикейд в дозе 5 мг/кг в режиме 0–2–6-я неделя, затем каждую 8-ю неделю. Результаты оценивали через 14, 30 и 54 недель у всех рандомизированных пациентов, получивших хотя бы одну дозу инфликсимаба (выборка intent-to-treat; ITT), и через 54 недели у пациентов, завершивших участие в исследовании согласно протоколу (выборка per protocol; РР). Частота ответа по критериям ASAS20 и ASAS40 через 14, 30 и 54 недели была сопоставимой в группах сравнения (р>0,05) [26]. Через 54 недели доля пациентов, достигших ответа по критериям ASAS20 при лечении BCD-055 и Реми кей дом, в выборке ITT составила 67,4% и 52,2%, соответственно (р=0,053), а в выборке РР – 80,9% и 68,6% (р=0,128). Частота ответа по критериям ASAS40 в двух группах составила, соответственно, 53,0% и 38,8% в выборке ITT (р=0,081) и 63,6% и 50,9% в выборке РР (р=0,177) [26].
В многоцентровом исследовании LIRA у 426 пациентов с активным ревматоидным артритом, рандомизированных на две группы в соотношении 2:1 (BCD-055 и Ремикейд), биоаналог инфликсимаба не отличался от референтного ГИБП по частоте ответа по критериям ACR20/50/70 и частоте ремиссии по критерию ACR/ EULAR [27].
Биоаналог адалимумаба (Далибра®). В 2019 году был зарегистрирован российский биоаналог адалимумаба (Далибра®). Регистрационное исследование 3 фазы проводилось у 346 пациентов со средне-тяжелым и тяжелым псориазом, которые были рандомизированы на две группы в соотношении 1:1. В этом исследовании была установлена эквивалентность исследуемого препарата BCD-057 (Далибра®, BIOCAD) оригинальному адалимумабу (Хумира®, Веттер Фарма-Фертигунг Гмбх и Ко.КГ, Германия) по эффективности, безопасности, фармакокинетике и иммуногенности. Также продемонстрировано отсутствие негативного влияния на описанные параметры переключения с оригинального препарата на биоаналог [28]. Весь спектр показаний к применению оригинального препарата был экстраполирован на биоаналог.
Заключение
Выход на рынок биоаналогов и их внедрение в клиническую практику позволяет существенно снизить затраты системы здравоохранения и обеспечить большее число пациентов эффективной терапией. Как правило, в течение 2-3 лет после выхода на рынок биоаналогов наблюдаются следующие тенденции: (1) снижение рыночной стоимости соответствующих МНН; (2) повышение доступности терапии для пациентов без дополнительной нагрузки на государственный бюджет; (3) замещение оригинальных препаратов в государственных закупках биоаналогами. В связи с увеличением частоты использования биоаналогов перед регуляторами встает вопрос о возможной взаимозаменяемости оригинальных препаратов и их копий. В Европейском союзе полномочия по решению этого вопроса переданы на национальный уровень. В настоящее время принято считать, что переключение с референтного препарата на его биоаналог является безопасным и эффективным. Более того, нет оснований предполагать другой кли нический исход при переключении между двумя биоаналогами. Обоснованность данного подхода подтверждается анализом опыта реальной клинической практики и национальных регистров.



