Деконтаминационная терапия что это
СЕЛЕКТИВНАЯ ДЕКОНТАМИНАЦИЯ
Селективная деконтаминация (англ. decontamination, обеззараживание, от лат. приставки de- извлечение, уничтожение + contaminatio смешение, слияние) — избирательная элиминация из желудочно-кишечного тракта человека аэробных бактерий (грамотрицательных палочек и грамположительных кокков) и грибков антимикробными препаратами с целью повышения резистентности организма к инфекции. При Селективной деконтаминации анаэробная микрофлора желудочно-кишечного тракта не повреждается.
Селективную деконтаминацию проводят при заболеваниях с иммунодефицитным состоянием (см. Иммунологическая недостаточность) при повышенном риске аутоинфекции, при угрозе развития сепсиса в случаях обширных травм, ожогов, цитотоксической и имммунодепрессивной терапии, трансплантации органов и тканей. При различных заболеваниях с тяжелой грану-лоцитопенией или панцитопенией С. д. резко сокращает частоту инфекционных осложнений. Метод эффективен и при других заболеваниях, сопровождающихся понижением резистентности организма, а также при лекарственной аллергии, нек-рых формах остеомиелита, хроническом фурункулезе и др. Селективная деконтаминация является новым эффективным методом профилактики внутрибольничных инфекций (см.) и борьбы с ними.
До появления метода С. д. применяли тотальную деконтаминацию — по возможности полное освобождение организма хозяина от всей микрофлоры. Первоначально оба метода были разработаны в гното-биологических лабораториях.
Деконтаминированных, практически «безмикробных» пациентов помещают в изолятор гнотобиологического типа для защиты от экзогенной микрофлоры (см. Палата стерильная). После окончания лечения восстанавливают нормальную микрофлору кишечника путем «заселения» его соответствующими видами бактерий, что достигается, напр., назначением бифидумбактерина (см.).
Нормальная микрофлора кишечника (см.) в основном состоит из бесспоровых облигатных анаэробов родов Bacteroides, Bifidobacterium, Eubacterium, Lactobacillus и др. Они обитают как на поверхности слизистой оболочки в результате адгезии к эпителиоцитам, так и в просвете кишечника, препятствуя его заселению (колонизации) условно-патогенными и патогенными микроорганизмами. Вместе с тем в составе нормальной микрофлоры кишечника имеются аэробные микроорганизмы (см. Аэробы), бурному размножению к-рых препятствуют облигатные анаэробы (см.). Данная экологическая закономерность, обусловленная конкурентными, антагонистическими и другими особенностями анаэробов кишечника, получила название колонизационной резистентности. Этот механизм защиты от экзо- и эндогенной инфекции нарушается при нерациональной анти-биотикотерапии. Широкое применение антибиотиков на протяжении ряда лет сопровождается изменением этиологической структуры внутрибольничных инфекций. Участились инф. осложнения, вызванные грамотрицательными аэробными бактериями родов Pseudomonas, Klebsiella, Proteus, Escherichia, Providencia, Serratia и др.
При лечении различных заболеваний некоторыми антибиотиками широкого спектра действия происходят значительные изменения видового состава нормальной микрофлоры кишечника, вплоть до исчезновения облигатных анаэробов, создающих колонизационную резистентность. В зависимости от влияния на колонизационную резистентность антимикробные лечебные препараты делятся на три группы: сильно подавляющие колонизационную резистентность (тетрациклин, природные и полусинтетические пенициллины, хлорамфеникол, фуразолидон); умеренно действующие на колонизационную резистентность при применении в больших дозах (напр., рифампицин); препараты, не действующие на колонизационную резистентность даже при назначении в высоких дозах (цефалоспорины, невиграмон, котримоксазол, гентамицин, полимиксин, амфотерицин В, нистатин, леворин). Для Селективной деконтаминации применяют препараты, не действующие на колонизационную резистентность.
До выбора схемы антибиотикотерапии и в процессе. лечения важно знать уровень колонизационной резистентности больного. На лабораторных животных (см.) колонизационную резистентность определяют путем заражения per os различными дозами условно-патогенных, патогенных, антибиотикоустойчивых штаммов бактерий. Однако для клин, использования наиболее приемлем экспрессный биохимический метод (высоковольтный электрофорез на бумаге с последующей окраской нингидрином), примененный У эллингом (G. W. Welling, 1979). Он основан на идентификации бета-аспартил-глицина в водном экстракте испражнений. Это вещество образуется в кишечнике из белков с аспарагин-глициновой последовательностью аминокислот и не расщепляется обычными протеазами. У здоровых людей и животных бета-аспартил-глицин не обнаруживается в фекалиях, т. к. разрушается бета-аспартил-пептидазой облигатных анаэробных бактерий. При снижении количества облигатных анаэробных бактерий или полном их уничтожении антибиотиками в фекалиях появляется бета-аспартил-глицин.
Деконтаминационная терапия что это
Цирроз печени представляет собой одну из наиболее сложных и нерешенных проблем современной гастроэнтерологии. В экономически развитых странах цирроз печени (ЦП) входит в число шести основных причин смерти в возрасте 35-60 лет и составляет от 14 до 30 случаев на 100000 населения.
Основными причинами смерти больных ЦП являются осложнения портальной гипертензии (ПГ). Современные клинические и экспериментальные исследования подтверждают важную роль нарушений состава интестинальной микрофлоры в патогенезе таких осложнений ПГ, как печеночная энцефалопатия, гепаторенальный синдром, спонтанный бактериальный перитонит [8]. Бактериальные инфекции, особенно с включением интестинальной флоры, являются частыми осложнениями и могут иметь тяжелые клинические последствия у больных ЦП [6].
В некоторых исследованиях было показано, что функциональное состояние и морфологические изменения слизистой оболочки кишечника у больных ЦП с ПГ являются потенциальным фактором риска для развития транслокации кишечных бактерий во внутреннюю среду [9]. Учитывая роль нарушений нормального состава кишечных бактерий в патогенезе осложнений ЦП, терапия, направленная на восстановление кишечной микрофлоры, является патогенетически обоснованной.
Цель исследования
Изучить роль нарушений кишечной микрофлоры в патогенезе функциональных расстройств кишечника у пациентов ЦП с наличием портальной гипертензионной колонопатии (ПГК).
Задачи исследования
1. Изучить частоту выявления синдрома избыточного бактериального роста в тонкой кишке и нарушений состава толстокишечной микрофлоры с наличием условно-патогенных бактерий у больных ЦП с ПГК.
2. Определить роль нарушений состава кишечной микрофлоры в формировании клинических проявлений, обусловленных функциональными кишечными расстройствами, у пациентов ЦП с ПГК.
3. Оценить эффективность терапии, включающей невсасывающийся антибиотик рифаксимин с последующим назначением пробиотика бифиформ, на нормализацию кишечной микрофлоры и купирование симптомов кишечной диспепсии у больных ЦП с ПГК.
Материалы и методы исследования
После одобрения локальным этическим комитетом протокола в исследование было включено 74 больных вирусным циррозом печени с наличием портальной гипертензионной колонопатии (54 мужчин и 20 женщин, средний возраст 56,5 лет).
Критерии включения больных в исследование: 1) наличие ЦП с портальной гипертензионной колонопатией, подтвержденной эндоскопическими и/или морфологическими методами исследования; 2) информированное согласие больного на участие в исследовании.
Критерии исключения больных из исследования: 1) ЦП токсического генеза (алкогольный, лекарственный и др.), а также ЦП с отсутствием ПГК; 2) наличие сопутствующих воспалительных заболеваний кишечника, дивертикулярной болезни, заболеваний поджелудочной железы с внешнесекреторной недостаточностью; 3) выявление опухолевых процессов любой локализации; 4) тяжелое состояние больного, не позволяющее проведение эндоскопического и морфологического исследований слизистой оболочки желудочно-кишечного тракта (ЖКТ).
Диагноз ЦП устанавливался на основании данных анамнеза, результатов физикального и лабораторно-инструментального и в ряде случаев гистологического исследования биоптатов печени. Вирусная этиология ЦП была доказана исследованиями маркеров вирусов гепатита В, С, D.
Наличие ПГ подтверждалось результатами компьютерной томографии, ультразвукового и эндоскопического исследования органов брюшной полости.
Всем больным, включенным в исследование, проводилось эндоскопическое исследование пищевода, желудка, двенадцатиперстной кишки и толстого кишечника, что позволило получить информацию о состоянии этих органов у больных ЦП с наличием портальной гипертензии [3].
При колоноскопии основное внимание уделялось оценке состояния СО с выявлением эндоскопических признаков ПГК. По аналогии с предложенными T.T. Mc Cormack критериями диагностики портальной гипертензионой гастропатии диагноз ПГК ставился на основании наличия при эндоскопическом исследовании множественных эритематозных участков на желтоватом или белесоватом фоне (мозаичность слизистой оболочки кишки), мелкоточечной гиперемии («скарлатиноподобные» изменения) вишнево-красных или темно-коричневых пятен, а также сосудистых эктазий [11].
У всех пациентов при КФС была взята биопсия из правых отделов толстой кишки и сигмовидной кишки с целью проведения морфологического и морфометрического исследований СО. При этом отличительным морфологическим признаком ПГК считалось наличие эктазии сосудов в сочетании с увеличением толщины их стенок.
Для диагностики избыточного бактериального роста (ИБР) в тонкой кишке использовался водородный дыхательный тест с лактулозой.
Все пациенты получали симптоматическое и патогенетическое лечение цирроза печени. В дополнение к базисной терапии пациентам с наличием нарушений кишечной микрофлоры проводилась деконтаминационная терапия, включающая рифаксимин 1200 мг/сутки в течение 7 дней с последующим назначением курса пробиотиков (бифиформ по 2 капсулы 2 раза в день) в течение 2 недель. При этом наблюдаемым пациентам не назначались препараты, влияющие на моторную функцию и висцеральную чувствительность кишки.
Результаты собственных исследований
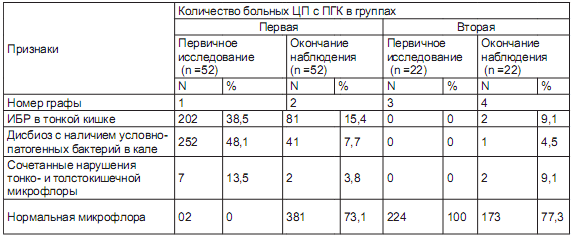
Динамика дисбиотических нарушений в кишечнике у исследуемых пациентов в процессе наблюдения представлена в таблице.
Характеристика кишечной микрофлоры у больных ЦП с наличием ПГК при первичном исследовании и по окончании наблюдения
К окончанию наблюдения нормальный состав кишечной микрофлоры был выявлен у 38 (73,1%) первой и у 17 (77,3%) второй группы. У 5 (22,7%) пациентов второй группы отмечено развитие дисбиотических нарушений. Так, ИБР в тонкой кишке, нарушение состава толстокишечной микрофлоры с выделением условно-патогенных штаммов бактерий и сочетание дисбиоза тонкой и толстой кишки были выявлены соответственно у 8 (15,4%), 4 (7,7%) и 2 (3,8%) больных первой и у 2 (9,1%), 1 (4,5 %) и у 2 (9,1 %) второй группы.
Результаты, полученные при сравнительном анализе состава кишечной микрофлоры и частоты выявления симптомов, связанных с нарушением функций кишечника, у больных ЦП при первичном исследовании и по окончании наблюдения свидетельствуют о том, что при первичном исследовании клинические проявления, связанные с нарушением функций кишечника, имели место у всех пациентов первой и у 22,7% второй группы, при этом преобладали СРК подобные нарушения, которые были обнаружены у 71,2% и у 18,2% больных первой и второй группы соответственно.
У пациентов второй группы к окончанию наблюдения увеличилось количество больных как с кишечным дисбактериозом, так и с наличием клинических проявлений, связанных с нарушением функции кишечника. Так, если при первичном исследовании клинические симптомы отсутствовали у 77,3% пациентов, то к окончанию наблюдения их количество составило 45,5%. Таким образом, у большинства больных ЦП с наличием ПГК после проведения курса антибактериальной терапии с последующим назначением пробиотика наряду с нормализацией кишечной микрофлоры наблюдалась существенная положительная динамика клинических проявлений кишечной диспепсии.
Обсуждение полученных результатов
В связи с тем, что у большинства наблюдаемых больных ЦП с ПГК имели место клинические проявления, характерные для функциональных нарушений толстой кишки, в нашей работе особое внимание было отведено изучению роли нарушений микробиоценоза кишечника в их формировании.
Полученные нами данные свидетельствуют, что СРК-подобные нарушения, абдоминальный болевой синдром, метеоризм в разных соотношениях выявлены у всех пациентов с нарушением состава кишечной микрофлоры, тогда как у больных с нормальной микрофлорой данные симптомы встречались значительно реже. Полученные нами данные о преобладании в первой группе исследуемых больных ЦП синдромов кишечной диспепсии могут свидетельствовать о связи последних с наличием нарушений кишечной микрофлоры. Результаты наших исследований совпадают с данными, опубликованными в последние годы, в которых приводятся убедительные доказательства роли нарушений нормального состава кишечной микрофлоры и ее взаимоотношений с СО кишечника в механизмах формирования клинических проявлений синдрома раздраженной кишки [12].
Учитывая важную роль дисбиоза кишечника не только в патогенезе диспепсических симптомов, но и осложнений ЦП [4], нами исследована эффективность терапии, направленной на нормализацию кишечной микрофлоры, которая включала недельный прием невсасывающегося антибактериального препарата рифаксимина с последующим назначением пробиотика бифиформ в течение 2 недель.
В литературе имеются доказательства успешного использования рифаксимина с целью нормализации микробного биоценоза в кишечнике, что приводит к положительной динамике симптомов СРК [1]. Полученные нами результаты свидетельствуют о том, что вышеуказаная терапия способствует элиминации дисбиотических нарушений у большинства (73%) пациентов, а также купированию клинических симптомов, связанных с нарушением функции кишечника в 78,9% случаев. Результаты наших исследований подтверждаются литературными данными об эффективности терапии, направленной на нормализацию кишечной микрофлоры у больных ЦП в купировании симптомов кишечной диспепсии и профилактике осложнений ЦП [10]. Следовательно, проведение у больных ЦП с наличием ПГК терапии, направленной на нормализацию состава кишечных бактерий, является патогенетически обоснованным.
Выводы
2. У большинства больных ЦП с нарушениями кишечной микрофлоры выявлялись СРК-подобные нарушения, что свидетельствует о роли дисбиоза кишечника в формировании симптомов кишечной диспепсии у данных пациентов.
3. Комплексная терапия с применением антибактериального препарата рифаксимина с последующим назначением пробиотика бифиформа оказалась эффективной в восстановлении кишечной микрофлоры у 73 % и купировании клинических проявлений, связанных с нарушением функций кишечника у 78,9 % больных ЦП с наличием ПГК, что подтверждает наличие патогенетической связи между нарушением состава кишечных бактерий и формированием синдрома кишечной диспепсии у данных пациентов.
Некоторые аспекты диагностики и лечения избыточной бактериальной контаминации тонкой кишки в клинической практике
Рассмотрены методы диагностики и лечения синдрома избыточного бактериального роста. Для восстановления нормального микробного пейзажа кишечника применяются пребиотики и пробиотики, в том числеметаболитные пробиотики.
The methods of diagnostics and treating the syndrome of excess bacterial increase are considered. For restoring the normal bacterial picture of intestine prebiotics and probiotics are used, including metabolic probiotics.
В желудочно-кишечном тракте (ЖКТ) человека в норме «проживают» от 300 до 500 различных видов бактерий. Микробный пейзаж проксимальных и дистальных отделов тонкой кишки значительно различается. Так, если в верхних отделах тонкой кишки количество микроорганизмов составляет примерно 10 2 колониеобразующих единиц/мл (КОЕ/мл), то ближе к толстой кишке их уже насчитывается 10 9 КОЕ/мл. Кроме того, в проксимальных отделах тонкой кишки наиболее распространенными являются грамположительные аэробные виды бактерий, в то время как грамотрицательные анаэробные бактерии чаще локализуются в дистальных отделах. У здоровых людей нормальная микрофлора кишечника поддерживается следующими основными физиологическими механизмами: уровень рН в желудке, активность секреторной функции поджелудочной железы и холерез, моторика тонкой кишки и структурная целостность ЖКТ. Нарушение любого из этих защитных механизмов может привести к развитию синдрома избыточного бактериального роста в тонкой кишке (СИБР) [1].
К наиболее важным этиологическим факторам СИБР относятся следующие [2]:
Кроме того, негативное влияние на микробный пейзаж кишечника оказывают различные диеты для похудения и «чистки» с применением объемных клизм, особенно гидроколонотерапия, которая имеет определенную популярность, но настойчиво не рекомендуется гастроэнтерологами всего мира, так как грубо нарушает микробные биотопы.
При СИБР не только увеличивается количество микроорганизмов, но и меняется спектр микрофлоры — происходит его сдвиг в сторону грамотрицательных бактерий и анаэробов. У 30% здоровых людей тощая кишка в норме почти стерильна, у остальных — имеет низкую плотность заселения бактериями, которая увеличивается по мере приближения к ободочной кишке и только в дистальном отделе подвздошной кишки обнаруживается микрофлора фекального типа: энтеробактерии, стрептококки, анаэробы рода бактероидов и др. [3].
Симптомы СИБР (метеоризм, вздутие живота, абдоминальная боль или дискомфорт, диарея, утомляемость, слабость, похудание) не характеризуются специфичностью, они отражают степень распространенности воспаления слизистой оболочки кишки, «наслаиваются» на проявления основного заболевания, являющегося причиной развития СИБР. Более тяжелые симптомы, включая мальабсорбцию, дефицит нутриентов и расстройство метаболизма костной ткани, указывают на осложнения СИБР. Неспецифичность этих симптомов часто бывает причиной диагностических ошибок и требует дифференциального диагноза с синдромом раздраженной кишки, непереносимостью лактозы или фруктозы.
Для характеристики СИБР необходимо не только определение абсолютного количества бактерий, но и их видовое типирование, которое определяет проявление признаков и симптомов заболевания. Если преобладает избыточный рост бактерий, метаболизирующих желчные соли в неконъюгированные или нерастворимые соединения, то развивается клиническая картина мальабсорбции жира или диарея, вызванная желчными кислотами. Деконъюгированные желчные кислоты могут оказывать токсический повреждающий эффект на энтероциты, что нарушает не только ассимиляцию жиров, но и углеводов и белков. При избыточном росте бактерий, которые преимущественно метаболизируют углеводы в короткоцепочечные жирные кислоты и газ, в клинической картине преобладают вздутия живота без диареи, поскольку образующиеся продукты метаболизма могут абсорбироваться.
Верификацию избыточного бактериального роста в тонкой кишке проводят с помощью прямого и непрямых методов диагностики данного синдрома. «Золотым стандартом» диагностики СИБР является посев микрофлоры, для этого необходима аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду. Однако избыточный бактериальный рост может затрагивать наиболее дистальные участки тонкого кишечника, находящиеся вне пределов досягаемости инструментария [4].
Посев кала, использующийся в нашей стране как метод оценки микробного биоценоза кишечника, в случае СИБР малоинформативен, так как даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление о микробном составе лишь 12–15 типируемых видов бактерий дистального отдела толстой кишки [5]. К тому же, если учесть, что основная нормофлора кишечника — анаэробы, а пациент собирает и несет свои фекалии до бактериологической лаборатории в присутствии обычного воздуха, в состав которого входит кислород, то большая часть этих бактерий погибает, зато очень быстро размножается патогенная аэробная флора. Что вырастет при посеве такого содержимого? Остается только гадать, но этот посев вряд ли будет иметь отношение даже к микробному пейзажу прямой кишки. Исследования кала информативны для поиска инфекционных возбудителей или глистной инвазии, но не для диагностики СИБР.
Помимо посева микрофлоры тонкой кишки, для установления избыточного бактериального роста применимы другие методы, основанные на изучении концентрации индикана, продуцируемого индолположительными микроорганизмами, фенола и паракрезола, являющихся метаболитами аэробных (в меньшей степени) и анаэробных (в большей степени) микроорганизмов, а также способ диагностики состояния микробиоценоза различных биотопов, в том числе кишечника, основанный на определении короткоцепочечных (монокарбоновых) жирных кислот (КЦЖК), являющихся метаболитами в основном анаэробных родов микроорганизмов, методом газожидкостного хроматографического анализа [6].
К непрямым методам диагностики СИБР относятся тесты, основанные на изучении метаболитов микрофлоры. Это 14 С- или 13 С-гликохолатный, 14 С-D- или 13 C-D-ксилозный дыхательные тесты, для выполнения которых необходимы изотопы и специализированная лаборатория, а также водородные дыхательные тесты с лактулозой, глюкозой, лактозой и другими сахарами.
Альтернативным методом являются водородные дыхательные тесты, наиболее часто применяемые для диагностики СИБР. Это простые, информативные и неинвазивные методы, которые были разработаны около 25 лет назад для диагностики различных заболеваний пищеварительного канала, в первую очередь для определения мальабсорбции углеводов и избыточного бактериального роста в тонкой кишке. В настоящее время во всем мире данный диагностический метод быстро внедряется в клиническую практику. Некоторые методологические аспекты отдельных водородных тестов все еще не стандартизированы, поэтому изучение эффективности существующих и разработка и/или усовершенствование новых тестов во всем мире продолжается [7].
В 2008 г. был принят Римский консенсус по водородным тестам, в котором изложены рекомендации международных экспертов для клинической практики относительно показаний и методов проведения водородных дыхательных тестов при заболеваниях пищеварительного канала [8]. Метод дешев, прост, однако многие практикующие врачи не только не знают основных положений консенсуса, но и до сих пор вообще не знакомы с этим тестом, не знают его диагностических возможностей, определенных ограничений и недостатков [9].
Водородный тест применяется для ориентировочного представления о степени бактериального обсеменения тонкой кишки. Этот показатель находится в прямой зависимости от концентрации водорода в выдыхаемом воздухе натощак. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 м. д. При бактериальном обсеменении тонкой кишки «пик» нарастания концентрации водорода в выдыхаемом воздухе появляется гораздо раньше. Данный тест характеризуется следующими преимуществами:
При помощи водородных дыхательных тестов можно диагностировать широкий спектр нарушений работы ЖКТ:
Лактулоза является искусственным синтетическим дисахаридом, состоящим из фруктозы и галактозы. В организме человека не существует фермента, способного разложить ее на моносахариды. Концентрация водорода в выдыхаемом воздухе при водородном дыхательном тесте с лактулозой может соответствовать разным типам графиков:
Тест с лактулозой является наиболее распространенным неинвазивным тестом для определения времени кишечного транзита различных углеводов. После базового выдоха обследуемым предлагается выпить раствор лактулозы в небольшом (50–150 мл) количестве воды: детям до 6 мес — 3,34 г (5 мл), детям старше 6 мес — 6,68 г (10 мл), взрослым — 10 г (15 мл). Непосредственную регистрацию измерений производит обученная медсестра, заключение дает гастроэнтеролог, клиническую оценку и лечение проводит врач, направивший пациента на обследование. Диагностическим считается повышение концентрации водорода свыше 15 м. д. Ранний пик концентрации Н2 говорит о синдроме избыточного бактериального роста, задержка роста концентрации Н2 указывает на удлинение времени кишечного транзита. Проводится тест в течение 2,5–4 часов, пациент делает выдохи в трубку прибора или специальный, герметически закрывающийся пакет определенного объема, через каждые 15–30 минут, в зависимости от фазы исследования. Для точности теста необходимо, чтобы продукция водорода из неабсорбированного углевода тестовой пищи бактериями толстой кишки приводила к четко различимому повышению водородного сигнала в выдыхаемом воздухе. На основании результатов исследований целесообразно воздерживаться от приема пищи в ночь перед обследованием. Кроме того, изменять выделение водорода с выдыхаемым воздухом может курение, поэтому пациентам запрещается курить до и во время прохождения теста [12].
Мы имеем пятилетний опыт работы с дыхательными водородными тестами с использованием в практике прибора Gastrolyzer 2. В данной статье приводятся несколько интересных клинических примеров из нашей практики. Всем пациентам кроме дыхательных водородных тестов с лактулозой назначались стандартные обследования: кроме общеклинических методов, комплекс методик на выявление целиакии, исследование кала на антиген лямблий, копрограмму, фекальную эластазу-1, компьютерную колоноскопию или ирригоскопию, фиброколоноскопию (по показаниям), психологическое тестирование, кроме того, каждый пациент заполнял опросник Irritable Bowel Syndrom Quality of Life (IBS-QoL), предназначенный для оценки качества жизни пациентов, страдающих синдромом раздраженного кишечника (СРК) [13].
Пациент А., возраст 60 лет. Жалобы на постоянный кашицеобразный стул частотой до 5–6 раз в день в течение двух лет, периодические боли в животе, вздутие живота, флатуленцию, непереносимость ряда продуктов, похудание на 17 кг за два года, ухудшение самочувствия в последние 3 месяца, необходимость соблюдать строгую диету, включающую рисовую кашу на воде, сухари, крепкий чай и т. п. Обследовался и лечился у инфекциониста с некоторым улучшением, которое не было длительным. По результатам стандартных обследований установлена железодефицитная анемия легкой степени тяжести, снижение показателей магния и кальция в крови. По данным дыхательного водородного теста диагностирована выраженная бактериальная контаминация тонкой кишки (рис. 1, № 1). Назначено лечение — антибиотики, затем курс пребиотиков и пробиотиков, поливитаминов. Через месяц на приеме пациент отмечал значительное улучшение самочувствия, прибавку в весе 5 кг, нормализацию стула. Через 6 месяцев результаты анализов крови и дыхательный водородный тест показали отсутствие патологии (рис. 2, № 1).
Пациентка У., возраст 72 года. Жалобы на тошноту, горечь во рту по утрам, чередование запоров и поносов, периодические боли в животе натощак и через некоторое время после приема пищи, вздутие живота. Похудела на 15 кг за последние 3 года, соблюдает строгую диету с исключением жирной, жареной и молочной пищи и т. п. По результатам исследования выявлены амилорея и стеаторея по копрограме, содержание фекальной эластазы-1 — 50 мкг/г кала, выраженная гипомоторная дисфункция желчного пузыря. Данные дыхательного водородного теста в норме (рис. 1, № 2). Назначена схема лечения хронического панкреатита и билиарной недостаточности с хорошим клиническим эффектом в динамике.
Пациентка А., возраст 42 года. Жалобы на чередование запоров и поносов, нервозность, слабость, повышенную утомляемость. Неоднократно лечилась по поводу «дисбактериоза» без эффекта. Стандартные исследования без патологии. По данным дыхательного теста (рис. 1, № 3) можно предположить снижение скорости транзита по тонкой кишке, снижение уровня нормофлоры в толстой кишке. По данным психологического тестирования — соматоформное тревожное расстройство в рамках СРК, средней степени тяжести. Назначено лечение психотропными препаратами, пребиотиками и пробиотиками. В динамике через 6 месяцев отмечено прекращение жалоб и нормализация показателей дыхательного водородного теста (рис. 2, № 3).
Пациент Р., возраст 64 года. Диагноз — цирроз печени вирусной этиологии в исходе гепатита С, класс В по классификации Чайлда–Пью. Жалобы на выраженный метеоризм, жидкий стул, боли в животе, которые усиливаются после приема лактулозы, входящей в схему лечения. Дыхательный водородный тест показал выраженную бактериальную контаминацию тонкой кишки (рис. 1, № 4). В таких ситуациях данный тест может использоваться для мониторирования СИБР с целью назначения антибактериальной терапии. В динамике после курса антибиотикотерапии отмечена значительная положительная динамика, но рекомендован повторный курс с заменой препарата (рис. 2, № 4).
Пациент Н., возраст 32 года. Жалобы на постоянные ноющие боли в животе, усиливающиеся при стрессе или после приема определенных продуктов, периодический кашицеобразный стул частотой до 2–4 раз в сутки, вздутие живота, утомляемость, нервозность, ангедонию. В результате стандартных исследований патологии не выявлено. В течение нескольких лет посещает гастроэнтерологов, хирургов, назначенное лечение «дисбактериоза» малоэффективно, вес стабилен. По результатам дыхательного теста выявлен СИБР (рис. 1, № 5). По психологическим опросникам выявлено соматоформное депрессивное расстройство в рамках СРК, ассоциированного с СИБР, тяжелой степени. Назначено лечение антибиотиками, пребиотиками, пробиотиками, антидепрессантами. После курса лечения СИБР у пациента клинически отмечено улучшение (рис. 2, № 5), но болевой синдром до конца не купирован, пациент продолжает прием антидепрессантов.
Водородные дыхательные тесты на сегодняшний день рассматривают как информативные методы диагностики определенных физиологических и патологических процессов, таких как мальабсорбция углеводов (лактоза, фруктоза, сорбитол), СИБР, а также определение времени ороцекального транзита. Ввиду неинвазивности и относительной дешевизны во многих случаях они являются диагностическими тестами первой линии обследования. Значение водородных дыхательных тестов и клинические показания для их проведения в гастроэнтерологической практике постоянно уточняются и расширяются. Практические врачи должны знать о преимуществах и недостатках этих методов обследования и широко применять их при лечении больных.
Следует отметить, что проблема терапии избыточной бактериальной контаминации не столь актуальна, как ее диагностика. Лечение пациентов с синдромом избыточного бактериального роста заключается в устранении избыточного бактериального обсеменения тонкой кишки, восстановлении микробиоценоза кишечника, нормализации кишечного пищеварения. Параллельно проводится симптоматическое лечение, направленное на ликвидацию или уменьшение выраженности основных симптомов заболевания.
Многими авторами рекомендуется назначение антибактериальных препаратов широкого спектра действия, эффективных против анаэробных бактерий, — рифаксимина (внутрь по 400–600 мг 2 раза в сутки), тетрациклина (внутрь по 0,25 г 4 раза в сутки), ампициллина (внутрь по 0,5 г 4 раза в сутки), метронидазола (внутрь по 500 мг 3 раза в сутки), ципрофлоксацина (внутрь по 500 мг 2 раза в день), норфлоксацина (внутрь по 800 мг в сутки), ванкомицина (внутрь по 125 мг 4 раза в день) [2, 3, 14]. Иногда требуется проведение повторных курсов продолжительностью от 7 до 14 дней. В нашей практике чаще всего мы используем рифаксимин в дозе по 400 мг 2 раза в сутки, часто для значительного улучшения самочувствия и для нормализации показателей дыхательного водородного теста бывает достаточно одного курса лечения. Если болевой синдром и кишечная диспепсия сохраняются при нормализации показателей дыхательного водородного теста, то данная симптоматика рассматривается как проявление СРК. При анализе данных, накопленных нами за 5 лет, частота ассоциации СРК и СИБР выявлена более чем у 60% пациентов.
После курса антибактериальной терапии мы назначаем про- и пребиотики, например, Линекс® (производства компании Sandoz Pharma, Швейцария) — пробиотический препарат, отвечающий современным требованиям. В состав его входят L. acidophilus, B. infantis, Ent. faecium, содержание которых составляет не менее 107 микробных тел. Микроорганизмы, входящие в состав препарата, заключены в капсулу, которая раскрывается в желудке. Вследствие высокой кислотоустойчивости всех компонентов препарата бактерии не разрушается в желудке и препарат способен оказывать пробиотическое действие на всех уровнях желудочно-кишечного тракта. Входящие в состав препарата Линекс® микробы устойчивы к большинству антибиотиков, что позволяет использовать препарат на фоне антибактериальной терапии. Резистентность полученных штаммов сохраняется при повторной инокуляции в течение 30 поколений и in vivo. В исследованиях препарата Линекс® показано, что переноса резистентности к другим микроорганизмам не происходит [14]. При необходимости Линекс® можно применять одновременно с антибактериальными и химиотерапевтическими средствами.
Выбор пробиотика для эмпирической коррекции микробного пейзажа кишечника — довольно сложная задача, поскольку многие препараты оказываются неэффективными. Возможно, это связано с быстрой гибелью вводимых штаммов из-за высокой агрессивности иммунной системы по отношению к собственной микрофлоре. Многие проблемы коррекции дисбактериоза кишечника могут быть разрешены путем разработки и внедрения принципиально новых препаратов — микробных метаболитов. Первым представителем этой группы стал Хилак® форте (производство Ratiopharm ГмбХ, Германия). Строго говоря, эти средства не относятся ни к пробиотикам, ни к пребиотикам. Тем не менее, их условно можно назвать метаболитными пробиотиками, поскольку в их в состав входят продукты жизнедеятельности нормальных симбионтов. В препарате содержится стерильный концентрат продуктов обмена сахаролитических (Lactobacillus acidophilus, Lactobacillus helveticus и Streptococcus faecalis) и протеолитических (Е. coli) представителей индигенной микрофлоры, КЦЖК. Дополнительно в состав Хилака® форте входят биосинтетические молочная, фосфорная и лимонная кислоты, сорбат калия, сбалансированный комплекс буферных солей (кислый фосфорнокислый натрий и калий) и ряд аминокислот. Биологическая активность 1 мл препарата Хилак® форте соответствует активности примерно 100 млрд живых микроорганизмов [15].
На фоне ускоренного развития нормальных симбионтов кишечника под действием препарата нормализуется естественный синтез витаминов группы В и К. Содержащиеся в Хилаке форте КЦЖК обеспечивают восстановление поврежденной микрофлоры кишечника при инфекционных заболеваниях ЖКТ, стимулируют регенерацию эпителиальных клеток кишечной стенки, восстанавливают нарушенный водно-электролитный баланс в просвете кишки [16].
Опубликованы работы, посвященные использованию препарата Хилак® форте в практической медицине как в России, так и за рубежом [17–21]. В результате исследований эффективности препарата было установлено, что его свойства пребиотика направлены не только на оптимизацию функционального состояния кишечника, но и участвуют в регуляции важных гомеостатических механизмов на уровне макроорганизма. В 2003 г. независимым экспертным комитетом препарату Хилак® форте была присуждена премия «Платиновая унция» [22]. Данный препарат реализует свое положительное влияние на физиологические функции макроорганизма в результате модуляции иммунных реакций, изменения функции макрофагов и продукции цитокинов, а также активации иммунной системы, связанной со слизистыми оболочками. Нормализуя водно-электролитный баланс и рН в просвете кишечника, Хилак® форте является мягким регулятором моторной функции толстой кишки, способствует быстрому восстановлению биоценоза кишечника через нормализацию нормальной микрофлоры — бифидо- и лактобактерий, стимулирует синтез эпителиальных клеток кишечной стенки кишечника. Благодаря тому, что Хилак® форте содержит биосинтетическую молочную кислоту и ее буферные соли, препарат нормализует кислотность в пищеварительном тракте независимо от состояния секреторной функции желудка. Молочная кислота создает условия, неблагоприятные для патогенных микроорганизмов [23].
Хилак® форте показан при самых разнообразных состояниях, сопровождающихся нарушением микробного баланса: нарушениях мальдигестии и мальабсорбции различного происхождения, нарушении перистальтической активности кишечника, в периоде выздоровления после острых инфекционных энтероколитов и т. д. Назначение Хилака® форте целесообразно во время лечения антибиотиками и некоторое время после их отмены для профилактики нарушений в составе кишечной микрофлоры. Хилак® форте характеризуется высокой эффективностью и хорошей переносимостью. Противопоказаний к назначению препарата и побочных действий не выявлено, его можно назначать не только взрослым, но и детям грудного возраста. Хилак® форте рекомендуется принимать внутрь до или во время еды, разбавив небольшим количеством жидкости (вода не должна иметь щелочную реакцию!). Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей — по 20–40 капель 3 раза в день; для детей грудного возраста — по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину. Хилак® форте нельзя принимать в одно время с антацидными препаратами и адсорбентами, поскольку антациды нейтрализуют, а адсорбенты снижают биодоступность кислот, входящих в состав препарата [14].
В качестве пребиотика длительного применения (до 6 месяцев) можно использовать лактулозу (препарат Дюфалак, производитель Эбботт Биолоджикалз, Нидерланды) в пребиотичекой дозе 5–10 мл в день. Лактулоза является классическим активным пребиотиком, или бифидус-фактором, уникальным углеводом, присутствующим в женском молоке. В кишечнике лактулоза становится идеальным питательным субстратом для сахаролитических бактерий (бифидо- и лактобактерий).
Таким образом, для диагностики СИБР у пациентов целесообразно назначать дыхательные водородные тесты с лактулозой, глюкозой, лактозой и другими сахарами наряду с другими стандартными методами обследования. Для коррекции СИБР, помимо селективной деконтаминации патогенной и условно-патогенной микрофлоры (при необходимости), очень важно восстановить нормальный микробный пейзаж кишечника с использованием пребиотиков и пробиотиков, в том числе и метаболитных пробиотиков.
Литература
Е. Ю. Плотникова*, доктор медицинских наук, профессор
М. В. Борщ**
М. В. Краснова***, кандидат медицинских наук
Е. Н. Баранова*
*ГБОУ ВПО КемГМА МЗ РФ, Кемерово,
**МБЛПУ Городская клиническая больница № 1, Новокузнецк,
***Кузбасский областной гепатологический центр МБУЗ ГКБ № 3 им. М. А. Подгорбунского, Кемерово
.jpg)