Дексаметазон во время химиотерапии для чего назначают
Дексаметазон во время химиотерапии для чего назначают
Тошнота и рвота, обусловленная химиотерапией, относится к числу наиболее тяжело переносимых осложнений для больного. К высокоэметогенным режимам относятся комбинации на основе цисплатина и доксорубицина (АС или FAC), которые широко используются при проведении адъювантной терапии у больных раком молочной железы. Для профилактики острой тошноты и рвоты (в первые 24 часа после введения препаратов) рекомендуется использовать комбинацию антагонистов рецепторов серотонина (например, ондансетрон) и нейрокинина-1 (апрепитант) совместно с дексаметазоном. Эта тройная комбинация успешно справляется с острой тошнотой и рвотой у большинства больных. Проблемой остается отсроченная тошнота и рвота, возникающая на вторые сутки и далее после введения препаратов.
Исторически для купирования отсроченной тошноты и рвоты использовали дексаметазон. В 2006 году Международная организация по сопроводительной терапии при злокачественных опухолях (MASCC) рекомендовала назначение дексаметазона или апрепитанта для купирования отсроченной тошноты и рвоты. Включение апрепитанта было обосновано его способностью уменьшать частоту развития отсроченной тошноты и рвоты по сравнению с ондансетроном при профилактике острой рвоты у больных, получавших цисплатин-содержащие режимы. С учетом того, что ондансетрон оказывает минимальное влияние на профилактику отсроченной тошноты и рвоты, реальная эффективность апрепитанта не была установлена.
Это послужило основанием для проведения исследования для оценки способности апрепитанта в сравнении с дексаметазоном предотвращать развитие отсроченной тошноты и рвоты у больных раком молочной железы, которые получали комбинацию доксорубицина и циклофосфамида (60/600 мг/м 2 ). Все больные получали одинаковую профилактику острой тошноты и рвоты, которая подразумевала назначение апрепитанта в дозе 125 мг внутрь за час до введения химиотерапии, палоносетрона 0,25 мг в/в струйно и дексаметазон 8 мг в/в капельно за 30 минут до введения. В дальнейшем пациенты были рандомизированы в две группы, одна из которых получала дексаметазон 4 мг внутрь 3 раза в день 2-3 дни, а другая апрепитант 80 мг внутрь на 2 и 3 дни. Лечение было двойным слепым. Основным критерием эффективности была частота отсутствия тошноты и рвоты на 2-5 дни после проведения терапии.
В исследование была включена 551 больная, из которых 273 получали дексаметазон, а 278 – апрепитант. Частота полного контроля острой тошноты и рвоты составила 87,6% и 84,9% в группе дексаметазона и апрепитанта соответственно. Частота отсутствия тошноты и рвоты в период 2-5 дней лечения составила 79,5% для обеих групп. Одновременно отмечена тенденция возникновения более выраженной тошноты и рвоты большей продолжительностью с большим числом эпизодов рвоты в группе апрепитанта по сравнению с дексаметазоном. В группе дексаметазона достоверно чаще отмечали развитие бессонницы и сердцебиений, а в группе апрепитанта – потерю аппетита и сонливость. Качество жизни в обеих группах существенно не отличалось.
Результаты исследования убедительно демонстрируют равную эффективность дексаметазона и апрепитанта для профилактики отсроченной тошноты и рвоты у больных, получивших комбинацию доксорубицина и циклофосфамида. Важным итогом данного исследования является изменение рекомендаций MASCC по профилактике отсроченной тошноты и рвоты. Вместо прежней рекомендации использовать дексаметазон либо апрепитант следует использовать дексаметазон. Несмотря на равную частоту полного контроля тошноты и рвоты в обеих группах, в группе дексаметазона отмечено меньшее число эпизодов рвоты с меньшей продолжительностью. Другим преимуществом дексаметазона является цена, которая примерно в 10 раз ниже, чем у апрепитанта. Остается неизвестным, способна ли комбинация дексаметазона и апрепитанта улучшить частоту контроля отсроченной тошноты и рвоты по сравнению с только дексаметазоном.
Ключевые слова: тошнота и рвота, дексаметазон, апрепитант, рак молочной железы.
Поддерживающая терапия при проведении современной химиотерапии (гемоцитокины и антиэметики)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Современные цитостатические средства позволяют добиваться значительных успехов в лечении ряда злокачественных новообразований. Платой за лечебный эффект во многих случаях являются побочные реакции, достигающие иногда значительной степени выраженности.
Угнетение различных ростков кроветворения сопряжено с риском развития инфекционных осложнений (при нейтропении), кровотечений (при тромбоцитопении), а несвоевременное восстановление показателей крови задерживает начало очередного курса лечения, что при некоторых злокачественных новообразованиях неминуемо ведет к снижению эффективности проводимого лечения.
| Оправдано использование КСФ для проведения первичной профилактики при высоком (40% и более) риске развития фебрильной нейтропении, а также у пациентов со сниженными резервами кроветворения. |
Эффективным средством борьбы с миелотоксичностью являются гемоцитокины, оказывающие стимулирующее влияние на клетки-предшественницы различных ростков кроветворения. Сегодня в клинической практике доступны и наиболее часто используются миелоидные колониестимулирующие факторы (КСФ; гранулоцитарный Г-КСФ и гранулоцитарно-макрофагальный ГМ-КСФ) и эритроидный фактор роста (эритропоэтин).
Основным показанием для применения миелоцитокинов является профилактика нейтропении и связанной с ней инфекции. Назначение КСФ после жесткого цикла химиотерапии с высокой вероятностью развития глубокой нейтропении называется первичной профилактикой. Ее начинают сразу после курса лечения до развития нейтропении и связанных с ней осложнений. Первичная профилактика показана также при лечении пациентов с повышенным риском развития миелодепрессии (метастатическое поражение костного мозга, повторные курсы химиолучевой терапии в анамнезе). Многочисленные контролируемые исследования с профилактическим использованием Г-КСФ показали существенное (на 40%) снижение частоты развития глубоких нейтропений, в том числе осложненных лихорадкой, а также уменьшение почти в 2 раза потребности в госпитализациях и антибиотикотерапии по сравнению с контрольной группой.
Миелоцитокины следует назначать с профилактической целью также тем пациентам, у которых после предыдущего курса химиотерапии уже наблюдалась глубокая нейтропения, осложненная лихорадкой. Вероятность развития в последующем инфекционных осложнений у таких больных очень высока. Назначение гемопоэтинов в такой ситуации называется вторичной профилактикой.
Характерным гематологическим недугом у онкологических больных является также анемия, которая развивается не только в результате опухолевой прогрессии, но и как следствие проводимой химиолучевой терапии, особенно при применении производных платины. Анемия, даже умеренная, значительно ухудшает качество жизни пациентов, снижает их сопротивляемость инфекции и другим осложнениям проводимого лечения, зачастую препятствует проведению специфической терапии. Коррекция анемии с помощью гемотрансфузий имеет много недостатков: высокий риск заражения вирусами гепатита и иммунодефицита, развитие гемосидероза внутренних органов, иммунодепрессия и др.
Сегодня для коррекции анемии целесообразнее использовать эритропоэтин, стимулирующий созревание красного ростка кроветворения. Применение эритропоэтина показано при анемиях различного генеза, в частности, он активен при миеломной болезни, анемиях, вызванных СПИДом, при миелодиспластическом синдроме, анемиях, индуцированных производными платины. Результаты одного из плацебо-контролируемых исследований показали, что использование эритропоэтина сократило потребность в гемотрансфузиях у больных с солидными опухолями с 45,5% в контрольной группе до 27,8% при применении в течение 3 мес и 10% при применении в течение 6 мес. Применение эритропоэтина в дозах от 150 до 900 МЕ/кг/нед приводило к восстановлению гематокрита до 38% и выше у 93,5% больных, не получавших в прошлом производных платины, и у 80,9% получавших ранее цитостатики этой группы.
Для развития эффекта эритропоэтина необходим определенный промежуток времени. Показано, что использование даже очень высоких доз препарата не приводит к немедленному повышению уровня гемоглобина.
Тошнота и рвота оцениваются пациентами как самое тяжелое осложнение противоопухолевого лечения. При отсутствии адекватной противорвотной терапии эти побочные явления не только ухудшают качество жизни больных, но и приводят к отказу от лечения вообще или от использования высокоэметогенных препаратов, часто в ущерб эффективности лечения.
Возникновение этих побочных реакций определяется не только свойствами используемых цитостатиков, но и психоэмоциональным состоянием больного, наличием в анамнезе заболеваний центральной нервной системы, функцией печени, почек, желудочно-кишечного тракта, предшествующей терапией.
Выделяют острую, развивающуюся в течение первых 24 ч, отсроченную, в течение последующих 2–6 сут, и предварительную тошноту и рвоту, которая может развиться у больных, получавших ранее химиолучевое лечение, сопровождавшееся острыми тошнотой и рвотой.
С помощью существующих в настоящее время антиэметиков у большинства пациентов удается купировать острую рвоту, в то время как отсроченная и предварительная рвота, имеющие, по-видимому, иные механизмы, значительно хуже поддаются лекарственному контролю.
Механизм развития тошноты и рвоты до конца не ясен, однако основная роль отводится рецепторам рвотного центра мозжечка и энтерохромаффинным клеткам тонкого кишечника, которые под воздействием цитостатиков или их метаболитов увеличивают синтез и секрецию серотонина, взаимодействующего с 5-НТ3 рецепторами. Активация афферентных нейронов блуждающего нерва стимулирует нейроны рвотного центра, что в конечном итоге и вызывает рвоту.
Еще несколько лет назад высокие дозы метоклопрамида в сочетании со стероидами и дифенгидрамином или лоразепамом считались адекватной противорвотной терапией для предотвращения острой рвоты, индуцированной цисплатином, и были эффективными у 60% больных.
Появление нового класса блокаторов 5-НТ 3 рецепторов позволяет купировать острую тошноту и рвоту у 40–60% больных при использовании в монотерапии, а в сочетании с дексаметазоном – у 60–70% пациентов. Эффективность этих препаратов в отношении отсроченной рвоты значительно меньше.
Клинически эффективность и переносимость перечисленых блокаторов 5-НТ3 рецепторов (ондансетрон, трописетрон, гранисетрон) при использовании в адекватных дозах примерно одинакова, и выбор того или иного средства определяется исключительно экономическими соображениями.
Оптимальная разовая эффективная доза ондансетрона составляет 8 мг (при неэффективности она может быть повышена до 16–24 мг), трописетрона – 5 мг, гранисетрона – 3 мг.
Схемы для купирования различных типов тошноты и рвоты
Купирование острой тошноты и рвоты, индуцированных цисплатином:
Купирование отсроченной тошноты и рвоты, индуцированных цисплатином
Современные рандомизированные исследования показали одинаковую способность контролировать отсроченную тошноту (около 60%) и рвоту (45–50%) для комбинаций метоклопрамида per os с дексаметазоном и ондансетрона per os с дексаметазоном. Учитывая меньшую стоимость метоклопрамида, его комбинация с дексаметазоном считается сегодня стандартной для купирования отсроченной тошноты и рвоты:
Купирование острой тошноты и рвоты, индуцированных умеренно эметогенными цитостатиками:
Купирование отсроченной тошноты и рвоты, индуцированных умеренно эметогенными цитостатиками
Отсроченная тошнота и рвота при использовании умеренно эметогенных препаратов встречается сравнительно редко (тошнота в 12% случаев и рвота в 14% случаев) у пациентов, не имевших острой тошноты и рвоты, и не требует лекарственной коррекции. При наличии острых тошноты и рвоты частота этих побочных реакций возрастает (до 55% для отсроченной тошноты и 75% для отсроченной рвоты). Для купирования тошноты и рвоты в этих случаях рекомендуется:
Купирование предварительной рвоты
Предварительная тошнота и рвота развиваются при проведении повторных курсов химиотерапии, причем только у тех пациентов, у которых ранее имело место развитие хотя бы одного эпизода острой тошноты и рвоты. Частота этого осложнения составляет примерно 30%. Очевидно, что предварительная тошнота и рвота имеют совсем иные механизмы, чем острая и отсроченная, поэтому использование блокаторов 5-НТ3 рецепторов и метоклопрамида в этой ситуации будет безрезультатным. Самым эффективным методом борьбы с предварительной тошнотой и рвотой является профилактика острой тошноты и рвоты на предшествующих курсах лечения. Учитывая психогенный характер этого осложнения, целесообразно применение седативных средств (диазепам, лоразепам, тазепам, феназепам и др.), желательны консультации психотерапевта, гипноз.
Антиэметики из группы блокаторов 5-НТ 3 рецепторов выпускаются различными фармацевтическими компаниями под следующими торговыми названиями: ондансетрон, трописетрон, гранисетрон.
Рациональная противорвотная терапия должна быть неотъемлемой частью проводимого противоопухолевого лечения, так как она обеспечивает нормальное качество жизни пациента и облегчает работу медицинского персонала.
В заключение следует еще раз подчеркнуть, что современная фармакология и биотехнология дали онкологам большое количество средств так называемой поддерживающей терапии. Их грамотное использование в сочетании со специфическим противоопухолевым лечением позволяет свести к минимуму неблагоприятное воздействие на организм человека цитотоксических агентов, значительно снизить риск угрожающих жизни осложнений и улучшить качество жизни онкологических больных.
Правила проведения химиотерапии: что нужно знать пациенту
Лекарственную противоопухолевую терапию получают практически все пациенты, болеющие злокачественными новообразованиями. Особенностью этого лечения является его длительность и повторяемость. Отдельные курсы введения препарата проводятся на протяжении нескольких лет, иногда в течение всей жизни больного. Какие правила необходимо соблюдать при получении этого вида лечения, чтобы сохранить качество жизни, рассказала кандидат медицинских наук Елена Викторовна Ткаченко – онколог, химиотерапевт, заведующая отделением краткосрочной химиотерапии НМИЦ онкологии имени Н.Н. Петрова.
– Елена Викторовна, когда применяют химиотерапевтическое лечение?
– Химиотерапию применяют на разных стадиях онкологического заболевания: на начальной стадии проводят предоперационную (неоадъювантную) и послеоперационную (адъювантную) терапию, также на более поздних стадиях, когда оперативное вмешательство по каким-то причинам уже невозможно. Противоопухолевая лекарственная терапия проводится и тогда, когда заболевание вернулось после радикального лечения. Поэтому многие наши пациенты получают это лечение и месяцы, и годы. И в этом нет ничего страшного или удивительного. Например, пациенты с сахарным диабетом, гипертонической или ишемической болезнями постоянно соблюдают определенные условия жизни и принимают специальные препараты. Так и онкологическое заболевание является хроническим, и, к сожалению, нередко даже после завершения лечения, через некоторое время вновь приходится его возобновлять.
– Какие побочные действия у химиотерапии?
– Побочные действия свойственны всем видам противоопухолевого лечения, даже если оно проводится по современным стандартам. Это связано с механизмом действия противоопухолевых препаратов. Осложнения бывают четырех степеней: побочные эффекты первой и второй степени больше тревожат самих пациентов, но врачи к ним относятся спокойно, потому что эти осложнения часто неизбежны и угрозы для жизни не представляют. В основном это изменения самочувствия пациента и лабораторных показателей, нетребующие лечения, например, выпадение волос или некоторое снижение лейкоцитов по результатам анализов. К третьей и четвертой степеням относятся так называемые жизнеугрожающие осложнения, они требуют серьезного внимания со стороны лечащего врача.
– Лекарственное противоопухолевое лечение пациент в основном получает через вену. Есть ли способы подготовить вены, чтобы избежать возможных побочных эффектов?
– Да, существует ряд рекомендаций, выполняя которые пациент может научиться тренировать свои вены перед введением препаратов.
– Какие побочные эффекты от введения препаратов бывают?
– При внутривенном введении цитостатиков нередко развиваются воспалительно– склеротические реакции со стороны вен. Они проявляются разнообразно: от выраженной боли по ходу сосудов уже во время инъекции до подострых флебитов, тромбофлебитов, флеботромбозов с исходом в облитерацию вен, иначе говоря, зарастание вены. При длительном введении фторурацила стенки сосудов пропитываются препаратом. Этот побочный эффект возникает практически в 100% случаев при применении некоторых препаратов. Зуд и эритема кожи по ходу вены во время введения цитостатиков отмечаются примерно в 3% инфузий, они проходят в течение 30 минут без осложнений и не свидетельствуют о подтекании препарата. Попадание под кожу раздражающих препаратов (цисплатин, дакарбазин, этопозид, фторурацил, паклитаксел, винорельбин) может вызвать жгучую боль и покраснение в месте инъекции, но если принять правильные меры, то к некрозу это не приведет.
– Существуют способы избежать осложнений или их облегчить?
– Медицинский персонал знает, как профилактировать осложнения со стороны вен. Полезно это знать и пациентам. Дело в том, что инъекции растворов цитостатиков вводятся только в минимально допустимых концентрациях. Капельные инфузии с большим количеством жидкости служат лучшим способом предупреждения повреждений стенки вен (только в случаях, когда это рекомендовано как способ введения цитостатика). Если препарат необходимо вводить струйно, то его разводят в 20-30 мл рекомендуемого растворителя, а после инъекции промывают вены изотоническим раствором NaCl. При попадании некоторых препаратов под кожу возникает гиперемия, воспаление. В трети случаев может возникнуть некроз, который без вмешательства не заживет. В этом случае необходимо обратиться за хирургической помощью.
– Что нужно делать, если химиопрепарат всё-таки попал под кожу?
– Подачу препарата необходимо остановить, но иглу или катетер вытаскивать из вены не нужно, через них медсестра извлечет попавший под кожу препарат. Для некоторых химиопрепаратов существуют антидоты (противоядия), но, к сожалению, есть они не для всех препаратов. Антидотом медсестра обколет место инъекции, а затем уже удалит из вены иглу или катетер. Пораженной конечности следует придать приподнятое положение на 48 часов, чтобы уменьшить риск воспаления и отека. Для этого достаточно закрепить руку в согнутом положении с помощью перевязки или косынки.
При попадании под кожу таких препаратов как винкристин, винбластин, винорельбин, этопозид прикладывают теплый компресс на 15-20 минут не менее четырех раз в сутки в течение 24- 48 часов. При воспалительной реакции возможна аппликация гидрокортизоновой мази.
Если развился флебит (т.е. воспаление вены), то он лечится по таким же принципам, как и обычные флебиты вне химических ожогов: применяются низкомолекулярные гепарины, антикоагулянты непрямого действия, антиагреганты.
– Почему лекарственное противоопухолевое лечение можно получать только в специализированных клиниках?
– Дело в том, что у каждого препарата свой срок и скорость введения, и для дробного и длительного введения применяется специальное оборудование. Именно поэтому ни в коем случае нельзя капать химиотерапию дома или в поликлинике, где не знают, что такое противоопухолевая лекарственная терапия. Давно уже, по крайней мере, в Санкт-Петербурге, комитетом по здравоохранению врачам, медсестрам запрещено капать противоопухолевые препараты на дому после смерти нескольких пациентов. Вы можете проводить химиотерапию только в специализированной клинике, где можно быть уверенным, что врач и медсестра понимают, что делают. Препараты должны определенным образом разводиться, капаться, храниться, их нельзя смешивать. Есть только пара препаратов, которые смешивают в одном флаконе. Все остальные должны капаться поочередно, да еще и между препаратами необходимо промывать систему физраствором. Каждый препарат должен разводиться определенным раствором: глюкозой, раствором Рингера, водой для инъекций или физраствором. Это сложная наука.
– Какое оборудование для введения препаратов сегодня используется?
– Существует несколько типов медицинского оборудования для длительного и дробного введения препаратов. Например, перфузоры – это устройства, позволяющие вводить медикаментозные препараты и растворы с исключительно высокой точностью. Порой счёт идет на десятые доли миллилитров в час (особенно часто это применяется в отделении реанимации, где скорости введения медикаментов, как правило, 1 мл/час, 5.6 мл/час и т.д.). Перфузоры могут быть механическими или электронными. Они имеют несколько названий: инфузоматы, линеаматы, шприцевые насосы, шприцевые дозаторы и др. Есть микроинфузионная помпа (инфузор) – безопасное и эффективное медицинское изделие, предназначенное для длительного, дозированного, контролируемого введения лекарственных препаратов, используемых в медикаментозной терапии (в том числе и химиотерапии). Как правило, такие помпы называют инфузор или инфузомат. Так же можно встретить названия: шприцевой насос, дозатор медицинский, инфузионный насос и др.
При использовании микроинфузионной помпы обеспечивается постепенное поступление препарата в организм за счет механизма сокращения резервуара и трубки инфузора.
– Какие правила введения противоопухолевых препаратов должен знать пациент?
– Введение противоопухолевых препаратов должно выполняться только в отделениях, специализирующихся на цитотоксической химиотерапии исключительно под наблюдением компетентного врача. Этот метод лечения требует специальной подготовки, тщательности при приготовлении растворов препаратов и соблюдения всех правил их введения, указанных в инструкциях. Поэтому к выполнению работ с цитостатиками должны допускаться медицинские сестры, прошедшие специальную подготовку, обученные безопасным методам и приемам работы. Также необходимо соблюдать последовательность и скорость введения препаратов, учитывать химические свойства при использовании оборудования для их введения. Соблюдать правила и сроки хранения препаратов как в аптечной упаковке, так и после их приготовления. Ни в коем случае нельзя смешивать препараты «в одном флаконе», если в инструкции по применению данных препаратов нет для этого особых указаний. Необходимо знать и соблюдать все условия хранения препарата и его транспортировки, если он приобретается и доставляется в клинику самим пациентом. Это очень важно. Потому что многие пациенты говорят: «Я куплю, привезу, а вы мне прокапайте!» Если вы купите, например, герцептин в аптеке и привезете его к нам не в холодильнике, а в обычной упаковке, что мы получим? В лучшем случае – воду. В случае личного приобретения препаратов уточните правила хранения и транспортировки у своего врача.
– Какие способы внутривенной доставки препаратов сегодня используются?
– На сегодняшний день существует несколько способов: через иглу, переферический венозный катетер, центральный венозный катетер и имплантируемый порт. Вы знаете, когда я начала работать в медицине, мы работали еще многоразовыми иглами. Они были тупые, поэтому могли долго стоять в вене. А как только появились одноразовые иглы, стали возникать сложности. Они же острые, чуть пациент шевельнулся, она прокалывает вену моментально. Поэтому если необходимо вводить препарат долго, то делать это лучше через переферический венозный катетер. Если его устанавливать в асептических условиях, правильно ухаживать, то до 10 дней им можно пользоваться.
Для более длительного венозного доступа используют центральный венозный катетер, особенно в тех случаях, когда необходимо обеспечить полное парентеральное питание у хронических больных. Край центрального венозного катетера вводится в пустотелую вену. У этих катетеров много преимуществ. Но неправильный уход за ними может привести и к серьезным осложнениям. Поскольку если возникнет воспаление, то оно будет не местным, а общим. Поэтому центральный венозный катетер требует профессионального использования и тщательного ухода.
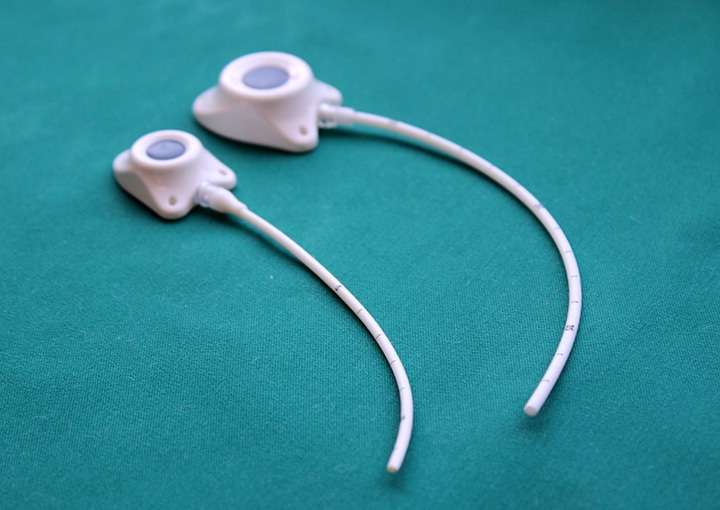
Еще существует порт-система. Это инвазионный порт, который представляет собой титановый резервуар в виде толстой монеты диаметром около 4-4,5 см и толщиной около 1 см, который покрыт изнутри биоинертным полимером. На верхней плоской части установлена мембрана из многослойного силикона, через которую вводят лекарственные препараты. Порт имеет тонкую трубочку-катетер длиной до 10-15 см, которая пропускается в яремную вену и реже в артерию.
Показания к применению порт-системы:
Есть свои противопоказания, но они все относительны, и доктора сами принимают решение, учитывать их или нет.
– Какие очевидные преимущества у порт-системы?
– Их много. Главное, что человек может вести привычный образ жизни. Венозный порт имплантируется под кожу пациента, он не виден снаружи, поэтому не может быть задет одеждой, инфицироваться при приеме ванны, «выскочить» из вены. Люди с установленными портами могут заниматься спортом, выполнять физическую нагрузку, плавать, путешествовать, отдыхать заграницей и т.д. Им можно проходить МРТ и КТ исследования, он совместим с магнитным полем. При правильной эксплуатации порт-система может работать 5-7 лет. Существуют наблюдения, что если за порт-системой правильно ухаживать, то фактически она может использоваться пожизненно. В некоторых странах установка порт-системы является неотъемлемой частью «золотого стандарта» лечения. В Западной Европе порты широко применяются у пациентов с впервые выявленным онкологическим заболеванием, которым планируется проведение множественных сеансов химиотерапии, особенно цитостастическими препаратами, которые вызывают повреждение периферических вен. Кроме того, инфузионные порты устанавливаются пациентам с тонкими периферическими венами на верхних и нижних конечностях. В отечественной онкологической практике порты пока используются редко.
– Как происходит установка инфузионного порта?
– Процедура имплантации порта проводится под местной анестезией и абсолютно безболезненна. Порт, как правило, имплантируется в правую подключичную область, хотя место может быть любым, главное, чтобы рядом была проходимая вена. Процедура занимает от 10 до 30 минут и не требует длительной госпитализации. Пациент находится в стационаре около часа после установки, а потом самостоятельно может ехать домой. Врач предоставляет ему необходимую информацию о правилах поведения после операции и о лекарствах, которые необходимо принимать в течение нескольких дней после процедуры.
– Как ухаживать за порт-системой?
– О каких «сигналах тревоги» должен знать пациент с установленным портом?
– Надо понимать, что при использовании порт-системы бывают и осложнения. Пациент должен насторожиться и обратиться к врачу в случае:
Источники
Материал подготовила:
НАТАЛЬЯ СУББОТИНА
специалист по связям с общественностью
НМИЦ онкологии им Н.Н. Петрова,
Кемеровский государственный университет, факультет филологии и журналистики, отделение журналистики
Материал подготовила:
ЮЛИЯ КОБЛЯКОВА
специалист по связям с общественностью
НМИЦ онкологии им Н.Н. Петрова,
Санкт-Петербургский политехнический университет Петра Великого
Кафедра рекламы и связей с общественностью