Дексилант или рабепразол что лучше
Дексилант или рабепразол что лучше
Гастроээофагеальная рефлюксная болезнь (ГЭРБ) – хроническое рецидивирующее заболевание, обусловленное нарушением моторно-эвакуаторной функции гастроэзофагеальной зоны и характеризующееся спонтанным или регулярно повторяющимся забрасыванием в пищевод желудочного или дуоденального содержимого, что приводит к повреждению дистального отдела пищевода с развитием в нем дистрофических изменений неороговевающего многослойного плоского эпителия, катарального эзофагита, эрозивно-язвенного эзофагита (рефлюкс-эзофагита) и у части пациентов – цилиндрической метаплазии. Работы последних лет свидетельствуют о том, что ГЭРБ является одним из наиболее часто встречающихся заболеваний в амбулаторной гастроэнтерологической практике.Она входит в число 5 состояний, которые в наибольшей мере ухудшают качество жизни пациентов [1, 2].
Среди взрослого населения Российской Федерации распространенность ГЭРБ составляет 40–60%. Наличие данного заболевания сопровождается значительным ухудшением качества жизни больных, особенно при присутствии ночных симптомов. Неблагоприятными для здоровья факторами являются рефрактерность к терапии у части больных и быстрый рецидив заболевания при прекращении терапии: в течение первых 3 месяцев у 60–70% больных [3–5].
Рецидив эрозивного эзофагита представляет собой главный фактор риска развития пищевода Барретта, что опасно в отношении формирования аденокарциномы пищевода (до 95% случаев аденокарциномы пищевода диагностируется у больных с пищеводом Барретта) [6, 7].
В основе лечения любого пациента с ГЭРБ лежит комплексный и индивидуальный подход – сочетание немедикаментозного и медикаментозного методов. Основные цели лечения данного заболевания – купирование симптомов «по требованию», контроль симптомов, предотвращение осложнений и достижение длительной ремиссии [3, 4, 8].
Практические врачи и сами пациенты нередко недооценивают значение этого заболевания. Больные в большинстве случаев поздно обращаются к врачу за медицинской помощью и даже при выраженных симптомах лечатся самостоятельно. Врачи, в свою очередь, нередко недооценивают последствия данного заболевания и нерационально проводят терапию, что в дальнейшем неизбежно приводит к осложнениям.
Цель исследования. Анализ эффективности медикаментозного лечения ГЭРБ у пациентов, находившихся на диспансерном наблюдении терапевта и гастроэнтеролога в поликлиническом отделении ГБУЗ РМ «Республиканская клиническая больница № 5» в период с 2017 по 2020 гг.
Материалы и методы исследования. В ходе исследования проведен ретроспективный анализ амбулаторных карт 90 пациентов разных возрастных групп с гастроэзофагеальной рефлюксной болезнью, находившихся на диспансерном наблюдении в поликлиническом отделении ГБУЗ РМ «Республиканская клиническая больница № 5» г. Саранска в 2017–2020 гг. Исследование было одобрено локальным этическим комитетом медицинского института ФГБОУ ВО «МГУ имени Н.П. Огарёва».
При анализе амбулаторных карт определяли характер жалоб пациентов, условия их возникновения, наличие осложнений и сопутствующих заболеваний со стороны желудочно-кишечного тракта (ЖКТ), группы препаратов и их комбинации, применяемые для лечения, регулярность приема лекарственных средств и эффективность назначенного лечения.
Статистический анализ полученных данных проводился с применением программы Microsoft Office Excel. Для описания данных использовали среднее арифметическое значение (M) и ошибку среднего арифметического (m). Номинальные данные описывались с указанием абсолютных значений (n) и процентных долей (%).
Результаты исследования и их обсуждение. В исследование были включены данные 90 амбулаторных больных с диагнозом ГЭРБ. Возраст исследуемых составлял от 25 лет до 71 года (средний возраст 45,3±3,9 года). Из них женщин было 39 человек (43,3%), мужчин – 51 человек (56,7%).
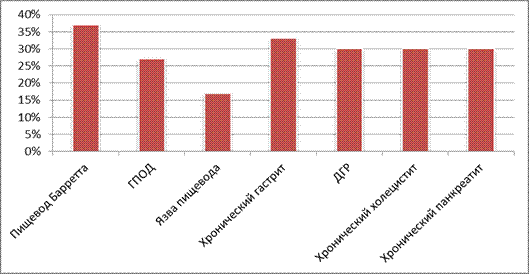
У 33 (36,7%) из исследуемых было выявлено осложнение – пищевод Барретта, у 24 (26,7%) – грыжа пищеводного отверстия диафрагмы (ГПОД) и у 15 (16,7%) – язва пищевода. Из сопутствующих заболеваний дуодено-гастральный рефлюкс (ДГР) наблюдался у 27 человек (30,0%), хронический холецистит и хронический панкреатит – у 27 человек (30,0%), хронический гастрит – у 30 человек (33,3%) (рис. 1).
Рис. 1. Распределение пациентов по наличию осложнений и сопутствующих заболеваний
Среди обследованных больных регулярно принимали препараты для лечения ГЭРБ 86,7% больных, остальные 13,3% – только при усилении симптомов и ухудшении состояния.
Для лечения ГЭРБ на амбулаторном этапе данным пациентам были назначены такие группы препаратов, как: ингибиторы протонной помпы (ИПП), прокинетики, гастропротекторы, антацидные, антисекреторные препараты, альгинаты и репаранты (табл. 1).
Распределение пациентов по получаемым для лечения препаратам
Общее количество пациентов, получающих препараты данной группы,
Количество пациентов, получающих данные препараты, по отношению к общему числу в указанной группе,
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ЭФФЕКТИВНОСТИ ИНГИБИТОРОВ ПРОТОННОЙ ПОМПЫ В ЛЕЧЕНИИ ЭЗОФАГИТА У ПОЖИЛЫХ
УДК: 615.03:616-008.6
Г.Р. Сорока, Т.А. Панина, Н.В. Долгенко
Рудненская городская поликлиника
В статье проведена сравнительная эффективность и переносимость трех ингибиторов протонной помпы, стандартно используемых в краткосрочной терапии эзофагитов у 101 пожилого пациента. Установлено, что пантопразол и рабепразол значительно более эффективны у пожилых пациентов, чем омепразол, в заживлении эзофагита и лучше и быстрее купируют симптомы гастроэзофагеальной рефлюксной болезни. Инфицирование H. pylori не оказывает влияния на коэффициент заживления эзофагита по результатам краткосрочного курса терапии ингибиторами протонной помпы.
Ключевые слова: пожилой возраст, эзофагит, ингибитор протонной помпы.
Пожилой возраст является значимым фактором риска развития серьезных эзофагитов [1], имеющих хроническое течение и сопровождающихся многочисленными жалобами. Клинические проявления эзофагита у пожилых пациентов существенно отличаются от таковых в молодом и зрелом возрасте. Действительно, пожилых пациентов значительно реже беспокоят классические симптомы, такие как изжога, отрыжка кислым и/или боль в эпигастрии. С возрастом гораздо чаще встречаются такие неспецифические симптомы, как отсутствие аппетита, снижение массы тела, анемия и/или рвота [2]. Вследствие этого диагноз рефлюкс-эзофагита может быть пропущен у пожилых людей, также у значительного числа пациентов заболевание может протекать субклинически.
Лечение эзофагита основано на подавлении продукции соляной кислоты с помощью антисекреторных препаратов. Ингибиторы протонной помпы (ИПП) являются широко используемой группой препаратов, и их эффективность и безопасность продемонстрирована у пациентов пожилого возраста в разных исследованиях [3]. На современном рынке представлены 5 ИПП: омепразол, лансопразол, рабепразол, пантопразол и эзомепразол. В доступной литературе имеются публикации, оценивающие различия фармакокинетики и фармакодинамики этих препаратов в зависимости от возраста пациентов [4]. Однако неизвестно, связаны ли эти особенности с клиническим (т.е. заживляющим) эффектом и/или лишь купированием симптомов, особенно в силу описанных выше причин это трудно выявить у пожилых пациентов.
Цель исследования — сравнение клинической эффективности и переносимости трех ИПП при краткосрочном курсе терапии эзофагита у пациентов пожилого возраста.
Материалы и методы исследования. Исследование проводилось как открытое многоцентровое рандомизированное, включающее пожилых пациентов, которым для верификации диагноза проводилась эзофагогастродуоденоскопия (ЭГДС). Исследование выполнено согласно Хельсинской декларации и стандартам GSP (хорошей клинической практике). Критерии включения в исследование: возраст старше 65 лет; эндоскопически верифицированный диагноз эзофагита согласно классификации Савари–Миллера [1]. Критерии исключения: наличие синдрома Золлингера–Эллисона в анамнезе; пилорический стеноз; наличие в анамнезе оперативных вмешательств на пищеводе и/или в желудочно-кишечном тракте – ЖКТ (исключая аппендэктомию и холецистэктомию); наличие злокачественных новообразований ЖКТ. Также в исследование не включали пациентов, получающих антациды, сукральфат, прокинетики, Н2-блокаторы гистамина и/или ИПП более чем 7 дней в течение 4 нед перед началом исследования.
Во время 1-го визита фиксировались демографические показатели, собирался анамнез, выяснялись клинические симптомы, применение нестероидных противовоспалительных (НПВП) и антисекреторных препаратов. Если данные пациента соответствовали условиям исследования, то пациенту выполнялась ЭГДС для диагностики острого эзофагита (основной критерий включения в исследование). После 2-месячного лечения проводилась повторная ЭГДС для оценки заживления эзофагита и эффективности терапии. Во время проведения курса лечения у всех пациентов фиксировались побочные эффекты. Побочные эффекты были градированы исследователем как «несвязанные», «вряд ли связанные», «возможно связанные», или «вероятно связанные» с лечением.
Рефлюкс-эзофагит был эндоскопически верифицирован при наличии эпителиального дефекта согласно классификации Савари–Миллера [1], включающей в себя 4 степени: не сливающиеся эрозии; сливающиеся эрозии; повреждение, распространяющееся на всю окружность нижней трети пищевода; глубокая язва или эзофагит с осложнениями (стеноз и/или кровотечение).
Во время эндоскопического исследования у пациентов были взяты 6 биоптатов: 3 из антрального отдела и 3 из тела желудка. Два антральных биоптата и 2 желудочных были использованы для гистологического анализа. Для гистологического исследования биоптаты немедленно фиксировали в буферизованном нейтральном формалине и помещали в парафин. Для диагностики H. pylori препараты окрашивали гематоксилином и эозином и модифицировали по Гимзе. Уровень инфицированности был оценен согласно Сиднейской классификации [5]. Пациентов считали не инфицированными H. pylori, если данные гистологии были отрицательными; пациенты считались инфицированными H. pylori, если гистология была положительной [5].
Симптомы были оценены во время структурированного интервью. У пациентов были выяснены основные симптомы, т.е. наличие отрыжки кислым, изжоги, и другие признаки гастроэзофагеальной рефлюксной болезни (ГЭРБ), включая и патогномоничные для пациентов пожилого возраста: боль в эпигастрии, дисфагию, рвоту и анемию (потеря ≥3 г гемоглобина за последние 3 мес). Симптомы отмечались как отсутствующий/существующий.
Пациенты, включенные в исследование, были разделены на 3 группы в зависимости от ИПП, принимаемого в течение 2 мес: омепразол (20 мг/сут), пантопразол (Контролок) 40 мг/сут и рабепразол (Париет) 20 мг/сут. Все ИПП принимались утром натощак перед завтраком. Пациентам, инфицированным H. pylori, были назначены ИПП и 2 антибиотика: амоксициллин 1 г 2 раза в день и кларитромицин 250 мг 2 раза в день или метронидазол 250 мг 4 раза в день ежедневно в течение 7 дней [2].
Статистический анализ был выполнен посредством «SPSS. 13». Результаты оценивали с использованием обоих видов анализа – «per protocol» (PP) и «intention-to-treat» (ITT), а также 95% доверительных интервалов (95% CI). ITT-сообщество определяли как всех первоначально зарегистрированных пациентов, получивших в ходе исследования одну дозу препарата. Статистический анализ выполняли с использованием точного теста (связь коэффициента заживления с инфицированием H. pylori и наличием симптоматики). Статистически достоверное значение определено как p
Новый подход к повышению эффективности ингибиторов протонной помпы у больного гастроэзофагеальной рефлюксной болезнью
Ингибиторы протонной помпы наиболее эффективны для лечения гастроэзофагеальной рефлюксной болезни. Особенности фармакокинетики и фармакодинамики декслансопразола в форме капсул с модифицированным высвобождением улучшают контроль кислотопродукции при однок
Proton pump inhibitors are the most efficient for treatment of gastroesophageal reflux disease. Characteristics of pharmacokinetics and pharmacodynamics of dexlansoprazole in the form of capsules with modified release improve acid-production control in single batching, regardless of the meal.
Гастроэзофагеальная рефлюксная болезнь (ГЭРБ) — это состояние, развивающееся, когда рефлюкс содержимого желудка вызывает появление беспокоящих пациента симптомов и/или развитие осложнений. ГЭРБ проявляется широким спектром пищеводных (прежде всего, изжогой и регургитацией) и внепищеводных симптомов (ассоциированные с рефлюксом бронхиальная астма, кашель, ларингит и др.). Осложнениями ГЭРБ являются рефлюкс-эзофагит, стриктуры, пищевод Барретта, аденокарцинома пищевода [1]. Распространенность ГЭРБ в Москве составляет 23,6%, в городах России 11,3–14,3% [2]. В странах Западной Европы она колеблется от 10% в Испании и Великобритании до 17% в Швеции, в США — от 13% до 29% [3]. В основе патогенеза ГЭРБ лежат моторные нарушения, ведущие к дисфункции антирефлюксных механизмов и возникновению патологического гастроэзофагеального рефлюкса, источником которого является «кислотный карман» — слой небуферизованной кислоты, образующийся на поверхности содержимого желудка после приема пищи [4].
Появление ингибиторов протонной помпы (ИПП) произвело революцию в лечении кислотозависимых заболеваний. Они признаны наиболее эффективными препаратами для лечения ГЭРБ [5].
Эффект ИПП при ГЭРБ основан на подавлении кислотопродукции желудка, в результате которого уменьшается объем и снижается повреждающий потенциал «кислотного кармана», что создает условия для купирования симптомов и заживления повреждений слизистой оболочки пищевода [6]. Вероятность устранения изжоги возрастает по мере угнетения секреции соляной кислоты, что определяет преимущества ИПП перед блокаторами Н2-рецепторов и прокинетиками (ОР изжоги при назначении прокинетиков 0,86; 95% ДИ 0,73–1,01; блокаторов Н2-рецепторов — 0,77; 95% ДИ 0,60–0,99; ИПП — 0,37; 95% ДИ 0,32–0,44) [7]. Четырехнедельный прием ИПП обеспечивает заживление рефлюкс-эзофагита у 90% больных [8]. ИПП наиболее эффективны для поддержания эндоскопической ремиссии ГЭРБ [9].
Вместе с тем все более существенной проблемой становится неэффективность ИПП. Принято считать, что стандартные дозы ИПП не обеспечивают полного разрешения симптомов у 10–40% больных. Неэффективность объясняется влиянием множества факторов, среди которых недостаточное подавление кислотопродукции, связанное с особенностями фармакокинетики ИПП, и проблемы комплаенса — несоблюдение больным рекомендаций врача по дозе и времени приема ИПП [10, 11].
ИПП необратимо блокируют активные протонные помпы [13]. Протонные помпы становятся активными только после встраивания в мембрану секреторного канальца париетальной клетки в ответ на стимуляцию. Оптимальным считается прием ИПП за 30 мин до приема пищи, что позволяет обеспечить максимальную концентрацию препарата в крови в период максимальной стимуляции кислотопродукции принятой пищей. Такой режим приема соблюдают лишь 46% больных. Среди пациентов, нарушающих оптимальный режим приема ИПП, значительная часть больных принимает лекарство более чем за час до еды (39%), после еды (30%), перед сном (28%) или по необходимости (3%), что снижает эффективность лечения [14]. Однако и в случае оптимального приема ИПП клетка сохраняет значительный запас неактивных помп, около 25% которых ежедневно синтезируется. В первый прием ИПП ингибируются те протонные помпы, которые активны в данный момент, во второй прием — те, которые стали активными после приема первой дозы, и так далее. Этот процесс циклично повторяется до достижения динамического равновесия, когда в среднем к третьему дню приема ИПП заблокированными оказываются примерно 70% помп [15].
Все традиционные ИПП обладают относительно коротким периодом полувыведения из плазмы крови (1–2 часа) и ограниченное время находятся в системном кровотоке [16]. Поэтому при однократном приеме системное воздействие ИПП постепенно снижается, по истечении суток циркулирующие молекулы ИПП в плазме отсутствуют, а секреция кислоты восстанавливается за счет активации новых помп [17]. Кроме того, период обновления помп у всех людей разный, и если он короткий, контроль кислотопродукции обеспечить труднее [18]. По этим причинам первый прием ИПП полностью купирует изжогу лишь у 30% больных, а у большинства пациентов в течение первых 2 дней лечения изжога не уменьшается [19]. Показано, что существенное преимущество в скорости купирования изжоги и улучшении качества жизни больных на первой неделе лечения, в период достижения оптимального антисекреторного эффекта ИПП, имеет комбинированная терапия ИПП и альгинатами [20].
Антисекреторные эффекты стандартных доз ИПП при длительном лечении сопоставимы [21]. Повышение эффективности терапии возможно при увеличении длительности нахождения ИПП в системном кровотоке, для достижения которой предложен ряд подходов [22]. Один из них — увеличить разовую дозу при применении препарата 1 раз в день. Однако существующие ИПП обеспечивают почти максимальное подавление активных протонных помп, поэтому увеличения разовой дозы недостаточно для повышения продолжительности контроля секреции желудка и прироста клинического эффекта [23]. Консенсус по лечению ГЭРБ Американской гастроэнтерологической ассоциации (American Gastroenterological Association, AGA) рекомендует в случае неэффективности лечения ИПП один раз в день увеличить кратность приема ИПП до двух раз в день [24]. Однако увеличение кратности приема снижает приверженность режиму лечения [25]. Кроме того, по данным наблюдательных исследований, длительное применение ИПП в высоких дозах может быть ассоциировано с повышенным риском остеопороза, переломов бедра и позвоночника, избыточного бактериального роста, колита, вызванного Clostridium difficile, и внебольничной пневмонии, а также увеличивает стоимость лечения [26, 27]. Поэтому предпочтительно назначение препарата один раз в день, что определяет потребность в ИПП, обладающем лучшими фармакокинетическими/фармакодинамическими характеристиками [28].
Одним из решений этой задачи стало создание энантиомеров ИПП, первый из которых эзомепразол — S-изомер омепразола. Более медленный метаболизм, чем у R-омепразола, обеспечивает его высокую концентрацию в плазме [29] и значительно более выраженное подавление кислотопродукции эзомепразолом в дозе 40 мг, чем омепразол в дозе 20 мг, лансопразол 30 мг, рабепразол 20 мг или пантопразол 40 мг [30]. Это объясняет клинические преимущества эзомепразола у больных ГЭРБ, у которых, несмотря на прием стандартной дозы ИПП в течение 8 недель, сохранялись симптомы. При замене ИПП на эзомепразол в дозе 40 мг было получено достоверное уменьшение частоты возникновения и выраженности изжоги, регургитации и боли в эпигастрии [31]. При этом время с рН > 4 в желудке после однократного приема эзомепразола составило только 58,43% суток, а период полувыведения эзомепразола из плазмы не отличается от других ИПП [32]. Следовательно, создание самой по себе энантиомерной формы может быть недостаточно для обеспечения длительного контроля секреции кислоты, необходимого для достижения оптимального эффекта.
Изучаются новые ИПП, обладающие большей мощностью и более длительными периодами полувыведения. Так, исследования тенатопразола у здоровых добровольцев показали, что это вещество на основе, отличной от бензимидазола, имеет более длительный период полувыведения (приблизительно 8 часов после однократного и 14 — после многократного применения), что приводит к примерно 20-кратному увеличению площади под кривой «концентрация/время» (AUC), и оказывает более выраженный ингибиторный эффект [33].
Повышение эффективности ИПП возможно за счет добавления компонентов, стимулирующих активацию протонных помп, что повышает скорость достижения эффекта и устраняет необходимость приема за 20–30 минут до еды. Так, омепразол немедленного высвобождения (Омез® Инста) представляет собой комбинацию из порошка омепразола без энтерального покрытия и гидрокарбоната натрия, который защищает действующее вещество от разрушения при контакте с соляной кислотой. Быстрое развитие эффекта связано с активацией протонных помп через механизм обратной связи секреции соляной кислоты при повышении внутрижелудочного pH гидрокарбонатом натрия [34].
Более длительное нахождение ИПП в плазме крови можно обеспечить путем использования препаратов с модифицированным высвобождением. Оно реализовано в лекарственной форме декслансопразола, представляющего собой энантиомер лансопразола с модифицированным высвобождением. Лансопразол и его энантиомеры не отличаются по их способности ингибировать протонные помпы. Вместе с тем R- энантиомер (декслансопразол) после приема лансопразола внутрь составляет 80% от его концентрации в крови, обеспечивает снижение выведения и в пять раз увеличивает системное воздействие по сравнению с капсулами с S-энантиомером [35]. Декслансопразол с модифицированным высвобождением представляет собой лекарственную форму декслансопразола, в котором используется новая технология двойного замедленного высвобождения. Использование технологии двойного высвобождения позволяет разделить высвобождение препарата в желудочнокишечном тракте (ЖКТ) на два этапа, благодаря чему он длительно остается в плазме и ингибирует вновь активированные протонные помпы. Капсулы декслансопразола с технологией двойного высвобождения содержат смесь из двух типов гранул, каждый из которых обладает своим pH-зависимым профилем растворимости. Один тип гранул обеспечивает быстрое высвобождение препарата в проксимальной части двенадцатиперстной кишки, гранулы второго типа высвобождаются в дистальном отделе тонкой кишки. В результате фармакокинетический профиль декслансопразола с использованием технологии двойного высвобождения характеризуется наличием двух пиков, в отличие от традиционных ИПП, для которых характерно наличие одного пика (рис. 1). Первый пик наблюдается через 1–2 часа после применения препарата, что соответствует пику концентрации при приеме лансопразола (показатель tmax). Второй пик отмечается через 4–5 часов после приема декслансопразола [36]. Декслансопразол с использованием технологии двойного высвобождения характеризуется большей AUC и увеличением максимальной концентрации (Cmax) при сравнении с лансопразолом. Средние значения Cmax и AUC декслансопразола после одно- и многократного применения пропорциональны дозе препарата. Для декслансопразола средние значения AUC были в 3–7 раз выше, а средние значения Cmax — в 1,5–3 раза выше, чем для лансопразола 30 мг.
Декслансопразол обеспечивал более длительное воздействие препарата по сравнению с лансопразолом 30 мг, о чем свидетельствует более позднее наступление tmax и существенное повышение концентрации препарата в плазме через 3–8 ч после его приема внутрь (рис. 2). Воздействие декслансопразола на 5 день сопоставимо с воздействием в 1-й день независимо от режима терапии, следовательно, фармакокинетика препарата после его приема внутрь не зависит от времени [37].
Следствием этого является удлинение среднего времени нахождения молекулы в системном кровотоке (MRT): для декслансопразола с использованием технологии двойного высвобождения от 5,6 до 6,4 часа, для традиционной лекарственной формы лансопразола с однократным высвобождением от 2,8 до 3,2 часа. Это указывает на то, что использование технологии двойного высвобождения позволяет повысить продолжительность воздействия за счет увеличения среднего времени всасывания [38]. Таким образом, декслансопразол с использованием технологии двойного высвобождения обладает улучшенным фармакодинамическим профилем по сравнению с традиционными системами доставки лекарств, обычно используемыми в лекарственных формах ИПП.
Более длительное поддержание концентрации декслансопразола в плазме обеспечивается его высвобождением на протяжении продолжительного времени, поскольку высвобождение препарата происходит в разных отделах ЖКТ в два этапа. Более длительное всасывание препарата не оказывало влияния на его период терминального полувыведения, а применение декслансопразола один раз в день не приводило к значимой кумуляции [37]. У пациентов, получавших декслансопразол на протяжении до 12 месяцев, наблюдалось повышение уровня гастрина сыворотки, характерное для ИПП, не зависевшее от дозы препарата [38]. Клинически значимых изменений лабораторных показателей, показателей жизнедеятельности и результатов биопсии желудка не наблюдалось [39].
Критерием клинической эффективности ИПП при лечении кислотозависимых заболеваний являются среднее значение рН и процент времени с pH > 4 в теле желудка за 24 часа после приема препарата. После приема внутрь декслансопразола с технологией двойного высвобождения были отмечены достоверно более высокие показатели pH среднего и времени с pH > 4, чем после приема лансопразола 30 мг (рис. 3). На 5-й день при применении декслансопразола отмечалось потенциально клинически значимое повышение среднего уровня pH (> 0,5) и доли времени с pH 4 (более 10% за период от 16 до 24 часов). Таким образом, при использовании декслансопразола воздействие и pH-контроль были длительнее по сравнению с лансопразолом 30 мг [40]. Эмпирические модели на основе информационных критериев Akaike позволяют оценить соотношение между долей времени, когда концентрация препарата в плазме остается выше пороговой, и долей времени, на протяжении которого pH больше 4 после многократного применения декслансопразола и лансопразола внутрь [40]. В соответствии с этим критерием пороговая концентрация должна составлять 125 нг/мл [41]. При применении декслансопразола в дозах от 30 мг концентрация препарата в плазме крови была выше пороговой в 2–3 раза дольше, чем при использовании лансопразола в дозе 30 мг (рис. 4).
Заключение
Появление ИПП установило новый стандарт лечения больных гастроэзофагеальной рефлюксной болезнью. Несмотря на их эффективность, важной проблемой стало появление случаев недостаточного ответа на лечение. Понимание ключевых механизмов неэффективности ИПП поставило задачу их преодоления, для чего потребовалось появление лекарственной формы, однократный прием которой вне зависимости от приема пищи позволил бы длительно контролировать кислотопродукцию желудка. Декслансопразол — препарат Дексилант®, в котором реализован новый метод доставки действующего вещества, позволяет решить некоторые проблемы ИПП с традиционным методом доставки и повысить клиническую эффективность [42]. Особенностью лекарственной формы декслансопразола с технологией двойного высвобождения является наличие двух пиков концентрации в плазме крови, в результате чего терапевтическая концентрация препарата сохраняется дольше по сравнению с традиционной лекарственной формой лансопразола, позволяя оптимизировать воздействие препарата на внутрижелудочный pH и улучшить клинический ответ на лечение.
Литература
Д. С. Бордин, доктор медицинских наук
ЦНИИГ ГБУЗ МКНЦ ДЗМ, Москва

.gif)
.gif)
_575.gif)
.gif)