Дендритная вакцина что это
Дендритная вакцина
Основа биовакцины – это материал опухолевого образования. Важно понимать, что использование вакцины на основе дендритных клеток является лишь частью комплексной терапии в лечении рака.
Дендритные клетки т.е. вакцину на их основе изготавливают после хирургического лечения с применением полученного в процессе вмешательства опухолевого материала, а также клеток, выделенных из крови больного.
После этого пациент продолжает основной курс терапии (химиотерапию или другое) и после его окончания несколько раз получает дендритную вакцину, при помощи которой удается закрепить полученный результат терапии. Это обеспечивает профилактику рецидива и развития метастазов.
До настоящего момента в мире было проведено более 1000 клинических испытаний биовакцин где применялись дендритные клетки. В этих испытаниях принимали участие больные с распространенными стадиями рака, и в результате был сделан вывод, что использование биовакцин должно быть направлено не только на борьбу с опухолью, но и на профилактику рецидивов и образования метастазов.
Роль дендритной вакцины в лечении рака сложно переоценить, ведь большинство летальных исходов при онкологических опухолях возникает в результате прогрессирования патологии и развития метастазов.
На сегодняшний день нами получены результаты клинических исследований, а изготовление дендритной вакцины проводится усовершенствованным методом, не имеющим аналогов во всем мире.
Роль дендритных клеток
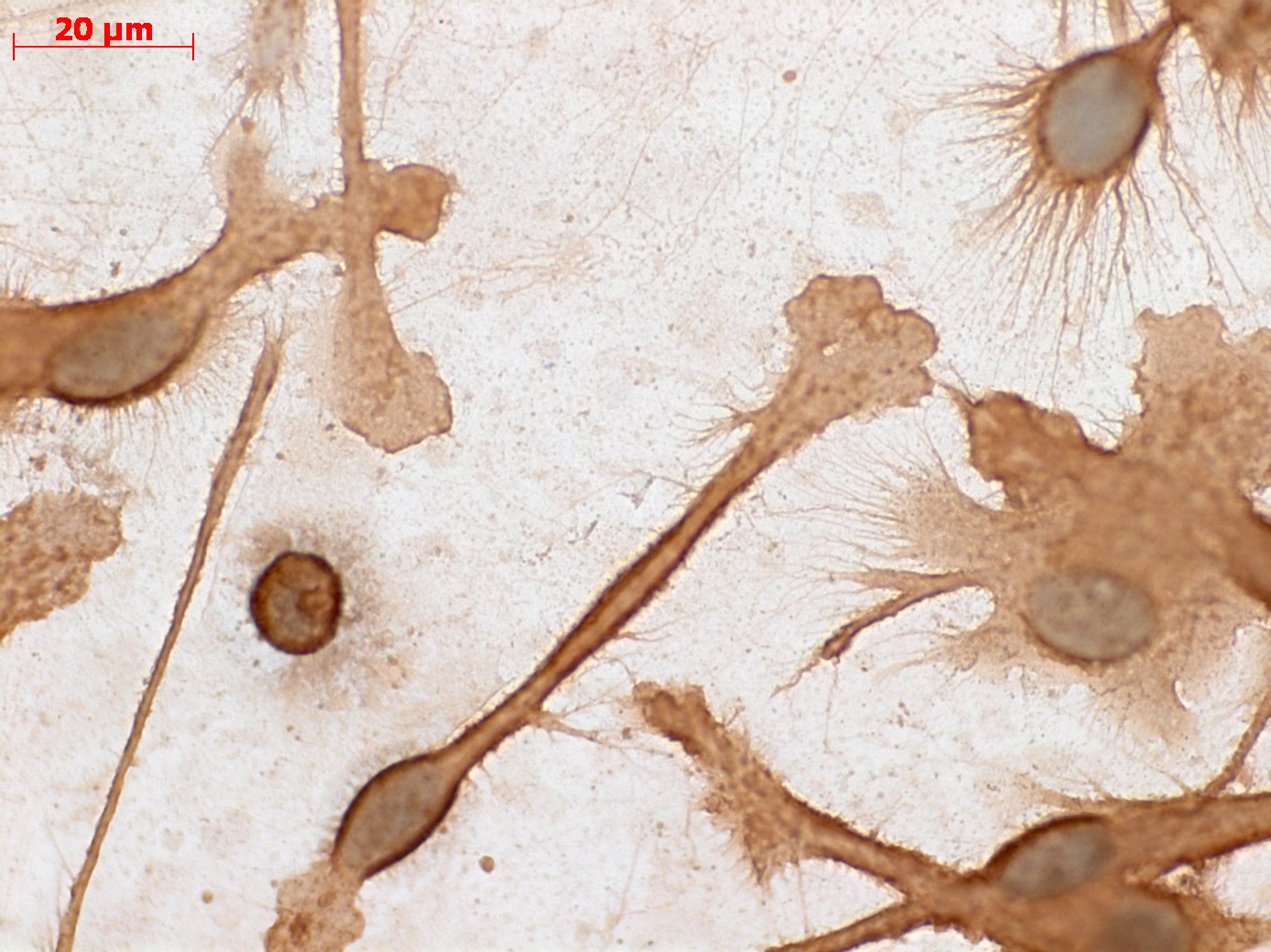
Дендритные клетки являются важным звеном в формировании приобретенного иммунитета. Согласно данным медицинских исследований, количество дендритных клеток в организме пациента со злокачественными опухолями существенно снижено, а сами они функционируют неполноценно.
Считается, что снижение количества дендритных клеток и потеря эффективности их работы является одной из основных причин отсутствия полноценной иммунологической защиты организма на развивающийся раковый процесс.
Из этого можно сделать вывод, что даже при введении антигенов непосредственно в патологический очаг не наблюдается активизации иммунитета в нужном объеме. При культивировании дендритных клеток в условиях in vitro часто удается избежать отрицательного действия иммунносупрессивных факторов и обеспечить полноценное созревание этих клеток.
Дендритные клетки культивируют в среде, которая содержит материал опухоли. Для изготовления вакцины материал, взятый из опухоли, обрабатывается специальным образом, что позволяет повысить иммуногенность опухолевых антигенов.
Индивидуальное изготовление вакцины для каждого пациента
Биовакцины, изготовленные индивидуально для каждого отдельного пациента, на сегодняшний день являются самыми безопасными и высокоэффективными в лечении онкологических заболеваний. Благодаря проведенным исследованиям было установлено, что использование вакцин на основе дендритных клеток в составе комплексного лечения рака позволило существенно повысить продолжительность и качество жизни пациентов.
После введения вакцины в организм дендритные клетки перемещаются в лимфоидную ткань, где участвуют в обучении Т-лимфоцитов и инициируют их пролиферацию. Терапевтический эффект вакцины заключается в активизации цитотоксических Т-лимфоцитов, активность которых у онкологических больных существенно снижена.
Для подбора эффективного метода лечения вы можете обратиться за
— методы инновационной терапии;
— возможности участия в экспериментальной терапии;
— как получить квоту на бесплатное лечение в онкоцентр;
— организационные вопросы.
После консультации пациенту назначается день и время прибытия на лечение, отделение терапии, по возможности назначается лечащий доктор.
Дендритная вакцина что это
Онкоиммунология является достаточно новым и перспективным направлением в лечении рака. В клинике онкоиммунологии в НМИЦ им. Н.Н. Петрова в рамках этого направления успешно применяется инновационная методика – вакцинотерапия дендритными клетками. Вот уже полтора десятка лет она показывает хорошие результаты лечения при таких видах онкологических заболеваний, как кожная меланома, саркома мягких тканей, рак кишечника, а также рак почки. С 2010 года коллективом специалистов научного отдела онкоиммунологии проведено более 1580-и лечебных циклов для 203-х больных. Результаты впечатляют. Поэтому именно сейчас пришло время для определения путей более широкого использования методики и расширения спектра заболеваний, в борьбе с которыми она может применяться.
Центр развивает онкоиммунологию с 1998 года
Иммунотерапия как новый подход в лечении онкологических заболеваний, была создана в Санкт-Петербурге, в НМИЦ им. онкологии Н.Н. Петрова, где в 1998-м году начала работу лаборатория онкоиммунологии. Именно на базе этой лаборатории удалось установить, что собственные иммунные клетки пациента можно «обучить» распознавать опухолевый процесс в организме.
Онкоиммунология преодолевает трудности лечения рака
Многие опухоли сложны в лечении именно потому, что они способны маскироваться от иммунных клеток, а порой и инактивировать их. Поэтому стандартные методы лечения рака, применяемые в клиниках: хирургия, химиотерапия, лучевая терапия, гормональная терапия – остаются без поддержки со стороны иммунной системы пациента. Однако в лаборатории онкоиммунологии был найден способ «перезапустить» иммунитет пациента, предварительно настроив его на конкретную опухоль. Для этого используются дендритные клетки из костного мозга (они всегда присутствуют в крови наряду с лейкоцитами, лимфоцитами и прочими клетками), задача которых предъявить основным защитным клеткам организма – Т-лимфоцитам – белковые молекулы, характерные для опухоли (антигены).
Создание вакцины из дендритных клеток
Процесс проходит в специальном сосуде, куда помещается подготовленная кровь, ранее взятая у пациента, а также «обломки» опухоли, выделенной из его же организма, либо антигены похожей опухоли, имеющиеся в банке НМИЦ. Дендритные клетки оседают на стенках сосуда и начинают активно поглощать (фагоцитировать) опухолевые частицы, формируя на своей поверхности специфический «обучающий сигнал». С последующим введением содержащей такие дендритные клетки суспензии в организм, Т-лимфоциты получают возможность «узнать» опухоль и начать атаковать её.
Детям – бесплатное лечение
Патент на онкоиммунологический способ лечения «Иммунотерапия костно-мозговыми дендритными клетками больных солидными опухолями» зарегистрирован НИИ им. Н.Н. Петрова в 2003 г. В 2008 г. запатентована вакцина на основе дендритных клеток. В 2010 г. получено разрешение Минздрава РФ на применение этой медицинской технологии в клинической деятельности. На сегодняшний день, лечение индивидуальными противоопухолевыми вакцинами доступно только для детей; для взрослых лечение платное.
Отзывы пациентов
Лечение индивидуальной противоопухолевой вакциной на основе дендритных клеток пациента в клинике онкоиммунологии в Санкт-Петербурге может быть назначено пациентам, соответствующим определенным критериям включения и исключения, как взрослым, так и детям.
Для того, чтобы определить возможность прохождения вакцинотерапии необходимо:
В зависимости от заболевания врач первичного приема может отменить то или иное исследование из п. 1-3 стандартного списка, а также уточнить параметры исследования 4. Стандартный список см. ниже.
Обследования, результаты которых необходимо иметь на руках во время первичного приема онкоиммунолога (должны быть выполнены в течение последних 30 дней):
МРТ и КТ выполняются с промежутком 1 день.
Обследования после остеосцинтиграфии проводятся через 3 дня (начиная с дня, следующего за днем проведения этого обследования).
Рекомендуем Вам выполнить исследования 4 и 6 в лаборатории НМИЦ онкологии.
Внимание!! Мы ждем Вас на консультации в клинике онкоиммунологии со всеми имеющимися медицинскими документами и их ксерокопиями: эпикризами, результатами обследований и анализов за прошедшие периоды (чтобы врач мог проанализировать динамику) и пр. Обязательно возьмите с собой свою гистологию: блоки и стекла.
Запись на анализы и прием по телефону (812) 43-99-555 с 9 до 21 часа
Материалы конгрессов и конференций
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ВАКЦИНЫ НА ОСНОВЕ ДЕНДРИТНЫХ КЛЕТОК В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
И.А. Балдуева
ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Многочисленными работами последних десятилетий показано, что при злокачественных опухолях нет адекватного иммунного ответа. Это может быть обусловлено несколькими причинами:
- 1) недостаточная иммуногенность опухолевого/опухолеасоциированного антигена;
2) способность опухоли вызывать местную или системную иммунодепрессию (интерлейкин-10, трансформирующий фактор роста-?, фактор роста эндотелия сосудов и др.) со снижением активности Т-лимфоцитов;
3) нарушение механизма представления опухолеасоциированного антигена.
Клинические исследования по изучению активной специфической иммунотерапии больных с опухолями различных локализаций проводятся в настоящее время во всех онкологических центрах мира. Объектами исследования являются вакцины на основе аутологичных или аллогенных не модифицированных и модифицированных опухолевых клеток, синтетические поливалентные вакцины, вакцины на основе дендритных клеток и др.
Известно, что свободные (несвязанные) антигены не распознаются Т-лимфоцитами даже в том случае, если эти клетки экспрeссируют рецепторы соответствующие антигену. Для того чтобы инициировать иммунный ответ, антиген должен быть представлен на поверхности антиген-представляющей клетки в контексте с HLA молекулами и в ассоциации с другими поверхностными молекулярными структурами (костимулирующие, адгезивные и др.). Это событие является определяющим как в стимуляции Т-клеток, так и в формировании эффективного иммунного ответа (Guinan E., 1994). Т-клетки «памяти» могут инициировать иммунный ответ в более короткий срок при взаимодействии с различными антиген-представляющими клетками (В-клетки, макрофаги, дендритные клетки), из которых дендритные клетки (ДК) способны к индукции первичного ответа непраймированными Т-клетками. К основным свойствам ДК относятся:
Как показали исследования, количество ДК в организме больных злокачественными опухолями снижено, а сами они функционально неполноценны. ДК, выделенные из периферических лимфоидных и нелимфоидных тканей и периферической крови как экспериментальных животных с опухолями, так и онкологических больных не способны стимулировать специфический ответ цитотоксических Т-лимфоцитов (ЦТЛ) и слабо стимулируют Т-хелперы (Bernard J. et al., 1997; Gabrilovich D. et al., 1996; Zitvogel L. et al., 1996). Кроме того, на их поверхности было выявлено снижение экспрессии адгезивных и костимулирующих молекул, а также критическое снижение экспрессии HLA-молекул, особенно I класса. Предполагается, что уменьшение количества ДК и потеря ими ряда функций может быть одной из главных причин отсутствия полноценного иммунного ответа на развивающуюся опухоль.
Культивирование периферических ДК in vitro в условиях, позволяющих получить их максимальный рост и активацию, приводило к увеличению экспрессии поверхностных молекул, но уровень их часто оказывался недостаточным для индукции устойчивого ответа специфических ЦТЛ (Gabrilovich D. et al., 1996). Наибольшей способностью по сравнению с периферическими ДК к представлению специфического опухолевого антигена Т-лимфоцитам обладают костномозговые предшественники ДК, а также сингенные или аллогенные ДК из периферической крови здоровых индивидуумов, активированные in vitro опухоль-ассоциированными антигенами (Palmer E. et al., 1997; Reid C., 1997). Только такие ДК в большинстве случаев стимулировали нормальный ответ ЦТЛ. Это позволяет считать активированные ДК перспективными кандидатами для активной специфической иммунотерапии пациентов с распространенными формами злокачественных опухолей, в том числе и резистентных к стандартному лечению.
Формирование эффективного противоопухолевого иммунного ответа на вакцинотерапию, как правило, требует от нескольких недель до нескольких месяцев. Поэтому клинический эффект активной специфической иммунотерапии является отсроченным (Jefford M. et al., 2001). Понятно, что этот метод должен быть более эффективным при применении с адъювантной целью в случае так называемой резидуальной опухолевой болезни. При большой опухолевой массе эффективность вакцинотерапии a priori значительно ниже, так как в этих случаях часто наблюдается недостаточное проникновение в опухоль клеток-эффекторов, генерированных в результате вакцинации.
Вакцинотерапия может быть неэффективной у пациентов с быстрым опухолевым ростом, так как при прогрессировании злокачественные опухоли генетически нестабильны (следствие мутаций), и это может способствовать «уклонению» новых опухолевых клонов от распознавания иммунной системой хозяина. Поэтому многие клинические исследования ДК-вакцинотерапии проводятся на пациентах с минимальной остаточной болезнью. Это связано с решением таких важных задач как увеличение выживаемости и безрецидивного периода. Вместе с тем применение современных методов иммунотерапии у больных с диссеминированными опухолями, устойчивыми к традиционным методам лечения, помогают более полно понять эффективность иммунологического ответа, биологию опухолевого роста, а также определить место иммунотерапии в комплексном лечении онкологических больных.
При разработке методов вакцинотерапии большое значение имеют лабораторные тесты, результаты которых могут прогнозировать клиническое течение заболевания. К ним относится: исследование специфических пептид-HLA-тетрамеров, внутрицитоплазматического интерферона-?, ELISPOT-тест (enzyme-linked immunospot), полимеразная цепная реакция с использованием обратной транскриптазы (Sznol M. & Marincola F., 2000). Эти тесты позволяют определить количество антиген-специфических Т-клеток в периферической крови и способность Т-клеток повреждать клетки-мишени, экспрессирующие чужеродный антиген.
Большие споры вызывает вопрос о выборе материала для лабораторного исследования при оценке ответа на вакцинотерапию: периферическая кровь, опухолевая ткань или дренированные лимфатические узлы. Определение содержания антигенспецифических эффекторных клеток в циркулирующей крови отмечено как наиболее значимое. Вместе с тем важным остается изучение связи лабораторных показателей и отсроченного регресса опухоли. С практической точки зрения наибольшее значение имеют клинические методы оценки лечебного эффекта (полный, частичный регресс, стабилизация процесса и их продолжительность).
Одновременно оцениваются различные методы доставки антигена для ДК ex vivo. Для активации ДК используют специфические пептиды, но их применение ограничено в связи с зависимостью от HLA фенотипа пациента (Nestle F., 2000). При некоторых опухолях опухолеассоциированные антигены остаются неизвестными, поэтому используется лизат цельных опухолевых клеток (Ashley D. et al., 1997), пептиды, элюированные с поверхности аутологичных опухолевых клеток, конъюгаты «ДК-опухолевая клетка» (Hart I. & Colaco C., 1997). РНК и ДНК опухолевой клетки также могут быть трансфицированы в ДК с целью синтеза антигенного опухолевого белка и/или представления на своей поверхности иммуногенных пептидов (Nair S. et al., 1998; Philip R. et al., 1998). Противоопухолевым эффектом обладают также экзосомы, которые представляют собой «антиген-представляющие пузырьки», полученные из опухолевых клеток или ДК (Zitvogel L. et al., 1999).
В последнее время установлено, что выбор типа ДК для клинического применения зависит от типа антигена (Serody J. et al., 2000). ДК процессируют антиген, который может быть доставлен как пептид, белок или генетическая вакцина. Незрелые ДК, которые активно используют эндоцитоз и эффективно захватывают экзосомы, могут быть наиболее подходящими для доставки иммуногенного белка или антигенных комплексов. В противоположность этому, зрелые ДК с высокой экспрессией HLA молекул могут быть наиболее подходящими для использования пептидов. Короткие пептиды (от 8 до 10 аминокислотных остатков) могут напрямую связываться с HLA молекулами (молекулами главного комплекса гистосовместимости) на поверхности ДК и не нуждаются в захвате антигена и его процессинге. В клинических исследованиях оцениваются молекулярно-биологические методы, которые способствуют увеличению функциональной активности ДК. Генные манипуляции с ДК ex vivo способствуют экспрессии на их поверхности молекул цитокинов или иммуностимулирующих молекул, которые могут усилить ДКТ-клеточное взаимодействие и, как следствие, противоопухолевый иммунный ответ (Philip R. et al., 1998).
Производится также поиск оптимальной дозы ДК, разрабатывается график вакцинаций, оцениваются пути введения ДК-вакцины. Установлено, что ДК должны обладать следующими свойствами:
1) после культивирования ex vivo быть жизнеспособными in vivo в течение продолжительного времени, так как они могут достаточно долго не встретить уникальные (редко встречающиеся) антигенспецифические Т-клетки в лимфатических узлах;
2) эффективно мигрировать к лимфатическим узлам;
3) содействовать эффекторной функции Т-клеток in vivo.
Кроме того, выживаемость in vivo эффекторных Т-клеток, генерированных с помощью вакцинации, нуждается в продолжительной стимуляции, обеспечивая тем самым оптимальную и устойчивую ориентацию на опухоль.
Важным является клинически оценить подкожное, внутрикожное, внутрилимфатическое и внутривенное введение ДК-вакцин. Введение вакцины в периферические лимфатические узлы требует от нагруженных ДК миграции в лимфоидную ткань и длительного поддержания там стимулирующей способности Т-клеток. При внутривенном введении ДК оседают в легких, печени, селезенке и костном мозге, но они не обнаруживаются в лимфатических узлах или опухолевых образованиях (Morse M. et al., 1999). В противоположность этому, исследования с использованием внутрикожного введения ДК, полученных из моноцитов, показали миграцию ДК в лимфатические узлы. В этих исследованиях использовались незрелые ДК, и их количество было незначительным. Большинство ДК остаются в месте введения (Thomas R. et al., 1999). Это свидетельствует о том, что незрелые ДК являются субоптимальной популяцией для достижения вакциной лимфоидной ткани. Вместе с тем Schuler-Thurner B. et al. (2000) использовали ДК, полученные из моноцитов ex vivo, которые эффективно стимулировали противоопухолевый иммунный ответ. Без прямого сравнения эти данные можно объяснить эффективной миграцией и представлением опухолеспецифического антигена Т-лимфоцитам активированными ex vivo ДК.
Таким образом, представленный обзор данных литературы показывает, что методы вакцинотерапии на основе ДК при лечении онкологических больных могут быть самыми разнообразными. Разработке перспективных методов ДК-вакцинотерапии способствуют успехи, достигнутые в области молекулярной биологии, гибридомная технология, рекомбинантные формы различных биологически активных веществ и многие другие достижения.
Решение вопроса об эффективности противоопухолевых вакцин, применяемых с лечебной и адъювантной целями, будет основано на получении объективных данных об увеличении продолжительности жизни онкологических больных, отсутствии риска развития поствакцинальных осложнений и соотношении стоимость/эффективность.
Дендритная вакцина что это
Аргументы и Факты
Вакцина против рака. Бороться с опухолью могут иммунные клетки больного
Меланома. Саркома. Рак прямой кишки. Каждый из этих диагнозов звучит как приговор. Традиционные методы лечения не помогают. Девять из десяти больных погибают в первый же год после диагноза. Остановить прогрессирование болезни – значит спасти жизнь. Пусть на время, пусть на 10–15 лет, но всё-таки…
Иммунная система пациента с агрессивной формой рака словно вывешивает белый флаг и в упор не видит опасные для жизни клетки. Но научить её распознавать клетки новообразования и бороться с ними всё-таки возможно.
Лаборатория в составе отделения биотерапии опухолей была создана в НИИ онкологии имени Н. Н. Петрова в 1998 году. Уже через пять лет учёные получили свой первый патент – на иммунотерапию костномозговыми дендритными клетками больных солидными опухолями. Ещё через пять лет, в 2003 году, запатентована аутологичная вакцина на основе костномозговых дендритных клеток в сочетании с фотодинамической терапией для лечения химиорезистентных диссеминированных солидных опухолей. В 2010 году специалисты НИИ получают разрешение применять своё изобретение в клинической деятельности. В 2014‑м создаётся научный отдел онкоиммунологии.
А если иммунитет очнётся?
Новое – это хорошо забытое старое. Уникальные противоопухолевые вакцины учёные из НИИ онкологии имени Н. Н. Петрова создают в конце XX – начале XXI века. Но мало кто помнит, что ещё в XIX веке медицинская наука обратила внимание на интересную закономерность: пациенты, у которых есть опухоль, заболевают инфекцией и… выздоравливают. Опухоль разрушается!
А почему разрушается опухоль? Впоследствии выяснилось: потому что активируется иммунная система. Она как будто приходит в сознание и начинает видеть не только вирусы или бактерии, но и опухолевые клетки, которые до поры до времени успешно уклонялись от иммунного надзора. Новое направление в медицине начало развиваться, но вскоре изобрели лучевую терапию, а затем химиотерапию. Эти методы стали давать результаты, и об иммунной системе на время забыли.
Но прошло много лет, и стало понятно, что химиотерапия и лучевая терапия – ещё не панацея. Необходимы дополнительные методы лечения, которые восстановят противоопухолевый иммунный ответ. К исследованию клеток иммунной системы вернулись вновь.
Когда опухоль сильнее лимфоцита
Кстати, а почему иммунитет оказывается беспомощным перед опухолевой клеткой? Наш организм похож на общество: наиболее активно и эффективно отстаивают свои права те, у кого они не так уж и нарушены.
«Опухолевые клетки секретируют факторы, которые уменьшают активность лимфоцитов, – рассказывает заведующая научным отделом онкоиммунологии, доктор медицинских наук, ведущий научный сотрудник Ирина Александровна Балдуева. – Бывает так, что когда лимфоцит контактирует с опухолевой клеткой, то… не лимфоцит разрушает опухолевую клетку, а опухолевая клетка запускает механизм клеточной смерти лимфоцита. Она оказывается сильнее. Своей изменчивостью, своим желанием защитить себя. В опухолевом очаге 3,5 см генетики насчитывают более ста тысяч мутаций. По некоторым опухолевым клеткам нельзя уже определить, от мужчины они или от женщины…»
Из-за мутаций и быстрого роста опухоли иммунная система перестаёт узнавать опасные клетки, которые когда-то были родными, а теперь стали чужеродными. Есть даже теория, что опухолевым клеткам помогают… нормальные, здоровые клетки, расположенные по соседству. Они начинают синтезировать факторы роста, благодаря которым развивается новообразование.
Надо успеть
У каждого пациента своя вакцина. Та, которая подействует именно на его опухоль. Для этого учёные тщательно изучают опухолевые клетки, взятые у больного. Измельчив биоматериал с помощью специальной автоматической машины, пытаются полностью охарактеризовать опухоль – выявить все особенности её поведения, все иммуносуппрессирующие факторы, которые она продуцирует. Нет, это совсем не опечатка.
Опухолевые клетки в отличие от многих из нас всеми силами цепляются за жизнь. Не сработал один механизм подавления иммунной системы – она вырабатывает другой. Не сработал другой – создаёт третий. На экране клеточного видеокомпьютера видно, как стремительно делятся клетки рака толстой кишки. Специальные ножи лабораторной автоматической машины, раскрошившие опухоль на отдельные клетки, новообразованию, кажется, нипочём.
«Конечно, то, что вы видите сейчас, – это процесс, ускоренный в несколько раз. Но как растёт опухоль здесь, в лаборатории, так она растёт и в организме пациента. И надо успеть начать лечить заболевшего человека», – замечает кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Татьяна Леонидовна Нехаева. И продолжает знакомить с процессом воссоздания клеток иммунной системы, способных вернуть к жизни уже ни на что не реагирующую иммунную систему.
Чтобы успеть, необходимо приготовить вакцинный препарат и ввести больному человеку его первую инъекцию. На создание препарата требуется десять дней – если процесс пройдёт удачно с первой же попытки.
За два первых месяца лечения пациент получит вакцину четырежды. В препарате будут активированные дендритные клетки, которые научат лимфоциты распознавать опухоль. Так стартует иммунный ответ.
Как рождается вакцина
Противоопухолевая вакцина создаётся из собственных клеток иммунной системы больного. Со стороны начало работы очень похоже на обычный анализ крови из вены. В биоматериале учёные по специальным методикам выделят предшественников периферических дендритных клеток – моноциты. А потом начнётся самое сложное. Моноциты необходимо дифференцировать в дендритные клетки. Для этого нужны специальные факторы роста клеток человека (никак не факторы роста для экспериментальных животных), в частности, интерлейкин‑4, гранулоцитарно-макрофагальный колониестимулирующий фактор и особая бессывороточная питательная среда (без ксеногенных факторов лабораторных животных) для получения индивидуальной вакцины человека. В такие условия моноциты помещаются на десять дней. Через неделю их забирают на анализ – проточную цитометрию. Если процесс прошёл правильно, лаборатория обнаружит в материале предшественников – незрелые дендритные клетки. Если же нет, придётся начинать всё сначала. И дай бог успеть вовремя. Так бывает у начинающих учёных без опыта работы, наличия импортных ростовых факторов и специальной дендритноклеточной питательной среды.
Следующий шаг – превратить дендритные клетки из круглых, незрелых, в зрелые, древовидные. Дендритная клетка растёт, когда «ловит» специфические антигены и представляет их на своей поверхности, поясняет Татьяна Нехаева. Если в период роста дендритной клетке добавить антигены бактериальные, то она поможет иммунной системе сформировать антибактериальный иммунитет. Если же клетка получит антигены опухоли, формируется сильный противоопухолевый иммунный ответ.
Созревшая дендритная клетка, уже представляющая частицы опухоли на своей поверхности, становится основным компонентом противоопухолевой вакцины.
Теперь, когда пациента вакцинируют, самое главное – способность полученных дендритных клеток к миграции. После введения вакцины в организм больного клетки направятся в лимфоузлы и там смогут представить опухолевые антигены клеткам иммунной системы, Т‑лимфоцитам. Т‑лимфоциты получат «отпечаток» опасности и, узнав врага в лицо, начнут с ним бороться. А врач будет следить за тем, как развивается противоопухолевый иммунный ответ в организме пациента, и думать, как его усилить, чтобы излечить болезнь.
Надо просто любить эти клеточки…
«Клетки ведут себя точно так же, как само поведение человека. У пациента с повышенной нервозностью состояние клеток будет соответствовать его душевному состоянию. И наоборот. Один из наших пациентов до болезни служил в разведке, длительное время работал за рубежом. Его индивидуальная вакцина оказалась образцовой! Снимки можно было помещать хоть на картинки в учебниках», – рассказывает Ирина Балдуева.
Приготовление вакцинного препарата – процесс не только и не столько химический. Если не любить отдельные живые клетки, если не относиться к ним бережно и заботливо, как к маленьким детям, лекарство не получится. И пациент не выздоровеет.
А причины могут быть самые разные: «молодой» учёный забыл добавить ростовые факторы, ошибся с дозировкой, не проверил состояние вакцинных клеток, проглядел инфекцию, непонятным образом проникшую в стерильный асептический блок…
Доктор медицинских наук Ирина Александровна Балдуева, разрабатывающая противоопухолевые вакцины в НИИ онкологии им. Н. Н. Петрова с 1998 года, замечает: важен не только настрой больного на выздоровление, но и настрой специалиста, который создаёт вакцинный препарат. И пусть это кажется странным, но клетки иммунной системы получаются активными и жизнеспособными только тогда, когда к ним относятся с особой любовью.
Одиночество опасно для жизни
Наши клетки – это мы сами в миниатюре. Сегодня в науке уже известно: когда человек в депрессии, по-другому работает не только мозг, но и все без исключения органы и системы. Возможности нашего организма безграничны – и многое вопреки всем достижениям медицинской науки зависит от того, какой приказ отдаст подсознание.
«Если больной НЕ хочет жить, то медицина бессильна, – говорит кандидат медицинских наук, старший научный сотрудник научного отдела онкоиммунологии Алексей Викторович Новик. – У меня была пациентка, которая заболела раком яичника. Её внучке было три года. И женщина поставила себе цель: хочу выдать любимую внучку замуж, увидеть, как начинается её семейная жизнь». Несмотря на страшный диагноз, бабушка прожила ещё 18 лет. И успела поздравить внучку со счастливым браком.
Другой случай из практики врачей НИИ онкологии им. Н. Н. Петрова. На сей раз печальный. Молодую женщину спасти не удалось. А всё началось с того, что во время медового месяца её муж случайно задел наручными часами родинку у неё на спине. На месте содранной родинки началось кровотечение. Несомненно, кровотечение остановили. Но вскоре развилась агрессивная форма меланомы. Далее было всё очень банально – пациентку бросил муж, ставший невольным виновником заболевания. Это подкосило женщину ещё больше. Не помогли ни поддержка родителей, ни усилия врачей. Красивая и очень молодая женщина с онкологическим диагнозом твёрдо решила, что жить ей незачем.
Пациент не должен оставаться один – это одно из главных условий выздоровления. Когда человек небезразличен своим близким, то и лечение идёт намного эффективнее. Другой вопрос, что одиночество и брошенность каждый понимает по-своему. Есть люди, для которых при расставании с супругом или возлюбленным перестают существовать и друзья, и родные, и смысл жизни. А кто-то считает, что у меня есть три кошки и я буду жить ради них. «Выздороветь ради счастливой будущей жизни вас и очень важных для вас близких людей», – напутствует своих пациентов доктор Ирина Александровна Балдуева.
На стенах кабинета Ирины Александровны Балдуевой – прекрасные картины. Многие из них создал её пациент – художник, капитан 2-го ранга в отставке. Несмотря на ампутированную руку, Борис Матвеевич пишет новые пейзажи, руководит Фондом культуры и учит рисованию маленьких детей из неполных семей. Денег за уроки он не берёт.
Метастазы может остановить противоопухолевая терапевтическая вакцина. В НИИ онкологии им. Н. Н. Петрова, на окраине Санкт-Петербурга, в посёлке Песочный, учёные трудятся над созданием профилактической вакцины против рака – такой, которую можно будет ввести каждому пациенту с факторами риска прогрессирования заболевания. Чтобы страшного диагноза «рак» он и его близкие не услышали уже никогда.