Депакин чем можно заменить
Выбор препаратов вальпроевой кислоты в терапии эпилепсии: оригинальный препарат или генерик?
Эпилепсия является одним из наиболее распространенных заболеваний центральной нервной системы (ЦНС). Ежегодный рост заболеваемости эпилепсией составляет от 40 до 70 человек на 100 тыс. населения, при этом приблизите
Эпилепсия является одним из наиболее распространенных заболеваний центральной нервной системы (ЦНС). Ежегодный рост заболеваемости эпилепсией составляет от 40 до 70 человек на 100 тыс. населения, при этом приблизительно у 1/3 пациентов заболевание является пожизненным. По данным ВОЗ, более 75% из 40 млн больных эпилепсией в мире не получают адекватного лечения. Длительность фармакотерапии эпилепсии составляет в среднем от двух до пяти лет, однако около 40% больных вынуждены получать лечение пожизненно. В России 8,65% больных эпилепсией находятся в состоянии ремиссии, у 48,1% пациентов регистрируется более 12 приступов в год. Политерапию получают 41,18% пациентов; 18,05% не получают лекарственной терапии, остальным же проводится лечение одним препаратом. Сплошные популяционные исследования по разным регионам России показывают, что доля пациентов без припадков от общего числа больных, получавших антиконвульсантную терапию, составляет 13–28%, в то время как при правильной тактике лечения она должна составлять 50–80% [2].
На протяжении последних лет наблюдается увеличение количества новых противоэпилептических препаратов (ПЭП), из которых многие уже широко применяются на практике. ПЭП уделяется большое внимание со стороны компаний-производителей, учитывая их большой удельный вес среди других препаратов на фармацевтическом рынке. Этому есть несколько причин:
Фармакоэкономические аспекты терапии эпилепсии
Эпилепсия является серьезной социально-экономической проблемой, приводящей к значительным экономическим потерям в обществе. Цена лекарства является действительно важным фактором в подборе лечения для определенных групп населения. Стоимость лекарств и расходы на лечение становятся все более важными факторами для врачей первичной медико-санитарной помощи при лечении эпилепсии. Независимое исследование, выполненное в нескольких европейских странах, определило, что прямые и непрямые расходы на лечение индивидуальных больных эпилепсией возрастают прямо пропорционально частоте припадков у них [1].
Именно пациенты с рецидивами приступов берут на себя большую часть прямых медицинских расходов. Больные, не восприимчивые к лечению, требующие постоянной терапии, частых посещений врача и непрерывного медицинского ухода, составляют примерно 75% всех прямых расходов, относящихся к эпилепсии. В популяции больных, резистентных к лечению, прямые расходы еще выше у пациентов, страдающих эпилепсией и имеющих сопутствующие болезни, такие как олигофрения, церебральный инсульт, депрессия [1].
Основой хорошей клинической эффективности является оптимальный контроль эпилептических приступов соответствующим ПЭП, используемым в дозе, максимально контролирующей приступы, но не приводящей к появлению побочных эффектов. Эти две характеристики — оптимальный контроль приступов и отсутствие побочных эффектов — определяют ценность препарата и являются критерием правильности лечения. Обе характеристики связаны с биодоступностью, из которой вытекают биоэквивалентность и терапевтическая эквивалентность ПЭП [5]. Это совпадает с фармакоэкономической эффективностью: увеличившийся процент ремиссий позволяет сэкономить дополнительные средства за счет меньшего количества амбулаторных визитов к специалистам и снижения койко-дней [1].
Терапия эпилепсии: оригинальные препараты и генерики
В настоящее время широко обсуждается проблема назначения оригинальных и генериковых препаратов в терапии эпилепсии. При регистрации препаратов-генериков допускаются отклонения в биодоступности ±20%, по сравнению с оригинальными препаратами. Однако в отношении ПЭП даже незначительное изменение биодоступности может привести не только к возобновлению, но и к повышению частоты и тяжести приступов [2, 3, 5, 6, 7].
Предыдущие клинические наблюдения указывают, что замена оригинального препарата генериком, содержащим ту же лекарственную субстанцию, может в некоторых случаях приводить к возобновлению эпилептических припадков или развитию токсических эффектов препарата. Это возникает вследствие того, что биодоступность и связанная с ней биоэквивалентность генериков отличаются от оригинальных препаратов и/или их оценка произведена недостаточно полно или правильно [5, 8, 9, 17].
В настоящее время во всем мире для контроля над судорожными и бессудорожными припадками у детей и взрослых наиболее широко применяются препараты вальпроевой кислоты (ПВК). Вальпроевая кислота используется в клинической практике для коррекции и парциальных, и генерализованных (эпилептических) приступов [3, 4]. Эффективность вальпроатов является 100% подтвержденной при контроле за абсансами, миоклоническими и тонико-клоническими судорогами при первично генерализованных формах эпилепсии, а также при парциальных приступах с вторичной генерализацией [4].
На данное время в России ПВК зарегистрированы под следующими торговыми наименованиями: оригинальный препарат Депакин (производитель — Sanofi-Winthrop Industrie, Франция) и его пролонгированные формы Депакин Хроно и Депакин Хроносфера; генерики Конвулекс (производитель Gerot Pharmazeutika GmbH, Австрия), Апилепсин (производитель KRKA d.d., Словения), Конвульсофин (владелец регистрационного удостоверения AWD.pharma GmbH & Co.KG, Германия) и ряд генериков, произведенных в Индии: Энкорат (производитель Sun Pharmaceutical Industries Ltd, Индия) и Вальпарин ХР (производитель Torrent Pharmaceuticals Ltd, Индия).
Данные исследований
Мы проанализировали доступные данные исследований зарубежных и отечественных авторов, посвященные проблеме замены ПВК в терапии эпилепсии.
Данные зарубежных авторов оказались достаточно противоречивыми. С одной стороны, в открытых рандомизированных исследованиях, проведенных у 64 больных, которые в течение 4 недель принимали оригинальный препарат ПВК, а в дальнейшем в течение 4 недель генерик, не было выявлено разницы в частоте приступов, концентрации препарата в плазме при использовании обоих препаратов [5, 18]. С другой стороны, исследования FDA в 1998 году продемонстрировали разность в биодоступности препаратов ПВК [5]. В исследованиях Mattson (2002) генерик ПВК вызывал больше побочных эффектов со стороны желудочно-кишечного тракта в сравнении с оригинальным препаратом пролонгированного действия [5, 16]. Замена оригинального препарата ПВК генериком вызвала снижение концентрации препарата в крови и появление приступов после 3-летнего бесприступного периода [5, 14].
Исследование П. Н. Власова с соавт. (2007) показало повышение обращаемости пациентов к окружному эпилептологу после перевода с оригинального препарата ПВК (Депакина Хроно) на генерики препарата (Конвулекс, Вальпарин ХР, Энкорат) в связи с неблагоприятными побочными действиями генериков (крапивница, диспептические явления, учащение приступов) [2].
Интерес представляет исследование динамики пароксизмального синдрома, ЭЭГ-параметров и показателей фармакокинетики у больных эпилепсией на фоне замены лекарственных форм пролонгированного высвобождения с Депакина Хроно на Конвулекс ретардированной формы (Т. А. Рогачева, Т. С. Мельникова, А. С. Петрухин с соавт.) [6]. В исследовании принял участие 21 пациент с различными формами эпилепсии, в возрасте от 18 до 46 лет. По результатам исследования, замена лекарственных форм пролонгированного высвобождения вальпроата натрия Депакина Хроно на Конвулекс (ретард) вызывает неблагоприятные изменения в течении пароксизмального синдрома. При этом изменения показателей биоэлектрической активности головного мозга регистрировались уже после трех дней приема Конвулекса в ретардированной форме и проявлялись усилением медленноволнового спектра дельта-, тета- и альфа-диапазонов, трансформацией медленноволновой активности в разрядную (к 14 дню терапии) с дальнейшим увеличением дизритмии и нарастанием разрядной активности. У всех больных после смены препаратов обнаруживались изменения максимальной концентрации их в сыворотке крови, которые имеют прямую зависимость с изменениями ЭЭГ-показателей. По мнению авторов, результаты проведенного исследования подтверждают существенные отличия в биоэквивалентности между исследуемыми препаратами, которые проявляются выраженными изменениями на ЭЭГ у большинства пациентов и утяжелением течения пароксизмального синдрома. Данные авторов свидетельствуют об отсутствии клинической эквивалентности между препаратами Депакин Хроно и Конвулекс (ретард), что может иметь существенное клиническое значение.
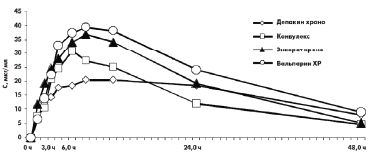
В исследовании А. В. Соколова и соавт. (2006) убедительно доказаны достоверные отличия фармакокинетических показателей различных форм ПВК с контролируемым высвобождением активного вещества [7]. Согласно полученным данным, наиболее адекватным по фармакокинетическим характеристикам оказался Депакин Хроно, динамика концентрации и режим дозирования которого полностью соответствовали заявленным фирмой-производителем. Фармакокинетические параметры других препаратов — Конвулекс, Вальпарин ХР и Энкорат Хроно — существенно отличались: они быстрее всасывались, скорость достижения максимальной концентрации в плазме крови (Сmax) была более высокой, препарат быстрее выводился из организма. Проведение терапевтического лекарственного мониторинга выявило их неэквивалентность Депакину Хроно, и, как следствие, были даны рекомендации по уменьшению разовой/суточной дозы и более частому приему ПЭП. При этом для Конвулекса разовая доза должна составлять 410 мг вместо 500 мг, а очередная доза препарата должна быть принята через 8,23 ч, а не через 12 ч, как заявлено в аннотации. Концентрации различных вальпроатов после приема однократной дозы представлены на рис.
Соответственно, в наблюдениях реально повышенная разовая доза препарата и высокий уровень Сmax приводили к развитию побочных явлений, а быстрое падение концентрации и выведение препарата обусловливало срыв медикаментозной ремиссии [2, 7].
Ретроспективное исследование Ю. Б. Белоусова и А. Б. Гехт с соавт. показало фармакоэкономические преимущества при применении Депакина Хроно [1]. Общее количество припадков снижалось в среднем с 48 до 1,5 в год, что было самым низким показателем среди всех исследуемых ПЭП. Высокую эффективность авторы связывают, в первую очередь, с фармакоэкономическими свойствами: если больной забывает принять таблетку, при приеме Депакина Хроно его пролонгированное 12-часовое действие позволяет избежать пикового снижения концентрации и, соответственно, эпилептических приступов, чего невозможно добиться от ретардированной формы карбамазепинов. Это позволяет снизить количество визитов к специалистам и госпитализаций минимум в 2 раза, что значительно экономит средства.
Таким образом, данные отечественных исследований свидетельствуют о более высокой частоте возникновения неблагоприятных побочных реакций при переводе с оригинального ПВК на генерик.
Диагноз: эпилепсия. Что назначить: оригинальный препарат или генерик?
В случае назначения лечения пациенту с впервые диагностированной эпилепсией необходимо принять решение: назначить оригинальный препарат или генерик? У больных с впервые диагностированной эпилепсией лечение можно начинать с использования оригинального препарата или генерика, подобранного в соответствии с общими принципами адекватного контроля приступов без проявления побочных эффектов. В большинстве случаев контроль над приступами достигается при использовании средних дозировок препарата [5, 10, 13, 16] и вероятность колебаний концентрации ПЭП в крови не имеет такого большого значения, как, например, в случае значения концентрации препарата в плазме на уровне верхней или нижней терапевтической. То же характерно и в случае длительно текущей эпилепсии с хорошим контролем приступов при помощи средних дозировок препарата. Учитывая то, что результат лечения оценивается клинически на основании уровня концентрации препарата в крови, правильно воспроизведенный генерик — это препарат, концентрация которого в крови соответствует терапевтической, принятой и для больных с впервые выявленной эпилепсией, и для больных с хронической эпилепсией. В таких ситуациях врач может руководствоваться при назначении препарата экономическими принципами, основываясь на том, что генерик отвечает всем установленным требованиям для регистрации [5].
Однако существуют ситуации, когда генерик назначать нежелательно, так как имеется риск ухудшения клинической картины, например, при выборе препарата для больных с высоким риском ухудшения состояния. Это следующие категории пациентов:
Заключение
Результаты анализа затрат на лечение эпилепсии указывают на то, что существует следующая зависимость: стоимость лечения тем ниже, чем лучше контроль приступов. Следовательно, оптимальный контроль над приступами (с минимальным количеством побочных проявлений) — самый важный элемент, снижающий стоимость терапии. Замена одного препарата другим (оригинального генериком и наоборот или одного генерика другим) может иметь опасные последствия для течения эпилепсии (рост частоты приступов и/или побочных проявлений). Эти последствия влекут за собой непредвиденные прямые затраты, связанные с дополнительными визитами к врачу, лабораторными исследованиями, госпитализацией.
Необходимо помнить о следующих категориях пациентов с риском ухудшения клинической картины при замене оригинального ПЭП на генерик. Это больные с резистентной эпилепсией с оптимально контролируемыми приступами без побочных проявлений при приеме ПЭП; пациенты с длительной ремиссией приступов на фоне приема низких доз препарата или в период снижения принимаемой дозы; пациенты с измененной фармакокинетикой ПЭП [5].
Фармацевты не должны заменять один препарат другим без разрешения врача, а врач, в свою очередь, должен сообщить больному о возможных последствиях замены.
По вопросам литературы обращайтесь в редакцию.
Д. В. Марушкин, кандидат медицинских наук, доцент
Л. Г. Раевская
ВолГМУ, Волгоград
Современные принципы противоэпилептической терапии взрослых
Эпилепсия — это хроническое заболевание головного мозга, требующее многолетнего, а в 30% процентах случаях пожизненного приема противоэпилептических препаратов.
Эпилепсия — это хроническое заболевание головного мозга, требующее многолетнего, а в 30% процентах случаях пожизненного приема противоэпилептических препаратов. Целью лечения эпилепсии является предотвращение развития приступов. Для этого применяют современные противоэпилептические препараты (ПЭП). При этом цель не может быть достигнута любой ценой. В настоящее время существует концепция, что лечение эпилепсии это больше чем просто контроль над приступами, хотя свобода от приступов очень важна. Таким образом, речь идет об изменении стратегии лечения: от количественной к качественной помощи больным эпилепсией. Проведение всесторонней реабилитации (медикаментозной и немедикаментозной) позволяет людям с эпилепсией вести полноценную, неограниченную, продуктивную жизнь при отсутствии приступов и побочных действий ПЭП.
Достижение полного прекращения эпилептических приступов у больных эпилепсией является не только клинически, но прогностически значимым. Полное отсутствие приступов у больного позволяет предотвратить различные медицинские и социальные последствия, такие как физические повреждения (травма и т.д.), психические нарушения (депрессия, тревога и т.д.), социальные последствия (отчуждение в обществе, дискриминация и др.), и в перспективе, при учете различных факторов после достижения медикаментозной ремиссии, добиться полного прекращения приема препаратов.
Современное назначение противоэпилептических препаратов основано на учете многих факторов, в первую очередь определении эпилептического синдрома, типа приступов, а также возраста, пола, сопутствующей патологии, социального статуса и «пожелания» самого больного. Для идентификации эпилептического синдрома, во время постановки диагноза, врачи должны основываться на ряде факторов: типе приступа, электроэнцефалограмме (ЭЭГ) (во время приступа и без него), этиологии, изменении на магнитно-резонансной томограмме (МРТ), ответе на лечение ПЭП, учитывать наследственность и анамнестические данные, историю настоящего заболевания.
В течение последних двух десятилетий основной стратегией лечения эпилепсии стало использование только одного ПЭП, т.е. монотерапия (Baulac M., 2003). Клинические данные показали, что монотерапия эпилепсии сопровождается лучшей переносимостью, меньшим числом нежелательных побочных явлений, более низкой токсичностью, а также меньшим риском тератогенности. Кроме того, монотерапия позволяет избежать использования сложных режимов дозирования, добиться более высокой комплайентности пациентов, а также снизить стоимость лечения, по сравнению с политерапией. Более того, в некоторых исследованиях было показано, что политерапия по сравнению с монотерапией не предоставляет никаких преимуществ в плане контроля над развитием эпилептических приступов и уменьшения числа побочных эффектов (Schmidt D., 1995, Baulac M., 2003, Kanner A., 2005). Одним из ранних примеров является исследование, проведенное в 1983 г. у пациентов специальных лечебных учреждений с интеллектуальными расстройствами, которых перевели с политерапии на режим монотерапии. Исследование показало, что эпилептические приступы не возникали у 78% пациентов, многие пациенты стали более внимательны (Bennett H., 1983).
Первичное назначение ПЭП больным эпилепсией в режиме монотерапии позволяет добиться медикаментозной ремиссии в 50% случаев. Включение альтернативной монотерапии, при неэффективности первичной, обеспечивает отсутствие приступов у 10% пациентов.
Использование монотерапии при эпилепсии обосновано: при первично диагностированном заболевании, при неэффективности проводимой политерапии, в ситуации до конца не использованных возможностей монотерапии и если при проведении политерапии эпилептические приступы отсутствуют.
Стартовое лечение эпилепсии всегда должно проводиться в форме монотерапии препаратами, зарегистрированными для использования в данном режиме. В России для лечения эпилепсии в режиме монотерапии зарегистрированы и могут быть использованы как «старые», так и «новые» противоэпилептические препараты. К «старым» зарегистрированным препаратам относят традиционно используемые — барбитураты, карбамазепины (Тегретол, Финлепсин), фенитоин, этосуксимид (Суксилеп), препараты вальпроевой кислоты и ее производных (Депакин, Конвулекс), к «новым» — ламотриджин (Ламиктал, Конвульсан), топирамат (Топамакс), окскарбазепин (Трилептал), леветирацетам (Кеппра). Для сравнения: в США одобренными для лечения эпилепсии противоэпилептическими препаратами Управлением по контролю за продуктами и препаратами (FDA) для начальной монотерапии большинства видов эпилептических приступов являются как препараты «старого» поколения (фенитоин, карбамазепин и вальпроат натрия), так и более новые препараты: топирамат и окскарбазепин. Ламотриджин одобрен для перехода к монотерапии. Также в рандомизированных исследованиях было показано использование ламотриджина (Ламиктал, Конвульсан) и леветирацетама (Кеппра) в качестве начальной терапии эпилепсии (Faught E., 2007).
Существуют данные о преимуществах новых ПЭП по сравнению с традиционными, что выражается в хорошей эффективности в сочетании с меньшей токсичностью, лучшей переносимостью и удобством применения, а также отсутствием необходимости проведения регулярного мониторинга концентрации препаратов в крови (Ochoa J. G., Riche W., 2002).
Проведенные различные исследования, основанные на доказательной медицине и базирующиеся на данных литературных обзоров, дают различные рекомендации о том, какие препараты должны назначаться пациентам в зависимости от формы эпилепсии (French J., 2004, NICE, 2006, Glauser T., 2006). Так, рекомендации Американской академии неврологии (ААН) и Американского общества эпилепсии (АОЭ) указывают на обоснованность использования как «старых», так и «новых» препаратов для монотерапии при впервые диагностированной эпилепсии. Главное, что выбор ПЭП должен зависеть от индивидуальных характеристик пациента. При эпилептических приступах, имеющих характер парциальных/смешанных судорог, из новых препаратов могут быть использованы: ламотриджин (Ламиктал, Конвульсан), топирамат (Топамакс), окскарбазепин (Трилептал), леветирацетам (Кеппра), при впервые диагностированных абсансных приступах может быть использован ламотриджин (Ламиктал, Конвульсан).
Для лечения взрослых пациентов с рефрактерной парциальной эпилепсией ААН и АОЭ рекомендуют применение окскарбазепина (Трилептал) и топирамата (Топамакс) в качестве монотерапии и габапентина (Нейронтин), ламотриджина (Ламиктал, Конвульсан), тиагабина, топирамата (Топамакс), окскарбазепина (Трилептала), леветирацетама (Кеппра) или зонисамида в качестве дополнительной терапии (French J., 2004). Топирамат (Топамакс) рекомендуется для лечения рефрактерных генерализованных тонико-клонических судорог у взрослых, а также, как и ламотриджин (Ламиктал, Конвульсан), для лечения приступов падения (дроп-атак) при синдроме Леннокса–Гасто (French J., 2004). В нашей стране такие препараты, как тиагабин, зонисамид, на сегодняшний день не зарегистрированы и официально применяться не могут, при этом зарегистрирован в качестве дополнительной терапии прегабалин (Лирика) у взрослых с парциальными приступами.
Рекомендации по применению новых ПЭП, опубликованные в Великобритании Национальным институтом (NICE), основаны на изучении результатов рандомизированных контролированных исследований (РКИ) и систематических обзоров, в которых новые ПЭП сравниваются между собой, с более «старыми» препаратами и с плацебо (NICE, 2006). В целом эти рекомендации более консервативны, чем рекомендации ААН. Рекомендации NICE указывают на обоснованность применения новых ПЭП в следующих случаях: использование более старого препарата не будет иметь преимуществ, применение более старого препарата противопоказано из-за возможных взаимодействий с другими агентами, имеется предшествовавший отрицательный опыт использования этих препаратов или указания на их плохую переносимость, лечение женщины детородного возраста (Beghi E., 2001, NICE, 2006).
Рекомендации Международной лиги борьбы с эпилепсией (ILAE) основываются на структурированном обзоре литературы, в котором качество доказательств клинического исследования использовалось для определения уровня рекомендаций. Эти рекомендации сконцентрированы на эффективности препаратов для лечения впервые выявленной или ранее не леченной эпилепсии (Glauser T., 2006). Для лечения взрослых пациентов с генерализованными тонико-клоническими судорогами ни один из ПЭП не характеризуется наивысшим уровнем доказательности, однако наиболее эффективными препаратами для проведения монотерапии в указанных ситуациях, согласно данным РКИ, являются карбамазепин (Тегретол, Финлепсин), ламотриджин (Ламиктал, Конвульсан), окскарбазепин (Трилептал), фенобарбитал, фенитоин, топирамат (Топамакс) и вальпроаты (Депакин, Конвулекс). Для лечения взрослых пациентов с впервые выявленными парциальными приступами считается установленным, что для начальной монотерапии эффективны карбамазепин (Тегретол, Финлепсин) и фенитоин, тогда как вальпроат считается вероятно эффективным, а габапентин (Нейронтин), ламотриджин (Ламиктал, Конвульсан), окскарбазепин (Трилептал), фенобарбитал, топирамат (Топамакс) представляются менее эффективными. Рекомендации по лечению пожилых пациентов с парциальными приступами включают карбамазепин, габапентин (Нейронтин) и ламотриджин (Ламиктал, Конвульсан) — все эти препараты характеризуются наивысшим уровнем доказательности эффективности (Glauser T., 2006).
Во взрослой популяции существует две категории больных, требующих особого внимания: это пожилые пациенты и женщины.
Эпилепсия и единичные эпилептические приступы широко распространены у пациентов пожилого возраста. Причиной приступов являются заболевания головного мозга сосудистого или другого генеза, приводящего к появлению очаговой симптоматики. Частота возникновения эпилепсии после 60 лет, по данным исследования, составляет 25% от всех вновь выявляемых случаев заболевания в этой возрастной группе. С учетом наличия различной соматической и/или иной патологии монотерапия у пожилых пациентов является предпочтительной для лечения эпилепсии (Hauser W., 1992, Pohlmann-Eden B., 2005). Лечение пожилых пациентов с эпилепсией представляет собой отдельную задачу (Faught E., 1999). Повреждения, обусловленные судорогами, у этих пациентов могут быть более тяжелыми, а продолжительность постприступного состояния — большей. Несмотря на то, что влияние судорог на работоспособность у лиц пожилого возраста меньше, все же лишение работы вследствие приступов тяжело переносится данной категорией пациентов. Фармакокинетические характеристики противоэпилептических препаратов также претерпевают изменения у пожилых пациентов. Это касается связывания с белками, распределения препарата и его выведения, что может привести к уменьшению клиренса препарата, а также повышению чувствительности рецепторов, все это увеличивает риск дозозависимых побочных эффектов (Bourdet S., 2001). Возможно, самым важным является то, что пожилые пациенты принимают большое число лекарственных препаратов, что значительно увеличивает риск возникновения фармакокинетических и фармакодинамических лекарственных взаимодействий. Так, карбамазепин (Тегретол, Финлепсин), фенитоин, вальпроаты (Депакин, Конвулекс), барбитураты взаимодействуют с часто принимаемыми в пожилом возрасте препаратами — варфарином, дигоксином, нейролептикими, антацидами и антибиотиками, в меньшей степени взаимодействуют топирамат (Топамакс) и окскарбазепин (Трилептал), и практически не оказывают влияния ламотриджин (Ламиктал, Конвульсан) и леветирацетам (Кеппра) (Pohlmann-Eden B., 2005).
Лечение пациентов пожилого возраста следует начинать с наименьшей возможной дозы препарата и увеличивать ее постепенно, при этом не имеет значения, какой препарат был выбран для проведения терапии (Pohlmann-Eden B., 2005). Для минимизирования рисков развития побочных и токсических действий препаратов рекомендуется начинать проведение терапии с половинной дозы, рекомендуемой для взрослых пациентов, увеличивать дозу до половины или двух третей от оптимальной дозы, а также замедлять время наращивания дозы препарата.
Важным является также не допустить ухудшения течения существующих проблем вследствие ограниченных возможностей выбора препаратов. Так, фенитоин не стоит назначать пациентам с нарушением координации, вальпроаты (Депакин, Конвулекс) могут усугубить течение эссенциального тремора, нарушение сердечной проводимости может возникнуть при применении карбамазепина (Тегретол, Финлепсин), седативные препараты не рекомендуется использовать у пациентов с сонливостью или деменцией (French J., 2004, Sheth R., 2004). Леветирацетам (Кеппра) при эффективности, отсутствии лекарственных взаимодействий и хорошей переносимости может вызывать поведенческие расстройства и сонливость. Ламотриджин (Ламиктал, Конвульсан) — эффективен, с некоторым межлекарственным взаимодействием, может вызвать аллергические реакции и бессонницу. Окскарбазепин (Трилептал) — эффективен, характеризуется меньшим лекарственным взаимодействием, чем карбамазепин, может спровоцировать гипонатриемию и головокружение. Топирамат (Топамакс) — эффективен и хорошо переносится, особенно в низких дозах, может утяжелить когнитивные нарушения, снизить вес (Pohlmann-Eden B., 2005). У пожилых пациентов дополнительным фактором риска является возможность индукции печеночных ферментов, что, в свою очередь, увеличивает риск лекарственных взаимодействий.
Другой группой, требующей особого внимания, являются пациенты женского пола. Особенность и функционирование женской репродуктивной системы оказывают влияние на течение эпилепсии и применение противоэпилептических препаратов. В течение различных периодов жизни женщин с эпилепсией происходят различные гормональные, физиологические и другие изменения, которые требуют особого внимания к лечению заболевания у данного контингента больных, особенно в детородном возрасте (O’Brien M., 2005, Tettenborn B., 2006, Thomas S., 2006).
Эпилептические приступы, а также препараты, применяемые для их купирования, влияют на зачатие, а после зачатия на здоровье матери и плода, на состояние женщин с эпилепсией в постменопаузе. В связи с этим проблемы, связанные с терапией женщин, являются важными и актуальными. В первую очередь, это контрацепция, наступление беременности, применение ПЭП во время беременности, тератогенность и многие другие вопросы, которые в целом определяют понятие женской эпилепсии.
Противоэпилептические препараты, впрочем, как и непосредственно заболевание — эпилепсия, могут влиять на вероятность зачатия и возникновение беременности, увеличивать риск синдрома поликистоза яичников (СПКЯ) и нарушения фармакокинетики пероральных контрацептивов (ПК). К признакам и симптомам СПКЯ относятся увеличение или структурные аномалии яичников, олигоменорея, аменорея, бесплодие вследствие хронической ановуляции, повышенный уровень андрогенов в плазме крови и центральное ожирение. Более того, женщины с эпилепсией подвержены большему риску развития множественных кист яичников, чем женщины общей популяции. Несмотря на то, что сведения о взаимосвязи применения ПЭП и развития СПКЯ противоречивы, некоторые исследования указывают, что определенные ПЭП могут повышать риск развития этого заболевания. В основном внимание исследователей было сосредоточено на вальпроатах (Депакин, Конвулекс), хотя достоверной причинной связи с этим препаратом выявлено не было. Несмотря на это, некоторые исследователи предлагают контролировать продолжительность менструального периода и уровень андрогенов в плазме крови у женщин с эпилепсией при проведении лечения вальпроатами (Isojarvi J., 2005).
При применении ПЭП у женщин с эпилепсией, получающих пероральные контрацептивы, возможно возникновение нежелательной или незапланированной беременности. Относительный риск неудачи контрацепции у женщин, принимающих одновременно ПК и ПЭП, индуцирующие фермент CYP450, по некоторым оценкам, в 25 раз выше, чем у женщин без эпилепсии, которые принимают только ПК. Основной механизм неудачи контрацепции связывается с повышением активности печеночных ферментов (CYP450), что приводит к ускоренному метаболизму эстрогенов до неактивных веществ, что сопровождается снижением концентрации эстрогенов в плазме крови, возникновением овуляции и наступлением беременности. ПЭП, индуцирующие печеночные ферменты, могут также приводить к увеличению уровня глобулина, связывающего половые гормоны (ГСПГ), что будет сопровождаться снижением уровня свободных биологически активных прогестерона и эстрогена и наступлением незапланированной беременности (Crawford P., 2002, Zupanc M., 2006).
Как правило, большинство ПК не влияют на эффективность ПЭП. В то же время ПК, как известно, значимо снижают уровень ламотриджина (Ламиктал, Конвульсан) в плазме крови и повышают риск эпилептических приступов при лечении этим препаратом (Sabers A., 2001). Поэтому в случае приема ПК необходима коррекция дозы ламотриджина. Для подтверждения создания терапевтической концентрации этого препарата важным представляется проведение лекарственного мониторинга.
Период беременности является очень важным в жизни женщины, и поэтому минимизировать факторы, которые могут вызвать ее прерывание, достаточно сложная задача, требующая грамотного и всеобъемлющего подхода. На развитие эмбриона и плода могут повлиять как неконтролируемые эпилептические приступы, так и ПЭП (Tettenborn B., 2006). Следовательно, целью лечения эпилепсии во время беременности должно являться обеспечение эффективного контроля над развитием эпилептических приступов и минимализация нежелательных эффектов ПЭП, которые, как известно, являются тератогенами. Повторные эпилептические приступы во время беременности связаны с рисками как для матери, так и для плода, и часто могут быть связаны с ненадлежащим приемом ПЭП. Польза от надлежащей терапии ПЭП, как правило, превышает риск, связанный с проведением такой терапии, поскольку неадекватная терапия эпилепсии во время беременности сопровождается развитием повторных эпилептических приступов. Применение монотерапии ПЭП, в отличие от политерапии, связано с более низким риском тератогенности.
Влияние наступления беременности на развитие эпилептических приступов у различных пациенток различно, однако у довольно большой части женщин (от 17% до 37%) частота развития судорог повышается (Pennell P., 2003, Study Group, 2006). Причинами этого явления могут являться гормональные изменения, снижение плазменных концентраций ПЭП вследствие фармакокинетических изменений, связанных с наступлением беременности, а также низкая комплайентность терапии (Sabers A., 2001, Tettenborn B., 2006). У беременных женщин с увеличившейся частотой эпилептических приступов часто регистрируются субтерапевтические концентрации ПЭП в плазме. Кроме того, у некоторых пациенток с тошнотой или рвотой беременных может наблюдаться нарушение всасывания принимаемых ПЭП (Tettenborn B., 2006). Фармакокинетические изменения, вызванные беременностью, обусловлены возрастанием объема распределения, более высокой почечной элиминацией препарата, измененной активностью печеночных ферментов, а также уменьшенным уровнем белка в плазме крови (Pennell P., 2003, O’Brien M., 2005). В связи с этим необходимо регулярно мониторировать уровнь ПЭП в плазме крови на каждом триместре беременности и непосредственно после. Наибольшее внимание следует уделить пациенткам, принимающим ламотриджин (Ламиктал, Конвульсан), клиренс которого существенно увеличивается в течение беременности, что может привести к возрастанию частоты развития эпилептических приступов (Tran T., 2002, de Haan G.-J., 2004). Напротив, непосредственно после родов уровень ламотриджина (Ламиктал, Конвульсан) в плазме снова возрастает. Это указывает на то, что уровень ламотриджина (Ламиктал, Конвульсан) в плазме следует контролировать перед зачатием, во время беременности и после родов, при этом для предотвращения развития эпилептических приступов и токсичности препарата необходима коррекция режима дозирования. Эти положения применимы также и ко всем другим ПЭП.
Данные за то, что судороги во время беременности являются фактором тератогенности, противоречивы; в то же время сомнения насчет того, что ПЭП увеличивают риск тератогенности, незначительны (Perucca E., 2005). Это влияние ПЭП четко установлено для традиционных препаратов; для более современных препаратов риск тератогенности такой же или несколько ниже, хотя данные для этих новых препаратов ограничены и недостаточны для того, чтобы сделать определенное заключение.
Следует помнить, что врач, лечащий беременную с эпилепсией, должен взвешивать пользу от применения ПЭП с риском для здоровья плода.
Независимо от возраста и пола у всех пациентов могут возникать побочные эффекты от принимаемых препаратов.
Все применяемые ПЭП могут приводить к нарушению функции ЦНС, в том числе к нарушению когнитивной способности (A., 2003). По данным различных авторов, более 60% пациентов указывают на наличие субъективных жалоб на побочные эффекты лекарственных препаратов. Чаще всего указываются расстройства со стороны ЦНС (усталость, головокружение) и когнитивные расстройства (например, проблемы с памятью, трудности в концентрации внимания) (Carpay J., 2005).
Эти побочные эффекты могут оставаться незаметными для врача, при этом пациенты, получающие ПЭП, обеспокоены их наличием, несмотря на полный контроль над эпилептическими приступами.
Кроме обычных дозозависимых побочных эффектов в отношении ЦНС, ПЭП могут иметь имеющие клиническое значение метаболические эффекты. Длительное использование ПЭП может привести к изменению метаболизма костной ткани, что приводит к уменьшению плотности кости и увеличению риска переломов. Прием вальпроатов (Депакин, Конвулекс), карбамазепинов (Тегретол, Финлепсин), габапентина (Нейронтин) и прегабалина (Лирика) может быть связан с увеличением массы тела, достаточным для увеличения долговременного риска для здоровья (Sheth R., 2004). Прием карбамазепинов (Тегретол, Финлепсин), фенобарбитала и фенитоина связан с повышением общего холестерина в сыворотке, а также уровня триглицеридов, липопротеинов высокой плотности и липопротеинов низкой плотности, хотя клиническая значимость этого явления пока неизвестна (Nikolaos T., 2004).
Побочные эффекты ПЭП возрастают при использовании политерапии. Монотерапия приводит к развитию контроля над эпилептическими приступами у большинства пациентов, но иногда оказывается неудачной вследствие недостаточной эффективности, наличия дозозависимых побочных эффектов или идиосинкразических побочных эффектов. У пациентов, при лечении которых монотерапия двумя или тремя различными препаратами была неэффективной, может быть необходим политерапевтический режим терапии (Deckers C., 2002). Для пациентов, у которых не удается достичь контроля над развитием эпилептических приступов с помощью политерапии, более эффективный контроль может быть достигнут путем увеличения дозы одного из препаратов, наиболее эффективного режима терапии с постепенной отменой других препаратов. Зачастую адекватная доза одного препарата более эффективна и лучше переносима, чем неадекватные дозы двух или трех препаратов.
Пациенты, у которых удается достичь контроля над развитием приступов с помощью комбинированной терапии, также являются кандидатами для перехода к монотерапии. Однако в этом случае необходим индивидуальный подход. Последний препарат, включенный в схему терапии (его назначение по времени было связано с установлением полного контроля), может являться препаратом выбора для проведения монотерапии. Это особенно актуально, если предшествовавшие препараты или настоящая комбинация препаратов сопровождались побочными эффектами. С другой стороны, если у пациента достигнута медикаментозная ремиссия и он хорошо переносит политерапевтический режим, то продолжение этого режима также является оправданным выбором лечения. Несмотря на то, что переход от политерапии к монотерапии является обычной клинической практикой, пациенты могут совершать такой переход с некоторым нежеланием из-за боязни возобновления приступов. Выбор терапии всегда должен совершаться с согласия пациента (Faught E., 2007).
При проведении лечения эпилепсии в режиме политерапии время от времени следует повторно оценивать возможность перехода к монотерапии. Как бы то ни было, вполне возможно, что единственная причина проводить именно монотерапию — отсутствие фармакокинетических и фармакодинамических лекарственных взаимодействий (Baulac M., 2003).
Современное лечение эпилепсии является сложной задачей, требующей от врача многих знаний и умений, чтобы подобрать терапию, соответствующую и максимально подходящую каждому конкретному пациенту, с более низкой стоимостью, более простыми режимами дозирования, менее токсичных и развитых лекарственных взаимодействий. Для большинства пациентов переносимость и максимальный контроль над приступами являются наилучшими критериями оценки препаратов.
По вопросам литературы обращайтесь в редакцию.
С. Г. Бурд, доктор медицинских наук, доцент, О. Л. Бадалян, доктор медицинских наук, доцент А. С. Чуканова, Г. Г. Авакян
Е. В. Крикова, РГМУ, Москва