Диагноз хзм в урологии что это такое
Расстройство процесса мочеиспускания у женщин и мужчин
Расстройства мочеиспускания (дизурические расстройства) не представляют угрозу для жизни, но значительно ухудшают ее качество и приводят к психологическому дискомфорту. Люди, столкнувшиеся с этой проблемой, нередко стесняются обратиться к специалисту, чем еще больше усугубляют ход болезни. В норме количество мочеиспусканий в день составляет до 8.
Виды расстройств мочеиспускания
Причины развития патологии
Расстройство процесса мочеиспускания провоцируют такие факторы:
Диагностика расстройства мочеиспускания
Расстройство мочеиспускания у мужчин и женщин должен лечить врач-уролог. Диагностика основывается на анализе данных анамнеза, симптоматической картины, лабораторных и инструментальных методах исследования. Врач проведет осмотр пациента и выслушает его жалобы. В ряде случаев потребуются дополнительные исследования:
Для уточнения диагноза может потребоваться консультации узких специалистов: гинеколога, уролога, андролога, невролога, эндокринолога, венеролога.
Методы лечения
Лечение функциональных расстройств мочеиспускания предполагает комплексный подход и направлено на устранение основного заболевания. Пациент сможет рассчитывать на благоприятный прогноз в том случае, если основная причина возникновения расстройства диагностирована и пролечена до поражения почек.
Если проблема с мочеиспусканием длится больше двух дней, появилась сильная боль в животе и поднялась температура – необходимо как можно скорее обратиться за медицинской помощью. Врачи Клиники урологии имени Р. М. Фронштейна Первого Московского Государственного Медицинского Университета имени И.М. Сеченова (Государственный центр урологии) помогут вылечить урологические заболевания любой сложности. Для лечения пациентов применяются такие методы: слинговые операции при недержании мочи у женщин, открытая аденомэктомия с высокой эффективностью результата, лапароскопическое удаление аденомы простаты и др. Полное обследование будет проведено в день обращения.
Задержка мочеиспускания
Такая деликатная проблема, как задержка мочеиспускания, встречается нередко. Обычно она не несет угрозы для жизни, но может перейти в хроническую форму. Стоит отнестись к этой патологии со всей серьезностью, пройти обследование и придерживаться схемы лечения. Типичные симптомы включают в себя напряжение и боль внизу живота, сопровождающиеся очень слабым и недостаточным выделением мочи. При отсутствии лечения возможно развитие осложнений.
Диагностика начинается с опроса и физикального осмотра – часто этого оказывается достаточно. Лечение зависит от причин развития патологии. В большинстве случаев для моментального облегчения состояния пациента достаточно установки мочевого катетера. В более тяжелых случаях может потребоваться длительная терапия или даже операция.
Задержка мочи – это распространенная проблема, встречающаяся и у мужчин, и у женщин. В 99% случаев ее возникновение обусловлено осложненным течением какого-либо заболевания. По статистике чаще всего патология наблюдается у мужчин в преклонном возрасте, что связано с дисфункцией предстательной железы. Хотя симптом может сопровождать самые разные урологические заболевания.
Причины
Ишурия (именно этот медицинский термин используют специалисты для описания проблем с мочеиспусканием) – это не отдельное заболевание, а симптом, указывающий на другие патологии мочевыделительной, иммунной, нервной или эндокринной системы. Важно отличать ишурию от анурии (полного отсутствия мочи).
При ишурии жидкость фильтруется через почки, поступает в мочевой пузырь, но не выводится. При накоплении значительного количества мочи и появляется характерная клиническая картина.
Основные причины задержки мочеиспускания:
Классификация
В первую очередь задержку мочеиспускания классифицируют как полную и неполную (чаще встречается при длительном течении). Первый вариант характеризуется абсолютным отсутствием оттока мочи. Второй – неполным опорожнением.
Кроме того, выделяют несколько вариантов патологии в зависимости от течения и клинической картины:
Формы ишурии не статичны, они могут переходить одна в другую. Так, острая задержка при отсутствии правильного лечения может привести к развитию хронической патологии.
Симптомы
Симптомы различаются в зависимости от формы патологии.
Проявления острой задержки мочи:
Типичные признаки хронической задержки:
Если хроническая задержка полная, то потребуется длительная катетеризация. В случае острой формы достаточно однократного полного освобождения мочевого пузыря и восстановления проходимости уретры. При полной задержке катетеризация не способствует восстановлению нормального мочеиспускания, требуется дополнительная терапия.
Необходимо обратиться к специалисту-урологу сразу после появления симптомов. В противном случае начинают развиваться осложнения. Застой жидкости провоцирует размножение бактерий и развитие воспалительных заболеваний: цистита и пиелонефрита. А избыточное давление жидкости нарушает работу всей выделительной системы. Хроническая задержка мочи может привести к образованию камней в следствие выпадения в осадок солей, содержащихся в моче.
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
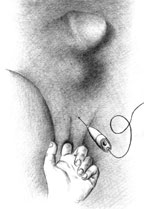 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
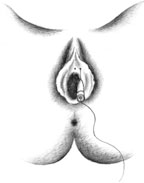 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва
Хроническая инфекция мочевых путей (патогенез, принципы диагностики и лечения)
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Клиническая больница № 6 ФУ МЗ РФ, Москва
Т о, что хроническая лейкоцитурия – симптом хронической инфекции в мочевых путях, является весьма расхожим мнением. Поскольку хроническая инфекция мочевых путей (ИМП) урологами и неурологами отождествляется с хроническим пиелонефритом, то последний с легкостью «диагностируется» и широко распространен в историях болезней и амбулаторных картах больных с вытекающими из этого диагноза рекомендациями продолжительного (если не постоянного!) приема «уросептиков».
Современные представления о хроническом пиелонефрите сводятся коротко к следующему [1, 2].
сводятся коротко к следующему [1, 2].
Хронический пиелонефрит – это тлеющий в почке (диффузно или в очагах) воспалительный процесс, вызванный неспецифической уропатогенной флорой. Прогрессирование процесса неизбежно ведет к сморщиванию почки, ее функциональной недостаточности. Он диагностируется по наличию: лейкоцитурии, бактериурии, уменьшенной в размерах или с признаками деформирующего сморщивания почки.
Уропатогенная флора: Escherichia coli, Proteus, Enterococcus, энтеробактерии группы KES (Klebsiella, Entеrobacter, Serratia) и проч.
Колонизация (заселение) мочевых путей уропатогенной флорой происходит:
• из толстой кишки (фекальной флорой),
• с кожи аногенитальной зоны (контаминированной фекальной флорой),
• из вульвы (той же флорой + некоторыми возбудителями заболеваний, передающихся половым путем (ЗППП): Chlamydia trachomatis, Candida albicans);
• из предстательной железы, мочеиспускательного канала (той же флорой + некоторыми возбудителями ЗППП, в частности, Chlamydia trachomatis);
• при инструментальной инвазии мочевых путей с лечебно–диагностической целью – нозокомиальной флорой (госпитальной, устойчивой к антибактериальным препаратам – Pseudomonas aeruginosa, E. coli, Providencia, Staphylococcus epidermidis, E. faecalis, Klebsiella, Enterobacter, Citrobacter + Candida albicans).
Путь проникновения инфекции в почку
Все попытки смоделировать пиелонефрит в эксперименте у животных путем введения вирулентного возбудителя в кровоток были безрезультатны. Однако как только нарушали отток мочи – добивались возникновения модели острого воспалительного процесса в почке, который, кстати, быстро саморазрешался с восстановлением оттока мочи и не трансформировался в хронический (пиелонефрит).
Никаких подтверждений гипотезы о гематогенном заносе инфекции в почку из гнойного очага (вне мочевого тракта), вызывающем хронический пиелонефрит, до настоящего времени не получено [1].
Итак, путь проникновения инфекции в почку – восходящий, уриногенный (по мочевому тракту снизу вверх).
Вместе с тем хронический пиелонефрит всегда является спутником хронически нарушенного оттока мочи по мочевым путям, прежде всего по верхним мочевым путям (ВМП), т.е. он всегда вторичен по отношению к хроническому уростазу (застою мочи). Хронический пиелонефрит, таким образом, не является самостоятельным патологическим процессом; он – неизбежное следствие хронической ретенции мочи в ВМП. И обратно – наличие хронического пиелонефрита означает, что, скорее всего, в мочевых путях имеет место хронический застой мочи.
На сегодня в современной урологии (европейской и американской) термин (или понятие) «хронический» по отношению к инфекции мочевых путей и мочеполовой сферы по возможности не используется; исключение делается лишь в отношении – хронического простатита [1]. Вместо термина «хроническая ИМП» применяются понятия:
• Персистенция ИМП – рецидив ИМП:
– с тем же возбудителем;
– из того же очага в мочеполовом тракте (т.е. очаг бактериальной персистенции – мочевые пути, почка и прочее).
• Реинфекция МП – рецидив ИМП:
– с другим видом возбудителя;
– из очага вне мочевого тракта (путь: толстая кишка – аногенитальная зона – мочеиспускательный канал и т.д.) но не из почки и мочевых путей.
Хроническая задержка (ретенция) мочи в мочевых путях является следствием:
Хроническая задержка (ретенция) мочи в мочевых путях является следствием:
• или отсутствия нормальной физиологической (с перистальтическим компонентом) уродинамики в силу отсутствия мышечных элементов в стенке мочеточника; при этом моча перемещается по ВМП сверху вниз только благодаря физическому градиенту давления между проксимальным и дистальным концами мочеточниковой трубки (ретенционное поражение – РП; например, при нейромышечной дисплазии ВМП);
• или извращения уродинамики по ВМП в результате повреждения мочеточниково–пузырного запирательного механизма, который начинает пропускать мочу в обратном направлении – из пузыря вверх, в мочеточник (пузырно–мочеточниковый рефлюкс – ПМР).
• или обструкции мочевых путей (ретенционно–обструктивное поражение – РОП).
Хроническое РОП – это патологический процесс, характеризующийся ретенцией жидкостного содержимого (мочи, гноя, крови, экссудата) в том или ином органе мочеполовой системы в результате наличия обструкции просвета отводящих от него трубчатых структур – путей оттока: чашечки, лоханка, мочеточник – для почки; шейка мочевого пузыря, мочеиспускательный канал – для мочевого пузыря; выводные протоки – для предстательной железы.
Признаком РОП являются расширенные (ретенционно измененные) мочевые пути.
Несмотря на то, что ретенция мочи является следствием, т.е. вторичной по отношению к вызвавшей ее причине – обструкции, клиническая симптоматика поражения, степень ее выраженности от легких до тяжелейших проявлений – определяются не обструкцией, какой бы этиологии она ни была (с оговоркой разве что в отношении туберкулеза, при котором, помимо ретенции, важными повреждающими факторами являются специфическая инфекция и деструкция), а, прежде всего, ретенцией мочи и степенью ретенционных изменений в органе.
Таким образом, ведущим повреждающим фактором в патогенезе РОП является застой мочи, и чаще всего – застой инфицированной мочи.
Хронический застой инфицированной мочи в чашечно–лоханочной системе может приводить к гнойному расплавлению почки – пионефрозу. В результате этого процесса в почке возникает множество патологических полостей, заполненных гноем, тканевым детритом, мочой. Прогрессирование деструкции паренхимы ведет к прорыву гнойного содержимого из ретенционных полостей в паранефрий, развивается гнойный паранефрит, всегда сопровождающий пионефроз. Это один из исходов хронической ИМП и в то же время – одна из клинических физиономий хронического пиелонефрита.
Разновидности хронического РОП мочевых путей и почки:
• Гидронефроз (ГНФ) – при стриктуре лоханочно–мочеточникового сегмента, камне в ВМП, опухоли в лоханке, мочеточнике и др.
• Гидроуретеронефроз (ГУНФ) – при стриктуре мочеточника, уретероцеле, при гипертрофии или раке предстательной железы, стриктуре мочеиспускательного канала, склерозе шейки или нейрогенной дисфункции мочевого пузыря (МП), нейромышечной дисплазии МП и др.
• Пузырно–мочеточниковый рефлюкс (ПМР) – при гипертрофии или раке предстательной железы, стриктуре или клапане мочеиспускательного канала, склерозе шейки или нейрогенной дисфункции МП и др.
• Хроническая задержка мочеиспускания (ХЗМ) – при гипертрофии или раке предстательной железы, стриктуре уретры, склерозе шейки или нейрогенной дисфункции МП и др.
Концепция РОП в аспекте хронической ИМП означает:
n приоритетно–значимым в патогенезе хронической ИМП является наличие (или отсутствие) ретенции мочи в мочевых путях;
n приоритетным в диагностике хронической ИМП, следовательно, является распознавание ретенции мочи в мочевых путях;
n приоритетным в лечении хронической ИМП является устранение, прежде всего, стаза мочи в мочевых путях.
Диагностика хронического РОП в мочевых путях
Поскольку при этих видах поражения суть патологического процесса и нередко его исход (вплоть до потери функции органа или даже смерти больного) определяет, как правило, уростаз, т.е. следствие, а не причина (обструкция), врач в распознавании болезни должен руководствоваться правилом: «сегодня же – искать ретенционное поражение мочевых путей, т.е. следствие (потому что уростаз, может быть, потребуется устранять сегодня же), а причину (обструкцию) –искать без спешки завтра (если даже не послезавтра)!»
Лейкоцитурия – практически постоянный лабораторный признак хронического РОП мочевых путей. Будучи ответом уротелия на бактериальную (а также – протозойную, грибковую, вирусную) инвазию, лейкоцитурия имеет место как при ИМП, так и при инфекции половых путей, а также – патологии кожи половых органов и вульвы (в т.ч. аллергической природы).
При несоблюдении правил сбора мочи (на лейкоцитурию) происходит попадание в мочу лейкоцитов с кожи и слизистой оболочки половых органов. Такая ложная лейкоцитурия трактуется, как проявление уроинфекции (а точнее – хронического пиелонефрита), следствием чего становится назначение терапии «уросептиками».
При лейкоцитурии без бактериурии следует искать: хламидии, кандиды, микобактерии туберкулеза и пр.
Бактериурия без лейкоцитурии свидетельствует о колонизации мочевых путей, но еще без инвазии уротелия (не исключена также, как указывалось выше, контаминация мочи флорой аногенитальной зоны при ее неправильном заборе).
Лейкоцитурия должна стать для врача сигналом к поиску РОП мочевых путей, а не к кропотливому подсчету лейкоцитов в камере Горяева (по Нечипоренко) или – к посевам мочи на флору и определению ее чувствительности к уросептикам.
УЗИ и экскреторная урография констатируют наличие уростаза в мочевых путях, локализуют его уровень и сторону.
Вероятность урологической патологии в различных возрастных группах определяет уровень, на котором чаще ожидается РОП:
• у детей патология предполагается и разыскивается в направлении снизу вверх, т.е. от нижних мочевых путей (НМП) к ВМП – ХЗМ, ГУНФ, ПМР;
• у стариков также в направлении снизу вверх – ХЗМ, ГУНФ;
• у взрослых больных – сверху вниз, т.е. в направлении от ВМП к НМЛ – ГНФ, ГУНФ, ПМР, ХЗМ.
Лечение при хронической ИМП (на почве РОП мочевых путей)
В соответствии с вышесказанным у врача должно быть сформировано и доведено до автоматизма предельно прагматичное «стереотипное профессиональное поведение» на совершенно определенную типовую патологическую ситуацию, именуемую РОП мочевых путей.
Производятся декомпрессия (с целью ликвидации уростаза) и дренирование ретенционно измененных мочевых путей. Это достигается:
– или катетеризацией мочевых путей;
– или чрескожной их пункцией и дренированием;
– или открытым оперативным доступом к ретенционно измененному органу (для его дренирования).
При пионефрозе (+ гнойном паранефрите) показано открытое оперативное вмешательство – расширенная нефрэктомия (или нефруретерэктомия), т.е. удаление пораженной почки вместе с гнойно–измененным паранефрием (или вместе с мочеточником и окружающей его клетчаткой).
Итак, устранение, прежде всего, хронического застоя мочи в мочевых путях или удаление погибшего органа с застойно–гнойным содержимым и окружающей гнойно–измененной клетчаткой (а не терапия «уросептиками») приводит к санации мочевых путей от хронической уроинфекции, ее эрадикации и, следовательно, ликвидации хронического пиелонефрита в подобных случаях.
Значительно реже источником упорной хронической ИМП является патологический очаг в мочевом тракте, не связанный с ретенцией мочи. При проведении даже массированной антибактериальной терапии высокие концентрации антимикробного препарата не могут быть достигнуты в очаге поражения в силу патологоанатомических и патологофизиологических его особенностей.
Хирургически корригируемые патологические процессы – источники персистирующей ИМП [1]:
• Инфицированный камень в мочевых путях;
• Инфицированная культя мочеточника (после нефрэктомии), нерефлюксирующая, нормального вида;
• Хронический бактериальный простатит;
• Влагалищная эктопия наружного отверстия мочеиспускательного канала *;
• Инфицированный дивертикул мочеиспускательного канала + инфицированные парауретральные железы;
• Инфицированная киста урахуса (мочевого протока), сообщающаяся с мочевым пузырем;
• Инфицированная киста почки, сообщающаяся с чашечкой;
• Губчатая почка (односторонняя);
• Свищи мочевого пузыря с влагалищем, прямой кишкой.
• Паравезикальный абсцесс, сообщающийся (фистулой) с мочевым пузырем;
При подобных поражениях эрадикация хронической инфекции в мочевых путях достигается только применением хирургических методов – эксцизии патологического очага, корригирующей пластики, ТУР предстательной железы и проч.
Цель статьи автор считал бы достигнутой, если после ее прочтения врач (и уролог – не в последнюю очередь) при обнаружении у больного лейкоцитурии вместо круглосуточной готовности к назначению «уросептиков» по поводу «хронической уроинфекции» (или «хронического пиелонефрита») – отчетливо осознавал первоочередную необходимость УЗ исследования для поиска, прежде всего, ретенционно–обструктивного поражения почек и мочевых путей.
1. Schaeffer A.J. Infection of urinary tract. Campbell’s Urology, 7–th Edition, 1998, v.1, P. 533–614.
2. Wise G.J. Fungal infection of urinary tract. Campbell’s Urology, 7–th Edition,1 998, v.1, P. 779–806.