Диагноз лдж у ребенка что это
Дефицит железа и его отрицательное влияние на развитие детей раннего возраста. Диетологические возможности постнатальной коррекции дефицита железа
Железодефицитные состояния (ЖДС) — важная проблема педиатрии. В первую очередь, это обусловлено широкой распространенностью данных состояний среди населения нашей планеты. По данным ВОЗ, дефицит железа (ДЖ) имеет около 1,5 млрд человек, и только половина этих случаев приходится на долю его явного дефицита, то есть железодефицитную анемию (ЖДА) [1–3].
В материалах United Nations Administrative Committee on Coordination/Sub-Committee on Nutrition and International Food Policy Research Institute. Fourth Report of the World Nutrition Situation отмечено, что в странах с низким социально-экономическим уровнем у детей, страдающих различными дефицитными состояниями, ДЖ является самым частым микронутриентным недостатком. В индустриализированных странах, несмотря на то, что дефицитные состояния в последние годы стали встречаться значительно реже, ЖДА остается самой распространенной формой анемии у детей раннего возраста [4, 5].
Наиболее «уязвимы» по развитию ЖДС дети раннего возраста, подростки и беременные женщины. Так, в России, по данным различных авторов, частота ЖДА колеблется от 6% до 40% среди детского населения [6–8] и от 15% до 56% у беременных женщин [9].
Такая высокая распространенность ЖДА среди лиц этих категорий обусловлена тем, что основными причинами развития ЖДС чаще всего являются алиментарные факторы (нарушение сроков введения продуктов прикорма, дефицит питания, нерациональное питание), интенсивный рост и повышенная потребность в железе [6–10]. У девочек-подростков к вышеназванным причинам следует добавить еще и потерю железа вследствие наступления менструаций. В работе Bruner A. B. et al. (1996) отмечено, что у девочек после десятилетнего возраста потребность в железе возрастает на 70% и ДЖ развивается у 25% девочек-подростков в США [11].
Особенно чувствительны к недостаточности железа дети второго полугодия и второго года жизни [10]. В исследовании, проведенном в Institute for Nutrition Research, University of Oslo (2004), показано, что в Норвегии частота выявления ЖДА у детей первого полугодия жизни составляет 3%, во втором полугодии увеличивается втрое и составляет 10%, незначительно увеличиваясь к двум годам до 12% [12].
Этот возрастной период с физиологических позиций рассматривают как критический период в жизни ребенка, который характеризуется бурным ростом, активным формированием адаптивного иммунного ответа. Именно этот период по времени совпадает с последней фазой «рывка» в развитии головного мозга, когда завершается процесс формирования гиппокампа, осуществляется активный дендритогенез, синаптогенез и миелинизация. Поэтому любой, даже самый незначительный дефицит нутриентов, перенесенный малышом в этот период, может иметь ряд негативных последствий для становления психомоторных, предречевых и речевых навыков, абстрактного мышления, памяти и поведения.
Результаты исследований последних лет показывают, что не только ЖДА, но и ДЖ без анемии может иметь долгосрочное отрицательное влияние на развитие умственных способностей и поведение ребенка, причем некоторые из этих эффектов могут быть необратимыми [11, 13, 14].
Основные понятия и критерии диагностики ЖДС
Развитие ДЖ в организме имеет определенную стадийность. Выделяют три последовательно развивающиеся стадии ЖДС: прелатентный дефицит железа (ПДЖ), латентный дефицит железа (ЛДЖ) и ЖДА [6, 15].
ПДЖ характеризуется только снижением содержания железа в депо при сохранении транспортного и гемоглобинового фондов. По мнению главного детского гематолога РФ Румянцева А. Г., отсутствие клинических проявлений и четких критериев диагностики позволяет считать, что это состояние не имеет практического значения [15].
ЛДЖ составляет 70% всех ЖДС и представляет собой функциональное расстройство с отрицательным балансом железа, а не болезнь. На этой стадии происходит обеднение депо железа, которое может быть охарактеризовано с помощью определения сывороточного ферритина (СФ). В норме концентрация ферритина в сыворотке тесно коррелирует с его запасами в депо, при этом концентрация ферритина, равная 1 мкг/л, соответствует 10 мкг железа в депо. Уровень СФ зависит не только от количества железа в тканях депо, но и от скорости высвобождения ферритина из тканей. На сегодняшний день СФ является единственным международно признанным маркером запасов железа в организме человека.
При обеднении депо снижается поступление железа к клеткам эритроидного ростка и ограничивается продукция эритроцитов. При ЛДЖ имеется характерная клиническая картина — сидеропенический синдром, но гемоглобин остается в пределах нормальных значений [10].
По рекомендации ВОЗ (1998) биохимическим маркером ЛДЖ служит уровень СФ, концентрация которого при данном состоянии меньше 12 мкг/л (у детей до 1 года
Н. М. Богданова, кандидат медицинских наук, доцент
Е. М. Булатова, доктор медицинских наук, профессор
Т. В. Габрусская
А. В. Верхососова, главный технолог ЗАО «Завод детских мясных консервов «Тихорецкий»»
СПбГПМА, Санкт-Петербург
Железодефицитная анемия у детей грудного и младшего возраста
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания
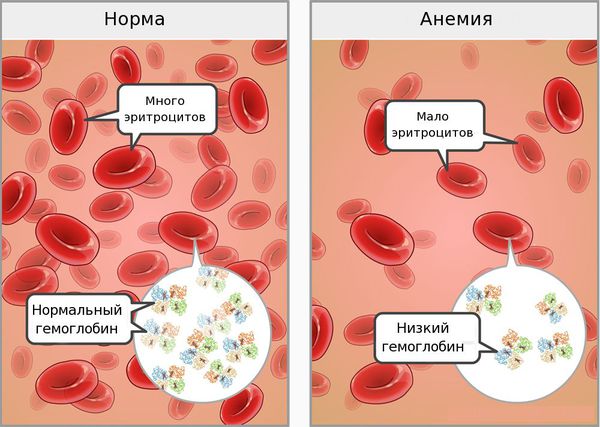
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания и патологические состояния, характеризующиеся уменьшением содержания гемоглобина и/или эритроцитов в единице объема крови, приводящие к нарушению снабжения тканей кислородом. Применяются следующие лабораторные критерии анемии (Н. П. Шабалов, 2003). В зависимости от возраста детей уровень гемоглобина составляет:
Физиологические потери железа с мочой, потом, калом, через кожу, волосы и ногти не зависят от пола и составляют 1–2 мг в сутки, у женщин во время менструации — 2–3 мг в сутки. У детей потеря железа составляет 0,1–0,3 мг в сутки, возрастая до 0,5–1,0 мг в сутки у подростков.
Ежедневная потребность детского организма в железе составляет 0,5–1,2 мг в сутки. У детей раннего возраста в связи с быстрыми темпами роста и развития наблюдается повышенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из депо: у недоношенных детей к 3-му месяцу, у доношенных — к 5–6-му мес жизни. Для обеспечения нормального развития ребенка в суточном рационе новорожденного должно содержаться 1,5 мг железа, а у ребенка 1–3 лет — не менее 10 мг.
Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и ЖКТ. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка. Установлено, что у детей, имевших в младенчестве железодефицитную анемию, в возрасте 3–4 лет определяются нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения из-за нарушения миелинизации и, как следствие этого, нарушение проводимости нервов.
Причины железодефицитных состояний у детей очень разнообразны. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. К антенатальным причинам относят также и осложненное течение беременности, нарушение маточно-плацентарного кровообращения, фетоматеринские и фетоплацентарные кровотечения, синдром фетальной трансфузии при многоплодной беременности. Интранатальными причинами дефицита железа являются: фетоплацентарная трансфузия, преждевременная или поздняя перевязка пуповины, интранатальные кровотечения из-за травматических акушерских пособий или аномалий развития плаценты или пуповины. Среди постнатальных причин сидеропенических состояний на первое место выступает недостаточное поступление железа с пищей. При этом более всего страдают новорожденные, находящиеся на искусственном вскармливании неадаптированными молочными смесями, коровьим и козьим молоком. Другими постнатальными причинами ЖДА являются: повышенная потребность организма в железе; потери железа, превышающие физиологические; заболевания ЖКТ, синдром нарушенного кишечного всасывания; дефицит запасов железа при рождении; анатомические врожденные аномалии (дивертикул Меккеля, полипозы кишечника); употребление продуктов, тормозящих абсорбцию железа.
В группе риска всегда находятся недоношенные дети и дети, родившиеся с очень большой массой, дети с лимфатико-гипопластическим типом конституции.
У детей первого года жизни к дефициту железа чаще всего приводит несбалансированная диета, в частности вскармливание исключительно молоком, вегетарианство, недостаточное употребление мясных продуктов.
К сидеропении способны приводить кровотечения различной этиологии. Источником этого могут быть: грыжа пищеводного отверстия диафрагмы, варикозное расширение вен пищевода, желудочно-кишечные язвы, опухоли, дивертикулы, язвенный колит, геморроидальные узлы, а также кровотечения из мочеполового тракта и дыхательных путей. Прием некоторых медикаментов, таких как нестероидные противовоспалительные препараты, салицилаты, кумарины, глюкокортикостероиды, также может привести к потере железа. Дефицит железа всегда сопутствует заболеваниям, сопровождающимся нарушениями кишечного всасывания (энтериты, болезнь Крона, паразитарные инвазии и др.). Дисбактериоз кишечника также препятствует нормальному перевариванию пищи и тем самым снижает способность организма усваивать железо. Кроме того, может иметь место нарушение транспорта железа из-за недостаточной активности и снижения содержания трансферрина в организме.
Распознать причину развития ЖДА в каждом конкретном случае чрезвычайно важно. Ориентация на нозологическую диагностику необходима, так как в большинстве случаев при лечении анемии можно воздействовать и на основной патологический процесс.
ЖДА проявляется общими симптомами. Один из главных и видимых признаков — бледность кожных покровов, слизистых оболочек, конъюнктив глаз. Обращают на себя внимание общая вялость, капризность, плаксивость, легкая возбудимость детей, снижение общего тонуса организма, потливость, отсутствие или снижение аппетита, поверхностный сон, срыгивание, рвота после кормления, понижение остроты зрения. Выявляются изменения со стороны мышечной системы: ребенок с трудом преодолевает физические нагрузки, отмечается слабость, утомляемость. У детей первого года жизни может наблюдаться регресс моторных навыков.
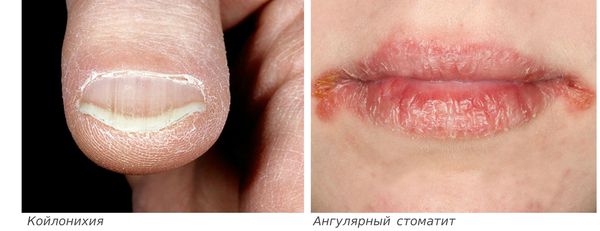
Во втором полугодии жизни и у детей старше года наблюдаются признаки поражения эпителиальной ткани — шершавость, сухость кожи, ангулярный стоматит, болезненные трещины в уголках рта, глоссит или атрофия слизистой оболочки ротовой полости, ломкость и тусклость волос, их выпадение, матовость и ломкость ногтей, разрушение зубов (кариес), отставание в физическом и психомоторном развитии.
Диагноз ЖДА ставится на основании клинической картины, лабораторных признаков анемии и дефицита железа в организме: гипохромная (цветовой показатель 3+ (мальтофер, мальтофер фол, феррум лек). Эти соединения имеют большую молекулярную массу, что затрудняет их диффузию через мембрану слизистой кишечника. Они поступают из кишечника в кровь в результате активного всасывания. Это объясняет невозможность передозировки препаратов в отличие от солевых соединений железа, всасывание которых происходит по градиенту концентрации. Взаимодействия их с компонентами пищи и лекарственными препаратами не происходит, что позволяет использовать неионные соединения железа, не нарушая режим питания и терапии сопутствующей патологии. Их применение существенно снижает частоту развития побочных эффектов, обычно наблюдаемых при назначении пероральных препаратов железа (тошнота, рвота, диарея, запоры и др.). Кроме того, у детей раннего возраста большое значение имеет лекарственная форма препарата. В этом возрасте удобно использовать капли и сиропы, что обеспечивает в том числе возможность точного дозирования препаратов и не вызывает негативного отношения ребенка.
При назначении любых препаратов железа необходимо рассчитывать индивидуальную потребность в нем для каждого пациента, исходя из того, что оптимальная суточная доза элементарного железа составляет 4–6 мг/кг. Среднесуточная доза железа при лечении ЖДА составляет 5 мг/кг. Применение более высоких доз не имеет смысла, поскольку объем всасывания железа не увеличивается.
Применение парентеральных препаратов железа показано для быстрого достижения эффекта при анемии тяжелой степени; патологии ЖКТ, сочетающейся с нарушением всасывания; неспецифическом язвенном колите; хроническом энтероколите; при тяжелой непереносимости оральных форм препаратов. На сегодняшний день в Российской Федерации для внутривенного введения разрешен только один препарат — венофер (сахарат железа), для внутримышечного может использоваться феррум лек.
Необходимо помнить, что у детей раннего возраста дефицит железа никогда не бывает изолированным и часто сочетается с недостаточностью витаминов С, В12, В6, РР, А, Е, фолиевой кислоты, цинка, меди и др. Это связано с тем, что алиментарная недостаточность и нарушенное кишечное всасывание, приводящие к дефициту железа, влияют и на насыщаемость данными микронутриентами. Поэтому в комплексную терапию ЖДА необходимо включать поливитаминные препараты.
Об эффективности терапии ЖДА можно судить уже через 7–10 дней по увеличению ретикулоцитов в 2 раза по сравнению с исходным количеством (так называемый ретикулоцитарный криз). Также оценивается прирост гемоглобина, который должен составлять 10 г/л и более в неделю. Соответственно, достижение целевого уровня гемоглобина наблюдается в среднем через 3–5 нед от начала терапии в зависимости от тяжести анемии. Однако лечение препаратами железа должно проводиться в достаточных дозах и длительно (не менее 3 мес) даже после нормализации уровня гемоглобина, с тем чтобы пополнить запасы железа в депо.
Если же в течение 3–4 нед не наблюдается значимого улучшения показателей гемоглобина, то необходимо выяснить, почему лечение оказалось неэффективным. Наиболее часто речь идет: о неадекватной дозе препарата железа; продолжающейся или неустановленной кровопотере; наличии хронических воспалительных заболеваний или новообразований; сопутствующем дефиците витамина В12; неверном диагнозе; глистной инвазии и других паразитарных инфекциях.
Противопоказаниями к назначению препаратов железа являются:
При развитии тяжелых анемий, сопровождаемых угнетением эритропоэза и снижением продукции эритропоэтина, показано назначение препаратов рекомбинантного человеческого эритропоэтина (рчЭПО). Особое значение имеет применение рчЭПО при развитии ранней анемии недоношенных, которая развивается на втором месяце жизни и встречается, по данным различных авторов, в 20–90% случаев. Назначение препаратов рчЭПО (рекормон, эпрекс, эпокрин) приводит к резкой активизации эритропоэза и, как следствие, к значительному возрастанию потребностей в железе.
Поэтому применение рчЭПО является показанием к назначению препаратов железа, как правило, парентеральных. В настоящее время в Российской Федерации разрешены к применению a- и b-эпоэтины, которые вошли в список дополнительного лекарственного обеспечения. Назначeние рчЭПО позволяет в большинстве случаев избежать гемотрансфузий, при которых велика вероятность осложнений (трансфузионные реакции, сенсибилизация и пр.). Предпочтительным способом введения препаратов рчЭПО, особенно в раннем детском возрасте, является подкожный. Подкожный способ введения более безопасный и экономичный, так как для достижения эффекта необходимы меньшие дозы, чем при внутривенном введении. До недавнего времени в странах Евросоюза и в Российской Федерации для лечения гипорегенераторных анемий у детей использовались в основном β-эритропоэтины, которые при подкожном введении не вызывали значимых побочных реакций в отличие от a-эритропоэтинов, при подкожном введении которых был велик риск развития красноклеточной аплазии. Наиболее широкое распространение среди β-эритропоэтинов получил препарат рекормон (Ф. Хоффманн-Ля Рош), который удобен в применении и приводит к быстрому повышению уровня эритроцитов и ретикулоцитов, не влияя на лейкопоэз, повышает уровень гемоглобина, а также скорость включения железа в клетки.
С 2004 г. в европейских странах разрешено подкожное введение a-эритропоэтинов, среди которых в нашей стране наиболее часто используются эпрекс (Янсен-Силаг) и эпокрин (Сотекс-ГосНИИ ОЧБ).
Целью лечения рчЭПО является достижение показателей гематокрита 30–35% и устранение необходимости переливаний крови. Значения целевой концентрации гемоглобина могут варьировать в зависимости от дней и месяцев жизни ребенка, однако не могут быть ниже 100–110 г/л. В зависимости от дозы целевые значения концентрации гемоглобина и гематокрита достигаются примерно через 8–16 нед лечения рчЭПО.
С целью профилактики ЖДА рчЭПО назначается недоношенным новорожденным, родившимся с массой тела 750–1500 г до 34-й недели беременности.
Лечение эритропоэтином должно начинаться как можно раньше и продолжаться 6 нед. Препарат рекормон вводят подкожно в дозе 250 МЕ/кг 3 раза в неделю. Однако необходимо учитывать, что чем меньше возраст ребенка, тем более высокие дозы эритропоэтина ему требуются, поэтому доза может быть увеличена.
Как было сказано выше, терапия рчЭПО приводит к резкому возрастанию потребления железа, поэтому в большинстве случаев, особенно у недоношенных детей, одновременно с повышением гематокрита снижается содержание ферритина в сыворотке. Быстрое расходование запасов железа в организме может привести к ЖДА. Поэтому всем больным, получающим терапию рчЭПО, показано назначение препаратов железа. Терапия препаратами железа должна продолжаться до нормализации уровня сывороточного ферритина (не менее 100 мкг/мл) и насыщения трансферрина (не менее 20%). Если концентрация ферритина в сыворотке сохраняется стойко ниже 100 мкг/мл или есть другие признаки дефицита железа, дозу железа следует увеличить, в том числе с использованием парентеральных препаратов.
Профилактика ЖДА у детей раннего возраста включает в себя: антенатальную (правильный режим и питание беременной, своевременное выявление и лечение анемии беременной, превентивное назначение препаратов железа женщинам из групп риска по развитию ЖДА); постнатальную (соблюдение гигиенических условий жизни ребенка, длительное грудное вскармливание и своевременное введение прикормов, адекватный выбор смеси для детей, находящихся на смешанном и искусственном вскармливании, профилактика развития у ребенка рахита, гипотрофии и ОРВИ). В профилактическом назначении препаратов железа нуждаются:
Профилактическое назначение препаратов железа показано детям из групп риска по развитию ЖДА:
Доза железа, назначаемого с профилактической целью, зависит от степени недоношенности ребенка:
Значимость проблемы ЖДА у детей раннего возраста обусловлена ее большой распространенностью в популяции и частым развитием при различных заболеваниях, что требует постоянной настороженности врачей любых специальностей. Тем не менее на современном этапе в арсенале врача имеется достаточно диагностических и лечебных возможностей для раннего выявления и своевременной коррекции сидеропенических состояний.
Литература
Л. А. Анастасевич, кандидат медицинских наук
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва
Что такое железодефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Головко О. А., терапевта со стажем в 12 лет.
Определение болезни. Причины заболевания
Основные причины развития ЖДА:
Группы риска по ЖДА:
Симптомы железодефицитной анемии
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием «мушек» перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 ° С), которое исчезает после лечения железосодержащими препаратами.
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
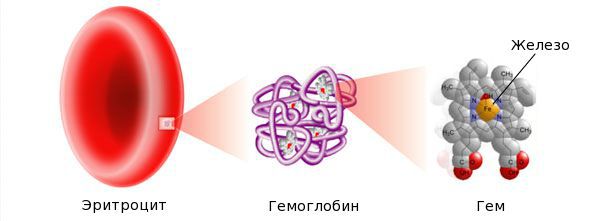
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
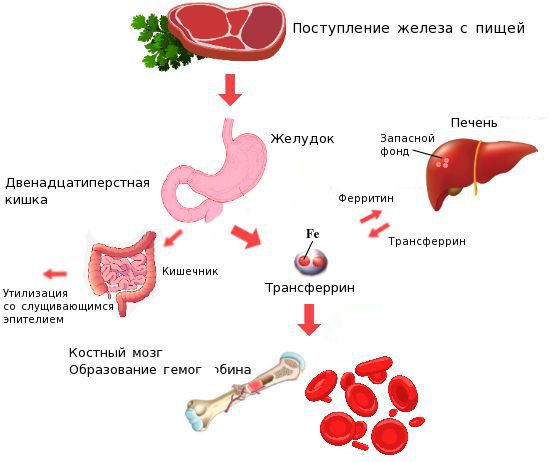
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
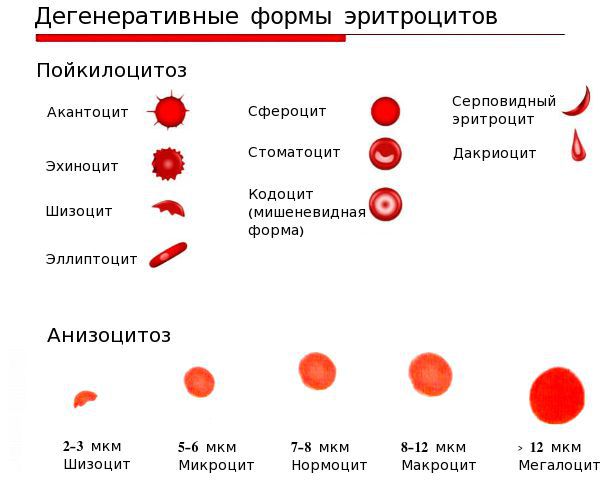
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
Осложнения железодефицитной анемии
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Диагностика железодефицитной анемии
Минимальный объём исследований:
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это достаточно калорийный продукт — в 100 г гематогена содержится 350–500 килокалорий, об этом следует помнить, включая его в рацион.
Прогноз. Профилактика
Прогноз при ЖДА благоприятный. В большинстве случаев заболевание успешно лечится амбулаторно. Но если не анемию не лечить, то она может прогрессировать, ухудшая общее самочувствие. ЖДА сложно скорректировать в следующих случаях:
Для профилактики ЖДА следует: