Диагноз мпр что это
Минимальная мозговая дисфункция
Минимальная мозговая дисфункция (ММД) — это синдром, который возникает при нарушении регуляции ЦНС и характеризуется различными неврологическими симптомами и расстройствами. Последние могут выражаться в виде физиологических, психологических, когнитивных и поведенческих отклонений. Если верить статистике, 25% детей дошкольного и младшего школьного возраста страдают синдромом минимальной мозговой дисфункции. «Легкие нарушения» родители могут не посчитать опасными, но без должного лечения и коррекции они ведут к более серьезным последствиям.
Несмотря на то, что некоторые специалисты до сих пор используют термин «Минимальная мозговая дисфункция», этот диагноз является устаревшим. Те расстройства, которые раньше описывались термином ММД, в настоящее время называют целым рядом других наименований, согласно МКБ-10 (Международной классификации болезней 10 пересмотра) — перинатальная энцефалопатия (ПЭП), СДВ, СДВГ, нарушения обучения и памяти и другие. Это произошло из-за того, что ММД было слишком общим понятием. Медицина не смогла получить точные данные о причинах заболевания, его развитии и предложить универсальные методы лечения, одинаково эффективные для всех проявлений ММД. Новые более узкие и точные диагнозы позволяют применять наиболее действенные способы коррекции нарушений. По сути, слишком общее понятие ММД охватывало большое количество разнообразных нарушений, каждое из которых нуждается в специальном подходе к лечению.
Почему же это понятие до сих пор встречается? Все дело в том, что многие действующие врачи обучались уже давно и старый диагноз ставят или потому, что не повышали квалификацию, или просто по привычке. Также это делается, когда ребенок имеет «смазанную симптоматику», и точный диагноз без дополнительных обследований поставить невозможно, но наличие определенных признаков, характерных для ММД, имеется.
Причины минимальной мозговой дисфункции
Данная патология чаще всего является результатом родовой травмы. Она может быть получена или во время беременности, или во время самих родов. Позвоночник ребенка в целом, а в особенности его шейный отдел, испытывает огромные нагрузки при движении по родовым путям. Когда малыш протискивается между костями таза, он поворачивается практически на 360 градусов. Это нередко вызывает смещение шейных позвонков, а в будущем и проблемы с кровоснабжением.
Часто причиной становятся и неверные действия акушерки, которые приводят к сдавливанию и деформации черепа, а иногда и его повреждениям. Крупный плод, кесарево сечение, стремительные роды и т.д. тоже относят к возможным причинам.
Также нарушение может начать развиваться еще в период беременности. Это может быть вызвано такими причинами, как:
Существуют случаи, когда ММД возникает после рождения малыша. Причинами этого могут стать неблагоприятные условия для жизни и неудовлетворение базовых потребностей ребенка, осложнения после заболеваний, повреждения головного мозга.
Патология проявляется на уровне центральной нервной системы, вследствие чего нарушаются речь, внимание и поведение. Стоит отметить, что хотя некоторые процессы развития у малыша с ММД проходят медленнее, чем у здоровых детей, его интеллект, как правило, находится в пределах нормы.
Симптомы минимальной мозговой дисфункции
Симптоматика у этого болезненного состояния крайне обширна. Обычно можно заметить нарушения уже с самого рождения ребенка. Если вы обнаружили у малыша один или несколько признаков, описанных ниже — незамедлительно обратитесь к врачу-неврологу:
В раннем детском, дошкольном и младшем школьном возрасте ММД у ребенка может выражаться в следующих проблемах:
У детей с СДВГ (синдром дефицита внимания и гиперактивность) наблюдаются проблемы с вниманием, повышенная активность и импульсивность. Они не слушают учителей в школе, постоянно допускают ошибки из-за невнимательности. Такие дети стараются избегать длительного интеллектуального напряжения, не могут усидеть на месте.
Взрослые же с СДВГ, которое не было вовремя скорректировано, часто социально не адаптированы: у них низкий профессиональный уровень, психические заболевания, могут страдать алкоголизмом и наркоманией.
Лечение минимальной мозговой дисфункции и последствий
Для успешного лечения ММД прежде всего нужно установить точный диагноз (или несколько) согласно МКБ-10. Это могут сделать только врачи: невролог, в некоторых случаях – детский психиатр (особенно если речь идет про СДВГ). Помимо диагностики врачи проводят медикаментозное лечение. Если диагноз поставлен правильно и вовремя, при некоторых нарушениях этих мер оказывается достаточно.
После 2-3 лет ребенку часто требуется дополнительное обследование и коррекция у следующих специалистов:
Диагнозы у этих специалистов могут отличаться от тех, что поставили врачи, но они важны для понимания структуры нарушений и последующей коррекции.
Также может понадобиться аппаратная диагностика (ЭЭГ, «вызванные потенциалы» и др.).
Также ребенку с минимальной мозговой дисфункцией очень важна правильная обстановка дома и гармоничные отношения с родителями:
Коррекция нарушений специалистами идет в зависимости от тех дефицитов, которые имеются у ребенка. Для эффективного исправления симптомов рекомендуются занятия с нейропсихологом, логопедом-дефектологом, очень важно участие в коррекции детского психолога. Дети с ММД могут испытывать трудности с адаптацией в обществе и иметь низкую самооценку. Психолог поможет ребенку понять и принять себя, научиться максимально спокойно реагировать на стрессовые ситуации, избавиться от страхов, развить внимание и мышление. Также детский психолог будет работать с родителями, помогая им создать благоприятную обстановку для ребенка дома.
Высокую эффективность при коррекции нарушений, связанных с ММД, показывает аппаратное стимулирование головного мозга. В нашем центре для этих целей применяется Томатис-терапия, а также гарнитура Forbrain и устройство Soundsory.
При правильной коррекции со стороны необходимых специалистов (невролог, нейропсихолог, детский психолог, логопед) и внимательного отношения родителей к особенностям развития ребенка прогноз ММД благоприятный, к переходному возрасту все симптомы исчезают.
Пузырно-мочеточниковый рефлюкс у детей
Содержание статьи
Пузырно-мочеточниковый рефлюкс (ПМР) – заболевание, при котором происходит обратный заброс мочи из мочевого пузыря в почку. Этот процесс обуславливается неправильной работой сфинктера, который запирает ток мочи в обратном направлении к мочеточнику и почке.
Это одна из самых распространенных урологических патологий, особенно среди детей. Врожденный ПМР диагностируется у 1 % детей. В первый год жизни девочки болеют в 5 раз чаще мальчиков. В более взрослом возрасте ситуация меняется в противоположную сторону. Многие пациенты в результате ПМР становятся инвалидами, потому что это заболевание имеет высокий риск серьезных осложнений – почечная недостаточность, гнойные патологии почек, вторичная артериальная гипертензия. Источник:
Ю.А. Ермолаева, О.П. Харина, С.Н. Иванов, Г.П. Филиппов
Современные представления о пузырно-мочеточниковом рефлюксе и рефлюкс-нефропатии в детском возрасте (обзор литературы) // Сибирский медицинский журнал, 2008, №4 (выпуск 2), с.111-119
Формы и степени ПМР у детей
Заболевание может быть первичным и вторичным. Причина ПМР первичного типа – врожденный дефект устья мочеточника либо стенки мочевого пузыря. Вторичное заболевание – это продолжение болезней мочевыводящей системы, например рецидивирующего цистита.
Также болезнь может быть постоянной или транзиторной. Постоянный ПМР присутствует всегда, а транзиторный появляется при других заболеваниях – остром простатите, цистите.
Степени ПМР
Рефлюкс малого объема мочи ограничен тазовым отделом мочеточника, который не расширен. Симптомов нет, риск осложнений минимален.
Заброс мочи по всей протяженности мочеточника, но без его расширения. Моча не доходит до почек и чашечно-лоханочной системы. Ярко выраженных симптомов нет, появляется небольшой риск получения инфекции, рефлюкс быстро прогрессирует.
Моча попадает в почки, но лоханки не расширяются. Почечная функция может быть снижена на 20 %. Мочеточник расширяется, моча застаивается в выделительной системе, что повышает риск инфекционного осложнения. Появляются средне выраженные симптомы.
Мочеточник существенно расширен, чашечно-лоханочная область деформирована, функция почек снижена на 50 %, вырабатывается меньше мочи. Выражена симптоматика, повышается температура тела, появляются отеки. Если ПМР двухсторонний, могут развиваться угрожающие жизни ребенка состояния.
Сохраняются все признаки предыдущих степеней, почки сильно поражены, их паренхима истончена. Мочеточник приобретает коленообразные изгибы. Нарастают симптомы почечной недостаточности – тошнота, рвота, снижение мочевыделения, кожный зуд.
Причины развития пузырно-мочеточникового рефлюкса
Общие причины появления пузырно-мочеточникового рефлюкса:
Какие симптомы ПМР могут быть у ребенка?
На ранних стадиях болезнь может протекать без симптомов. Первые признаки появляются при отсутствии лечения или присоединении инфекции.
При врожденном или приобретенном рефлюксе в раннем возрасте для детей характерны:
При утяжелении состояния развивается задержка мочи, повышается температура тела. Это признаки того, что присоединилась инфекция. У детей грудного возраста признаки инфекции – это отсутствие аппетита, диарея, раздражительность, лихорадка. Источник:
Н.А. Пекарева, Е.Ю. Пантелеева, С.А. Лоскутова
Особенности течения и диагностики пузырно-мочеточникового рефлюкса у детей // Педиатрия. Журнал им. Г.Н. Сперанского, 2008, т.87, №3, с.31-36
Чем старше ребенок, тем выраженнее рефлюкс, если отсутствует лечение:
Диагностика заболевания у детей
Диагноз ставит детский уролог. Обычно достаточно опроса пациента и его осмотра. Дополнительные методы диагностики позволяют определить причину и тяжесть патологии:
Методы лечения у детей
Для коррекции ПМР у детей может применяться диета, медикаментозное лечение, физиотерапия и операция, если у ребенка есть к ней показания.
Диета
Детям с таким заболеванием показан стол №7 по Певзнеру. Общие клинические рекомендации по диете №7 при ПМР у детей:
Необходимо исключить пряности, острые блюда, ограничить белок. В качестве источников белка разрешены яйца, нежирная птица, мясо, рыба. Количество белковых продуктов в рационе ребенка назначает его лечащий врач.
Полностью исключают из рациона:
Медикаментозное лечение
Для профилактики и лечения инфекций мочевыделительной системы ребенку показаны антибиотики, уросептики, фитотерапия или иммунотерапия. Применение антибиотиков оправдано тем, что чем меньше рецидивов пиелонефрита, тем ниже риск развития ПМР. После курса лечения, через полгода-год, делаю контрольную цистографию.
При I-III степени ПМР эффективность медикаментозного лечения достигает 70 %, у маленьких детей – до 90 %.
Физиотерапия
Физиотерапия – вспомогательный способ лечения, который сильно повышает эффективность основного лечения. Методы физиотерапии зависят от рефлекторной функции мышечной оболочки мочевого пузыря.
При гипорефлекторности назначают электрофорез с хлоридом кальция, прозерином, ультразвук на мочевой пузырь, электростимуляцию.
При гиперрефлекторности показаны: электрофорез с папаверином, атропином, ультразвук на мочевой пузырь, расслабляющая электростимуляция, магнитотерапия.
Хирургическое лечение
Если у ребенка высокая степень ПМР или неадаптированный мочевой пузырь, то показана операция. Она проводится по эндоскопической методике. Показания к операции:
Эндоскопическая операция проводится для того, чтобы усилить клапанный механизм. Для этого какое-либо вещество («Уродекс», коллаген или «Вантрис») имплантируется в подслизистый отдел устья мочеточника. Эта методика малоинвазивна, дети быстро восстанавливаются, есть возможность проводить вмешательства повторно. Недостаток – постепенное рассасывание или миграция введенного вещества, что приводит к необходимости оперировать снова.
Классическая хирургическая операция может быть, в зависимости от доступа, внутрипузырной, внепузырной или комбинированной. Общий принцип всех вмешательств – создание клапанного механизма путем формирования подслизистого тоннеля. Отношение диаметра мочеточника к длине тоннеля – 1:5. Самые распространенные операции – Коэна, Политано-Леадбеттера, Жиль-Вернэ, Гленн-Андерсона, Лич-Грегуара.
Если рефлюкс возникает вторично, то лечение сосредоточено на устранении тех факторов, которые его вызывают.
Если у ребенка присутствует такая врожденная патология, как клапан задней уретры, то створки это клапана резицируются эндоскопически. После этого устанавливается уретральный катетер и мочевой пузырь дренируется. Через 10 дней делают контрольную уретроскопию для решения вопроса о дальнейшем дренировании.
Методы профилактики
Если у ребенка хронический ПМР, то повышается риск инфицирования. Поэтому нужно регулярно показывать ребенка детскому урологу. Чтобы моча не задерживалась в мочевом пузыре, надо своевременно лечить болезни, которые вызывают такое состояние, – МКБ, стриктуры и др.
Миелодиспластический синдром
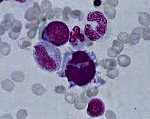
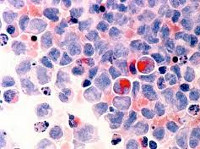
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Мукополисахаридоз I типа у детей
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации: Мукополисахаридоз I типа у детей
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
• Мукополисахаридоз I типа (болезнь Гурлер). Шейный гиперлордоз. Правосторонний грудной сколиоз II-III степени. Килевидная деформация грудной клетки. Множественные контрактуры верхних и нижних конечностей. Вальгусная деформация нижних конечностей с вершиной на уровне коленных суставов. Плосковальгусная деформация стоп II степени. Кардиомиопатия вторичная. Миксоматоз створок митрального клапана, недостаточность митрального клапана 2 степени, недостаточность аортального клапана. НК I-IIA ст. Дисфункция синусового узла Экзофтальм, помутнение роговицы средней степени. Гиперметропия слабой степени. Птоз 1 ст. Темповая задержка речевого развития. Синдром запястного канала. Дизартрия. Пупочная грыжа.
Таблица 1 – Классификация (номенклатура) МПС
Этиология и патогенез
Эпидемиология
Клиническая картина
Cимптомы, течение
При сдавлении спинного мозга, вызванного утолщением его оболочек или нестабильностью атлантоаксиального сустава, отмечают: нарушение походки, мышечную слабость, неуклюжесть при сохранных моторных навыках и дисфункцию мочевого пузыря.
Карпальный тоннельный синдром – частая нейропатия сдавления у пациентов в возрасте от 5 до 10 лет и взрослых. При отсутствии лечения может привести к необратимой контрактуре дистальных межфаланговых суставов, а также к нарушению или потере чувствительности первых трех пальцев и парезу мышц тенара. К сожалению, пациенты редко сообщают о болевых ощущениях, пока не происходит потеря функции.
Органы дыхания: частые респираторные заболевания в виде ринитов, отитов. Накопление ГАГ в миндалинах, надгортаннике, а также в трахее приводит к утолщению и сужению дыхательных путей и развитию обструктивного апноэ.
Желудочно-кишечная система: гепатоспленомегалия, пахово-мошоночные и пупочные грыжи.
Диагностика
Диагноз МПС I устанавливается на основании совокупности клинических данных, результатов лабораторного исследования и молекулярно-генетического анализа. Частота применения методов при первоначальной оценке и дальнейшем наблюдении приведена в Приложении Г2 3.
Пузырно-мочеточниковый рефлюкс
Пузырно-мочеточниковый рефлюкс (ПМР) — это ретроградный ток (заброс) мочи из мочевого пузыря в мочеточник. ПМР воздействует отрицательно на почку, создавая условия для активизации инфекции мочевых путей и хронического пиелонефрита, а также вызывает патологические изменения ткани почки со снижением её функции — рефлюкс нефропатию.
Моча, образуясь в ткани почки, далее попадает в почечную лоханку, из лоханки — в мочеточник, из мочеточника — в мочевой пузырь. В мочевом пузыря моча накапливается (фаза накопления мочи), и при сокращении мочевого пузыря выводится наружу через мочеиспускательный канал (фаза изгнания мочи).В норме, моча течёт только в направлении «от почки к мочеиспускательному каналу», что обеспечивается волнообразными сокращениями мышечных волокон лоханки и мочеточника, и наличием функционального клапана в месте впадения мочеточника в мочевой пузырь. Пузырно-мочеточниковый рефлюкс — заболевание, при котором ток мочи приобретает обратное направление, вследствие несостоятельности клапанного механизма пузырно-мочеточникового сегмента, т.е. моча забрасывается в мочеточник в фазу накопления мочи (пассивный рефлюкс), в фазу изгнания мочи (активный рефлюкс) или в обе фазы (смешанный рефлюкс).
Синонимами термина «пузырно-мочеточниковый рефлюкс» являются: пузырно-почечный рефлюкс и пузырно-лоханочный рефлюкс.
Основной опасностью существования пузырно-мочетоикового рефлюкса (ПМР) является рецидивирующая инфекция мочевыхпутей и рефлюкс- нефропатия, приводящие к ухудшению функции почки, или даже, в тяжёлых случаях, к потере функции почки.
Под термином «рефлюкс-нефропатия» понимают комплекс склеротических изменений в структуре почки, приводящих к замещению паренхимы почки — патологической соединительной тканью,неспособной выполнять почечную функцию.
Симптомы
Наиболее частым проявлением пузырно-мочеточникового рефлюкса является инфекция мочевых путей, в виде:
Если у ребёнка любого возраста отмечается устойчивое увеличение количества лейкоцитов в анализе мочи — первое состояние, которое нужно диагностировать — ПУЗЫРНО-МОЧЕТОЧНИКОВЫЙ РЕФЛЮКС.
Диагностика
На первом этапе диагностики выполняется ультразвуковое исследование почек, мочеточников и мочевого пузыря. При расширении лоханки почки и мочеточника может быть заподозрен пузырно-мочеточниковый рефлюкс. При наличии признаков истончения паренхимы почек — требуется проведение дополнительного исслеования — ультразвуковой допплерографии почек. УЗДГ почек позволит выявить признаки рефлюкс-нефропатии.
Так же на начальном диагностическом этапе выявляются варианты дисфункции мочевого пузыря, которые могут быть причиной и(или) усугублять течение пузырно-мочеточникового рефлюкса, путём регистрации ритма спонтанных мочеиспуканий, выполнения УЗИ с полным и опорожнённым мочевым пузырём, функциональных исследований мочевого пузыря в случае необходимости.
Основным способом диагностики ПМР является микционная цистография.
Микционная цистография заключается в введении раствора, содержащего контрастное вещество в мочевой пузырь (через катетер) и выполнении рентгеновских снимков до и во время мочеиспускания. Если отмечен заброс контрастного вещества в мочеточник и лоханку почки — диагностируется ПУЗЫРНО-МОЧЕТОЧНИКОВЫЙ РЕФЛЮКС.
В зависимости от уровня ретроградного заброса контрастноговещества на цистографии и сопутствующих изменений размеров мочеточника и почечной лоханки разделяют 5 степеней ПМР (внутренняя ссылка):
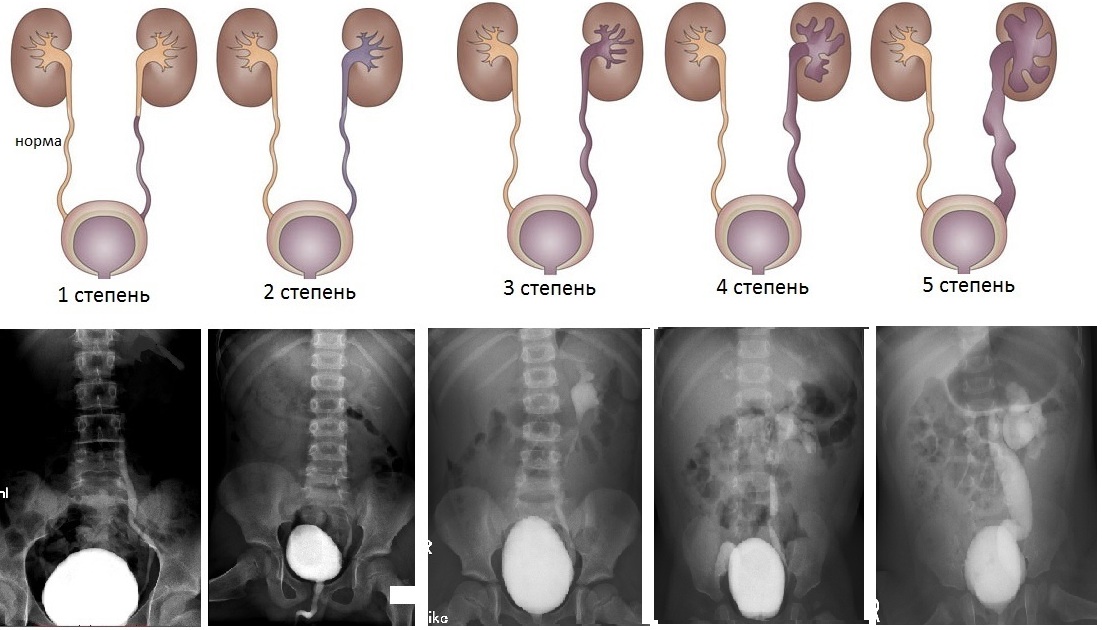
В ряде случаев, с целью исключения сопутствующих пороков верхних мочевых путей необходимо выполнение экскреторной урографии (введения контрастного вещества внутривенно и последующим выполнением серии рентгеновских снимков, с целью визуализации структуры лоханки почки и мочеточника и для выявления нарушения эвакуации контрастного вещества из верхних мочевых путей).
С целью оценки функции почек и выраженности рефлюкс-нефропатии выполняется радиоизотопное исследование почек — статическая нефросцинтиграфия.
Цистоскопия — инструментальное исследование, которое выполняется на этапе выбора тактики лечения. Технология выполнения цистоскопии: Через мочеиспускательный канал в полость мочевого пузыря вводится ЦИСТОСКОП — оптический прибор, имеющий вид стержня — трубки, диаметром от 1,2 до 4 мм (подбирается в зависимости от возраста), подключённый к видеокамере и экрану. Через цистоскоп осматривается полость мочевого пузыря, слизистая и устья мочеточников — отверстия, которыми открываются мочеточники в полость мочевого пузыря. Визуальная анатомия устьев мочеточников оказывает влияние на выбор тактики лечения пузырно-мочеточникового рефлюкса.
Лечение
На выбор тактики лечения оказывает влияние степень рефлюкса, активность инфекции мочевых путей (как часто возникают изменения в анализе мочи и(или)обострение пиелонефрита), выраженность признаков рефлюкс-нефропатии и цистоскопическая анатомия устьев мочеточников.
При первой и второй степени рефлюкса показана консервативная терапия (средства направленные на профилактику инфекции мочевых путей, на улучшение трофики мочевого пузыря, физиотерапия). Только при неэффективности терапии и персистенции инфекции мочевых путей рассматривается вопрос об эндоскопической инъекционной коррекции ПМР.
При третьей степени рефлюкса частота перехода от консервативной терапии к инъекционной коррекции выше. У части пациентов с прогрессирующей нефропатией, рецидивирующей инфекцией мочевых путей и нарушением эндоскопической анатомии устьев мочеточников целесообразно выполнение хирургического вмешательства для ликвидации ретроградного заброса мочи — антирефлюксной операции — реимплантации мочеточников.
При четвёртой и пятой степени рефлюкса эффективность эндоскопической инъекционной коррекции существенно ниже, чем при меньших степенях и используется ограниченно, при невыраженных нарушениях эндоскопической анатомии устьев мочеточников. Наибольшее значение при высоких степенях ПМР приобретают варианты оперативного лечения — антирефлюксные операции Лич-Грегуара, Политано-Леадбеттера, Коэна, Барри.
Описание способов коррекции ПМР
Эндоскопическая инъекционная коррекция пузырно мочеточникового рефлюкса заключается в введении гелевого импланта через специальную иглу в область устья мочеточника во время цистоскопии.
Введённый имплант формирует «бугорок», который при отсутствии выраженных изменений анатомии устья обеспечивает «функциональный клапан» и препятствует забросу мочи из мочевого пузыря в мочеточник.
Существуют различные типы имплантов — биодеградируемые (рассасывающиеся), частично биодеградируемые и небиодеградируемые (нерассасывающиеся). При выборе импланта специалист руководствуется множеством различных факторов — активностью инфекции, возрастом, степенью рефлюкса, анатомией устьев — и осуществляет его (выбор) индивидуально дифференцированно.
Оперативное лечение пузырно-мочеточникового рефлюкса сохраняет свою актуальность для высоких степеней ПМР и в случае неудачных эндоскопических инъекционных коррекций, заключается в реимплантации мочеточников в мочевой пузырь с хирургическим формированием антирефлюксного механизма.
Предложено множество открытых оперативных методик формирования антирефлюксного механизма через разрез передней брюшной стенки и мочевого пузыря. Самые распространённые и часто используемые: уретероцистонеоимплантации по Коэну (Cohen), Лич-Грегуару (Lich-Gregoir), Политано-Леадбеттеру (Politano-Leadbetter), Барри (Barry).
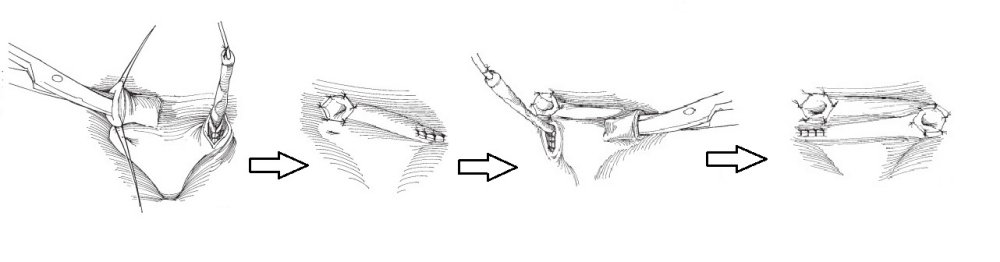
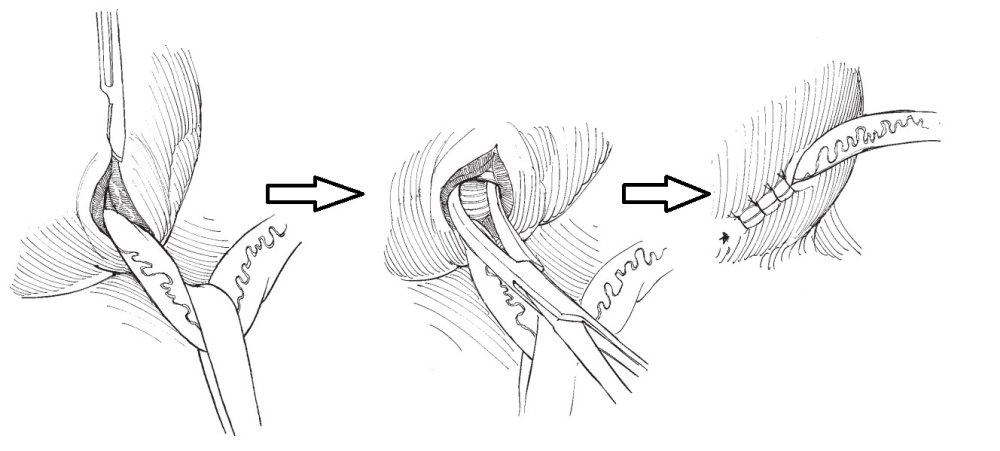
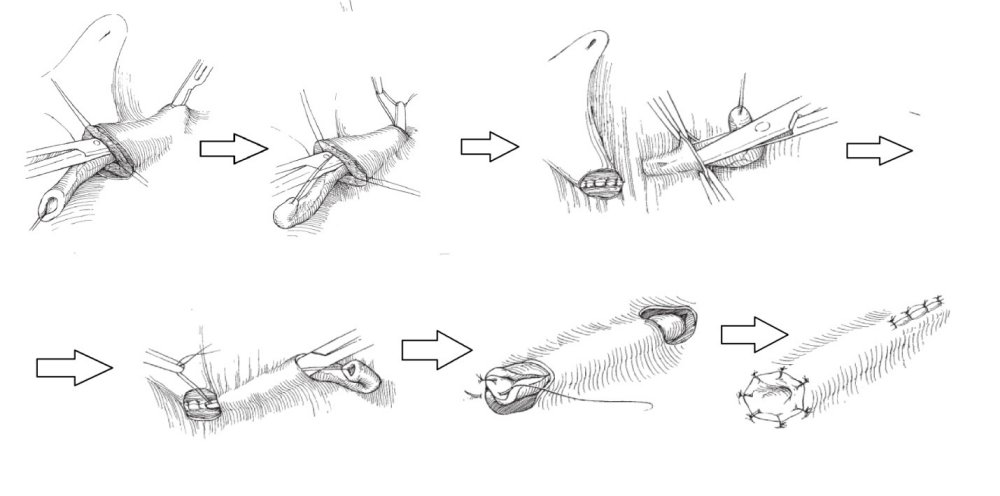
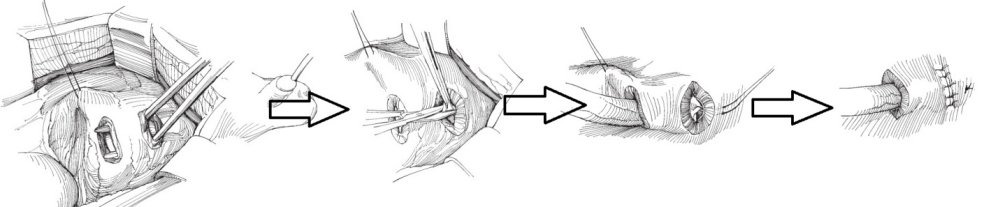
С ними Вы можете подробнее ознакомиться в любом руководстве по урологии. В нашей статье мы опишем своё «ноу-хау» — модификации открытых методик, которые мы выполняем лапароскопически или везикоскопически — через проколы передней брюшной стенки и мочевого пузыря, без больших разрезов, малотравматически.
Везикоскопическая уретроцистонеоимплантация по Коэну (Cohen). Выполняется в нашем отделении при высоких степенях рефлюкса с нарушением анатомии устья мочеточника, в том числе после неудачных инъекционных эндоскопических коррекций.
Через 3 прокола передней брюшной стенки в полость мочевого пузыря вводится лапароскоп и два эндоскопических инструмента. Мочеточник мобилизовывается в полости мочевого пузыря, затем формируется подслизистый тоннель в поперечном направлении. Длина тоннеля, согласно классическим представлениям, подтвердившим свою эффективность должна быть в 4 раза больше диаметра мочеточника. Мобилизованный отдел мочеточника перемещается в подслизистый тоннель. Неоустье (новое устье) фиксируется по окружности мочеточника 5-6 узловыми швами тонкой, саморассасывающейся нитью на атравматичной игле. Затем ушиваются оставшиеся дефекты слизистой мочевого пузыря, троакары удаляются.
Лапароскопическая операция выгодно отличается ототкрытой более лёгким протеканием послеоперационного периода, отличным косметическим эффектом (нет разреза) и более быстрой выпиской из стационара (5-8 дней).
Лапароскопическая операция Лич-Грегуара (Lich-Greoir). Выполняется в нашем отделении при 3 и 4 степени рефлюкса при неэффективности эндоскопических коррекций, типичной локализации устья мочеточника, когда требуется создание дополнительной антирефлюксной защиты.методика применяется преимущественно у мальчиков (у девочек расположение матки и её кровеносных сосудов может препятствовать применению способа).
Через три троакара в брюшную полость вводится лапароскоп и два эндоскопических инструмента. Мобилизуется дистальный отдел мочеточника, рассекается мышечный слой мочевого пузыря. На слизистую мочевого пузыря укладывавется мочеточник и над ним сшивается рассечённый мышечный слой мочевого пузыря — формируется антирефлюксный механизм.
Лапароскопическая модификация операция Политано-Леадбеттера подразумевает под собой сохранение направления хода мочеточника по направлению к шейке мочевого пузыря. Это делает её предпочтительной у пациентов с мочекаменной болезнью в анамнезе, так как предоставляет возможность для эндоскопического удаления или дробления камней в просвете мочеточника. В мочевой пузырь через переднюю брюшную стенку устанавливаются 3 троакара, мочеточник мобилизовывается внутрипузырно. Слизистая мочевого пузыря рассекается по направлению к шейке мочевого пузыря. На мышечный слой укладывается мочеточник, швами фиксируется устье, рассечённая слизистая мочевого пузыря сшивается над мочеточником — формируется антирефлюксная защита.
Лапароскопическая экстравезикальная уретероцистонеоимплантация (модификация операции Barry) незаменима при необходимости изолированной реимплантации рефлюксирующего мочеточника нижнего сегмента при удвоении почек. Методика предотвращает травматизацию мочеточника верхнего, неповреждённого сегмента.
В брюшную полость устанавливаются три тоакара, над дистальными отделами удвоенных мочеточников вскрывается брюшина и порочный мочеточник нижнего сегмента отделяется от нормального мочеточника верхнего сегмента. Со стороны брюшной полости мышечный слой мочевого пузыря рассекается в поперечном направлении до слизистой. В сформированное ложе укладывается дистальный отдел мочеточника, перфорируется слизистая, узловыми швами формируется устье, а мышечный слой сшивается над мочеточником — создаётся антирефлюксный механизм.
Все описанные оперативные методики являются ультрасовременными, и освоены далеко не во всех клиниках России и стран развитого капитализма. В нашем отделении выполнено более 30 подобных операций. Какую методику применить в конкретном случае мы каждый раз решаем коллегиально, оценивая данные обследования и все необходимые аспекты описанные Выше. На момент публикации этого текста у наших пациентов, перенёсших лапароскопические или везикоскопические антирефлюксные операции по поводу пузырно-мочеточникового рефлюкса РЕЦИДИВОВ или других осложнений, характерных для открытых методик, НЕТ.
Дети быстрее восстанавливаются, болевой синдром минимален, соответственно выписываются домой раньше.
Отделение плановой хирургии и урологии андрологии
Морозовская детская городская клиническая больница
Москва, 2014