Диагноз опера что это
Периферический рак легкого
С каждым годом наблюдается все интенсивней рост онкологической патологии. Первое место в структуре онкологических заболевания занимает рак легких. Это связано как с загрязнением окружающей среды, так и с курением, алкоголизмом, генетической предрасположенностью и другими факторами. Статистика смертей от рака легких тоже устрашает. Все связано с тем, что человек долгое время вообще не замечает симптомов, а даже когда замечает – легко находит им более простое объяснение. Затем следует период симптоматического лечения, а только когда совсем тяжко становится – больные обращаются за помощью. К сожалению, дольше половины пациентов при появлении выраженной клинической картины уже имеют многочисленные метастазы.
В зависимости от локализации разделяют центральный и периферический рак легких, а в случае вовлечение в процесс всего легкого, он носит название массивный. Центральный локализуется в крупных бронхах, а периферический рак легких – в бронхах с меньшим диаметром вплоть до альвеол. Но ученые утверждают, что отличия не только в локализации, но и в строении, происхождении, патогенезе, клинике и др. Например, считается, что курение и длительное вдыхание загрязненного воздуха является этиологическим фактором для центрального, а для периферического рака легких свойственно лимфогенное и гематогенное попадание канцерогенов.
Сколько времени живут с периферическим раком легких зависит от многих факторов, в том числе от лечения. Прогноз при периферическом раке достоверно благоприятней при своевременной диагностике и эффективной специфической терапии.
Около семидесяти процентов случаев периферического рака правого легкого, как и локализуется в верхних долях, около двадцати – в нижних, а в средних – меньше десяти. Гистологически же периферический рак чаще всего представлен либо аденокарциномой, либо плоскоклеточным раком.
Именно периферическая форма рака протекает практически бессимптомно. Диагностика на ранних стадия чаще связана с профилактическими медицинскими осмотрами.
Юсуповская больница оснащена всей современной аппаратурой, которая необходима для диагностики рака легких. Комфортабельные палаты, вежливый персонал, врачи высшей квалификации – это все залог успешного лечения.
Симптомы
Симптомы периферического рака легких чаще всего появляются на поздних стадиях. Клинические симптомы при периферическом раке в большинстве случаев связанные либо с сдавлением соседних органов или структур, либо с метастатическим поражением.
Периферический рак легкого имеет несколько форм – узловую, пневмониеподобную и верхушечную. Формы отличаются течением, клинической картиной и др.
Узловая форма дает клиническую картину, когда начинает давить на бронхи, плевру или сосуды. Это и становится причиной появления боли, кашля, выделения мокроты.
Пневмониеподобная протекает как воспаление легких, часто осложняется плевритом, но, что естественно, на терапию антибиотиками не отвечает, что и заставляет врача задуматься.
А вот периферический рак верхней доли правого легкого, как и периферический рак верхней доли левого легкого в литературе часто встречается как «верхушечный». Клиническая картина этой формы рака обусловлена врастанием новообразования в симпатические узлы. Внимание притягивает боли в плече, предплечье, кисти, появляется осиплость голоса, опускается верхнее веко и сужается зрачок. Данные симптомы часто сначала приводят к невропатологу, а уже потом к онкологу.
Лечение верхушечного рака так же имеет свои особенности, ведь, например, в случае оперативного лечения, возможно удаление вместе с ключицей и ребром. Химиотерапевтическое и лучевое лечение зачастую применяют в комплексе.
Прогноз
Сколько живут при периферическом раке легкого зависит от стадии, строения, возраста, сопутствующей патологии, наличия метастазов и др. К сожалению, продолжительность жизни, как и выживаемость при раке легких оставляет желать лучшего. Именно поэтому нельзя упускать ни минуты и как можно раньше приступать к лечению.
В случае наличия запущенной стадии периферического рака легкого и отказа от лечения продолжительность жизни измеряется в нескольких месяцах.
В случае своевременной диагностики и адекватного лечения пятилетняя выживаемость наблюдается в около шестидесяти процентов случаев, согласно статистическим данным.
Врачи Юсуповской больницы со своего опыта могут привести примеры многочисленных длительных ремиссий и выздоровлений, которых они смогли добиться своим трудом. Развиваясь, пытаясь найти решения специалисты Юсуповской больницы в круглосуточном режиме спасают жизни пациентов.
Синдром Апера
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
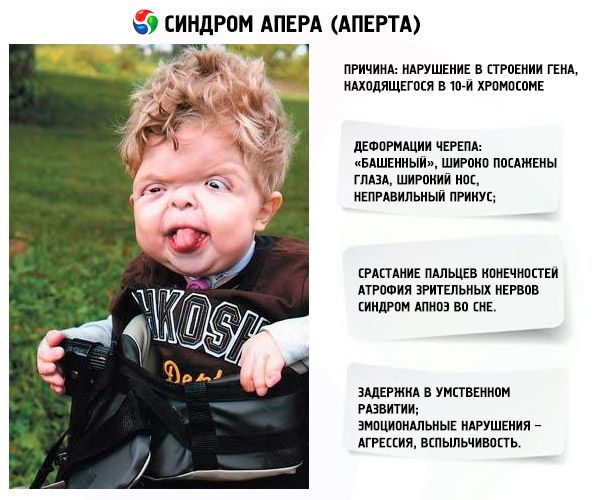
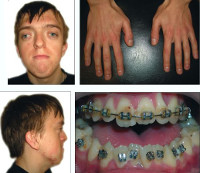
Синдром Апера (Аперта) является генетической патологией, в результате которой наблюдаются пороки в развитии черепа (широкопосаженные глаза, излишне высокий череп), а помимо этого нижних и верхних конечностей (пальцы на них полностью срастаются; могут появляться также дополнительные).

Код по МКБ-10
Эпидемиология
Эпидемиологические показатели: подобные случаи встречаются 1 на 160 тыс. Больные с данной патологией составляют примерно 4,5% ото всех случаев развития краниосиностозов.

Причины синдрома Апера
Развитие синдрома провоцируется нарушением в строении гена, находящегося в 10-й хромосоме. Данный ген ответственен за процесс разделения пальцев, а помимо этого за своевременное закрытие черепных швов.
Помимо этого причинами появления патологии считаются перенесённые в период вынашивания инфекционные болезни (такие, как краснуха или туберкулёз, сифилис либо грипп, а также менингит), облучение матери рентгеновскими лучами. Чаще всего подобный синдром выявляют у детей, родившихся у пожилых родителей.

Патогенез
Синдром Апера передаётся наследственным путём. Его тип – аутосомно-доминантный (т.е., в семье, в которой болен кто-то из будущих родителей, вероятность рождения малыша с этим заболеванием равна 50-100%).
Уникальный фактор роста фибробластов рецептор 2 (FGFR2) вследствие мутации приводит к увеличению числа клеток-предшественников, которые развиваются по остеогенному пути. В конечном счете, это приводит к повышенному образованию поднадкостничной костной матрицы и преждевременному окостенению швов черепа во время развития плода. Порядок и скорость шовного плавления определяют степень деформации и инвалидности. После того, как шовный материал заростает, рост других тканей перпендикулярно к этому шву становится ограниченным, и слитые кости действуют как единый костный каркас.
Первое генетическое доказательство того, что синдактилия при синдроме Апера является следствием дефекта фактора роста рецептора кератиноцитов (KGFR) стало наблюдение корреляции между экспрессией KGFR в фибробластах и серьезности синдактилией.
Амблиопия и косоглазие чаще встречается у пациентов с мутацией FGFR2 Ser252Trp а атрофия диска зрительного нерва чаще встречается у пациентов с мутацией FGFR2 Pro253Arg. У больных с FGR2 Ser252Trp мутации имеют значительно большую распространенность нарушений зрения по сравнению с пациентами с мутацией FGFR2 Pro253Arg.

Симптомы синдрома Апера
Отдельные проявления болезни отчётливо заметны уже при рождении малыша, потому как развиваются ещё внутри материнской утробы. Среди основных симптомов синдрома:

Осложнения и последствия
Большинство пациентов имеют некоторую степень обструкции верхних дыхательных путей в грудном возрасте. Верхние дыхательные пути за счет уменьшения размера носоглотки и хоан имеют плохую проходимость, нижние дыхательные пути в связи с аномалиями трахеи хряща могут стать причиной ранней смерти.

Диагностика синдрома Апера
Для постановки диагноза требуются следующие мероприятия:

Анализы
Проводится генетический анализ частых мутаций, возникающих в гене типа FGFR2.

Дифференциальная диагностика
Дифференцировать этот синдром нужно с прочими генетическими патологиями, при которых наблюдается краниосиностоз. Это такие болезни, как синдромы Пфайффера, Крузона, а также Сэтре-Чотцена и Карпентера. Чтобы исключить данные аномалии, применяются молекулярно-генетические способы тестирования.
К кому обратиться?
Лечение синдрома Апера
Выполнение хирургической операции считается единственным действенным методом лечения синдрома Апера – он помогает откорректировать отдельные физические дефекты, а также исправляет отсталость в умственном развитии.
В процессе проведения данной процедуры выполняется закрытие венечного шва, чтобы предупредить возможное травмирование головного мозга. Наиболее распространённой считается методика краниофациальной дистракции, при которой выполняется градационное вытяжение черепа. Для удаления отдельных дефектов на лице проводится ортодонтическая и/либо ортогнатическая операция.
Помимо этого пациентам хирургическим путём устраняют сращение пальцев.
Профилактика
Так как синдром Апера является наследственной патологией, способов профилактики его появления не существует.

Прогноз
Синдром Апера имеет неблагоприятный прогноз дальнейшего развития и жизни ребёнка. Исключение составляют лишь дети, которые достигли зрелости без каких-либо сердечных патологий.

Диагноз опера что это
Синдром Апера (Apert), или акроцефалосиндактилия, является редко встречающейся аномалией, которая характеризуется мальформациями черепа, лица и конечностей и в 50% случаев сопровождается умственной отсталостью различной степени тяжести. Впервые этот синдром был описан Уитоном (Wheaton) в 1894 году и обобщен Апером (Apert) в 1906 году, который представил 9 клинических наблюдений этой патологии.
По некоторым данным частота встречаемости синдрома Апера (Apert) составляет от 0,0625 до 0,1 на 10 000 родов. Вследствие высокого уровня неонатальной смертности ожидаемая распостраненность в общей популяции приблизительно оценивается на уровне от 5 х 10 6 до 1 х 10 5 на 10 000 новорожденных. Соотношение по половому признаку составляет 1:1.
Синдром Апера (Apert) представляет собой аутосомное нарушение с доминантным типом наследования. Большинство случаев возникает спорадически и обусловлено появлением новых мутаций. Описана связь возникновения патологии с увеличением возраста родителей.
При развитии заболевания вследствие новой мутации риск рецидива маловероятен. Если один из родителей является носителем заболевания, риск рецидива составляет 50%.
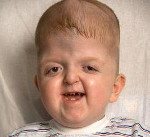
Наиболее типичными признаками синдрома Апера (Apert) являются краниосиностоз (с вовлечением коронарного шва при данном заболевании), двухсторонняя симметричная синдактилия конечностей (варежкообразные кисти и стопы) и гипоплазия срединных отделов лица. Дополнительные признаки, появляющиеся с переменной частотой, могут быть представлены:
• скелетными аномалиями, такими как уменьшенная по высоте и широкая голова; высокий «башенный» мозговой череп (акроцефалия); выступающий лоб; гипертелоризм и проптоз глазных яблок; глубокая переносица с носом, напоминающим клюв попугая; гипоплазия верхней челюсти; прогнатия;
• пороками сердца, такими как стеноз ствола легочной артерии, «верхом сидящая» аорта и дефекты межжелудочковых перегородок;
• аномалиями центральной нервной системы, такими как гидроцефалия, мальформации мозолистого тела и лимбических структур, аномалии извилин, гипоплазия белого вещества и гетеротопия серого вещества.
Имеются сообщения о пренатальной диагностике с помощью ультразвукового исследования и фетоскопии во всех триместрах беременности. Эхографическим маркером данной патологии в первом триместре также может быть увеличение толщины воротникового пространства.
Наиболее распространенными мутациями, которые вызывают синдром Апера (Apert), являются замены нуклеотидов серина на триптофан S252W и пролина на аргинин P253R, происходящие в гене рецептора 2 фактора роста фибробласта (FGFR2). При подозрении на синдром Апера (Apert) рекомендуется проведение молекулярно-генетических исследований у плода (путем биопсии ворсин хориона или амниоцентеза), а также обследование родителей, особенно в тех семьях, где заболевание регистрируется впервые.
Недавно выполненное исследование выявило, что при мутации P253R отмечаются меньшая выраженность черепно-лицевых аномалий и более значимымые деформации конечностей. Кроме того, с помощью генетических методов была выявлена связь между нарушением экспрессии генов рецепторов фактора роста кератиноцитов (KGFR) и возникновением деформаций конечностей при синдроме Апера (Apert).
В дифференциальный диагноз могут быть включены генетические синдромы, характеризующиеся наличием краниосиностоза, такие как синдромы Крузона (Crouzon), Пфайффера (Pfeiffer), Карпентера (Carpenter) и Сэтре-Чотцена (Saethre-Chotzen). В настоящее время для исключения этих аномалий могут использоваться молекулярно-генетические методы исследования.
До наступления периода жизнеспособности плода может быть предложено прерывание беременности. В более поздние сроки гестации стандартная акушерская такика не изменяется. Рекомендуется родоразрешение в специализированных перинатальных медицинских центрах.

Синдром Апера
Синдром Апера – генетическое заболевание, характеризующееся нарушениями процессов окостенения черепа и связанными с этим вторичными расстройствами, а также многочисленными пороками развития скелета и конечностей. Симптомами этого состояния являются карликовый рост, башенная форма черепа, расширенная переносица, незаращение твердого нёба, синдактилии на руках и ногах. Диагностика синдрома Апера производится по характерной клинической картине патологии, на основании рентгенологических данных и молекулярно-генетических исследований. Специфического лечения заболевания не существует, применяют поддерживающую терапию, проводят хирургические вмешательства паллиативного характера.
Общие сведения
Синдром Апера (акроцефалосиндактилия 1 типа) – генетическая патология, обусловленная нарушением образования некоторых видов соединительной ткани, главным образом костной. Впервые данное состояние было описано в 1906 году французским педиатром Э. Апером, дальнейшие исследования подтвердили генетическую природу этого заболевания. Этиология и молекулярно-генетические механизмы развития синдрома Апера были определены значительно позднее – лишь в 1995 году. Данная патология может наследоваться по аутосомно-доминантному механизму, однако в подавляющем большинстве случаев ее причиной являются спонтанные мутации в половых клетках родителей (так называемые герминативные мутации).
Синдром Апера с одинаковой частотой поражает как мальчиков, так и девочек, его встречаемость составляет в среднем 1 случай на 160 000-200 000 новорожденных. Врачи-генетики в настоящее время относят синдром Апера к особой группе наследственных заболеваний – акроцефалосиндактилиям, характеризующиеся одновременным поражением костей черепа и конечностей. Особенностью этой патологии является важность ее как ранней диагностики, поскольку паллиативные мероприятия в раннем возрасте могут в значительной степени влиять на дальнейшее интеллектуальное развитие больного.
Причины синдрома Апера
Синдром Апера, согласно последним научным данным, обусловлен мутациями гена FGFR2, расположенного на 10 хромосоме. Он кодирует белок-рецептор фактора роста фибробластов-2, который оказывает значительное влияние на развитие клеток соединительных тканей, в том числе и костной. Значительный размер (20 экзонов) и специфическое расположение гена делают его уязвимым к различного рода повреждениям, которые затем фенотипически проявляются наследственными заболеваниями. Помимо синдрома Апера дефекты гена FGFR2 приводят к развитию таких патологий, как синдром Бира-Стивенсона, синдром Пфайффера, синдром Сетре-Чотзена, краниофациально-скелетно-дерматологическая дисплазия и ряду других. Поэтому исследования данного гена довольно распространены в современной генетике.
Как показали исследования 1995-2000 годов, наиболее часто (в 96% случаев) к развитию синдрома Апера приводят мутации в области 7 экзона гена FGFR2. При этом на долю мутации S252W приходится порядка 74-76% от всех случаев заболевания, а примерно 21-23% вызываются дефектом P253R. Таким образом, причиной подавляющего большинства случаев синдрома Апера являются всего лишь два типа мутации, что упрощает молекулярно-генетическую диагностику этого состояния. Так как эти дефекты относятся к миссенс-мутациям, полученный в результате трансляции такого гена рецептор к фактору роста фибробластов имеет нарушенную структуру и неспособен выполнять свои функции. Это приводит к нарушению процессов окостенения черепа, в частности – к преждевременному зарастанию швов и остановке нормального роста черепной коробки. Дефект рецепторов при синдроме Апера также становится причиной пороков развития иных структур, где участвуют фибробласты (стенки сосудов крупного калибра, сердце, кости лицевого черепа, трахея). Наследуется это состояние по аутосомно-доминантному механизму, но чаще всего имеют место спонтанные мутации.
Кроме того, при синдроме Апера возникает аномальная экспрессия гена KGFR, тоже расположенного на 10 хромосоме. Он кодирует последовательность белка, являющегося рецептором к фактору роста кератоцитов. Никаких мутаций или других нарушений в структуре KGFR при синдроме Апера выявлено не было, лишь его чрезмерная активность, приводящая к увеличению количества кодируемых им рецепторов. Возможно, это явление объясняется сложными взаимоотношениями генов или же рецептор к фактору роста фибробластов 2 обладает супрессирующим действием на ген KGFR. Результатом аномальной экспрессии этого гена становятся фенотипические нарушения формирования конечностей – различные формы синдактилии, всегда встречающиеся при синдроме Апера, иногда полидактилия.
Симптомы синдрома Апера
Некоторые проявления синдрома Апера заметны с самого рождения – например, синдактилия, которая может быть полной или в виде перепонок. Как правило, срастаются 2, 3 и 4 пальцы на кистях, иногда аналогичный порок возникает и на пальцах ног. Среди неонатологов симптом иногда носит название «среднего пальца» – в тяжелых случаях эти три пальца прочно срастаются между собой и имеют один общий ноготь. Другим постоянным симптомом синдрома Апера, обнаруживающимся сразу после рождения или в первые месяцы жизни, является раннее развитие синостоза костей черепа. Чаще всего происходит срастание венечного или стреловидного шва, что по мере роста головного мозга приводит к деформации черепа по типу «башенной». Из-за черепного синостоза у больных синдромом Апера наблюдается хроническое повышение внутричерепного давления, становящееся причиной задержки умственного развития, головных болей, тошноты и рвоты.
Помимо деформации черепа о наличии синдрома Апера свидетельствует характерный внешний вид больных. У них обычно обнаруживается плоский или выпуклый лоб, гипертелоризм и экзофтальм, может развиваться косоглазие. Деформации затрагивают и кости лицевого черепа – переносица расширена, челюсти нередко недоразвиты, наблюдается нарушение прикуса. Из других симптомов синдрома Апера иногда регистрируются нарушения дыхания (из-за недоразвития верхней челюсти, сужения хоан или трахеи), незаращение твердого нёба, врожденные пороки сердца, аномалии развития позвонков, почек, прямой кишки.
У взрослых лиц, страдающих синдромом Апера, может возникать атрофия зрительных нервов вплоть до полной слепоты. Интеллектуальное развитие больных часто отстает от возрастной нормы, однако достоверно неизвестно, обусловлено это генетическими нарушениями или вторичными факторами (хронической внутричерепной гипертензией). Практически всегда при синдроме Апера наблюдается карликовый рост. При соответствующем паллиативном лечении и уходе больные могут доживать до преклонного возраста, но риск внезапной смерти из-за поражений дыхательной, нервной и сердечно-сосудистой систем у них намного выше, чем в популяции.
Диагностика
Диагностика синдрома Апера производится на основании осмотра и изучения настоящего статуса пациента, рентгенологических исследований, молекулярно-генетических анализов. При осмотре у больного выявляется синдактилия (у лиц старшего возраста могут обнаруживаться следы ее хирургической коррекции), деформация черепа – башенный череп или брахикефалия, характерный внешний вид лица.
С возрастом у больных синдромом Апера могут нарастать признаки нарушения дыхания, при ЭхоКГ нередко определяются пороки сердца и сосудов – стеноз легочного ствола или аорты, дефекты межжелудочковой перегородки. Иногда на этом фоне выявляются признаки сердечной недостаточности. Также возможно наличие иных пороков развития – аномалий позвонков, глухоты, слепоты (из-за катаракты, пигментного ретинита, атрофии зрительных нервов), патологий почек и поджелудочной железы. Из-за столь широкого спектра возможных нарушений больные синдромом Апера нуждаются в тщательном и всестороннем медицинском обследовании.
Рентгенологическими методиками уже у маленьких детей можно обнаружить синостоз костей черепа в области венечного или стреловидного шва. В дальнейшем при помощи рентгенографии можно определить характерную для синдрома Апера деформацию черепной коробки, пороки развития костей лицевого черепа, аномалии позвонков и другие нарушения.
Наиболее достоверным диагностическим методом при этом состоянии является молекулярно-генетический анализ. Как правило, для выявления синдрома Апера производят секвенирование 7 экзона гена FGFR2, иногда используют менее затратные техники, ориентированные только на поиск наиболее распространенных мутаций (S252W и P253R), приводящих к этому заболеванию. Подобные методики более дешевые и быстрые в выполнении, обладают точностью на уровне 95%, возможно их использование в качестве пренатальной диагностики этого состояния. Подобный анализ особенно актуален, если посредством профилактических УЗИ у плода выявляются нарушения, предположительно связанные с синдромом Апера – пороки развития черепа, сердца, верхних или нижних конечностей.
Лечение синдрома Апера
Специфического лечения синдрома Апера на сегодняшний день не существует, однако паллиативные и симптоматические мероприятия могут значительно облегчить состояние больного и улучшить качество его жизни. Особенно важно как можно раньше диагностировать это заболевание по той причине, что своевременная хирургическая коррекция черепного синостоза позволит избежать значительного роста внутричерепного давления. По многочисленным данным, после таких операций, произведенных в раннем детстве, признаки умственной неполноценности у больных синдромом Апера были выражены значительно слабее, иногда сохранялся нормальный интеллект. Поэтому борьба с внутричерепной гипертензией играет центральную роль в паллиативном лечении этого состояния. Если же у пациентов имеется умственная отсталость, то ее выраженность снижается путем психокоррекционной работы.
Другой часто выполняемой паллиативной хирургической операцией при синдроме Апера является вмешательство для разделения сросшихся пальцев на руках и ногах. Это относительно несложная процедура при перепончатом типе сращения, однако при более тяжелых формах порока операция значительно усложняется. При синдроме Апера также может потребоваться помощь хирургов в случае пороков сердца, сужения хоан или трахеи, нарушения формирования прямой кишки и других проявлений этого генетического заболевания. Больные нуждаются в регулярных медицинских обследованиях у специалистов различного профиля.
Прогноз и профилактика
Прогноз синдрома Апера неопределенный по причине очень широкого спектра проявлений и значительного диапазона их выраженности. На прогноз также оказывают влияние такие факторы, как своевременность диагностики заболевания, объем паллиативного и симптоматического лечения. При относительно легких случаях синдрома Апера или правильной терапии этого состояния больные могут доживать до преклонного возраста. При этом возможно снижение интеллекта и появляющиеся с возрастом нарушения все новых органов и систем, что негативно сказывается на качестве жизни пациентов. В тяжелых случаях наблюдается летальный исход в раннем детстве из-за врожденных пороков сердца или полиорганной недостаточности.
Профилактика синдрома Апера возможна только в качестве пренатальной диагностики, которая может производиться как ультразвуковыми методиками, так и путем молекулярно-генетического анализа. Обычно проявления патологии сначала обнаруживаются на профилактических УЗИ, а затем диагноз подтверждается врачом-генетиком. Если данное состояние удается выявить на ранних сроках беременности, то ставится вопрос о ее прерывании.