Диарея на антибиотики у ребенка что делать
Антибиотик-ассоциированные диареи у детей: что нового?
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Эра антибиотиков (АБ) началась всередине ХХв. Широкое ибесконтрольное применение различных групп антибактериальных препаратов, особенно вамбулаторных условиях, привело кразвитию множества нежелательных эффектов, одним изкоторых является диарея. Еепоявление нафоне приема АБобозначается как диарея (ААД). Согласно определению ВОЗ, ААД характеризуется учащением стула (более 3 р./сут), которое возникает нафоне антибиотикотерапии или втечение 2мес. после ееокончания, сопровождается увеличением объема, изменением консистенции, появлением патологических примесей ввиде слизи, зелени икрови [1]. Поданным различных авторов, ААД развивается у5–30% лиц, получающих АБ[2, 3].
Ежегодно, согласно данным ВОЗ, в мире регистрируются 1–1,2 млрд диарейных заболеваний, а 5 млн случаев заканчиваются летальным исходом. Около 1,87 млн случаев смерти приходится на возраст до 5 лет. В России ежегодно заболевают диареей 500 тыс. детей [1]. Основную долю составляют диареи вирусной и бактериальной этиологии (рис. 1), в 6–7% случаев она обусловлена применением АБ.
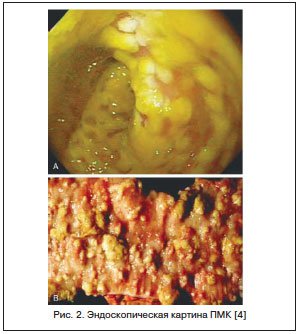
Считается, что в 20–25% случаев ААД отмечается в стационарах, но в последние годы увеличивается ее доля при назначении АБ в амбулаторной практике. Точных данных о частоте развития ААД у детей нет, чаще всего педиатры при подобной ситуации диагностируют дисбактериоз кишечника. У части пациентов ААД может иметь легкое течение, и при отмене АБ симптомы исчезают. Однако существуют тяжелые формы ААД, проявляющиеся псевдомембранозным колитом (ПМК). ПМК — острое, тяжелое заболевание толстой кишки, связанное с применением АБ и/или хирургическим вмешательством на кишечнике. ПМК характеризуется появлением на слизистой оболочке округлых фибринозных бляшек, сливающихся между собой, на фоне изменений (рис. 2).
Механизмы развития диареи на фоне применения АБ:
1. Собственные побочные эффекты АБ (например, усиление перистальтики кишечника при приеме амоксициллина с клавулановой кислотой, макролидов, которые обладают мотилиноподобным действием на рецепторы кишечника) [5].
2. Осмотическая диарея в результате нарушения метаболизма желчных кислот и углеводов в кишечнике (например, при приеме фосфомицина трометамола) [6].
3. Избыточный рост бактерий в результате подавления облигатной интестинальной микрофлоры кишечника [7].
Осмотическая и ААД в результате собственных побочных эффектов антибиотиков чаще всего протекает легко и требует отмены проводимой антибактериальной терапии или изменения пути введения «виновного» антибиотика. При ее развитии необходимо назначение препаратов — энтеросорбентов (Смекта®) от 3 до 7 дней и пробиотиков.
ААД этиологически может быть связана c воздействием различных микробов: C. difficile, Pseudomonas aeruginosa, Klebsiella oxytoca, Staphylococcus aureus, а также грибов рода Candida. Однако наиболее тяжелые формы ААД и ПМК обусловлены наличием C. difficile.
К факторам риска развития ПМК, обусловленного наличием C. difficile, относятся [3, 10, 11]:
C. difficile — грамположительный спорообразующий анаэроб, устойчив к воздействию алкогольсодержащих антисептиков, чувствительный к кислой среде желудка (при рН ниже 3,5) [12]. Особенностью жизненного цикла C. difficile является развитие форм — вегетативной и спор. Споры чрезвычайно устойчивы к различным внешним агрессивным воздействиям и могут оставаться жизнеспособными в течение многих лет в окружающей среде [13]. Вегетативные формы C. difficile обладают способностью продуцировать экзотоксины, среди которых идентифицированы энтеротоксин (токсин, А) и цитотоксин (токсин В), повреждающие кишечную стенку [14].
На сегодняшний день доказано, что токсин, А повышает секрецию жидкости в просвет кишечника, способствуя развитию диареи. Токсин В ингибирует процессы синтеза белка в энтероцитах и колоноцитах, оказывает выраженное цитопатогенное действие, нарушая функции клеточных мембран и приводя к потере калия и развитию выраженных электролитных нарушений. Токсин В действует только в присутствии токсина, А, повреждая мембраны в тысячу раз сильнее. Энтеротоксичность C. difficile реализуется путями: прямой эффект заключается в непосредственном действии токсинов на энтероциты и нервный аппарат кишечной стенки; непрямой обеспечивается за счет активации макрофагов, тучных клеток и увеличения продукции провоспалительных цитокинов.
В исследованиях, проведенных в Европе и Америке, отмечается, что токсигенные штаммы C. difficile связаны с госпитальными вспышками и являются причиной генерализации инфекции, продуцируя значительно больше токсинов [15–17]. Споры C. difficile проявляют высокую устойчивость к факторам внешней среды и стандартным дезинфицирующим средствам, а вегетативные формы резистентны к большинству АБ (природные и полусинтетические пенициллины, пенициллины, цефалоспорины, линкозамиды и др.) [12].
Инфицирование C. difficile осуществляется путем, резервуаром могут быть бактерионосители, пациенты и медработники, а также контаминированные поверхности в стационарах и амбулаториях [18]. путь передачи C. difficile с участием различных факторов создает серьезный риск развития внутрибольничной инфекции, особенно у пациентов, получающих массивную антибактериальную терапию. Кроме этого, контингентами риска по развитию тяжелых форм нозокомиальной C. являются дети раннего возраста, ослабленные, а также пациенты, длительно находящиеся в стационаре [19, 20].
Клинические варианты течения C. диареи у детей могут быть малосимптомными или тяжелыми, вплоть до развития ПМК. Легкое течение часто характеризуется клиническими проявлениями нетяжелого колита (энтероколита), без лихорадки и интоксикации. Дети могут отмечать появление болей в животе, но чаще болезненность со стороны кишечника выявляется лишь при его пальпации. Отмечается увеличение количества дефекаций в сутки, часто не приводящее к нарушениям [18]. В некоторых случаях отмечаются усиление болей в животе, его вздутие, нарастание интоксикации и диареи с прогрессированием процесса при отсутствии адекватной терапии [9].
Клинические проявления ПМК у детей разнообразны и развиваются остро. Для детей младшего возраста характерны лихорадка, отказ от еды, нарастание интоксикации, срыгивания, диарея с нарушениями и вздутием живота, болезненной пальпацией живота по ходу толстой кишки [9, 18]. Стул частый, в каловых массах — примесь слизи и иногда крови. Иногда большая часть испражнений представлена густой белесоватой слизью и обрывками фибринозных наложений. В случаях резко выраженного учащения стула развивается эксикоз с нарушениями кровообращения, значительно реже отмечается коллапс без предшествующей диареи. Течение ПМК может осложниться кишечным кровотечением, перфорацией кишечника с развитием перитонита [18]. Для своевременного выявления этих грозных осложнений за пациентами с тяжелыми формами инфекции C. difficile необходимо совместное наблюдение педиатром и хирургом [19, 20].
При бактерионосительстве C. difficile и легких вариантах ААД изменений в клиническом анализе крови обычно не отмечается. При манифестных формах инфекции изменения в крови характеризуются нейтрофильным лейкоцитозом, сдвигом лейкоцитарной формулы влево и увеличением СОЭ. Водянистая диарея как главный симптом C. обычно появляется через несколько дней после колонизации C. difficile. У каждого четвертого пациента C. с диареей сопровождается лихорадкой, болью внизу живота и судорогами на фоне электролитных нарушений, у половины больных в анализе крови отмечается выраженный лейкоцитоз [21].
У здоровых детей бессимптомное носительство C. difficile не требует проведения лечебных мероприятий. При развитии манифестных форм инфекции, независимо от степени выраженности клинических проявлений, принципиальным положением является незамедлительная отмена используемых АБ. Этиотропная терапия должна назначаться в каждом случае индивидуально, с учетом возраста ребенка, тяжести заболевания и фоновых состояний [19].
У детей раннего возраста, ослабленных, у пациентов с нейтропенией, тяжелыми хроническими заболеваниями и пороками развития (особенно ЖКТ), даже при легких формах инфекции назначение антиклостридиальных препаратов считается обоснованным.
C. диарея легкого и среднетяжелого течения у детей протекает с клиническими симптомами нетяжелого колита/энтероколита и чаще без лихорадки и с незначительной интоксикацией. Отмечаются умеренные боли в животе, самостоятельные и/или при пальпации, метеоризм, умеренное учащение дефекации, как правило, не приводящее к выраженным нарушениям. В терапии таких вариантов течения хорошо зарекомендовали себя симптоматические препараты, обладающие энтеросорбирующим, цитопротективным и вяжущим эффектами.
У детей с высоким риском развития ААД стоит уделить внимание профилактике данных состояний, выбирая энтеросорбент, обладающий не только сорбирующими, но и протективными свойствами. И в этом смысле диоктаэдрический смектит (Смекта®) является препаратом выбора, обладает цитомукопротективными свойствами [22].
В 2008 г. совместная рабочая группа ESPGHAN и ESPID опубликовала научно обоснованные рекомендации по применению противодиарейных препаратов, которые оправданно использовать в качестве дополнительной терапии диарейного синдрома у детей. Среди энтеросорбентов рекомендован диоктаэдрический смектит (Смекта®) с высоким уровнем доказательности (II, B) в комплексе с оральной регидратацией [23]. Диоктаэдрический смектит обладает текучестью и обволакивающей способностью, предохраняет слизистую оболочку кишечника от воздействия агрессивных и токсических факторов. Диоктаэдрический смектит проникает в муциновый слой и изменяет физические свойства слизи, увеличивая энзиматическую активность гликокаликса, тем самым снижая потерю электролитов и воды с калом [24]. Являясь селективным сорбентом, диоктаэдрический смектит выводит из организма бактерии, вирусы, токсины, желчные кислоты, избыточное количество углеводов и уменьшает количество газа [25].
При острых состояниях оправданно применение двойной суточной дозировки диосмектита в течение первых дней терапии [30]. Смекта® является топическим препаратом и имеет высокий профиль безопасности, не всасывается из ЖКТ, что позволяет создать в просвете кишки высокую концентрацию активного вещества; при этом препарат быстро и полностью выводится из организма.
Абсолютными показаниями для этиотропной терапии являются тяжелые формы заболевания, сохраняющаяся диарея после отмены АБ, а также рецидив инфекции на фоне повторного приема АБ. C. difficile высокочувствительны к метронидазолу, ванкомицину и фидаксомицину. При этом стартовую этиотропную терапию C. в большинстве случаев начинают с введения метронидазола, который считается препаратом выбора. Ванкомицин является альтернативным АБ для лечения данной инфекции и назначается как препарат первой линии лишь в тех случаях, когда введение метронидазола противопоказано (индивидуальная непереносимость, тяжелые поражения печени и нервной системы, выраженная лейкопения). Фидаксомицин в настоящее время для использования в РФ не зарегистрирован.
Метронидазол для лечения C. применяется в дозе 30 мг/кг/сут, вводится ребенку в 3–4 приема. В отличие от ванкомицина метронидазол может вводиться как перорально, так и парентерально — путем инфузии. В тех случаях, когда у ребенка с C. выражены тошнота, срыгивания и/или рвота, стартовая этиотропная терапия должна начинаться с парентерального введения метронидазола. При купировании указанных симптомов и улучшении общего состояния целесообразно заменить введение метронидазола на его пероральный прием. При приеме внутрь препарат быстро и хорошо всасывается (биодоступность — 80–100%) [26].
Ванкомицин — АБ из группы гликопептидов также обладает выраженным бактерицидным действием на C. difficile. Однако при C. его рекомендовано использовать как препарат второй линии, когда отсутствует клинический эффект стартовой терапии, либо в качестве альтернативного АБ у детей с противопоказаниями к применению метронидазола. Ограничения к широкому использованию ванкомицина объясняются попыткой снизить риск развития устойчивости к нему грамположительной флоры, в первую очередь стафилококков и энтерококков. Это связано с тем, что ванкомицин в настоящее время — один из немногих антибактериальных препаратов, эффективных при инфекциях, вызванных штаммами стафилококка. В случаях необходимости применения ванкомицина при C. используется только пероральный способ его введения [6, 27]. В исследовании et al. (2007) установлено, что ванкомицин (пероральный путь введения) имеет преимущество перед метронидазолом (чувствительность к ванкомицину 97% против 76% к метронидазолу). Однако в связи с высокой стоимостью ванкомицина и развитием резистентности к нему некоторых микроорганизмов в качестве препарата первой линии рекомендуется метронидазол [28].
Фидаксомицин — новый представитель узкоспектральных макролидов. Это продукт ферментации актиномицет Dactylosporangium aurantiacum. У него отсутствуют системные эффекты, минимальна абсорбция в кровоток, он обладает бактерицидным действием и выраженной антагонистической активностью к C. difficile с самым минимальным влиянием на нормальную микрофлору. В экспериментах показывает способность снижать частоту повторяющихся инфекций C. difficile. Выпускается в таблетках по 200 мг, назначается 2 р./сут с интервалом 12 ч на 10 дней. Экскретируется со стулом (>90%), незначительная часть — с мочой (0,59%). На данный момент препарат отличается высокой стоимостью, как уже упоминалось, не зарегистрирован в РФ. За рубежом необходимость его применения до сих пор является предметом дискуссии, отсутствуют исследования безопасности его применения у пациентов с воспалительными заболеваниями кишечника.
Согласно рекомендациям ESPGHAN и ESPID по применению противодиарейных препаратов, обновленным в 2014 г., диоктаэдрический смектит (Смекта®) в сочетании с пробиотиками Lactobacillus GG эффективен в терапии острой диареи у детей раннего возраста.
Заключение
Таким образом, основными резервами снижения заболеваемости у детей C. являются улучшение санитарной культуры населения в целом и повышение профессионализма медицинских работников. Дополнением к перечисленным видам профилактики и лечения C. являются различные методы восстановления микробиоты кишечника: прием препарата Смекта® и пробиотиков.
Только для зарегистрированных пользователей
Антибактериальная терапия инфекционных диарей у детей
Рассмотрены подходы к терапии острых кишечных инфекциях у детей. Широкий спектр антибактериального действия, практически полное отсутствие влияния на нормальную микрофлору, высокую безопасность, позволяет рекомендовать кишечный антисептик нифуроксазид для
Инфекционные диареи в настоящее время занимают второе место в структуре инфекционной заболеваемости детей, уступая только острым респираторным инфекциям. Уровень заболеваемости острыми кишечными инфекциями (ОКИ) у детей в 2,5–3 раза выше, чем у взрослых, при этом более половины регистрируемых случаев инфекционных диарей приходится на долю детей раннего возраста. По данным Всемирной Организации Здравоохранения (ВОЗ) (2008), в мире ежегодно регистрируется до 2 млрд диарейных заболеваний и около 5 млн детей ежегодно умирают от кишечных инфекций и их осложнений. В Европе ежегодно регистрируется от 0,5 до 1,9 эпизодов инфекционных диарей у каждого ребенка младше 3 лет [1]. У детей инфекционная диарея по-прежнему является одной из основных причин смертности, причем не только в развивающихся странах [2, 3].
В настоящее время в России отсутствуют согласованные подходы к терапии ОКИ у детей, причем частота назначения антимикробных препаратов остается на высоком уровне, особенно у госпитализированных пациентов [4]. По этой причине представляется актуальным освещение вопросов антимикробной терапии ОКИ на современном этапе. Прежде чем начать терапию ОКИ, необходимо установить патогенетический тип диареи (инвазивный, секреторный, осмотический или смешанный), определить синдром поражения желудочно-кишечного тракта (ЖКТ) (гастрит, гастроэнтерит, энтерит, гастроэнтероколит, энтероколит, колит, дистальный колит), кроме этого, необходимо диагностировать развившиеся осложнения ОКИ (синдром дегидратации, инфекционно-токсический шок, гемолитико-уремический синдром и т. д.) и оценить преморбидный фон пациента (есть ли у больного пищевая аллергия, синдром мальабсорбции, иммунодефицитное состояние и т. д.) [5].
Основные принципы терапии ОКИ у детей предполагают целенаправленное воздействие, в первую очередь, на макроорганизм, обуславливающее коррекцию возникших водно-электролитных расстройств, а также и элиминацию возбудителя. При остром гастроэнтерите ВОЗ считает абсолютно доказанной эффективность двух терапевтических мероприятий: регидратации и диетотерапии (2006). При этом не следует забывать, что более 70% всех инфекционных диарей у детей вызываются вирусными агентами [3, 6, 7], а при вирусных инфекциях антибактериальная терапия не только не показана, но и наносит значительный вред макроорганизму [8, 9].
Наиболее дискутабельным остается вопрос о целесообразности использования антимикробных средств в лечении бактериальных ОКИ у детей. Назначая антибиотик в этих случаях, врач ожидает: уменьшения выраженности клинических симптомов; сокращения продолжительности заболевания; снижения частоты развития осложнений; прекращения выделения возбудителя; предупреждения дальнейшего распространения инфекции [10].
В то же время доказано, что использование антибиотиков при бактериальной диарее далеко не всегда эффективно и безопасно. При энтерогеморрагическом эшерихиозе, вызванном как E. coli О157: Н7, так и E. coli O104: H4, применение антибиотиков приводит к массивному высвобождению шигаподобного токсина, следовательно, увеличивает риск развития гемолитико-уремического синдрома (ГУС). При этом включение в терапию фторхинолонов и триметоприм/сульфаметоксазола сопровождалось высоким риском развития ГУС, а наиболее безопасным и эффективным оказалось использование карбапенемов, макролидов и рифаксимина [11].
Назначение антимикробных препаратов при бактериальных диареях в значительном проценте случаев не только не приводит к санации макроорганизма от возбудителя, но и, наоборот, способствует продолжительной персистенции бактериального агента в ЖКТ, вследствие не только подавляющего влияния на нормальную микрофлору кишечника, но и прямого иммуносупрессивного действия [12, 13]. По данным отечественных и зарубежных исследователей, затяжное реконвалесцентное бактериовыделение сальмонелл формируется у значительного числа пациентов, получавших антибиотики в острую фазу инфекции, по сравнению с лицами, получавшими исключительно патогенетическую терапию [14, 15]. По нашим собственным данным, бактериовыделение сальмонелл в периоде реконвалесценции отмечено в среднем у 37% детей, лечившихся системными антимикробными средствами. Влияние антимикробной терапии на иммунный ответ было показано авторами при шигеллезе, причем комбинированная антибактериальная терапия приводила к выраженной супрессии как гуморального иммунного ответа, так и показателей фагоцитоза [16].
Самым серьезным недостатком широкого использования антибактериальных препаратов при лечении инфекционных диарей является быстрое развитие у представителей семейства Enterobacteriaceae резистентности к антимикробным препаратам [17]. Так, отечественными авторами зафиксирован неуклонный рост числа штаммов Salmonella enteritidis, устойчивых к большинству стартовых антимикробных препаратов. Например, к налидиксовой кислоте в настоящее время резистентно до 60% циркулирующих штаммов сальмонелл [14]. Все чаще выявляются штаммы кампилобактерий, обладающие широкой антибиотикорезистентностью, в том числе к макролидам и фторхинолонам [14, 18]. Параллельно с ростом антибиотикорезистентности отмечено снижение клинической эффективности стартовой антибактериальной терапии при назначении налидиксовой кислоты, она уменьшилась к 2009 г. по сравнению с 2000–2005 гг. с 61% до 48,3%, а при использовании амикацина — с 53,9% до 31,7% [14, 15].
Кроме того, применение противомикробных препаратов нередко обуславливает развитие аллергических реакций, вплоть до анафилактического шока, а также назначение антибиотиков может привести к развитию не только идиопатической антибиотикоассоциированой диареи, но и тяжелых антибиотикоассоциированных колитов, обусловленных токсинообразующими штаммами Clostridium difficile [6, 10].
Проведенные в России немногочисленные фармакоэпидемиологические исследования показали, что у детей, болеющих ОКИ, в большинстве случаев в стационаре используется антибактериальная терапия (72–100% госпитализированных), причем минимум у трети больных отсутствуют какие-либо показания к ее назначению, при этом во многих стационарах используются малоэффективные или токсичные препараты (хлорамфеникол, естественные пенициллины, рифампицин) [4, 19, 20].
В практическом здравоохранении отмечаются не только ошибки в выборе антимикробного препарата для лечения инфекционных диарей, но и часто встречаются как недостаточные, так и избыточные дозы назначаемых препаратов, неадекватный способ введения, неправильный выбор интервалов между введениями, необоснованное сочетание двух и более антибактериальных средств [13]. Если доза антибиотика недостаточна и не обеспечивает в крови и тканях концентрации, превышающие минимально подавляющие концентрации основных возбудителей инфекции, то это не только становится одной из причин неэффективности лечения, но и создает предпосылки для формирования антибиотикорезистентности микроорганизмов. В современной ситуации, при наличии высокоэффективных антимикробных препаратов широкого спектра действия для лечения ОКИ, показания к комбинированной антибактериальной терапии практически отсутствуют и приоритет в лечении остается за монотерапией [6, 18, 21].
Кроме этого, до настоящего времени при инфекционных диареях проводится необоснованно длительная антибактериальная терапия со сменой 3–4 лекарственных средств, реже имеет место неоправданно короткая антимикробная терапия [4].
В силу вышесказанного в настоящее время показания к использованию антибиотиков в лечении ОКИ являются строго ограниченными и определяются типом диареи и этиологией заболевания, формой тяжести инфекционного заболевания, возрастом и состоянием преморбидного фона пациента [6, 9, 21].
Антимикробный препарат, предназначенный для лечения инфекционных диарей у детей, должен отвечать следующим критериям: иметь высокую активность в отношении основных циркулирующих возбудителей бактериальных ОКИ; обладать бактерицидным действием; иметь высокую биодоступность действующего вещества и создавать высокую концентрацию в ЖКТ. Необходимо, чтобы уровень штаммов, имеющих резистентность к препарату, был низким. Немаловажную роль в педиатрии играют профиль безопасности (количество и характер токсических эффектов), фармакоэкономические характеристики (соотношение эффективности, безопасности и стоимости) препарата, удобная для детей форма выпуска (суспензия) и режим дозирования лекарственного средства [1, 5–7].
Ю. Б. Белоусовым и С. М. Шатуновым (2001) было предложено разделить антимикробные препараты для лечения кишечных инфекций на две группы. Первая — препараты, которые после перорального приема не абсорбируются (т. е. имеют низкую биодоступность) и обеспечивают антимикробный эффект только в кишечнике, не оказывая системного действия (так называемые кишечные антисептики — нитрофураны, нефторированные хинолоны и хинолины, некоторые сульфаниламиды и др.); вторая — антибиотики, хорошо всасывающиеся в тонкой кишке, которые оказывают системное действие, но одновременно обеспечивают низкие терапевтические концентрации в стенке кишечника (фторхинолоны, хлорамфеникол, тетрациклины, макролиды, нитроимидазолы и др.) [22].
Высокие концентрации препаратов первой группы в пищеварительном тракте являются важной характеристикой для лечения инфекционных диарей, но в случае генерализации инфекции эти антимикробные средства оказываются неэффективными, так как не обеспечивают терапевтических концентраций в крови и паренхиматозных органах [22–24]. В последние годы при лечении бактериальных ОКИ широко применяются невсасывающиеся антимикробные препараты. Их преимуществами по сравнению с системными антибиотиками являются: возможность непосредственного воздействия на бактериальный агент при низком риске развития резистентности штаммов; практически полное отсутствие негативного влияния на нормальную микрофлору; незначительная частота развития системных побочных реакций; отсутствие лекарственного взаимодействия, так как они не оказывают влияния на ферменты системы цитохрома Р450 [25–28].
В соответствии с рекомендациями ВОЗ, антимикробная терапия при инфекционных диареях показана только при следующих нозологических формах: холере, брюшном тифе, шигеллезе и амебиазе [1].
По мнению ведущих отечественных инфекционистов, показаниями к назначению антимикробной терапии у детей с острыми кишечными инфекциями являются развитие (угроза развития) генерализованных форм (тифоподобных, септических) заболеваний; тяжелые формы инвазивных диарей, а также среднетяжелые формы инвазивных ОКИ у детей групп риска. К пациентам групп риска относятся дети с тяжелыми хроническими заболеваниями (первичные иммунодефициты, злокачественные новообразования, воспалительные заболевания кишечника, корригированные оперативным путем врожденные пороки сердца, ювенильные артриты и т. д.) и дети раннего возраста (первые 6–12 месяцев жизни) [6, 7, 21]. Кроме вышеперечисленных лиц, антибактериальная терапия является обязательной для пациентов с иерсиниозами.
Принципы рациональной антибактериальной терапии ОКИ у детей предусматривают своевременное назначение препарата (период разгара болезни); разделение используемых антимикробных препаратов на стартовые, альтернативные и препараты резерва; учет антибиотикочувствительности выделенных штаммов; использование оптимального способа, дозы, кратности введения и курса терапии, а также учет индивидуальных особенностей пациента (возраста, преморбидного фона и т. д.).
Большинство зарубежных источников препаратами выбора для терапии инфекционных диарей у детей, протекающих с клиникой гемоколита, считают цефтриаксон и азитромицин, а у взрослых пациентов — фторхинолоны и азитромицин [1, 18]. Длительность назначения антимикробных препаратов не превышает 5 суток, а во многих случаях ограничивается 24–48 часами. Для терапии шигеллезов сохраняют актуальность ампициллин, налидиксовая кислота, триметоприм/сульфаметоксазол, нитрофураны [18, 29].
Стартовые препараты антибактериальной терапии ОКИ целесообразно использовать в ранние сроки заболевания при среднетяжелых формах инвазивных диарей и отсутствии индивидуальной непереносимости препаратов. Преимущество отдается препаратам с широким спектром действия, которые обладают бактерицидным или бактериостатическим действием, плохо всасываются из кишечника и не оказывают подавляющего влияния на аутохтонную микрофлору. К таким препаратам относятся производные оксихинолина, нитрофураны, аминогликозиды I–II поколения. Так как выбор антибактериального препарата в острый период инфекционной диареи осуществляется эмпирически, то при необходимости следует корригировать терапию в соответствии с антибиотикочувствительностью выделенного возбудителя [13, 22].
Эффективность антибактериальной терапии, основными критериями которой являются нормализация температуры тела, купирование или уменьшение выраженности интоксикации и диарейного синдрома, оценивается в течение 48–72 часов после начала лечения. При отсутствии положительной клинической динамики или прогрессировании симптомов заболевания, а также на поздних сроках заболевания как альтернатива стартовым антибиотикам могут использоваться иные антибиотики: защищенные аминопенициллины, нефторированные хинолоны (налидиксовая кислота), хлорамфеникол, макролиды II поколения, цефалоспорины II–III поколения, аминогликозиды II–III поколения (амикацин, нетилмицин), нитроимидазолы. При тяжелых формах ОКИ целесообразно начинать терапию с парентерального введения антимикробных препаратов, а по достижении клинического эффекта возможен переход на пероральный прием антибиотика до завершения полного курса терапии.
Антибиотики резерва используются исключительно в условиях стационара, обладают широким спектром действия и высокоэффективны в отношении практически всех возбудителей ОКИ, в том числе и устойчивых к антибактериальным препаратам стартовой и альтернативной терапии. Показаниями к назначению таких препаратов являются генерализованные и септические формы ОКИ, тяжелое течение ОКИ у детей с неблагоприятным преморбидным фоном, подозрение на нозокомиальную природу заболевания, а также неэффективность вышеназванных групп антибиотиков. К препаратам резерва относятся цефалоспорины III–IV поколения, карбапенемы, аминогликозиды II–III поколения, фторхинолоны (у детей можно использовать только по жизненным показаниям) [8, 21, 22].
При выборе этиотропной терапии необходимо учитывать не только предполагаемого возбудителя ОКИ, но и быстро формирующуюся резистентность циркулирующих энтеробактерий к традиционно применяемым антибактериальным средствам. В этой связи рекомендации по выбору оптимального антибактериального средства должны обязательно основываться на региональных данных по структуре антибиотикорезистентности.
В детской практике имеются сложности в антимикробной терапии инфекционных диарей, особенно это касается пероральных форм лекарственных средств и связано в первую очередь с возрастными ограничениями по применению препаратов в педиатрии. Так, налидиксовая кислота разрешена к применению с 2-летнего возраста (а по некоторым источникам с 18 лет); рифаксимин с 12-летнего возраста, а Интетрикс в настоящее время вообще не разрешен в педиатрии.
Следовательно, основным стартовым препаратом в детской инфектологии в последние годы является нифуроксазид. Нифуроксазид относится к нитрофурановым препаратам, антибактериальная активность которых обусловлена продукцией нитроанионов. Нитрофурановые препараты являются акцепторами ионов водорода при переносе электронов с флавиновых ферментов на цитохром, тем самым нитрофураны блокируют энергообразование в бактериальной клетке. Кроме этого, нифуроксазид блокирует активность альдолаз, дегидрогеназ, транскетолаз и синтез макробелковых комплексов. В результате этих взаимодействий нитрофуранов с бактериальными агентами нарушаются процессы роста и деления бактериальных клеток. Доказано, что нифуроксазид в среднетерапевтических дозах оказывает бактериостатический, а в высоких дозах — бактерицидный эффект [23, 24, 30].
Нифуроксазид относится к местным антисептикам и практически не всасывается в кровь из ЖКТ, не влияет на эндогенную микрофлору, практически не приводит к формированию антибиотикорезистентных штаммов [30, 31].
В России и за рубежом имеется обширный положительный опыт использования нифуроксазида при шигеллезе, сальмонеллезе, ОКИ, вызванных условно-патогенными возбудителями [15, 31, 32]. В 2013 году в РФ зарегистрирован нифуроксазид под торговым названием Стопдиар, причем у данного препарата есть две лекарственные формы — таблетки, 100 мг, покрытые пленочной оболочкой, разрешены с 6-летнего возраста и форма суспензии для пациентов с 2-месячного возраста. Данная лекарственная форма является комплексной, так как в ее составе кроме нифуроксазида (5 мл = 220 мг) содержится симетикон. Симетикон — это поверхностно-активное пеногасящее средство, уменьшающее газообразование в кишечнике. Содержание симетикона в суспензии Стопдиара особенно актуально для детей раннего возраста, которые страдают от повышенного газообразования на фоне инфекционных диарей.
Таким образом, рост и изменение лекарственной чувствительности штаммов возбудителей инвазивных диарей требует строгих подходов к назначению антимикробных препаратов при ОКИ у детей, целесообразно использовать режим ступенчатой терапии, что определяется высокой клинической эффективностью и уменьшением психотравмирующего влияния на маленького пациента. Учитывая широкий спектр антибактериального действия, практически полное отсутствие влияния на нормальную микрофлору, высокий профиль безопасности и наличие суспензионной лекарственной формы, кишечный антисептик нифуроксазид можно считать стартовым препаратом при лечении инфекционных диарей у детей.
Литература
ФГБУ НИИДИ ФМБА России, Санкт-Петербург