Диэтиленгликоль что это такое применение
Диэтиленгликоль
| Диэтиленгликоль | |
|---|---|
 | |
| Систематическое наименование | 2-[2-гидроксиэтокси]этанол |
| Сокращения | ДЭГ |
| Традиционные названия | дигликоль |
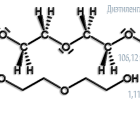
| Хим. формула | C4H10O3 |
| Молярная масса | 106,12 г/моль |
| Плотность | 1,118 г/см³ |
| Т. плав. | -7.8 °C |
| Т. кип. | 244-245 °C |
| Т. разл. | 343 °C |
| Т. всп. | 124 °C |
| Энтальпия образования | -626.8 кДж/моль |
| ГОСТ | ГОСТ 10136-77 |
| Рег. номер CAS | 111-46-6 |
| PubChem | 8117 |
| Рег. номер EINECS | 203-872-2 |
| SMILES | |
| ChEBI | 46807 |
| ChemSpider | 13835180 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диэтиленгликоль, двуэтиленовый спирт (дигликоль) — химическое соединение, представитель двухатомных спиртов.
Содержание
Физические свойства
Диэтиленгликоль является прозрачной вязкой жидкостью. Гигроскопичен, обладает сладковатым вкусом. Растворим в воде, низших спиртах, ацетоне, анилине, феноле и хлороформе. Ограниченно растворим в бензоле, диэтиловом эфире и четырёххлористом углероде. Плохо растворим в минеральных и растительных маслах.
Химические свойства
Наличие в молекуле диэтиленгликоля двух спиртовых групп приводит к образованию внутри- и межмолекулярных водородных связей — с другими веществами, содержащими электроотрицательный атом (вода, амины).
Может быть использован в качестве топлива для портативных горелок. Горит пламенем, практически не имеющим цвета, при этом выделяется большое количество теплоты:
Диэтиленгликоль склонен к автоокислению. Автоокисление значительно ускоряется при наличии примесей пероксидных соединений (пероксиды, гидропероксиды) и замедляется при добавлении ингибиторов (хиноны, гидрохиноны). Окисляясь, диэтиленгликоль приобретает желтоватую окраску.
Диэтиленгликоль проявляет свойства как гликолей, так и сложных эфиров. С карбоновыми кислотами, их ангидридами и хлорангидридами образует сложные моно- и диэфиры, с альдегидами и кетонами в присутствии катализатора — фосфорной кислоты — соответствующие циклические ацетали.
Дегидрирование диэтиленгликоля на катализаторе (медь, цинк-медь-хром) приводит к 1,4-диоксан-2-ону. Дегидрирование на щелочных катализаторах даёт 1,4-диоксан. При оксиэтилировании при 150‒200 о С в присутствии щелочных катализаторов образуется полиэтиленгликоль.
Реагирует с фосгеном, образующиеся продукты являются очень реакционноспособными. Для бис-хлоруглекислого эфира дигликоля возможна реакция с аллиловым спиртом в присутствии щелочи.
Получение
Промышленный синтез диэтиленгликоля заключается в следующих процессах:
Применение
Диэтиленгликоль является сырьём в промышленном получении сложных эфиров, полиуретанов, олигоэфиракрилатов. Он служит пластификатором, эффективным экстрагентом ароматических веществ в процессах риформинга. Диэтиленгликоль используется как осушитель газов, в качестве основного компонента антифризов, гидравлических и гидротормозных жидкостей, как растворитель нитратов целлюлозы и полиэфирных смол.
Все, что нужно знать, о диэтиленгликоле и триэтиленгликоле
Диэтиленгликоль и триэтиленгликоль, основные сопродукты производства моноэтиленгликоля, за последние десятилетия нашли на рынке собственные узкие ниши, где их использование экономически выгодно, а ограниченные объемы производства – достаточны. Они используются как сырье и растворители в нефтехимической отрасли, а триэтиленгликоль даже можно добавлять в косметику и пищу.
Невольные попутчики
При выпуске моноэтиленгликоля методом гидратации окиси этилена формируется два сопродукта со схожими свойствами – диэтиленгликоль (ДЭГ) и триэтиленгликоль (ТЭГ). Они – прозрачная, бесцветная и вязкая жидкость без запаха со сладковатым привкусом, менее летучи и обладают более высокой температурой кипения.

ДЭГ менее токсичен, чем моноэтиленгликоль и относится к третьему классу опасности. ТЭГ еще более безопасен, но, несмотря на это, оба вещества остаются ядовитыми для человека, вызывая тяжелое отправление в случае проглатывания. Пары не токсичны и не представляют опасности даже при долговременном вдыхании.
Есть два наиболее распространенных варианта производства диэтиленгликоля:
На данный момент в России всего два крупных производителя ди- и триэтиленгликоля – «СИБУР-Нефтехим» и входящий в ТАИФ «Нижнекамскнефтехим». До 2011 года оба продукта также выпускал другой актив ТАИФа – «Казаньоргсинтез», но затем компания отказалась от производства триэтиленгликоля.
Внутренние объемы производства не покрывают растущий спрос, так что сопродукты, в основном – ТЭГ, российским потребителям приходится закупать в Европе. Основной импортер – немецкая корпорация BASF.
Достойная замена
Гликоли стали активно использоваться в промышленности только в начале 20 века, хотя впервые моноэтиленгликоль французский химик Шарль Адольф Вюрц синтезировал в 1859 году, а во время Первой мировой войны он использовался для производства взрывчатых веществ.
Сопродукты моноэтиленгликоля получили широкое распространение еще позже, чем исходный компонент. Гликоли заменили глицерин сначала в области производства динамита, а затем – как компонент охлаждающих жидкостей, так как были эффективней технически и экономически.
После 1936 года они выиграли конкуренцию у глицерина как абсорбент для осушки углеводородных газов.
Несмотря на свое более позднее распространение, ТЭГ имеет преимущества перед ДЭГ в нефтегазовой сфере за счет более низкого давления над раствором и более высокой температуры разложения.

Каждому – свое место
Отличия диэтиленгликоля и триэтиленгликоля от МЭГ определило специфику их использования. За счет более низкой летучести и более высокой температуры кипения и вязкости в некоторых сферах предпочтение производителей отдается именно диэтиленгликолю.
Он используется как:
Еще одной крупной сферой применения ДЭГ с его высокой гигроскопичностью является газовая отрасль. Там он выполняет роль осушителя газов и используется в трубопроводах для удаления конденсата и влажных паров, предотвращая образование ледяных пробок. Также он помогает убирать углекислый газ и сероводород.
Способность поглощать влагу делает его полезным для поддержания необходимой влажности табачных изделий и бумаги.
Диэтиленгликоль применяется при производстве целлофана, клеев, пленок. Также за счет высокой теплоемкости он может использоваться в качестве топлива для переносных горелок.
В то же время как компонент антифриза диэтиленгликоль хоть и применяется, но намного реже, чем моноэтиленгликоль. Но это никак не связано с конкретными свойствами веществ, так как параметры замерзания водных растворов МЭГ и ДЭГ серьезно не отличаются.

Просто объемы производства моноэтиленгликоля существенно выше, а сам компонент – более привычен в качестве сырья для нефтехимии. При этом в некоторых случаях использование в производстве охлаждающих жидкостей обоих веществ позволяет добиться их более высоких эксплуатационных показателей.
Ближе к людям
Сферы применения триэтиленгликоля во многом определяет его сниженная летучесть и относительная безопасность по сравнению с МЭГ и ДЭГ. Вещество используется в тех продуктах, с которыми потребитель контактирует напрямую или в течение долгого времени.
Например, триэтиленгликоль выступает растворителем и пластификатором для лаков и лакокрасочных материалов. Он также используется в качестве дезинфицирующего средства. Ограниченно применяется в фармацевтике и на предприятиях пищевой промышленности. Так, за счет более низкой токсичности, ТЭГ в некоторых странах разрешен к применению в малых дозах в косметических и лекарственных препаратах.
Относительная безопасность сопродуктов моноэтиленгликоля стала причиной «антифризного» скандала в сфере виноделия в Австрии. В 1985 году в ходе стандартной проверки винной продукции немецкая лаборатория обнаружила в некоторых видах австрийской продукции повышенное содержание диэтиленгликоля.
Выяснилось, что отдельные производители в Австрии добавляли ДЭГ, который маскирует в вине дополнительные объемы сахара, который виноделам приходилось добавлять в неудачные годы, когда виноград не успевал вызреть и набрать нужное количество природного сахара.
Помимо этого, диэтиленгликоль делал напитки более сладкими, а букет – более полным. После выявления ДЭГ в составе продажи австрийских вин рухнули во всем мире и еще более 15 лет не могли вернуться на прежние уровни, даже несмотря на то, что из-за их потребления не было жертв. По расчетам экспертов, отравиться насмерть можно было только аяв течение двух недель по 28 бутылок вина с ДЭГ ежедневно.
В целом, как отмечает глава Центра отраслевых исследований Андрей Костин, диэтиленгликоль и триэтиленгликоль со временем нашли свои определенные ниши потребления, хоть и не очень крупные. По его словам, это напрямую связано с небольшими объемами производства сопродуктов. Но, говорит эксперт, наращивать объемы этих продуктов отдельно – невозможно экономически оправданным способом, это реально только вместе с увеличением производства основного продукта – МЭГ.
Диэтиленгликоль — востребованный промышленностью гликоль
Диэтиленгликоль — органическое соединение, 
Свойства
Дигликоль представляет собой густую прозрачную жидкость без запаха и цвета (допускается желтоватый оттенок), со слегка сладковатым вкусом. Впитывает влагу из окружающего воздуха, водорастворим в любых соотношениях. Водные растворы отличаются низкой температурой замерзания. Реактив смешивается с низшими спиртами, гликолями, целлозольвом, ацетоном, фенолом, хлороформом и некоторыми другими орг. веществами. Слабо растворяется в бензоле, стироле, толуоле, диэтиловом эфире, дибутилфталате, тетрахлорметане. Почти не растворяется в маслах.
Малолетуч, что выгодно отличает его от этиленгликоля. Токсичен. Горюч.
 |  |
| Этиленгликоль в/с техн | Полиэтиленгликоль 8000 |
ДЭГ — химически активное вещество, проявляет все свойства гликолей и простых эфиров. Реагирует с:
• водой и кислородом;
• карбоновыми кислотами, их ангидридами и хлорангидридами;
• альдегидами, кетонами, фосгеном, аминами.
В реакциях синтеза может отщеплять атомы водорода (реакция дегидрирования) и молекулы воды (дегидратация). В результате оксиэтилирования (воздействия оксида этилена) превращается в полиэтиленгликоль. Хорошо растворяет щелочи.
Меры предосторожности
Дигликоль считается менее токсичным, чем этиленгликоль; относится к 3-му классу опасности. Тем не менее, для человека он ядовит. Раздражает кожу, при проглатывании вызывает тяжелое отравление, негативно влияет на функционирование почек, печени и центральной нервной системы. Пожароопасен, может самовоспламеняться уже при нагревании до +132 °С. При горении не выделяет опасных соединений. Тушат горящий реактив водой, пенными или углекислотными огнетушителями.
В помещениях, в которых работают с диэтиленгликолем, следует применять строгие меры противопожарной безопасности. Оно должно быть вентилируемым; снабжено автоматической системой пожаротушения и ручными средствами для тушения локального очага возгорания. Работникам следует использовать средства защиты: спецодежду, перчатки, защитные очки или лицевые маски.
Хранят вещество на крытых неотапливаемых складах, в таре из нержавеющей стали, алюминия или алюминированной стали. Для герметичности емкости снабжаются химически стойкими прокладками.
Утилизацию реактива проводят с помощью ионно-обменных смол или сжиганием.
Применение
• В химпроме — сырье для синтеза сложных эфиров, полиуретанов, некоторых других сложных органических соединений; вспомогательных веществ для текстильпрома (набивочных, уплотняющих материалов).
• В качестве очень эффективного высокоизбирательного экстрагента для извлечения ароматических углеводородов в процессах каталитического риформинга, например бензола, ксилола, толуола.
• Пластификатор, стабилизатор, активатор синтеза полимеров; увлажнитель табака, бумаги и химических волокон.
• Осушитель газов; используется для удаления конденсата и влажных паров из трубопроводов для предотвращения образования ледяных пробок. Для очистки технических газов от разных примесей, например, от двуокиси углерода, сероводорода.
• Применяется при производстве целлофана, клеев, пленок.
• Входит в состав антифризов, тормозных и гидравлических жидкостей, смазок, взрывчатых веществ.
• Как растворитель полиэфирных и эпоксидных смол, нитратов целлюлозы.
• В качестве топлива для компактных переносных горелок (обладает высокой теплоемкостью).
Диэтиленгликоль
ДИЭТИЛЕНГЛИКOЛЬ (2,2′-дигидроксидиэтиловый эфир, дигликоль)
молярная масса 106,12
бесцветная, вязкая гигроскопичная жидкость, без запаха, со сладковатым вкусаом;
Смешивается с водой, низшими спиртами, карбитолами, гликолями, целлозольвами, ацетоном, анилином, фенолом, хлороформом.
Ограниченно — с бензолом, дибутилфталатом, толуолом, стиролом, диэтиловым эфиром, ССl4.
В диэтиленгликоле плохо растворяются минеральные и растительные масла. Диэтиленгликоль обладает химическими свойствами, характерными для гликолей и простых эфиров. При взаимодействии с карбоновыми компонентами и их ангидридами образует сложные моно- и диэфиры, с альдегидами и кетонами.
Диэтиленгликоль образует водородные связи также с водой, аминами. Диэтиленгликоль способен к автоокислению. Процесс автоокисления резко ускоряется при наличии в диэтиленгликоле, пероксидов, гидропероксидов. Антиокислители (гидрохинон или др.) сильно увеличивают стабильность диэтиленгликоля.
Получение диэтиленгликоля.
В промышленности диэтиленгликоль получают двумя способами:
1) оксиэтилированием этиленгликоля в присутсвии щелочи при 160-180°С, давлении 1,1-2,0 МПа и мольном соотношении этиленоксид : этиленгликоль = 1:2 (выход диэтиленгликоля 60%):
2) как побочный продукт в производств этиленгликоля, путем гидратации этиленоксида в присутсвии щелочи или кислето при температуре 160-200 °С, 1-2 МПа и мольном соотношении этиленоксид: вода = 1:10. При этом около 15% этиленоксида превращается в диэтиленгликоль. На производство 1 т диэтиленгликоля расходуется 1,0-1,1 т этиленоксида.
Применение диэтиленгликоля.
Диэтиленгликоль — применяется как сырье в производств сложных эфиров, полиуретанов, олигоэфиракрилатов, полиалкиленгликольмалеинатов. Используется как пластификатор, высокоселективный экстрагент ароматических углеводородов из катализатов риформинга, а также увлажнитель табака, осушитель газов, компонент антифризов, гидротормозных и гидравлических жидкостей. Является Растворитель нитратов целлюлозы и полиэфирных смол.
Мировое производство на 1975г. диэтиленгликоля около 400 тыс. т/год.
Диэтиленгликоль
| Диэтиленгликоль | |
 | |
| Общие | |
|---|---|
| Химическая формула | C4H10O3 |
| Физические свойства | |
| Молярная масса | 106,12 г/моль |
| Плотность | 1,118 г/см³ |
| Термические свойства | |
| Температура плавления | -7.8 °C |
| Температура кипения | 244-245 °C |
| Энтальпия образования (ст. усл.) | -626.8 кДж/моль |
| Классификация | |
| Рег. номер CAS | 111-46-6 |
| SMILES | OCCOCCO |
Диэтиленгликоль, двуэтиленовый спирт — химическое соединение, представитель двухатомных спиртов.
Содержание
Физические свойства
Диэтиленгликоль является прозрачной белой вязкой жидкостью. Гигроскопичен, обладает сладковатым вкусом. Растворим в воде, низших спиртах, ацетоне, анилине, феноле и хлороформе. Ограниченно растворим в бензоле, диэтиловом эфире и четырёххлористом углероде. Плохо растворим в минеральных и растительных маслах.
Химические свойства
Наличие в молекуле диэтиленгликоля двух спиртовых групп приводит к образованию внутри- и межмолекулярных связей — с другими веществами, содержащими электроотрицательный атом (вода, амины).
Диэтиленгликоль склонен к автоокислению. Автоокисление значительно ускоряется при наличии примесей пероксидных соединений (пероксиды, гидропероксиды) и замедляется при добавлении ингибиторов (хиноны, гидрохиноны).
Диэтиленгликоль проявляет свойства как гликолей, так и сложных эфиров. С карбоновыми кислотами, их ангидридами и хлорангидридами образует сложные моно- и диэфиры, с альдегидами и кетонами в присутствии катализатора — фосфорной кислоты — соответствующие циклические ацетали.
Дегидрирование диэтиленгликоля на катализаторе (медь, цинк-медь-хром) приводит к 1,4-диоксан-2-ону. Дегидрирование на щелочных катализаторах даёт 1,4-диоксан. При оксиэтилировании при 150—200 о С в присутствии щелочных катализаторах образуется полиэтиленгликоль.
Получение
Промышленный синтез диэтиленгликоля заключается в следующих процессах:
Применение
Диэтиленгликоль является сырьём в промышленном получении сложных эфиров, полиуретанов, олигоэфиракрилатов. Он служит пластификатором, эффективным экстрагентом ароматических веществ в процессах риформинга. Диэтиленгликоль используется как осушитель газов, в качестве основного компонента антифризов, гидравлических и гидротормозных жидкостей, как растворитель нитратов целлюлозы и полиэфирных смол.
Ссылки
Литература
Полезное
Смотреть что такое «Диэтиленгликоль» в других словарях:
диэтиленгликоль — диэтиленгликоль … Орфографический словарь-справочник
Диэтиленгликоль — (a. diethylenglycole; н. Diathylenglykol; ф. diethyleneglycol; и. dietilenglicol) густая бесцветная жидкость, β, β1 диоксидиэтиловый эфир (НОСH2СH2)2О. Темп ра плавления Д. 8° С, темп pa кипения 245° С, относит. плотность d41 … Геологическая энциклопедия
диэтиленгликоль — сущ., кол во синонимов: 2 • пластификатор (11) • растворитель (67) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
диэтиленгликоль — — [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность EN diethylene glycol … Справочник технического переводчика
диэтиленгликоль — (HOCH2CH2)2O, густая бесцветная жидкость, tкип 245,8°C. Растворитель масел, нитроцеллюлозы, фенольных смол; пластификатор, компонент антифризов и др. * * * ДИЭТИЛЕНГЛИКОЛЬ ДИЭТИЛЕНГЛИКОЛЬ, (НОСН2СН2)2O, густая бесцветная жидкость, tкип 245,8 °С.… … Энциклопедический словарь
диэтиленгликоль — 2,2ˊ oksidietanolis statusas T sritis chemija formulė O(CH₂CH₂OH)₂ atitikmenys: angl. diethylene glycol; 2,2ˊ oxydiethanol rus. диэтиленгликоль; 2,2ˊ оксидиэтанол ryšiai: sinonimas – dietilenglikolis … Chemijos terminų aiškinamasis žodynas
Диэтиленгликоль — β,β диоксидиэтиловый эфир, HOCH2CH2OCH2CH2OH, густая бесцветная жидкость; tпл 8°С, tkип 245°С, плотность 1,1197 г/см3(15°С), показатель преломления n20D 1,4472. Д. смешивается с водой, спиртом, ацетоном, плохо растворим в эфире, бензоле;… … Большая советская энциклопедия
диэтиленгликоль — диэтиленглик оль, я … Русский орфографический словарь
ДЭГ — диэтиленгликоль … Словарь сокращений русского языка