Диффузная лимфоплазмоцитарная инфильтрация желудка что это
Особенности эндоскопической семиотики и антихеликобактерная терапия MALT-лимфом желудка
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%
Лимфомы гастроинтестинального тракта охватывают от 14% до 27% всех экстранодальных поражений и составляют от 1% до 15% всех злокачественных опухолей желудочно-кишечного тракта. Чаще всего поражается желудок (50–75%), сравнительно реже тонкая кишка (20–35%). Лимфомы толстой кишки наблюдаются в 5–10% случаев. Самыми редкими признаны первичные неходжкинские лимфомы пищевода [1].
В 1983 году Brooks и Enterline [2] провели клинико-морфологическое исследование, где показали, что нодальные и экстранодальные лимфомы отличаются по биологическим свойствам и что экстранодальные варианты лимфомы имеют более благоприятный прогноз.
Brooks и Enterline впервые отметили патогенетическую связь между хроническим воспалением слизистой оболочки желудка и развитием лимфомы. Было высказано предположение, что многие типы лимфом желудка представляют собой злокачественную трансформацию доброкачественных и длительно текущих лимфоцитарных поражений желудка. Авторы пришли к тому заключению, что длительная антигенная стимуляция вместе с аутоиммунным феноменом в клетках слизистой оболочки желудка в целом приводят к появлению злокачественного клона. Эта гипотеза была подтверждена результатами клинико-морфологических исследований, проведенных при лимфомах слюнной и щитовидной желез. Было показано, что лимфомы этих желез могут возникнуть на фоне хронического тиреоидита и сиалоаденита с синдромом Шегрена или без него.
P. Isaacson и D. H. Wright [3] обратили внимание на то, что большая часть первичных лимфом желудка развивается на фоне хронических гастритов. Более того, было показано, что другие варианты экстранодальных лимфом также связаны с хроническими воспалительными процессами. Доказано, что Нelicobacter pylori — грамотрицательная спиралевидная бактерия, впервые выделенная из гастробиоптата австралийскими исследователями Warren и Marschall в 1983 году, является причиной подавляющего большинства случаев хронических гастритов. Она приводит к возникновению язвенной болезни желудка, 12-перстной кишки, является одним из факторов риска аденокарциномы желудка.
Показано, что при эрадикации этого микроорганизма симптомы хронического воспаления становятся менее интенсивными и снижается степень лимфоцитарной инфильтрации. В 1993 году были представлены доказательства, что Н. pylori играет важную роль в возникновении подгруппы лимфом желудка MALT-типа [4]. Рядом авторов [5] было высказано мнение, что Н. pylori вызывает нарушение физиологических и иммунологических процессов, окислительное повреждение ДНК и пролиферацию как гемапоэтических, так и клеток слизистой оболочки желудка. В дальнейшем было установлено, что 90% больных MALT-лимфомой инфицированы Н. pylori [6, 7, 8]. Было показано также, что Н. pylori непосредственно и посредством цитотокина вызывает пролиферацию Т-клеток и макрофагов, что сопряжено с высвобождением цитокинов (интерлейкина-2 и интерлейкина-6). Последние, в свою очередь, вызывают пролиферацию В-клеток, способствуют развитию лимфоидных фолликулов и агрегатов лимфоцитов в толще слизистой оболочки желудка [9].
Материалы и методы исследования
Эндоскопическая картина лимфом желудка изучена нами у 250 пациентов, при этом поражение у 160 (64%) больных расценено как первичное, а у 90 (36%) — как вторичное, наблюдаемых в РОНЦ с 1995 года, из которых было 99 пациентов с MALT-лимфомой желудка. Разработаны эндоскопические и эндосонографические критерии диагноза MALT-лимфомы, ее дифференциально-диагностические признаки, проведена оценка лекарственной терапии.
Результаты и их обсуждение
При тщательном анализе развития болезни нами установлено, что в группе с первичными лимфомами желудка практически одна треть (32%) пациентов имели гастроэнтерологический анамнез: язвенную болезнь желудка, хронический атрофический, гипертрофический или смешанные гастриты, зачастую ассоциированные с инфекцией H. pylori.
Согласно нашим наблюдениям длительность существования гастроэнтерологической патологии до установления наличия опухоли в группе с первичной лимфомой желудка весьма вариабельна: в течение первых трех месяцев диагноз установлен у 30,6% (49 больных), в течение 6 месяцев у 18,1% (29 больных), в срок от 6 до 12 месяцев у 15,6% (25 больных). Отдельно следует отметить, что практически у трети пациентов (27,5% — 44 пациента) диагноз первичной лимфомы желудка был установлен спустя год (табл. 1).
Также отдельно необходимо отметить, что диагноз первичной лимфомы желудка у 8% пациентов выявлен при плановом обследовании по поводу сопутствующей патологии и оказался диагностической находкой, так как заболевание у части больных протекало бессимптомно.
В группе пациентов со вторичным поражением желудка от момента установления диагноза первичной локализации процесса до времени выявления поражения желудка сроки были различны и представлены в табл. 2.
Как видно из представленных в таблице данных, поражение желудка в большинстве случаев развилось в первые два года от начала заболевания, что диктует нам необходимость обязательных периодических эндоскопических исследований желудка с целью своевременного выявления метастатического поражения его при лимфомах.
В нашей работе чаще всего при лимфомах желудка имело место инфильтративно-язвенное и инфильтративное его поражение — 28,4% и 21,6% соответственно, затем в 14,8% встречается язвенная форма роста опухоли. Гастритоподобный вариант опухоли отмечен в 14,4%. Реже встречались смешанная и экзофитная формы роста опухоли — 12,0% и 8,8% соответственно.
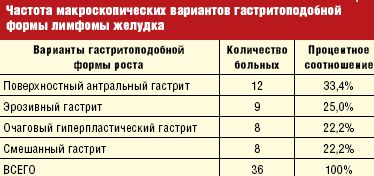
Причем, как показывает анализ наших данных, при MALT-лимфоме преобладала гастритоподобная форма роста, которая составила 34,3%.
Эндоскопическая картина гастритоподобной формы лимфомы желудка является наиболее вариабельной и по преобладанию макроскопических признаков может проявляться в виде:
Естественно, такое деление является относительно условным, и эти формы выделяются нами по преобладанию наиболее выраженных указанных признаков, симулирующих ту или иную форму гастрита (табл. 3).
Анализируя полученные данные, чаще всего, в 33,4%, отмечался поверхностный антральный гастрит, вторым по частоте стал эрозивный гастрит — 25,0%, с одинаковой частотой в 22,2% встречается очаговый гиперпластический гастрит и смешанный гастрит.
При гастритоподобной форме лимфомы желудка в виде антрального гастрита, как следует из самого определения, визуальные проявления опухоли симулируют воспалительные изменения в антральном отделе желудка, которые отмечены нами в 33,4%. При сохраненной эластичности стенок желудка отмечается пастозность, разрыхленность и очаговая гиперемия слизистой антрального отдела желудка, чередующаяся с участками белесоватого цвета, ее повышенная контактная кровоточивость. Как и при других вариантах, характерным является появление стекловидного блеска. При проведении биопсии подвижность и эластичность слизистой оболочки снижена, отмечается ее фрагментация.
Изменения при лимфоме желудка в виде эрозивного гастрита отмечаются в 25,0% случаев и характеризуются наличием множественных поверхностный острых эрозий неправильной или щелевидной формы на фоне пастозной, неравномерно гиперемированной слизистой с усиленным сосудистым рисунком. Участки эрозий могут локализоваться в различных отделах желудка, чередуясь с неизмененной слизистой, либо занимать изолированную, ограниченную зону. Эластичность стенок остается, как правило, сохраненной или снижена незначительно.
Лимфома желудка в виде локального гиперпластического гастрита. Этот тип лимфомы отмечается в 22,2% случаев и характеризуется умеренным неравномерным утолщением складок на ограниченном участке чаще по большой кривизне и в проксимальном отделе желудка иногда с переходом на переднюю или заднюю стенки. Эластичность стенки сохранена, подвижность складок может быть сохраненной или сниженной. Поверхность складок покрыта вязкой стекловидной слизью, разрыхлена. При инсуффляции складки слизистой пораженного участка, как правило, не расправляются полностью.
В нашем исследовании инфицирование H. pylori было выявлено практически у всех больных при мелкоклеточном варианте и составило 96,7%, при промежуточном варианте MALT-лимфомы желудка — 90%, в отличие от смешанно-клеточных MALT-лимфом, при которых частота инфицирования составила только 53,8%.
При выявлении инфицирования H. pylori мы также определяли степень обсемененности. Оказалось, что при мелкоклеточных MALT-лимфомах высокая частота инфицирования сочетается с выраженной степенью обсемененности чаще (75,9%), чем при других подвариантах. Так, у больных с промежуточным вариантом наличие H. pylori-инфекции сопровождается выраженной степенью обсемененности достоверно реже и выявлено в 38,9%, при смешанных MALT-лифмомах выраженная степень обсемененности установлена у 57,1% пациентов.
Умеренная степень обсемененности при мелкоклеточных опухолях выявлена у 20,7%, при промежуточном варианте чаще — у 61,1%, а при смешанной MALT-лимфоме — у 14,3%.
Слабая степень обсемененности H. pylori встречается у больных MALT-лимфомой желудка крайне редко, она была определена лишь у трех пациентов.
Терапия больных первичной MALT-лимфомой представляет ряд особенностей. Это обусловлено тем, что в мировой практике накоплен относительно небольшой опыт использования всех видов лечебного воздействия — антихеликобактерной терапии, химиотерапии, лучевой терапии, хирургического лечения и их сочетаний.
Антихеликобактерная терапия использовалась нами только при I стадии (классификация Lugano, 1993) MALT-лимфомы желудка мелкоклеточного строения. Лечение проводилось в соответствии с рекомендациями Международного протокола LY03 по изучению MALT-лимфом желудка низкой степени злокачественности [10]. Нами применялась трехкомпонентная схема первой линии эрадикационной терапии, включающая одновременное применение в течение 10–14 дней следующих препаратов:
В результате проведенного лечения у 14 пациентов (87,5%) из 16 больных была достигнута полная ремиссия, у 2 больных (12,5%) констатирована стабилизация заболевания.
Терапевтический эффект антибиотикотерапии реализовался постепенно. Нами установлена последовательность исчезновения проявлений болезни. Первыми ликвидировались клинические симптомы: боль, изжога, тошнота, желудочный дискомфорт.
Вслед за эрадикацией H. pylori постепенно уменьшались визуальные эндоскопические проявления опухолевого поражения: сокращались размеры опухолевого поражения, подслизистой инфильтрации, уменьшался калибр складок слизистой, происходило рубцевание специфических язвенных дефектов, затем восстанавливалась нормальная архитектоника слизистой, исчезала деформация стенок желудка.
Необходимо акцентировать внимание на том, что сроки наступления полного терапевтического эффекта весьма вариабельны. Полная ремиссия, подтвержденная гистологическим и иммунологическим исследованием гастробиоптатов, была диагностирована у больных, получавших антихеликобактерное лечение, в сроки от 2 до 10 месяцев (медиана 5,5 месяцев).
Это означает, что лечение мелкоклеточных MALT-лимфом с применением антихеликобактерных препаратов — это терапия, осуществленная всего за 10–14 дней, но требующая в последующем взвешенного динамического наблюдения и корректной оценки происходящих изменений. Темп наступления полного клинического благополучия является косвенным признаком прогнозирования терапевтического эффекта.
Из 14 больных с подтвержденной полной ремиссией вследствие антихеликобактерной терапии только у одной больной в возрасте 51 год был констатирован рецидив заболевания при контрольном обследовании через 7 месяцев после окончания лечения без каких-либо клинических проявлений. Трактовка эндоскопической картины была сложной: осуществлялась дифференциальная диагностика между эрозивным гастритом и минимальными проявлениями лимфомы. Рецидив был подтвержден иммуноморфологическими исследованиями. В последующем больная получала последовательное лечение Лейкераном (хлорамбуцил), COP с эффектом, который расценен нами как стабилизация заболевания. Учитывая клиническое благополучие, а также наличие тяжелой сопутствующей патологии, было решено хирургическое лечение не применять, а больную оставить под динамическим наблюдением. В течение последующих 36 месяцев больной проводится регулярное обследование (каждые 4–5 месяцев). За этот период наблюдения прогрессирования заболевания не наступило по настоящее время.
Это наблюдение демонстрирует особое свойство мелкоклеточной MALT-лимфомы. Сочетание клинического благополучия с объективными данными стабилизации позволяет длительно наблюдать за больными на фоне проведения регулярного полноценного обследования.
Таким образом, антихеликобактерная терапия правомочна и эффективна при первичных MALT-лимфомах желудка, но при обязательном строгом соблюдении показаний к ее использованию — I стадия процесса с небольшим локализованным поражением слизистого и подслизистого слоев при H. pylori-позитивных опухолях. Обязательным является динамическое исследование опухолевого субстрата на наличие H. pylori, эрадикация которого необходима для реализации противоопухолевого эффекта. Отсутствие эрадикации H. pylori требует использования химиотерапии с повторными курсами антибиотикотерапии.
Диффузная лимфоплазмоцитарная инфильтрация желудка что это
ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, Оренбург
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия
Особенности В-лимфоцитарной инфильтрации прилежащей к опухоли слизистой оболочки желудка при раке. Клинико-морфологические аспекты
Журнал: Онкология. Журнал им. П.А. Герцена. 2015;4(5): 8-11
Сеньчукова М. А., Рябов А. Б. Особенности В-лимфоцитарной инфильтрации прилежащей к опухоли слизистой оболочки желудка при раке. Клинико-морфологические аспекты. Онкология. Журнал им. П.А. Герцена. 2015;4(5):8-11.
Senchukova M A, Ryabov A B. Characteristics of B-lymphocytic infiltration in the peritumoral mucosa of the stomach in its cancer: Clinical and morphological aspects. P.A. Herzen Journal of Oncology. 2015;4(5):8-11.
https://doi.org/10.17116/onkolog2015458-11
ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, Оренбург
Цель исследования — изучение особенностей перитуморальной инфильтрации слизистой оболочки желудка (СОЖ) В-лимфоцитами и их связь с клиническими характеристиками рака желудка (РЖ). Материал и методы. Исследованы образцы ткани опухоли и прилежащей СОЖ у 73 радикально оперированных пациентов РЖ. Гистопрепараты окрашивали гематоксилином и эозином и иммуногистохимически, с использованием антител к CD20. Результаты. В перитуморальной области отмечено три вида структур с экспрессией CD20: В-лимфоциты, расположенные диффузно, лимфоидные фолликулы (ЛФ) и очаговые лимфоидные инфильтраты (ЛИ). Установлены отрицательные корреляции плотности СD20 В-лимфоцитов с распространенностью РЖ. Наиболее низкие значения плотности СD20 В-лимфоцитов наблюдались при низкодифференцированной аденокарциноме и недифференцированном РЖ (р=0,051), при глубине инвазии опухоли Т1—2 (р=0,06) и наличии метастазов в регионарных лимфатических узлах (р=0,02). Наличие ЛИ и ЛФ было связано только с гистологическим типом РЖ. При диффузном и кишечном типах РЖ очаговые ЛИ наблюдались в 46,7 и 21,4% случаев (р=0,15) и множественные ЛФ — в 72,7 и 38,9% случаев (р=0,07) соответственно. Наличие очаговых ЛИ было связано со статистически недостоверным снижением 3-летней общей выживаемости с 94,7 до 70,0% (р=0,07), а наличие множественных ЛФ — со снижением 3-летней безрецидивной выживаемости с 75 до 40% (р=0,08). Заключение. Полученные данные свидетельствуют о связи В-лимфоцитов с клиническими характеристиками и отдаленными результатами лечения РЖ. Полагаем, что необходимы дальнейшие исследования роли В-лимфоцитов в прогрессии РЖ.
ГБОУ ВПО «Оренбургский государственный медицинский университет» Минздрава России, Оренбург
Московский научно-исследовательский онкологический институт им. П.А. Герцена, филиал ФГБУ НМИЦ радиологии Минздрава России, Москва, Россия
Рак желудка (РЖ) остается одной из наиболее частых причин смерти от злокачественных опухолей во всем мире [1, 2]. Определение факторов, влияющих на прогноз РЖ, важно как для диагностики, так и для поиска новых схем лечения этого заболевания. Одним из таких факторов является выраженность воспалительных изменений в опухоли и прилежащих тканях. Однако оценка его роли в опухолевой прогрессии неоднозначна. Одни авторы считают, что высокая инфильтрация опухоли и прилежащих тканей иммунными клетками может быть связана с противоопухолевой активностью и с лучшей выживаемостью онкологических больных [3, 4]. Другие предполагают, что опухолеассоциированные лимфоциты и макрофаги могут быть связаны с опухолевой прогрессией [5—8]. При этом следует отметить, что большинство исследований связано с изучением роли Т-лимфоцитов и макрофагов в опухолевой прогрессии [3, 8, 9], тогда как роль В-лимфоцитов остается практически неизученной. В связи с этим целью настоящего исследования явилось изучение особенностей перитуморальной инфильтрации слизистой оболочки желудка (СОЖ) В-лимфоцитами и их связь с клиническими характеристиками РЖ.
Материал и методы
В проспективное исследование включены 73 пациента с РЖ, радикально оперированных (R0) в Оренбургском областном клиническом диспансере с января 2009 г. по июль 2010 г. Средний возраст пациентов составил 61,2±9,3 года (от 34 до 78 лет, медиана — 61 год). Мужчин было 43 (58,9%), женщин — 30 (41,1%). Опухоль локализовалась в верхней трети у 14 (19,2%) пациентов, в средней трети — у 18 (24,7%) и нижней трети — у 41 (56,1%). Кишечный тип рака желудка был отмечен у 41 (56,2%) больного и диффузный — у 32 (43,8%). Высокодифференцированная аденокарцинома (G1) наблюдалась у 27 (36,9%) пациентов, умереннодифференцированная (G2) — у 14 (19,3%), низкодифференцированная аденокарцинома и недифференцированный РЖ — у 9 (12,3%) и перстневидно-клеточный рак (ПКР) — у 23 (31,5%). Распределение больных по стадии заболевания было следующим: T1—2N0M0 — у 34 (46,6%), T3N0M0 — у 9 (12,3%), T3—4N1M0 — у 9 (12,3%) и T3—4N2M0 — у 21 (28,6%) больного.
Субтотальная проксимальная резекция была выполнена 10 (13,7%) пациентам, субтотальная дистальная резекция — 56 (76,7%) и гастрэктомия — 7 (9,5%). Лимфаденэктомия в объеме D2 была выполнена всем пациентам, с элементами D3 — 38 (52,0%). У 7 (12,3%) больных произведены комбинированные операции: в 3 наблюдениях была выполнена спленэктомия, в 2 — резекция поперечной ободочной кишки, в одном — холецистэктомия. В исследование не включали больных с декомпенсацией хронических заболеваний, острой инфекционной патологией, выраженными аллергическими процессами, а также получавшие кортикостероиды, антигистаминные, нестероидные противовоспалительные препараты, неоадъювантную химиотерапию.
После удаления препарата желудок вскрывали по большой кривизне. Выполняли биопсию опухоли и макроскопически неизмененной СОЖ, отступя 3—5 см от проксимального края опухоли. Взятые образцы тканей помещали в нейтральный формалин. Материал проводили по стандартной методике и заливали в парафин. Срезы толщиной 4—5 мкм окрашивали гематоксилином и эозином и иммуногистохимически, с использованием антител к CD20 (Epitope Specific Rabbit Antibody, Thermo Fisher Scientific) в разведении 1:400. Материал для исследования иммуногистохимическими (ИГХ) методами фиксировали 10% нейтральным формалином в течение 24 ч, заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и высушивали при температуре 37 °C в течение 18 ч. Депарафинизацию и демаскировку антигенов проводили в РТ-модуле при температуре 121 °C в течение 20 мин с последующим остыванием 60 мин. В качестве системы визуализации применялась Ultra Vision LP Detection System HRP Polymer & DAB Plus Chromogen. В качестве отрицательного контроля срезы аналогичным образом инкубировали с раствором для разведения антител (UltrAb Diluent). В перитуморальной области полуколичественным методом оценивали наличие очаговых лимфоидных В-клеточных инфильтратов и количество лимфоидных фолликулов (ЛФ) в СОЖ (нет, единичные — не более 2 в поле зрения, множественные — более 2 фолликулов в поле зрения). Также оценивали наличие обычных и атипичных светлых центров в них. Подсчет плотности диффузных В-лимфоцитов осуществляли, используя увеличение 400, на площади 1200×1800 пикс, принятой за условную единицу площади (УЕП), при разрешении 10 пикс/см (0,42×0,28 мм 2 ). Плотность метрической сетки составила 216 точек.
Плотность диффузных CD20 В-лимфоцитов в зависимости от клинических характеристик РЖ представлена в таблице. Наиболее низкие значения плотности отмечены при низкодифференцированной аденокарциноме и недифференцированном РЖ (G3—G4), при глубине инвазии опухоли Т1—2 и при наличии метастазов в регионарных лимфатических узлах (N1—2). Также были отмечены положительные корреляции плотности диффузных CD20 В-лимфоцитов в опухоли с наличием очаговых ЛИ (ρ=0,634, t=3,28, р=0,005). Плотность диффузных СД20 В-лимфоцитов была выше при наличии ЛИ, чем при отсутствии (49,0±15,4 и 22,9±12,1 клеток на УЕП соответственно, р=0,009). Связи этого показателя с выживаемостью больных РЖ и с локализацией опухоли и типом роста не выявлено.

Наличие очаговых ЛИ отрицательно коррелировало с гистологическим типом (гамма =–0,524, Z=–2,02, р=0,04) и общей 3-летней выживаемостью (гамма =–0,770, Z=–2,60, р=0,01). Очаговые Л.И. чаще наблюдались при диффузном типе РЖ, чем при кишечном (в 46,7 и 21,4% случаев соответственно, р=0,15). Несмотря на то что связи этого показателя с глубиной инвазии опухоли и наличием метастазов в регионарных лимфатических узлах не выявлено, наличие очаговых CD20 ЛИ сопровождалось статистически недостоверным снижением 3-летней общей выживаемости с 94,7 до 70,0% (р=0,07). Однако связи очаговых ЛИ с 3-летней безрецидивной выживаемостью пациентов РЖ не отмечено.
Аналогично, количество ЛФ в СОЖ, прилежащей к опухоли, коррелировало с гистологическим типом (гамма=0,509, Z=2,39, р=0,02) и 3-летней безрецидивной выживаемостью (гамма =–0,636, Z=–2,51, р=0,01). Множественные Л.Ф. чаще встречались при диффузном типе РЖ, чем при кишечном (в 72,7 и 38,9% соответственно, р=0,07), и при их наличии отмечено снижение 3-летней безрецидивной выживаемости с 75 до 40%, р=0,08). В то же время связи этого показателя с 3-летней общей выживаемостью не выявлено.
Наличие ЛФ с атипическими светлыми центрами коррелировало только с выраженностью желудочной дисплазии (гамма =0,833, Z=3,22, р=0,001). Чаще всего они выявлялись при тяжелой степени дисплазии желудочного эпителия (в 50,0 и 12,5% соответственно при наличии или отсутствии и тяжелой или умеренной степени дисплазии желудочного эпителия, р=0,02).
Обсуждение
Роль опухолеинфильтрирующих иммунных клеток в прогрессии злокачественных опухолей подтверждена в большом количестве исследований. Полагают, что основные механизмы могут быть связаны с секрецией иммунными клетками цитокинов, хемокинов, факторов роста и протеаз [6, 7, 10], активацией ангиогенеза [4, 5, 11], с участием иммунных клеток в ремодуляции экстрацеллюлярного матрикса, способствующих инвазии опухолевых клеток и метастазированию в отдаленные органы [4, 6]. Роль В-лимфоцитов в опухолевой прогрессии остается малоизученной. Наши результаты свидетельствуют о неоднородности структур, экспрессирующих CD20, в перитуморальной области СОЖ. Они были представлены диффузными В-лимфоцитами, ЛФ и очаговыми Л.И. При этом интересно, что высокая плотность диффузных В-лимфоцитов была статистически значимо связана с начальными стадиями заболевания и не связана с отдаленными результатами лечения РЖ, тогда как наличие очаговых ЛИ и множественных ЛФ было связано с диффузным типом РЖ и ухудшением отдаленных результатов лечения этой патологии.
Данные литературы малочисленны и неоднозначны. Ряд авторов свидетельствуют о том, что повышение количества В-лимфоцитов является прогностически благоприятным признаком, так как связано со специфическим противоопухолевым иммунитетом [12, 13]. Однако другие исследователи отметили, что В-лимфоциты могут способствовать прогрессии злокачественных новообразований. Так, было показано, что в опухолеинфильтрирующих В-лимфоцитах отмечается активация «сигнального белка и активатора транскрипции 3» (STAT3). Известно, что STAT3 играет важную роль в опухолевом ангиогенезе, участвуя в регуляции экспрессии эндотелиального фактора роста сосудов (VEGF) и других про-ангиогенных факторов [14, 15]. Было показано, что плотность опухолеинфильтрирующих В-лимфоцитов прямо коррелирует с уровнями экспрессии VEGF, матричной металлопротеиназы 9 (MMP9) и фактора, индуцируемого гипоксией 1а (HIF1a) [16, 17]. Увеличение уровня В-лимфоцитов с активированным STAT3 было отмечено при раке желудка, легких, печени, простаты и было связано с ухудшением отдаленных результатов лечения [16]. Кроме того, было показано, что В-лимфоциты и сами могут являться источником VEGF-A, играющего ключевую роль в лимфо- и ангиогенезе [18], а В-лимфоциты, экспрессирующие интерлейкин 10, могут способствовать поляризации М1 макрофагов, обладающих противоопухолевой активностью, в М2 макрофаги, обладающие способностью стимулировать рост и метастазирование злокачественных опухолей [19, 20].
Заключение
Таким образом, проведенное исследование позволило установить неоднородность структур, экспрессирующих CD20 в перитуморальной области СОЖ при Р.Ж. Полагаем, что отмеченные корреляции СД20, ЛИ и ЛФ с диффузным типом роста опухоли и отдаленными результатами лечения свидетельствуют о важности дальнейших исследований для изучения роли В-лимфоцитов в прогрессии РЖ.