Дихлорметан что это такое
Дихлорметан
| Дихлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | дихлорметан |
| Сокращения | ДХМ |
| Традиционные названия | дихлорметан, метилен хлористый |
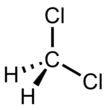
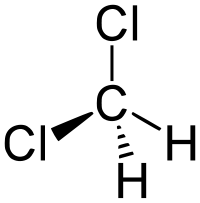
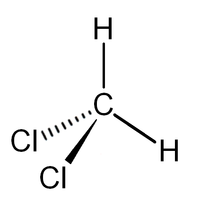
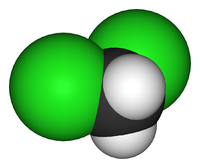
| Химическая формула | CH2Cl2 |
| Эмпирическая формула | CH2Cl2 |
| Физические свойства | |
| Состояние (ст. усл.) | подвижная прозрачная жидкость |
| Примеси | хлорметаны |
| Молярная масса | 84.9 г/моль |
| Плотность | 1.3266 г/см³ |
| Термические свойства | |
| Температура плавления | -96.7 °C |
| Температура кипения | 40 °C |
| Температура вспышки | 14 °C |
| Критическая точка | 245 |
| Энтальпия образования (ст. усл.) | -87.86 кДж/моль |
| Удельная теплота испарения | 336,4 Дж/кг |
| Давление пара | 470 |
| Химические свойства | |
| Растворимость в воде | при 20 °C 1.3 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4242 |
| Классификация | |
| Рег. номер CAS | 75-09-2 |
| SMILES | C(Cl)Cl |
| RTECS | PA8050000 |
Дихлормета́н (хлористый метилен, ДХМ, CH2Cl2) — прозрачная легкоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °C при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцией. После чего он имеет чистоту не менее 99,7 % В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Растворимость в воде 2% по массе (13 г/л), смешивается с большинством органических растворителей. Легколетуч (40 °C), образует азеотропную смесь с водой (т.кип. 38,1 °C, 98,5 % дихлорметана). Метиленхлорид (дихлорметан) реагирует с хлором с образованием хлороформа и четырёххлористого углерода. С йодом при 200 °C дает СН2l2, с бромом при 25-30 °C в присутствии алюминия — бромхлорметан. При нагревании с водой гидролизуется до СН2О и НСl. При нагревании со спиртовым раствором NH3 до 100—125 °C образует гексаметилентетрамин. Реакция с водным раствором NH3 при 200 °C приводит к метиламину,муравьиной кислоте и НСl. С ароматическими соединениями в присутствии АlСl3 метиленхлорид вступает в реакцию Фриделя — Крафтса, например с бензолом образует дифенилметан. [1]
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворителя для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворения смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов.
Также используется в хроматографии.
В промышленности в смеси с полимерами используют для создания формы, которая быстро застывает за счёт испарения дихлорметана. Он также используется для склеивания пластмасс: полистирола, поликарбонатов, полиэтилентерефталата, АБС-пластиков, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Дихлорметан используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Работы следует проводить при работающей вытяжной вентиляции.
В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлорметаном может вызвать его накопление в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия.
В Евросоюзе запрещены краски с дихлорметаном как для личного пользования, так и для профессонального применения.
Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
Контакт дихлорметана с щелочными металлами приводит к взрыву.
ПДК в рабочей зоне 50мг/м³, в воде водоёмов не более 7.5 мг/л. КПВ 12-22 %
Хлористый метилен
 | Хлорорганические растворители импортного производства | |
|---|---|---|
| Наименование вещества: | Метилен хлористый | |
| Синонимы: | дихлорметан ДХМ METHYLENE CHLORIDE | |
метилен дихлорид
хладон 30, фреон 30.
Каталожный номер на метилен хлористый: CAS 75-09-2
Фасовка: Бочки 200 литровые
Российский стандарт на метилен хлористый: ГОСТ 9968-86
Описание метилена хлористого
Легкоподвижная прозрачная и легколетучая жидкость с, характерным для хлорпроизводных, едким сладковатым запахом.
Хорошо растворим в органических растворителях, плохо растворяется в воде.
Спецификация на метилен хлористый импортного производства, и сравнительная характеристика с нормами ГОСТ 9968-86 по результатом проведенной экспертизы
| Наименование показателя | единица измерения | Норма по ГОСТ 9968-86 Для высшего сорта | Значение согласно спецификации Производителя |
| Плотность при 20 град.С | г/см(куб) | 1,326-1,328 | 1,326-1,328 |
| Содержание основного вещества метилена хлористого, не менее | мас % | 99,7 | 99,9 |
| Содержание воды в метилене хлористом, не более | мас % | 0,01 | 0,010 |
| Кислотность (в пересчете на HCl) | мас % | 0,0004 | 0,0004 |
| Остаток после прокаливания, не более | мас % | 0,0005 | 0,0005 |
| Массовая доля железа, не более | мас % | 0,0001 | 0,0001 |
| массовая доля хлорорганических примесей, не более | мас % | 0,23 | 0,08 согласно данным гжх анализа |
| в том числе массовая доля хлороформа, не более | мас % | 0,05 согласно данным ГЖХ анализа | — |
| Цветность фосфорной кислоты (единицы Хазена), не более | не нормируется | 10 |
прим. 1. Для первого сорта (продажа которого распространена по России ) содержание основного вещества 98,8%, а хлороформа 0,8%
прим. 2. Может быть стабилизирован, для увеличения срока хранения при этом содержание основного вещества уменьшается смотри ГОСТ 9968-88
Результаты экспертизы. Согласно представленным данным Метилен хлористый поставляемый нашей компанией соответствует. требованиям ГОСТ 9968-88 а по параметрам, таким как, основное вещество, и содержание хлороформа превосходит ГОСТ 9968-88. Параметр содержание хлорорганики и хлороформа особенно важен, поскольку определяет силу запаха и токсичность продукта!!
Основные физ.хим. параметры вещества метилен хлористый
| Физическое состояние: | жидкое вещество |
| Цвет | прозрачный |
| Запах: | характерный запах |
| Порог восприятия запаха: | 250 PPM |
| Температура вспышки в закрытом тигле, ASTM D 56 град.С по ГОСТ | — 14 град |
| Пределы воспламеняемости на воздухе | Низкая: 14 %(об.) по ГОСТ 16,2% Высокая: 22 %(об.) по ГОСТ 19,1% |
| Температура самовоспламенения | 556 C согласно ГОСТ 580 C (разница методик измерения) |
| Давление паров | 47,33 кПа при 20 град.C |
| Температура кипения (760 мм ртутного столба) | 39,8 град.C |
| Плотность паров (плотность воздуха = 1) | 2,93 |
| Относительная плотность (плотность воды = 1) | 1,320 при 25 град.C/град.25 C |
| Температура замерзания | -96,7 град C |
| Температура плавления | -96,7 град.C |
| Растворимость в воде (по весу) | 1,3 % при 25 град. C |
| pH | Не применимо |
| Температура разложения: | Данные испытаний отсутствуют |
| Коэффициент разделения, октанолl/ вода (log Pow) | 1,25 |
| Скорость испарения (бутил ацетат = 1) | Данные испытаний отсутствуют |
| Динамическая вязкость | 0,41 мПа-с |
| Кинематическая вязкость | 0,31 мм2/с при 25 C Рассчитано |
Устойчивость продукта
Трудногорюч, но при определенных условиях, способен образовывать взрывоопасные смеси с воздухом.
При пожаре дым может содержать исходный материал в
добавление к неустановленным токсичным и/или вызывающим раздражение соединениям.
Опасные побочные продукты сгорания могут включать и не ограничиваются: Хлорид водорода и следовые количества хлора и фосгена
Опасность для человека
В Евросоюзе не рекомендован для прямых продаж населению.
В России по ГОСТ 12.1.005-88 отнесен к 4 класс опасности (малоопасные и безопасные вещества).
ПДК в рабочей зоне
50мг/м(куб), в воде водоёмов не более 7.5 мг/л
Хотя он и является наименее ядовитым среди галогеналканов, но он очень летуч и при превышение ПДК может вызвать острое отравление. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу.
Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В то же время не было отмечено какого-либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
Ограничения в Евросоюзе
В Евросоюзе запрещены краски с дихлорметаном, как для личного пользования, так и для профессионального применения. Для регулярной работы с дихлорметаном не подходят перчатки из латекса или нитриловые.
разлагается при 720 ° C [3]
39,75 ° С (103,55 ° F, 312,90 К)
при 760 мм рт. [4]
17,5 г / л (25 ° С)
15,8 г / л (30 ° С)
5,2 г / л (60 ° С) [3]
2 кПа (-40 ° C)
19,3 кПа (0 ° C)
57,3 кПа (25 ° C) [6]
79,99 кПа (35 ° C) [3]

 [7]
[7]10000 частей на миллион (кролик, 7 ч)
12295 частей на миллион (кошка, 4,5 ч)
14108 частей на миллион (собака, 7 ч) [10]
Дихлорметан (DCM или же метиленхлорид) является хлорорганические соединения соединение с формула CЧАС2Cl2. Эта бесцветная летучая жидкость с хлороформ-подобный сладкий запах широко используется в качестве растворитель. Хотя это не так смешивающийся с водой, это полярный, и смешивается со многими органическими растворители. [11]
Содержание
Вхождение
Природные источники дихлорметана включают океанические источники, макроводоросли, водно-болотные угодья и вулканы. [12] Однако большая часть дихлорметана в окружающей среде является результатом промышленных выбросов. [12]
Производство
На выходе этих процессов получается смесь хлорметана, дихлорметана, хлороформ, и четыреххлористый углерод а также хлористый водород в качестве побочного продукта. Эти соединения разделены дистилляция.
DCM был впервые подготовлен в 1839 г. Французский химик Анри Виктор Рено (1810–1878), который выделил его из смеси хлорметан и хлор который подвергся воздействию Солнечный свет. [13]
Использует
Летучесть DCM и способность растворять широкий спектр органических соединений делают его полезным растворителем для многих химических процессов. [11] в пищевая промышленность, он использовался для без кофеина кофе и чай а также для приготовления экстрактов хмель и другие ароматизаторы. [14] Его непостоянство привело к его использованию в качестве аэрозольный баллончик и как пенообразователь за полиуретан пены.
Водородная связь
Специализированное использование
Низкое химическое соединение точка кипения позволяет химическому веществу функционировать в Тепловой двигатель которые могут извлекать механическую энергию из небольших перепадов температур. Примером теплового двигателя DCM является пьющая птица. Игрушка работает при комнатной температуре. [17] Он также используется в качестве жидкости в рождественских огнях, у которых есть цветная пузырящаяся трубка над лампой в качестве источника тепла и небольшое количество каменной соли для обеспечения тепловой массы и места зародышеобразования для растворителя с изменяющейся фазой.
DCM химически сваривает некоторые пластмассы. Например, его применяют для опломбирования кожуха электросчетчиков. Часто продается как основной компонент пластиковые сварочные клеи, он также широко используется Построение модели любители соединять пластмассовые детали вместе. Его обычно называют «Ди-кло».
Он используется в полиграфической промышленности для удаления термосваренных переносчиков одежды, а его летучесть используется в новинках: пузырьковые огни и музыкальный автомат отображает.
DCM используется в области тестирования материалов гражданское строительство; в частности, он используется во время испытаний битумных материалов в качестве растворителя для отделения связующего от агрегата асфальт или же щебень чтобы разрешить тестирование материалов. [18]
Дихлорметановый экстракт Аспарагопсис таксомоторныйводоросли корм для крупного рогатого скота, снижает выбросы метана на 79%. [19]
Он также является основным компонентом средства для удаления краски, хотя существуют его замены.
Токсичность
DCM также метаболизируется в организме, чтобы монооксид углерода потенциально ведущий к отравление угарным газом. [23] Острое воздействие при вдыхании привело к оптическая нейропатия [24] и гепатит. [25] Продолжительный контакт с кожей может привести к растворению DCM некоторых жировые ткани в коже, что приводит к раздражению кожи или химические ожоги. [26]
Это может быть канцерогенный, поскольку он был связан с рак из легкие, печень, и поджелудочная железа у лабораторных животных. [27] Другие исследования на животных показали рак молочной железы и рак слюнной железы. Исследования пока не ясно, какие уровни могут быть канцерогенными. [1] [22] DCM пересекает плацента но Плода токсичность у женщин, подвергшихся его воздействию во время беременность не было доказано. [28] В экспериментах на животных он был токсичен для плода в дозах, токсичных для матери, но не тератогенный эффекты были замечены. [27]
У людей с уже существующими проблемами с сердцем воздействие DCM может вызвать: аномальные сердечные ритмы и / или сердечные приступы, иногда без каких-либо других симптомов передозировки. [22] Люди с существующими печень, нервная система, или же кожа проблемы могут усугубиться после воздействия хлористого метилена. [9]
Регулирование
Во многих странах продукты, содержащие DCM, должны иметь маркировку, предупреждающую о рисках для здоровья.
В феврале 2013 года США Управление по охране труда (OSHA) и Национальный институт охраны труда и здоровья предупредил, что с 2000 года по меньшей мере 14 мастеров по ремонту ванн умерли от воздействия DCM. Эти рабочие работали в одиночестве, в плохо вентилируемых ванных комнатах, с недостаточной защитой органов дыхания или без нее и без обучения опасностям DCM. [9] [22] [29] С тех пор OSHA выпустила стандарт DCM. [30] в Евросоюз, то Европейский парламент в 2009 году проголосовали за запрет использования DCM в средствах для удаления краски для потребителей и многих специалистов. [31] Запрет вступил в силу в декабре 2010 года. [32]
В Европе Научный комитет по предельным значениям воздействия на рабочем месте (SCOEL) рекомендует для DCM предел профессионального воздействия (8-часовое средневзвешенное значение) 100 ppm и предел краткосрочного воздействия (15 мин) 200 ppm. [33]
Опасения по поводу его воздействия на здоровье привели к поиску альтернатив во многих из этих приложений. [11] [34]
15 марта 2019 года Агентство по охране окружающей среды США (EPA) издало окончательное правило, запрещающее производство (включая импорт и экспорт), переработку и распространение хлористого метилена во всех средствах для снятия краски для потребительского использования, вступившее в силу через 180 дней. не влияет на другие продукты, содержащие хлористый метилен, включая многие потребительские товары, не предназначенные для удаления краски.
Экологические последствия
Дихлорметан не классифицируется как озоноразрушающее вещество Монреальский протокол. [35] Соединенные штаты. Закон о чистом воздухе не регулирует дихлорметан как разрушитель озона. [36] Согласно EPA, время жизни дихлорметана в атмосфере очень короткое, так что вещество разлагается, не достигнув озонового слоя.
Метиленхлорид
Метиленхлорид
| Дихлорметан | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | дихлорметан |
| Сокращения | ДХМ |
| Традиционные названия | дихлорметан, метилен хлористый |
| Химическая формула | CH2Cl2 |
| Эмпирическая формула | CH2Cl2 |
| Молярная масса | 84.9 г/моль |
| Физические свойства | |
| Плотность вещества | 1.3266 г/см³ |
| Примеси | хлорметаны |
| Состояние (ст. усл.) | подвижная прозрачная жидкость |
| Термические свойства | |
| Температура плавления | -96.7 °C |
| Температура кипения | 40 °C |
| Температура вспышки | 14 °C |
| Критическая точка | 245 |
| Энтальпия (ст. усл.) | -87.86 кДж/моль |
| Удельная теплота парообразования | 336,4 Дж/кг |
| Давление пара | 470 |
| Химические свойства | |
| Растворимость в воде | 20 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,4242 |
| Классификация | |
| номер CAS | 75-09-2 |
| RTECS | PA8050000 |
Дихлорметан (хлористый метилен, ДХМ, CH2Cl2) — прозрачная лекгоподвижная и легколетучая жидкость с характерным для галогенпроизводных сладковатым запахом. Впервые был синтезирован в 1840 году выдерживанием смеси хлора с хлористым метилом на свету. В целом наиболее безопасен среди галогеналканов.
Содержание
Получение
Получают прямым хлорированием метана хлором в условиях радикального механизма при 400—500 °С при соотношении равном 5:1
В результате получается смесь всех возможных хлоридов: хлорметан, дихлорметан, хлороформ и четырёххлористый углерод, которые потом разделяются дистилляцей. После чего он имеет чистоту не менее 99,7% В 1995 году годовое производство оценивалось в 500 миллионов тонн.
Свойства
Применение
Дешевизна, высокая способность растворять многие органические вещества, легкость удаления, относительно малая токсичность привела к широкому применению его как растворитель для проведения реакций, экстракций в том числе и в лабораториях. Используют в смесях для снятия лака, обезжиривания поверхностей. В пищевой промышленности используют для приготовления быстрорастворимого кофе, экстракта хмеля и других пищевых препаратов. Для растворение смол, жиров, битума. Его высокая летучесть используется для вспенивания полиуретанов. Также используется в хроматографии. В промышленности в смеси с полимерами используют для создания формы которая быстро застывает за счёт испарения дихлорметана. Он же используется для склеивания этих пластиков: полистирол, поликарбонат, полиэтилентерефталат, АБС-пластик, но не для полиэтилена и полипропилена.
Очистка в лаборатории
Специализированные применения
Используется в составах для склеивания пластиков. В смеси с метанолом используют как пропеллент, в качестве хладагента.
Безопасность
Хотя он и является наименее ядовитым среди галогеналканов, но нужно быть осторожным при обращении, так как он очень летуч и может вызвать острое отравление. Вытяжная вентиляция необходима. В организме дихлорметан метаболизируется до монооксида углерода, что может вызвать отравление им. Длительный покровный контакт с дихлрометаном может вызвать накопление его в жировых тканях и привести к ожогу. Также при длительной работе с ним возможно поражение печени и нейропатия. На крысах показано, что он может вызывать рак лёгких, печени и поджелудочной железы. В тоже время не было отмечено какого либо влияния на развития эмбрионов у женщин имевших контакт с ДХМ.
Общая безопасность и методы устранения аварий [3]