Динамика отрицательная что означает
Динамика отрицательная что означает
Отрицательная ультразвуковая динамика пневмонии, по нашим данным, в большей степени связана с развитием экссудативного плеврита или эмпиемы плевры, реже возникали гнойно-некротические изменения, когда в структуре воспалительного инфильтрата появлялись анэхогенные участки деструкции легочной ткани. Динамика деструктивных изменений подробно рассмотрена в разделе «Ультразвуковая семиотика абсцедирующих пневмоний». Необходимо добавить только, что при обратном развитии абсцсдирующей пневмонии сначала происходит постепенное очищение очагов распада от гнойного экссудата с образованием воздушных полостей, которые затем рубцуются и исчезают в процессе рассасывания воспалительной инфильтрации по мере восстановления воздушности легочной ткани.
Увеличения размеров пневмонических очагов с нарастанием выраженности воспалительных изменений и переходом в более тяжелую ультразвуковую форму нам наблюдать нe приходилось. Однако такая вероятность существует при неадекватной терапии ослабленных пациентов. Чаще нам приходится сталкиваться с отсутствием динамических изменений в течение определенного времени при затяжной пневмонии, что требует коррекции схемы лечения, если, конечно, правильно установлена причина нарушения воздушности легкого.
Неосложненные пневмонии рассасываются бесследно, с полным восстановлением пристеночной гиперэхогенной линии.
После абсцедирующей пневмонии при тяжелом течении и крупных полостях деструкции возможно формирование очагового или диффузного пневмосклероза, протекающего в рамках эхокартины «интерстициальпых изменений в легких». Оставшиеся после деструктивной пневмонии субплевральные тонкостенные полости недоступны ультразвуковой визуализации, так как эхосигнал от воздуха в них не дифференцируется на фоне фиброзных интерстициальных изменений в окружающей легочной ткани.
УЗИ дифференциация пневмоний и ателектазов легкого
Важной задачей трансторакального УЗИ является определение этиологии безвоздушного участка. Причиной потери воздушности легочной ткани может быть не только воспалительная инфильтрация при пневмонии, но и обтурационный ателектаз доли при центральном раке легкого или компрессионный ателектаз при массивном плевральном выпоте.
Для выявления их ультразвуковых дифференциально-диагностических признаков мы провели сравнительный анализ эхокартины пневмонии, обтурационного и компрессионного ателектазов и выявили характерные для каждого из них ультразвуковые признаки. Исходя из требований клинической практики, наибольшее внимание уделялось дифференциальной диагностике долевых пневмоний и обтурационных ателектазов, поскольку рентгенологически не всегда возможно определить опухолевую или воспалительную природу потери воздушности в пределах доли.
При дифференцировании этих процессов форма и контуры безвоздушного участка не имеют принципиального диагностического значения.
Для пневмонии типична неоднородная эхоструктура, обусловленная линейными гиперэхогенными сигналами от воздуха в бронхах или воздушной эхобронхограммой в сочетании с мелкими включениями воздушных долек, а при абсцедирующсм течении — гиперэхогенными овальными или дугообразными сигналами от полостей распада с акустической тенью.
Линейные гиперэхогенные сигналы являются наиболее частым и наименее специфичным компонентом при неоднородной эхоструктуре безвоздушной доли легкого и встречаются при разных причинах нарушения воздушности, но с различной частотой.
В наибольшей степени они характерны для долевых и сегментарных пневмоний, при которых имеют диффузное или неравномерное распределение в эхоструктуре инфильтрата и служат важным диагностическим отличием, свидетельствующим о сохраненной проходимости бронхиального дерева.
При компрессионных ателектазах гиперэхогенные линейные сигналы наблюдаются намного реже, единичны и видны только в центральной части на границе с воздушной легочной тканью в виде так называемого центрального бронха.
Для долевых обтурационных ателектазов гиперэхогенные сигналы совершенно не характерны. Они могут наблюдаться только при обтурации сегментарного бронха в виде отдельных коротких отрезков по периферии безвоздушного сегмента и обусловлены коллатеральной легочной вентиляцией.
Воздушная эхобронхограмма, в отличие от жидкостной, часто встречается при пневмониях и изредка в центральной части компрессионных ателектазов, но никогда не возникает при обтурационных ателектазах, поскольку представляет собой отражение ультразвука от воздуха в просвете бронхов. Ее наличие позволяет полностью исключить обтурационную причину потери воздушности, так как свидетельствует о сообщении бронхов безвоздушного участка с остальным бронхиальным деревом.
Жидкостная эхобронхограмма в виде анэхогенных трубчатых структур без доплеровских сигналов от кровотока представляет собой отражение от цилиндрически расширенных и заполненных жидким экссудатом бронхов. Она лоцируется только в обтурационном ателектазе при полной обтурации долевого бронха опухолью с развитием добита в безвоздушной доле. При пневмониях и компрессионных ателектазах она не возникает, поскольку бронхи сохраняют проходимость, и при потере воздушности не расширяются за счет накопления анэхогенного экссудата.
Наличие в безвоздушном участке легкого жидкостной эхобронхограммы требует тщательной визуализации области корпя легкого для выявления объемного образования. При его обнаружении диагноз центрального рака не вызывает сомнений, а при отсутствии показано проведение рентгеновской томографии на корень легкого или бронхоскопии для исключения обтурирующей эндобронхиальной опухоли.
Динамика отрицательная что означает
Первые препараты для иммунотерапии в США и Европе начали использоваться в 2011 году. Разработаны и опробованы они были, разумеется, ещё раньше.
Сначала иммунотерапия использовалась только как средство лечения меланомы, опасной формы рака кожи. Сейчас спектр применения иммунотерапевтических средств существенно шире.
В Российской Федерации эти препараты были зарегистрированы в конце 2015 — начале 2016 года, и с этого времени уже и в России накопился достаточно большой опыт их применения.
«Дело в том, что иммунотерапия — это, наверное, самое важное из всего, что за последние годы произошло в онкологии как в науке.
Онкология — это вообще очень динамично развивающаяся область, и новые лекарства появляются практически ежегодно. Но с появлением иммунотерапии в нашем распоряжении оказалось целое новое направление. Оно дополнило имеющиеся подходы: химиотерапию и таргетную терапию; изменило принципы и алгоритмы лечения целого ряда заболеваний.
До появления иммунотерапии некоторые виды опухолей считались не поддающимися лекарственной терапии ни в каком формате. А теперь даже пациенты с распространённым опухолевым процессом могут жить годами. В некоторых случаях мы можем получить полный клинический эффект даже на четвёртой стадии заболевания — и все это благодаря иммунотерапии. Поэтому это действительно чрезвычайно новое, интересное, перспективное направление в мировой онкологии», – отметил эксперт.
Он добавил, что химиотерапия сейчас – важный и нужный метод, он активно используется в онкологии. Но при выборе препаратов необходимо руководствоваться тем, какое лечение показано конкретному пациенту. А показано может быть только то лечение, которое даёт самые лучшие результаты, лечение, с помощью которого пациент живёт дольше.
Но химиотерапия не может продлевать жизнь до бесконечности, её возможности предельны. Если бы это было не так, мы бы вылечивали рак первой линией терапии. Назначили препарат, добились полной регрессии опухоли, пациент выздоровел. Всё замечательно. Но, к сожалению, в реальности так не бывает, потому что эффективность химиотерапии предельна. Если поначалу мы получаем яркий клинический эффект, то при последующих контрольных исследованиях он слабеет, и в какой-то момент заканчивается, вынуждая нас подбирать новый препарат. Но и линейка препаратов может исчерпаться.
«Поэтому каждый раз, когда мы получаем дополнительную опцию в виде нового химиопрепарата, нового таргетного препарата, рассчитанного на лечение того или иного заболевания, и уж тем более нового направления, такого как иммунотерапия, конечно, мы этому бесконечно рады. Более того, конечно же, если мы говорим о переносимости, то иммунотерапия переносится на порядки легче, чем среднестатистическая химиотерапия, к тому же она обладает существенно меньшим количеством побочных эффектов. Хотя нельзя сказать, что их нет. Они есть, они встречаются, но, конечно, выражены они не так сильно, как побочные эффекты химиотерапии», – добавил онколог.
По его словам, в последнее время снижается подход к онкологии, как к «смертельному заболеванию». Есть огромное количество различных онкологических заболеваний, которые успешно излечиваются. Существуют так называемые прогностически благоприятные опухоли, например определённые виды рака щитовидной железы, рака предстательной железы. Более того, обсуждается даже, что рак предстательной железы на определённой стадии заболевания, в принципе, требует только динамического наблюдения. То есть человек знает, что у него есть рак, но не получает никакого лечения, потому что этот рак не представляет опасности — до определённых моментов.
«Некоторые виды рака молочной железы, — опять же, на определённой стадии — могут быть полностью излечены. Даже сейчас есть очень много пациенток, которые приходят на обследования после операций, сделанных в семидесятые годы, и у них все в порядке.
Конечно, есть и агрессивные, прогностически неблагоприятные опухоли, но даже в этой области произошло очень много положительных изменений. Одна из самых агрессивных опухолей, например, — это рак поджелудочной железы. Буквально пятнадцать лет назад в крупных хирургических центрах — даже применив все возможные варианты лечения, — было практически невозможно получить хоть какие-то цифры пятилетней выживаемости у больных. А сейчас есть огромное количество публикаций, в которых приводятся цифры не только пяти-, но и десятилетней выживаемости при этом заболевании. Связано это с использованием, во-первых, новых схем, новых препаратов, а во-вторых, с тем, что сейчас практически никакое онкологическое заболевание не лечится только одним методом, практически всегда используется комбинированный подход, сочетание хирургического лечения с лекарственной терапией и лучевой терапией.
Поэтому рак, безусловно, излечим. Рак — это никоим образом не приговор», – заключил Андрей Пылёв.
Как сообщалось ранее, член правления Российского общества клинической онкологии (RUSSCO), заведующая отделением химиотерапии НМИЦ онкологии им. Н. Н. Блохина Елена Артамонова рассказала о значении новых иммунных препаратов при уничтожении рака, а также о ближайшей перспективе развития лечения онкологии. Подробнее читайте: «Иммунные препараты – не панацея, но мы стоим на пороге новых достижений».
Динамика отрицательная что означает
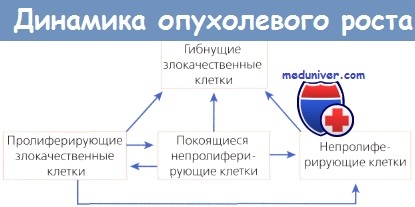
Время удвоения размера опухоли зависит от скорости как деления клеток, так и их гибели. Время генерации нельзя считать продолжительным просто из-за того, что опухоль медленно растет. Возможно, медленный рост опухоли обусловлен коротким временем генерации в сочетании с высоким показателем клеточной гибели.
Небольшая опухоль, обнаруженная с помощью рентгенологического или физикального исследования, необязательно представляет собой раннюю стадию развития опухоли, поэтому необходимо провести серию исследований, чтобы оценить скорость роста, что поможет установить стадию заболевания. Крупные опухоли (диаметр более 2—3 см) увеличиваются гораздо медленнее, чем маленькие, т. к. их клетки, особенно те, которые находятся в самом центре (дальше всего от кровоснабжения), имеют длительное время генерации. Конкуренция за питательные и другие вещества снижает активность всей массы опухоли.
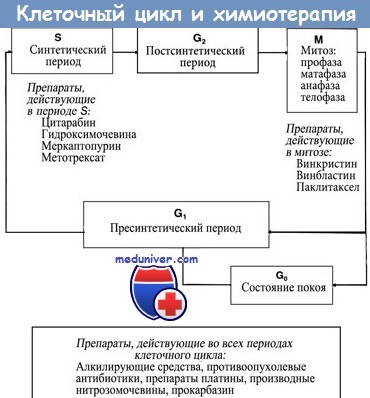
Для успешной химиотерапии (XT) злокачественных новообразований необходимо использовать физиологическое ограничение, чтобы дифференцированно уничтожать опухолевые клетки, но максимально сохранять нормальные. Для создания терапевтических режимов может быть использован тот факт, что скорость клеточного роста опухолевых клеток больше по сравнению с нормальными тканями. В любой момент времени сравнительно большое количество раковых клеток будет находиться в фазе синтеза ДНК (S-фаза) клеточного цикла, в течение которого фазоспецифические препараты (те, которые ингибируют синтез ДНК) могут действовать.
Таким образом, краткосрочная высокодозная химиотерапия (ХТ) с помощью препаратов, влияющих на синтез ДНК, таких как метотрексат, более эффективно уничтожают быстроделящиеся опухолевые клетки, при этом сохраняется сравнительно большое число нормальных элементов костного мозга. Ксожалению, клетки костного мозга, эпителия ЖКТ и волосяные фолликулы имеют время генерации, сравнимое с таковым опухолей, поэтому они чувствительны к веществам, которые ингибируют синтез ДНК.
Однако по сравнению с более синхронно растущей клеточной популяцией опухоли в конкретный момент времени лишь немногие клетки костного мозга находятся в S-фазе, что объясняет избирательную токсичность фазоспецифических препаратов. Курс терапии, длящийся несколько дней или даже недель, необходим, чтобы уничтожить медленнорастущие опухоли, в которых небольшая часть клеток находится на стадии синтеза ДНК в конкретный момент времени. Препараты, действие которых не зависит от синтеза ДНК (т. е. фазонеспецифические препараты), такие как алкилирующие средства, более эффективны в отношении крупных медленнорастущих опухолей.
Клетки, оставшиеся после лечения, имеют тенденцию к более быстрому делению и более восприимчивы к действию фазоспецифических препаратов. Таким образом, химиопрепараты гибко взаимодействуют друг с другом.
Появление повышенной чувствительности опухолевых клеток при возвращении к норме после воздействия на них алкилирующих средств служит обоснованием для сочетания фазонеспецифических и фазоспецифических препаратов во многих новых схемах XT. Кроме того, если препараты с различными механизмами токсичности комбинируются, безопасно применять дозы препаратов, используемые в ионотерапии.
Каждый выбранный препарат для сочетанной терапии должен также обладать противоопухолевой активностью и в монотерапии. Когда возможно, чередующиеся курсы химиотерапии (XT) должны способствовать восстановлению численности нормальных клеток, если в ходе лечения их количество уменьшилось. В случаях, когда известны антидоты к химиотерапевтическим препаратам, например лейковорин (цитроворум-фактор, кальция фолинат) для метотрексата, их можно использовать, чтобы ускорить восстановление нормальных клеток.
Конечно, существует опасность восстановления сублетально поврежденных опухолевых клеток, которую необходимо оценить в каждом новом режиме лечения. Хотя необходимы тщательные исследования, чтобы сравнить каждую новую комбинацию с монотерапией, в настоящее время наблюдается тенденция к использованию комбинаций препаратов, применяемых одновременно или последовательно.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Оценка динамики функционального состояния пациентов в остром периоде мозгового инсульта на фоне терапии цитиколином
Изучено функциональное состояние ведущих адаптационных механизмов и данных неврологического статуса у пациентов в остром периоде мозгового инсульта по данным исследования вегетативных показателей на фоне терапии цитиколином.
Functional state of the main adaptation mechanisms and data of neurological status in patients in acute period of cerebral stroke, on the data of research of vegetative indices against the background of therapy with citicoline, were studied.
При развитии у человека такого тяжелого состояния, как острое нарушение мозгового кровообращения (ОНМК), перед врачами встает задача интегративного осмысления ряда медико-биологических процессов, происходящих в организме пациента. В большинстве случаев специалисты ориентированы на «базовые пункты» восстановления пациента после инсульта: витальные функции, динамика двигательного дефицита, когнитивные нарушения. Безусловно, эти позиции являются во многом определяющими в формировании стратегии лечения и реабилитации, уточнении прогноза у пациента. Однако мы не должны забывать об основах, создающих предпосылки для положительной (или отрицательной) динамики состояния больного, перенесшего инсульт. Речь идет о так называемых функциональных системах (ФС), которые обеспечивают гомеостаз и адаптацию организма на разных уровнях организации: метаболическом, гомеостатическом, поведенческом, психическом и социальном. В этой работе мы делаем попытку оценить динамику состояния пациентов, перенесших ОНМК, не только через призму оценки неврологического статуса (двигательный дефицит, когнитивные нарушения), но и проанализировать уровень напряженности функциональных систем, статус которых, по нашему мнению, имеет очень важное прогностическое значение, и, что не менее важно, их основные показатели дают возможность объективно трактовать эффективность проводимой терапии, в частности, использования нейропротекторов у больных в остром периоде ОНМК.
Нам представляется любопытным соотнесение с упомянутыми выше уровнями организации процессов, проходящих в организме при развитии ишемического инсульта (ИИ), с оценкой полученных результатов исследования в соответствии с теорией о ФС.
Следует отметить, что компенсаторно-приспособительные механизмы в организме реализуются главным образом деятельностью надсегментарных структур вегетативной нервной системы (ВНС), преимущественно через сегментарные аппараты: в результате функционирования парасимпатических структур создаются устойчивые состояния органов и гомеостаз, а симпатическая часть изменяет эти состояния применительно к выполняемой функции. Согласно современным представлениям, ВНС принимает ведущее участие в формировании адаптационных реакций в ответ на непрерывно меняющиеся условия внешней и внутренней среды в норме и патологии.
На сегодняшний день имеется большое количество работ, свидетельствующих о ведущей роли ВНС в механизмах симптомообразования, патогенеза и компенсации при целом ряде органических и функциональных заболеваний организма [6, 16]. В большинстве случаев течение и исход многих патологических состояний зависят именно от адекватности ведущих механизмов вегетативного гомеостаза (BГ). Очевидно, это в полной мере касается течения и исхода мозгового инсульта (МИ).
На практике врачи сталкиваются с проблемой объективизации данных в диагностике состояний вегетативного гомеостаза. На сегодняшний день чувствительная методика исследования вариабельности сердечного ритма (ВСР) позволяет неинвазивно и безболезненно диагностировать расстройства вегетативной нервной системы, обеспечивая индивидуальный подход к каждому пациенту.
Вместе с тем значимость дезадаптационных процессов, в частности проблема роли ВГ в развитии и течении МИ, остается малоисследованной, что диктует необходимость изучения функционального состояния ВНС при ОНМК.
Оценка функциональных характеристик ВНС в настоящее времени проводится на различных методических уровнях. В современных условиях совершенно обоснованно рекомендована и используется оценка реакции синусового узла как наиболее адекватного индикатора вегетативного обеспечения организма (BOO) и резерва адаптации на уровне сердечно-сосудистой системы (ССС) и организма в целом, методом кардиоинтервалографии (КИГ). Ценность КИГ заключается в непосредственной оценке вегетокардиальных реакций при воздействии различных стрессовых факторов. На базе КИГ ассоциируется в полном объеме оценка деятельности высших вегетативных центров и реализация их активности на вегетокардиальном уровне в частности и организма в целом [1, 5, 6]. Исходя из данных предпосылок в настоящем исследовании для оценки функционального состояния ВНС использовался метод КИГ.
Целью настоящего исследования явилось изучение функционального состояния ведущих адаптационных механизмов и данных неврологического статуса у пациентов в остром периоде МИ по данным исследования вегетативных показателей на фоне терапии цитиколином.
Материал и методы исследования
Обследовано 55 пациентов в остром периоде ишемического МИ в каротидном бассейне. Возраст пациентов варьировал от 42 до 82 лет (средний возраст 64,6 ± 13,0 лет), среди них было 26 женщин и 29 мужчин (табл. 1). Важным представляется включение в группу обследованных лиц пациентов без нарушений сердечного ритма, так как это могло повлиять на результаты оценки показателей вегетативного гомеостаза.
Все пациенты были разделены на две группы: 1-ю (основную) группу составили 35 человек, получающие базисную терапию (профилактика и лечение отека мозга, гемодилюция, коррекция нарушений витальных функций и гемостаза, предупреждение осложнений) и цитиколин (препарат Цераксон®) в дозе 2000 мг в сутки внутривенно капельно в течение 5 суток с дальнейшим переходом на прием пероральной формы в дозе 1000 мг/сут в течение 20 дней; 2-ю группу — 20 пациентов, получавших базисную терапию, без цитиколина. Сравнительный анализ эффективности терапии цитиколином проводили по темпам восстановления нарушенного сознания, регресса общемозговой и очаговой неврологической симптоматики, с использованием клинико-неврологического анализа (оценка по шкале NIHSS, Бартеля, Ранкина). Для оценки функционального состояния ВНС использовался метод КИГ. Рассчитывали следующие показатели: Мо — мода — наиболее часто встречающиеся значения КИГ, характеризующие нейрогуморальный (НГ) канал регуляции и уровни функционирования систем; АМо — амплитуда моды — число наиболее часто встречающихся значений продолжительности кардиоинтервалов (в %) к общему числу интервалов в массиве, отражает влияние симпатоадреналового (СА) звена на синусовый узел; ВР (вариационный размах) — разность между максимальным и минимальным значениями длительности интервалов R-R в данном массиве кардиоциклов, отражает уровень активности парасимпатического (ПС) звена ВНС; ИН (индекс напряжения) — отражает степень централизации управления сердечным ритмом. Тестирование по шкалам и КИГ проводили дважды: при поступлении (в течение суток) и при выписке больного (на 21-е сутки лечения). Статистическую обработку результатов проводили с использованием пакета прикладных программ Excel.
Результаты исследования
Результаты исследования активности ведущих механизмов ВНС (СА, ПС и НГ) у больных с ИИ в динамике заболевания представлены на рис. 1–4.
На фоне терапии цитиколином на 21-е сутки наблюдается увеличение Мо на 3,2%, в группе контроля к концу лечения Мо снижается на 7,7%.
АМо в основной группе снижается на 3,3%, в группе контроля к концу лечения возрастает на 14,5%.
На фоне терапии цитиколином на 21-е сутки ВР возрастает на 31,8%, в группе контроля к концу лечения ВР незначительно снижается на 2%.
На фоне терапии цитиколином ИН снижается на 13,7%, в группе контроля к концу лечения ИН возрастает на 109,4%.
Результаты исследования в целом свидетельствуют о наличии фазовой преемственности смены активности ведущих механизмов ВНС в динамике течения МИ. Выявленная тенденция в полной мере согласуется с клинико-экспериментальными исследованиями Г. Селье о фазовой структуре стресса и указывает на соответствие динамики изменений ведущих механизмов ВНС закономерностям динамики ответной реакции организма на стресс. В 1-е сутки ишемического МИ вегетовисцеральные взаимоотношения на уровне ССС характеризуются преобладанием СА-механизмов. Это иллюстрирует повышение величины Амо как индикатора СА-напряженности. В последующем имеется тенденция к превалированию роли ПС- и НГ-механизмов в регуляции вегетативного тонуса. CA-напряжение характеризуется тенденцией к нивелированию.
Вместе с тем, как показывают результаты исследований, в двух исследуемых группах отмечается различная динамика изменений активности ведущих механизмов ВНС. В частности, в контрольной группе пациентов отмечается чрезвычайное напряжение СА-механизмов, которое возрастает к 21-му дню заболевания. Это наглядно иллюстрирует повышение величины Амо как индикатора СА-напряженности. Параллельно снижаются величины Мо и ВР, характеризующие активность НГ- и ПС-механизмов BOO. Все это в конечном итоге обусловливает повышение величины ИН, являющегося не только интегральным показателем напряжения адаптационных механизмов в системе BOO, но и характеризующего тяжесть состояния больных.
При анализе динамики клинического балла по шкале NIHSS было выявлено опережение восстановления нарушенных неврологических функций (более значимое снижение суммарного клинического балла) у больных, получавших цитиколин, по сравнению с контрольной группой. Разница баллов на 1-й и 21-й день исследования составила 5,22 ± 0,7 в основной группе и 2,0 ± 0,82 в группе контроля (р
Э. З. Якупов, доктор медицинских наук, профессор
ГБОУ ВПО КГМУ МЗ РФ, Казань
.gif)
.gif)
.gif)