Диоксид углерода что это такое
Углекислый газ: характеристики и применение
Человечество научилось использовать газообразные вещества для поддержания искусственных процессов и реакций, в результате которых удаётся получить другие химические соединения. Кроме этого, различные газы используются для получения определённых физических явлений и свойств. Углекислый газ или СО2 обладает большим количеством качеств, которые не могут не использоваться в химической промышленности и быту.
Что такое углекислый газ
Оксид углерода (IV) представляет собой тяжёлый газ. Плотность углекислоты примерно в полтора раза больше чем у атмосферного воздуха. Несмотря на то, что этот газ уже при температуре минус 78,3 градуса Цельсия превращается в снегообразную массу, получить жидкую углекислоту при нормальном давлении не представляется возможным. Так называемый сухой лёд при малейшем повышении температуры сразу переходит из твёрдой, в газообразную форму. Получить жидкую углекислоту можно только при давлении более 60 атмосфер. В таких условиях газ конденсируется даже при комнатной температуре с образованием бесцветной жидкости.
Углекислый газ не окисляется, но может поддерживать горение некоторых металлов. В среде углекислоты, при определённых условиях, могут возгораться такие активные элементы как магний, кальций и барий. Этот газ хорошо растворим в воде, а в воздухе его содержится большое количество благодаря дыханию живых организмов и растений, наличию вулканической активности на земле, а также в результате сгорания органических веществ.
В результате растворения СО2 в воде в большой концентрации образуется угольная кислота. Это вещество может вступать в реакцию с фенолом и магнийорганическими соединениями. Углекислый газ также реагирует с щелочами. В результате такой реакции образуются соли и эфиры угольной кислоты.
Свойства углекислого газа
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста. Большая концентрация СО2 может привести к гибели людей. При потере сознания человек может оказаться на полу, где количество кислорода будет недостаточным для поддержания нормального процесса дыхания.
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Применение углекислого газа
Благодаря наличию определённых физических и химических свойств углекислый газ может использоваться в различных сферах. В химической промышленности углекислота используется для:
В металлургии CO2 применяется с целью:
Кроме перечисленных областей углекислый газ активно используется при производстве бумаги. Оксид углерода применяется регулирования водородного показателя древесной массы, а также усиления мощности производственных машин.
Углекислый газ используется в пищевой промышленности в качестве добавки, которая оказывает консервирующее действие. При изготовлении выпечки СО2 применяется в качестве разрыхлителя. Газированные напитки также изготавливаются с применением углекислоты, а для хранения быстро портящихся продуктов используется «сухой лёд».
Незаменим углекислый газ и при выращивании овощей и фруктов в зимних теплицах. В таких помещения в воздухе недостаточное количество СО2, который необходим для «дыхания» растений, поэтому приходится искусственно насыщать атмосферу этим газом.
В медицине углекислота применяется во время проведения сложных операций на внутренних органах. Наиболее ценным качеством этого газа, является использование его для реанимационных мероприятий, ведь благодаря возможности повысить его концентрацию можно эффективно стимулировать процесс дыхания пациента.
При сварке металлов углекислота применяется в качестве инертного облака, которое служит защитой расплавленного участка от попадания в него активного кислорода. В результате такой обработки сварочный шов получается идеально ровным и не подверженным окислению.
Благодаря способности охлаждаться при испарении, СО2 используется для тушения пожаров. Заправленные этим веществом огнетушители являются эффективным средством борьбы с возгораниями на объектах, где применение порошковых или пенных средств тушения невозможно.
В быту углекислота используется в качестве напорного газа в пневматическом оружии, а также для отпугивания комаров и борьбы с грызунами.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Диоксид углерода
Диоксид углерода
| Диоксид углерода | |
|---|---|
  | |
| Другие названия | углекислый газ, углекислота, сухой лед(твердый) |
| Формула | CO2 |
| Молярная масса | 44.0095(14) г/моль |
| В твердом виде | сухой лед |
| Вид | бесцветный газ |
| Номер CAS | [124-38-9] |
| Свойства | |
| Плотность и фазовое состояние | 1.98 кг/м³, при н.у.; 771 кг/м³, жидкий; 1512 кг/м³, твёрдый |
| Растворимость в воде | 1.45 кг/м³ |
| Удельная теплота плавления | 25.13 кДж/моль |
| Точка плавления | −57 °C (216 K), под давлением |
| Точка кипения | −78 °C (195 K), возгоняется |
| Константа диссоциации кислоты (pKa) | 6.35 and 10.33 |
| Вязкость | 0.07 пз при −78 °C |
| Строение | |
| Форма молекулы | линейная |
| Кристаллическая решётка | кварцевидная |
| Дипольный момент | ноль |
| Техника безопасности | |
| MSDS | External MSDS |
| Главные опасности | удушающее, раздражающее |
| NFPA 704 | |
| R-phrases | R: As, Fb |
| S-phrases | S9, S23, S36 (ж) |
| RTECS number | FF6400000 |
| Страница дополнительных сведений | |
| Структура и свойства | n, εr, и т. д. |
| Спектр | УФ, ИК, ЯМР, Масс-спектроскопия |
| Родственные соединения | |
| Оксиды | CO C3O2 C2O CO3 |
| Если не указано иное, данные даны для материалов при стандартных условиях (25 °C, 100 кПа) Infobox disclaimer and references | |
Диокси́д углеро́да (двуо́кись углеро́да, углеки́слый газ, окси́д углеро́да (IV), диокси́д углеро́да, у́гольный ангидрид, углекислота́) — CO2, бесцветный газ со слегка кисловатым запахом и вкусом.
Концентрация углекислого газа в атмосфере Земли составляет 0,038 %.
Не следует путать с Диоксин.
| Изменение климата | Палеоклиматология • Эль-Ниньо • Геохимический цикл углерода • Протерозойское оледенение, Ледниковый период, Малый ледниковый период • Термальный максимум (Позднепалеоценовый термальный максимум, Последний ледниковый максимум) • Ледники |
|---|---|
| Глобальное потепление | Вырубка лесов • Противодействие изменению климата • Глобальная климатическая модель • Глобальное похолодание • Глобальное затемнение • Озоновая дыра • Парниковый эффект • Диоксид углерода • Парниковые газы • Межправительственная группа экспертов по изменению климата • Рамочная конвенция ООН об изменении климата (Киотский протокол) • Пик нефти • Возобновляемая энергия • Температурный тренд • Повышение уровня моря • Копенгагенский консенус |
Полезное
Смотреть что такое «Диоксид углерода» в других словарях:
ДИОКСИД УГЛЕРОДА — (син. углекислый газ, Д.у.) СО2, продукт окисления соединений, содержащих углерод. Д.у. образуется при дыхании организмов и при сжигании топлива, содержащего углерод, а также при извержении вулканов и выветривании карбонатных горных пород. При… … Экологический словарь
Диоксид углерода — (двуокись углерода, углекислый газ CO2) бесцветный газ, имеющий кисловатый запах; тяжелее воздуха; продукт полного сгорания углерода. В промышленности получают обжигом известняка при 900 1300°C. Применяют в производстве соды, сахара, пива,… … Российская энциклопедия по охране труда
диоксид углерода — (Е290) – бесцветный газ с кисловатым вкусом. Для промышленных нужд получают при обработке известняка кислотой. Используется для производства газированных напитков и в системах охлаждения холодильников. Жидкой углекислотой заправляют огнетушители … Универсальный дополнительный практический толковый словарь И. Мостицкого
диоксид углерода — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN carbon dioxide … Справочник технического переводчика
Диоксид углерода — двуокись углерода, угольный ангидрид, углекислый газ, СO2 бесцветный газ, плотность 1,98 кг/м3. При 20° С в 1 л H20 растворяется 0,88 л СO2. При 78,5° С превращается в белое снегообразное вещество (сухой лед). Жидкий СO2 получают при давлении 6… … Энциклопедический словарь по металлургии
ДИОКСИД УГЛЕРОДА — двуокись углерода, угольный ангидрид, углекислый газ, СO2 бесцветный газ, плотность 1,98 кг/м3. При 20° С в 1 л Н2O растворяется 0,88 л СО2. При 78,5° С превращается в белое снегообразное вещество (сухой лед). Жидкий СO2 получают при… … Металлургический словарь
диоксид углерода из карбонатов угля — Ндп. углекислота карбонатов Диоксид углерода, выделяющийся из карбонатов, содержащихся в минеральной массе угля, при обработке кислотами в установленных стандартом условиях. [ГОСТ 17070 87] Недопустимые, нерекомендуемые углекислота карбонатов… … Справочник технического переводчика
диоксид углерода в сверхкритическом состоянии — Состояние, при котором углекислый газ взаимодействует с молекулами воды [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN supercritical carbon dioxide … Справочник технического переводчика
Диоксид углерода из карбонатов угля — 92. Диоксид углерода из карбонатов угля Ндп. Углекислота карбонатов D. Karbonat Kohlendioxyd Е. Carbon dioxide in carbonates F. Dioxyde de charbon en charbonate Диоксид углерода, выделяющийся из карбонатов, содержащихся в минеральной массе угля,… … Словарь-справочник терминов нормативно-технической документации
Диоксид Углерода, Газ Углекислый (Carbon Dioxide) — бесцветный газ, образующийся в тканях в результате обмена веществ и переносимый с током крови в легкие, откуда он выдыхается при дыхании (увеличение концентрации этого газа в крови стимулирует процесс дыхания). В небольших количествах углекислый… … Медицинские термины
Диоксид углерода (углекислый газ): свойства, реакции, применение
Диоксид углерода – это углекислый газ CO₂ (двуокись углерода, углекислота), широко распространен в промышленных, пищевых сферах, при транспортировке замороженных (скоропортящихся) товаров. Рассмотрим: формулы, сферы применения, способы получения, как влияет на организм человека, где купить.
Что такое диоксид углерода
Диоксид углерода также известен, как Е290 (в международной регистрации пищевых добавок). В большой концентрации обладает кисловатым привкусом и запахом, плотность 1,977 г/л. Применяется в качестве регулятора кислотности, антиоксиданта, консерванта. Представляет собой нетоксичный (в допустимых дозах), инертный, негорючий, тяжелый бесцветный газ, также именуемый, как углекислый, двуокись/оксид углерода, угольный ангидрид (СО₂).
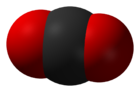
Строение молекулы углекислого газа:
Молекула углекислого газа
Физические свойства
Углекислый газ существует в жидком, газообразном и твёрдом состоянии, в виде белого «сухого льда». Особенность – стремительный переход из кристаллизованного состояния в газообразное, минуя стадию жидкости. Цвет и запах ощутим только в условиях высокой концентрации СО₂. Газ двуокись углерода тяжелее воздуха, устойчива к термическому воздействию, поэтому в привычных атмосферных условиях испаряется, а не плавится. Сублимируется при 78°С. В жидкости не растворяется, частично контактирует с ней.
Формула и свойства
Традиционная формула углекислого газа: CO2, масса: 44 г/моль.
Инертную окись относят к оксидным кислотам.
Следовательно, углекислый газ обладает 4 важнейшими свойствами:
Свойства позволяют диоксиду углерода обладать несколькими формами. Например: при традиционном давлении атмосферы элемент существует в форме газа. Охлаждение океанскими глубинами трансформирует СО₂ в жидкое состояние, а заморозка – кристаллизует, формируя лёд. Резкое нагревание стимулирует испарение и восстановление газообразной формы.
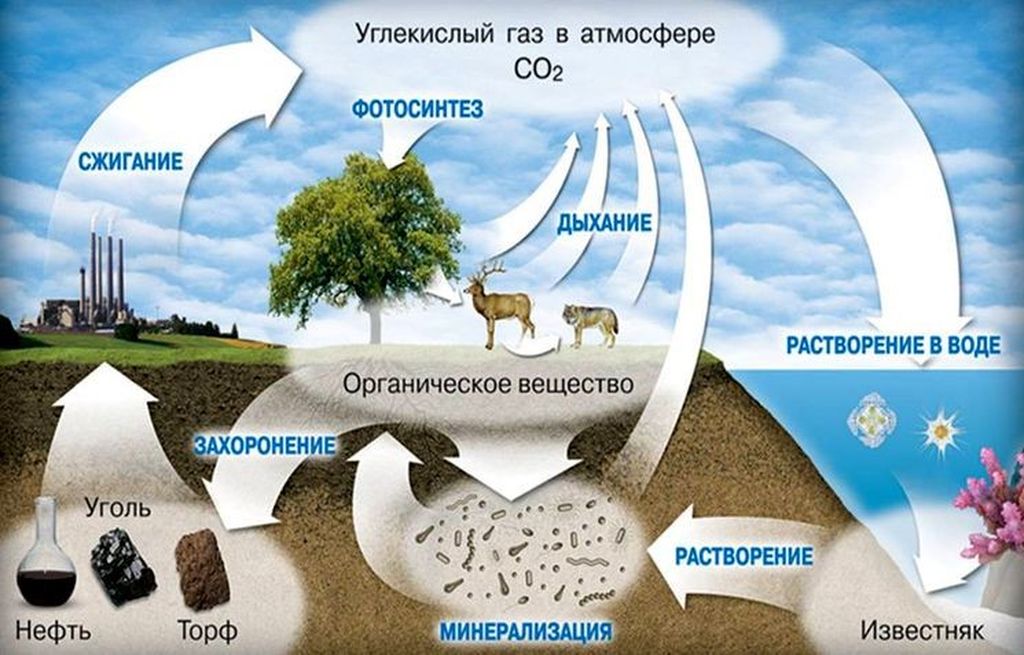
Углекислый газ в атмосфере и природе
В окружающей среде газ СО₂ образуется несколькими источниками: природой, человеком, животными:
Важно! В сутки человеческий организм выделяет в атмосферу 0,03% углерода = 1 кг СО2
Формирование газа диоксида углерода в недрах земли и выведение СО2 в атмосферу живыми существами взаимосвязано. Первоначально органические вещества (выделяемые животными, известняки) минерализуются, превращаясь в ископаемые, хранящиеся в недрах земли веками. Затем уголь, нефть, торф используются перерабатывающими станциями и выделяют в атмосферу СО2.
Также люди, животные, растения, поглощая кислород, выводят в воздух газообразный диоксид углерода, растворяющийся в морях и океанах, превращающийся в известняк.
Считается, что избыток углекислого газа – это причина климатических изменений в мире, ведь она провоцирует парниковый эффект. Следовательно, солнечное излучение беспрепятственно попадает на поверхность почвы и задерживается в атмосфере. Возникает тепловой эффект, плавящий ледники, повышающий уровень моря.
Последствия климатических изменений и повышенного количества СО2:
Больше всех пострадает человечество: уменьшится территория для жизнедеятельности, которая станет менее комфортной. Способ спастись – снизить выбросы диоксида углерода, путём минимизации выработки углекислоты на производстве и переходом на экологический транспорт.
Получение углекислоты
Кроме получения газа СО₂ природными способами, его также добывают лабораторно и в промышленности для применения в пищевой, медицинской и др. индустриях.
Лабораторные способы
Лаборатории изготавливают небольшие партии углекислого газа, путём вытеснения воздуха при взаимодействии соли, мрамора, мела с соляной кислотой:
CaCO₃ + 2HCl → CaCl₂+ H₂O + CO₂, NaHCO₃+ HCl → NaCl + H₂O + CO₂
Промышленное производство
Диоксид углерода получают при отделении азота, кислорода, аргона при обжиге промышленных отходов (дыма). Это наивыгодный способ добычи газа углекислоты. Моноэтаноламин адсорбируют, путем подачи в дымовую трубу. Частицы впитывают углекислый газ и подаются в специальные резервуары, где при определённом давлении и температурных показателях высвобождаются (из моноэтаноламина). Так получают диоксид углерода в газообразной форме.
Получение углеродного оксида в жидком состоянии выполняют, путём брожения сырья (при изготовлении алкоголя). Тогда полученные газы обрабатывают углем, перманганатом калия и водородом.
Добыча углерода в сухой форме производится на ликеро-водочных заводах, пивоварнях. Сложный и продолжительный процесс, выполняющийся в несколько этапов:
Полученный высококачественный диоксид углерода направляется на предприятия для дальнейшего применения, в качестве охладителя, в виде белоснежного «сухого льда».
Химические реакции с диоксидом углерода, соединения
Сам по себе углерод не горюч, не активен, но реагирует с другими веществами, позволяя получить новые вещества, используемые практически во всех сферах промышленности.
Благородные газы: ксенон, аргон, гелий и пр. не вступают в реакцию с двуокисью углерода, из-за несовместимого молекулярного строения этих газов.
Применение углерода
Пищевая добавка Е290 (углекислый газ) разрешается для использования в пищевой индустрии, в качестве консерванта, регулятора кислотности, антиоксиданта, газификации напитков (алкогольных и безалкогольных). Также, растворенные частицы углекислоты в воде, оказывают обеззараживающее и антибактериальное действие.
Пищевая промышленность
В хлебобулочном производстве пищевая добавка Е290 является разрыхлителем, придающим изделиям пышность и объём. В виноделии угольная кислота – регулятор брожения.
Углекислый газ в кристаллизованной форме применяют для транспортировки и хранения пищевых продуктов.
Пищевая добавка Е290 в оптимальных количествах не воздействует негативно на организм, поэтому может применяться для изготовления пищевых продуктов.
Химическая промышленность
Химическая отрасль использует СО₂ для регуляции температуры реактора, изготовления синтетических, химических веществ, нейтрализации щёлочи сточных вод и увеличения их проводимости, сушки\очистки полимеров растительного, животного происхождения.
Медицина, косметология
В лечебных целях углекислый газ применяют для стимуляции углублённого дыхания, криоабляции злокачественных опухолей.
В дерматокосметологии диоксид углерода вводят подкожно для расщепления липидов. Попадая в дерму изотонический раствор, вступает в реакцию с углекислотой, распадается на гидрокарбонаты и ионы водорода, приводя к сжиганию жиров. Остатки СО₂ вызывают нехватку кислорода, стимулируя улучшение кровотока и обмена веществ.
Металлургия
Металлургия применяет углекислоту для защиты окружающей среды от вредных выбросов в атмосферу:
Металлургическая отрасль использует лазеры для резки металлов, устройства заправляют жидким углекислым газом. Так, диоксид углерода выступает ещё и топливом для металлургического оборудования.
Лабораторные исследования
Подвижный диоксид углерода (стадия между жидкой и газообразной) применяется для экстрагирования и хроматографического анализа.
Полиграфия
Углекислый газ применяют для регуляции pH переработанного сырья, отбеливания древесины, целлюлозы для качественного изготовления тетрадей и белоснежных листов. А также для улучшения производительности оборудования, нейтрализации талового масла.
Электроника
Диоксид углерода в электронике применяется при испытательных проверках воздействия электронного оборудования на окружающую среду. Также для увеличения проводимости, обработки сточных вод, устранения фототвердеющих частиц из кристаллических пластин, чтобы избежать применения растворителей органического типа.
Охрана окружающей среды
Углекислый газ используется в качестве альтернативы серной кислоты для поддержания pH в сточных водах.
Влияние на человеческий организм
Углекислый газ – это конечный продукт метаболизма, возникающий при глюкозно-жировом расщеплении. Гемоглобин переносит его к лёгким, откуда выводится в воздух. Скопление в организме приводит к расширению капилляр, увеличению кровотока, переизбытку кислорода.
Польза углекислого газа
Именно диоксид углерода возбуждает дыхательную систему, поэтому очередной вдох регулируется количеством углекислоты. При вдохе происходит обмен – поступление кислорода и выделение углекислого газа.
Примечание! Кислород при помощи гемоглобина транспортируется по клеткам, а отходы (в виде газа СО₂) переносятся им же в дыхательную систему для выведения.
Процессы, в которых участвует газ СО₂:
Углекислый газ помогает кислороду высвобождаться и проникать в клетки организма. Недостаток СО₂ влечет затрудненное дыхание, ощущение нехватки кислорода, вялость, плохое самочувствие, сбой работе всего организма.
Организм нуждается в углекислоте наравне с кислородом, но его нехватка или переизбыток влечёт серьёзные проблемы, такие как:
В норме газы О₂ и СО₂ крепятся по разные стороны гемоглобина и двигаются по телу, насыщая нужными веществами и забирая отработанные. Переизбыток СО₂ нарушает способность красных кровяных телец прикреплять кислород, из–за чего питательные вещества перестают насыщать клетки.
Повышенная концентрация газа СО₂ встречается в шахтах и в быту, особенно в осенне–весенний период, когда помещения проветриваются реже.
Считается, что напитки, содержащие в составе углекислый газ, вымывают кальций и нарушают обмен веществ, поэтому противопоказаны людям с заболеваниями желудочно-кишечного тракта (язва, гастрит и пр.)
Тип пищевой добавки
Пищевая добавка Е290 – это консервант, продлевает срок хранения продуктов, используется, как разрыхлитель, антибактериальное средство, регулятор кислотности.
Класс опасности и токсичности
Углекислый газ – это невзрывоопасное, негорючее, не поддерживающее горение вещество. В газообразной форме в 1,5 раза тяжелее воздуха, поэтому скапливается в шахтах, тоннелях, ямах, внутри подземного оборудования.
При контакте кожного покрова с углекислотой возможно покалывание пораженного участка, краснота, ощущение теплоты, вплоть до обморожения. Медленное согревание холодной водой приводит к прогрессированию болезни внешним источником холода.
Горячая вода может вызвать ожог пораженной области, в связи с частичной\полной потери температурной чувствительности дермы. Немедленно обратитесь к врачу!
Резервуары с газом СО₂ могут взрываться при воздействии высоких температур, ударах и сублимации сжиженной кислоты, разгерметизации баллона.
Хранение и транспортировка углекислого газа
Баллоны высокого давления с углекислым газом хранят в специализированных складских помещениях и огражденных площадках, оснащенных навесом, препятствующим контакту резервуаров с солнечными лучами и осадками. Хранить, не более 1 года со дня изготовления.
Низкотемпературный диоксид углерода с жидким веществом хранят в изотермических цистернах. Срок хранения 6 месяцев с момента изготовления.
Углекислый газ в баллонах
Транспортировка углекислого газа относится ко 2-му классу опасности. Требуется строгое соблюдение правил безопасности: не бросать, не бить! Во избежание повреждения баллона, утечки газа и, как следствие взрыва!
Где купить, сколько стоит диоксида углерода
Приобрести углекислый газ в промышленных целях, можно:
Покупая у завода или дистрибьютора, вы оформите заказ на нужное количество сжиженного углекислого газа. Доставку организует отправитель, соблюдая технику безопасности. Стоимость договорная. Оговаривается непосредственно при формировании заказа, отталкиваясь от формы вещества (жидкая\«сухой лёд») и величины заказа.
Углекислый газ не оказывает негативного воздействия на организм, если употреблять в разумном количестве. Соединяется со многими элементами, помогая создать новые вещества, используемые в быту и промышленности.
Заключение
Углекислый газ имеет много названий: диоксид углерода, углекислота, двуокись углерода др. Газ СО₂ имеет много полезных и опасных свойств, применяется в пищевой и химической промышленности, медицине, металлургии и других сферах.
Углекислый газ не оказывает негативного воздействия на организм, если употреблять в разумном количестве. Вступает в реакции со многими элементами, помогая создать новые вещества, используемые в быту, промышленности. Хоть СО2 считается невзрывоопасным, относитесь к цистернам и баллонам бережно. Сегодня важно сократить производство диоксида, выбрасываемого в воздух (во избежание климатической катастрофы), поэтому ученые активно разрабатывают электромобили. Чем быстрей население перейдёт на экологический транспорт, тем быстрей климат нормализуется, и перестанут таять ледники.


