Дипроспан не помогает что делать
БОЛИ В СПИНЕ: болезненный мышечный спазм и его лечение миорелаксантами
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны
Боли в спине — одна из наиболее распространенных жалоб, которые пациенты предъявляют в общемедицинской практике. Часто они вызываются остеохондрозом позвоночника — дегенеративным поражением хряща межпозвонкового диска и реактивными изменениями со стороны тел смежных позвонков. Поражение межпозвонкового диска развивается вследствие его повторных травм (подъем тяжести, избыточная статическая и динамическая нагрузка, падения и др.) и возрастных дегенеративных изменений. Студенистое ядро, центральная часть диска, высыхает и частично утрачивает амортизирующую функцию. Фиброзное кольцо, расположенное по периферии диска, истончается, в нем образуются трещины, к которым смещается студенистое ядро, образуя выпячивание (пролапс), а при разрыве фиброзного кольца — грыжу. В настоящее время созданы препараты, оказывающие структурно-модифицирующее действие на хрящевую ткань (старое название — хондропротекторы). Типичным представителем группы является препарат хондро, назначаемый курсом по 4 месяца (эффект сохраняется 2 месяца после отмены). В пораженном позвоночном сегменте возникает относительная нестабильность позвоночника, развиваются остеофиты тел позвонков (спондилез), повреждаются связки и межпозвонковые суставы (спондилоартроз). Грыжи межпозвонковых дисков наиболее часто наблюдаются в нижних поясничных дисках, реже — в нижних шейных и верхних поясничных, крайне редко — в грудных. Грыжи диска в тело позвонка (грыжи Шморля) клинически не значимы, грыжи диска в заднем и заднебоковом направлении могут вызвать сдавление спинно-мозгового корешка (радикулопатию), спинного мозга (миелопатию на шейном уровне) или их сосудов.
Кроме компрессионных синдромов возможны рефлекторные (мышечно-тонические), которые обусловлены импульсацией из рецепторов в ответ на изменения в дисках, связках и суставах позвоночника — болезненный мышечный спазм. Рефлекторное напряжение мышц вначале имеет защитный характер, поскольку приводит к иммобилизации пораженного сегмента, однако в дальнейшем этот фактор становиться причиной возникновения боли. В отличие от компрессионных синдромов остеохондроза позвоночника, которые встречаются относительно редко, болевые мышечные спазмы возникают в течение жизни практически у каждого второго человека.
Классический пример болезненного мышечного спазма представляет люмбаго (поясничный прострел), который характеризуется резкой, простреливающей болью в пояснице, развивающейся, как правило, при физической нагрузке (подъем тяжести и др.) или неловком движении. Больной нередко застывает в неудобном положении, попытка движения приводит к усилению боли. При обследовании выявляют напряжение мышц спины, обычно сколиоз, уплощение поясничного лордоза или кифоз.
Люмбалгия — боль в спине — и люмбоишиалгия — боль в спине и по задней поверхности ноги — развиваются чаще после физической нагрузки, неловкого движения или переохлаждения, реже — без каких-либо причин. Боли носят ноющий характер, усиливаются при движениях в позвоночнике, определенных позах, ходьбе. Для люмбоишиалгии характерна боль в ягодице, в задненаружных отделах ноги, не достигающая пальцев. При обследовании выявляют болезненность, напряжение мышц спины и задней группы мышц ноги, ограничение подвижности позвоночника, часто сколиоз, симптомы натяжения (Ласега, Вассермана и др.).
На шейном уровне могут возникать рефлекторные мышечно-тонические синдромы: цервикалгия и цервикобрахиалгия, которые чаще развиваются после физической нагрузки или неловкого движения шеи. Цервикалгия — боль в шейной области, которая нередко распространяется на затылок (цервикокраниалгия). Цервикобрахиалгия — боль в шейной области, распространяющаяся на руку. Характерно усиление болей при движениях в шее или, наоборот, при длительном статическом положении (в кино, после сна на плотной высокой подушке и др.). При обследовании выявляют напряжение шейных мышц, часто наблюдается ограничение движений в шейном отделе, болезненность при пальпации остистых отростков и межпозвонковых суставов на стороне боли.
При компрессии нервного корешка (радикулопатии) кроме болезненного мышечного спазма и ограничений подвижности в позвоночнике и конечностях выявляются чувствительные, рефлекторные и (или) двигательные нарушения в зоне пораженного корешка. На поясничном уровне чаще поражаются пятый поясничный (L5) и первый крестцовый (S1) корешки, реже — четвертый поясничный корешок и очень редко — верхние поясничные корешки. Радикулопатии нижних шейных корешков встречаются значительно реже.
Важно помнить, что боли в спине могут быть единственным симптомом при опухоли спинного мозга, сирингомиелии и других заболеваниях спинного мозга. Боли возникают при деструкции позвонков и поражении нервных корешков вследствие инфекционных процессов (туберкулезный спондилит, спинальный эпидуральный абсцесс), новообразованиях (первичные и метастатические опухоли позвоночника, миеломная болезнь), дисметаболических нарушениях (остеопороз, гиперпаратиреоз, болезнь Педжета). Боль в спине может быть следствием перелома позвоночника, его врожденных или приобретенных деформаций (сколиоза и др.), стеноза позвоночного канала, спондилолистеза, анкилозирующего спондилоартрита.
Она возможна при различных соматических заболеваниях (сердца, желудка, поджелудочной железы, почек, органов малого таза и др.) по механизму отраженных болей.
Обследование пациента с болью в спине требует тщательности. Нельзя любые боли в спине списывать на «остеохондроз» — состояние, которое при рентгенологическом исследовании выявляется у большинства людей среднего и пожилого возраста. Для неврологических проявлений остеохондроза позвоночника и миофасциальных болей характерны болезненный мышечный спазм и ограничение подвижности позвоночника.
Диагноз рефлекторных и компрессионных осложнений остеохондроза основывается на клинических данных и требует исключения других возможных причин болей в спине. Рентгенографию позвоночника используют, в основном, для исключения врожденных аномалий и деформаций, воспалительных заболеваний (спондилитов), первичных и метастатических опухолей. Рентгеновская КТ или МРТ позволяет выявить грыжу диска, определить ее размеры и локализацию, а также обнаружить стеноз позвоночного канала, опухоль спинного мозга.
Диагноз миофасциальных болей основывается на клинических данных (выявление болезненного мышечного напряжения одной или нескольких мышц) и требует исключения других возможных причин боли; дифференциальный диагноз с рефлекторными синдромами (мышечно-тоническими синдромами) вследствие остеохондроза позвоночника часто вызывает сложности; возможно сочетание этих заболеваний.
Лечение рефлекторных синдромов и радикулопатий вследствие остеохондроза основывается в остром периоде на обеспечении покоя — больному рекомендуется избегать резких наклонов и болезненных поз. Предписаны постельный режим в течение нескольких дней до стихания резких болей, жесткая постель (щит под матрац), прием миорелаксантов центрального действия, при необходимости — также дополнительно анальгетиков, нестероидных противовоспалительных средств. Для облегчения передвижения в этот период следует надеть шейный или поясничный корсет (фиксирующий пояс). Можно использовать физиотерапевтические анальгезирующие процедуры, втирание обезболивающих мазей, компрессы с 30–50-процентным раствором димексида и новокаином, новокаиновые и гидрокортизоновые блокады. При ослаблении болей рекомендуют постепенное увеличение двигательной активности и упражнения на укрепление мышц.
При хроническом течении рефлекторных синдромов и радикулопатий могут быть эффективны мануальная терапия, рефлексотерапия, физиотерапевтическое лечение, санаторно-курортное лечение. Хирургическое лечение (удаление грыжи диска) необходимо в тех редких случаях, когда возникает сдавление спинного мозга или корешков конского хвоста. Хирургическое лечение также показано при дискогенной радикулопатии, сопровождающейся выраженным парезом, и при длительном (более трех-четырех месяцев) отсутствии эффекта от консервативного лечения и наличии большой грыжи диска. Для профилактики обострений остеохондроза рекомендуют избегать провоцирующих факторов (подъем больших грузов, ношение тяжелой сумки в одной руке, переохлаждение и др.), регулярно заниматься лечебной гимнастикой.
При миофасциальных болях необходимо, чтобы мышца находилась в покое в течение нескольких дней. В качестве лечения можно назначать упражнения на растяжение мышц (постизометрическая релаксация), физиотерапию, рефлексотерапию или местное введение анестетиков в триггерные зоны, компрессы с димексидом и анестетиками.
Как уже было отмечено, и при острых болях, и при хронических болевых синдромах большое значение имеет лечение болезненного мышечного спазма. Тоническое напряжение мышц может не только само по себе быть причиной боли, но и способно вызвать деформацию и ограничивать подвижность позвоночника, а также обуславливать компрессию проходящих вблизи нервных стволов и сосудов. Для его лечения помимо нестероидных противовоспалительных средств, анальгетиков, (например, нимулид в форме трансдермального геля для местной терапии или в форме лингвальных таблеток при остром болевом синдроме), физиотерапии и лечебной гимнастики в качестве препаратов первого ряда применяют миорелаксанты — препараты, способные разорвать «порочный круг» болевого синдрома [2].
Для лечения болезненного мышечного спазма миорелаксанты используются внутрь или парентерально. Снижая рефлекторное мышечное напряжение, миорелаксанты уменьшают боль, улучшают двигательные функции и облегчают проведение лечебной физкультуры. Лечение миорелаксантами начинают с обычной терапевтической дозы и продолжают до тех пор, пока сохраняется болевой синдром; как правило, курс лечения составляет несколько недель. В ходе целого ряда исследований удалось доказать, что при болезненном мышечном спазме добавление к стандартной терапии (нестероидные противовоспалительные средства, анальгетики, физиотерапия, лечебная гимнастика) миорелаксантов приводит к более быстрому регрессу боли, мышечного напряжения и улучшению подвижности позвоночника.
В качестве миорелаксантов применяются мидокалм, баклофен и сирдалуд. Миорелаксанты обычно не комбинируют друг с другом. Для снятия болезненных мышечных спазмов можно также использовать диазепам (седуксен, реланиум) в индивидульно подобранной дозе.
Сирдалуд (тизанидин) — агонист α-2 адренергических рецепторов. Препарат снижает мышечный тонус вследствие подавления полисинаптических рефлексов на уровне спинного мозга, что может быть вызвано угнетением высвобождения возбуждающих аминокислот и активацией глицина, снижающего возбудимость интернейронов спинного мозга; сирдалуд обладает также умеренным центральным анальгезирующим действием. При приеме внутрь максимальная концентрация сирдалуда в крови достигается через час, прием пищи не влияет на его фармакокинетику. Начальная доза препарата составляет 6 мг в сутки в три приема, средняя терапевтическая доза — 12—24 мг в сутки, максимальная доза — 36 мг в сутки. В качестве побочных эффектов отмечаются сонливость, головокружение, незначительное снижение артериального давления; требуется осторожность при приеме препарата больными пожилого возраста.
Мидокалм (толперизон) в течение длительного времени широко используется при лечении рефлекторных и компрессионных осложнений дегенеративно-дистрофических изменений позвоночника (остеохондроз, спондилез, спондилоартроз) и миофасциальных болей [3]. Мидокалм оказывает преимущественно центральное миорелаксирующее действие. Снижение мышечного тонуса при приеме препарата связывается с угнетающим влиянием на каудальную часть ретикулярной фармации и подавлением спинно-мозговой рефлекторной активности. Препарат обладает умеренным центральным анальгезирующим действием и легким сосудорасширяющим влиянием. Прием мидокалма начинают с 150 мг в сутки три раза в день, постепенно увеличивая дозу до получения эффекта, у взрослых обычно до 300—450 мг в сутки. Для быстрого эффекта препарат вводится внутримышечно по 1 мл (100 мг) два раза в сутки или внутривенно по 1 мл один раз в сутки.
Эффективность и безопасность применения мидокалма при болезненном мышечном спазме доказана в ходе двойного слепого плацебо-контролируемого исследования [4]. В восьми исследовательских центрах 110 больных в возрасте от 20 до 75 лет методом рандомизации получали мидокалм в дозе 300 мг в сутки или плацебо в сочетании с физиотерапией и реабилитацией в течение 21 дня. В качестве объективного критерия эффективности лечения рассматривают болевой порог давления, измеряемый с помощью специального прибора (Pressure Tolerance Meter) в 16 симметричных точек туловища и конечностей. Кроме того, пациенты субъективно оценивали свое состояние по интенсивности боли, ощущению напряжения мышц и подвижности позвоночника; врач также оценивал напряжение мышц и подвижность позвоночника. Перед началом лечения и после его окончания проводилось развернутое клиническое и лабораторное обследование, включая ЭКГ, измерение артериального давления, биохимический анализ крови по 16 показателям.
Согласно результатам исследований, применение мидокалма достоверно снижает болезненный мышечный спазм, измеряемый объективно инструментальным методом. Различие между группами лечения и плацебо, которое отмечалось уже на четвертый день, постепенно увеличивалось и становилось статистически достоверным на 10-й и 21-й дни лечения, которые были выбраны в качестве конечных точек для доказательного сравнения. Анализ субъективной оценке результатов лечения, данной врачами и пациентами после его окончания (через 21 день), показал, что в группе больных, получавших мидокалм, достоверно чаще результаты лечения оценивались как очень хорошие, тогда как в группе плацебо эффект существенно чаще отсутствовал. Согласно субъективной оценке результатов лечения, данной больными после его окончания (через 21 день), каких-либо значимых различий, касающихся переносимости мидокалма и плацебо, выявлено не было. У подавляющего большинства больных отмечалась хорошая переносимость мидокалма. Результаты ЭКГ, биохимические и гематологические показатели в группе пациентов, принимавших как мидокалм, так и плацебо, также не различались.
Важно отметить, что более половины (62%) пациентов, включенных в исследование, получали другие виды терапии до начала исследования, и у большинства из них (68%) при этом не отмечалось улучшения. Это свидетельствует об эффективности мидокалма в лечении болезненного мышечного спазма, резистентного к другим видам терапии.
Введение мидокалма парентерально позволяет быстро снять боль и уменьшить мышечное напряжение. При вертеброгенном мышечно-тоническом синдроме внутримышечное введение 100 мг мидокалма ослабляет боль уже через 1,5 ч, а лечение мидокалмом в течение недели по 200 мг/сут в/м, а затем на протяжении двух недель по 450 мг/сут перорально имеет достоверное преимущество над стандартной терапией; при этом терапия мидокалмом не только позволяет уменьшить боль, но и снимает тревожность, повышает умственную работоспособность [1].
При болезненном мышечном спазме достоинствами мидокалма помимо эффективного миорелаксирующего и обезболивающиего эффекта являются отсутствие побочных эффектов и хорошее взаимодействие с нестероидными противовоспалительными средствами, что во многих случаях позволяет уменьшить дозу последних и вследствие этого ослабить или даже полностью устранить их побочные эффекты, не снижая эффективности лечения.
Важным преимуществом мидокалма перед другими миорелаксантами является отсутствие седативного эффекта и мышечной слабости при его приеме. Это преимущество доказано в ходе двойного слепого плацебо-контролируемого исследования [5]. В исследовании вошли 72 здоровых добровольца в возрасте от 19 до 27 лет (средний возраст — 21,7 лет). Исследование проводилось в течение восьми дней, все это время добровольцы методом рандомизации получали 150 или 450 мг мидокалма в сутки в три приема либо плацебо — также в три приема. Нейропсихологические исследования осуществляются утром в первый и последний (восьмой) дни исследования до и после приема мидокалма через 1,5, 4 и 6 ч либо плацебо. Результаты исследования не показали каких-либо существенных различий в скорости сенсомоторных реакций и быстроте выполнения различных психологических тестов через 1,5, 4 и 6 ч после приема мидокалма в дозе 50 или 150 мг либо плацебо. Аналогичные исследования, проведенные на восьмой день с начала приема мидокалма, также не показали существенных различий в сравнении с группой плацебо. Это свидетельствует о хорошей переносимости мидокалма и возможности назначения его в тех случаях, когда по роду деятельности пациенту требуется сохранить быстроту реакций и способность концентрировать внимание, в том числе при вождении автомобиля.
Таким образом, болезненный мышечный спазм представляет собой одну из наиболее распространенных причин болей в спине (вследствие рефлекторных синдромов остеохондроза или миофасциальных болей). В таких случаях рекомендуется применение миорелаксантов в комбинации с различными лекарственными средствами, физиотерапией и лечебной гимнастикой. В последние годы доказана эффективность и безопасность миорелаксанта мидокалма, который не вызывает седативного эффекта и выпускается в форме для парентерального введения с целью быстрого купирования болевого синдрома.
Литература.
В. А. Парфенов, доктор медицинских наук, профессор ММА им. И. М. Сеченова
Т. Т. Батышева, кандидат медицинских наук Поликлиника восстановительного лечения №7 Москвы
Терапия острых аллергических состояний на догоспитальном этапе
К острым аллергическим заболеваниям относят анафилактический шок, обострение (приступ) бронхиальной астмы, острый стеноз гортани, отек Квинке, крапивницу, обострение аллергического конъюнктивита и/или аллергического ринита. Считается, что аллергическими
К острым аллергическим заболеваниям относят анафилактический шок, обострение (приступ) бронхиальной астмы, острый стеноз гортани, отек Квинке, крапивницу, обострение аллергического конъюнктивита и/или аллергического ринита. Считается, что аллергическими заболеваниями страдает в среднем около 10% населения земного шара. Особую тревогу вызывают данные ННПО скорой медицинской помощи, согласно которым за последние 3 года число вызовов по поводу острых аллергических заболеваний в целом по РФ возросло на 18%.
Основные причины возникновения и патогенез
Патогенез аллергических реакций на сегодняшний день достаточно полно изучен и подробно описан во многих отечественных и зарубежных монографиях по аллергологии и клинической иммунологии. Центральная роль в реализации иммунопатологических реакций принадлежит иммуноглобулинам класса Е (IgE), связывание которых с антигеном приводит к выбросу из тучных клеток медиаторов аллергии (гистамина, серотонина, цитокинов и др.).
Наиболее часто аллергические реакции развиваются при воздействии ингаляционных аллергенов жилищ, эпидермальных, пыльцевых, пищевых аллергенов, лекарственных средств, антигенов паразитов, а также при укусах насекомых. Лекарственная аллергия чаще всего развивается при применении анальгетиков, сульфаниламидов и антибиотиков из группы пенициллинов, реже цефалоспоринов (при этом следует учитывать риск перекрестной сенсибилизации к пенициллину и цефалоспоринам, составляющий от 2 до 25%). Кроме того, в настоящее время возросло число случаев развития латексной аллергии.
Клиническая картина, классификация и диагностические критерии
С точки зрения определения объема необходимой лекарственной терапии на догоспитальном этапе оказания помощи и оценки прогноза острые аллергические заболевания можно подразделить на легкие (аллергический ринит — круглогодичный или сезонный, аллергический конъюнктивит — круглогодичный или сезонный, крапивница), средней тяжести и тяжелые (генерализованная крапивница, отек Квинке, острый стеноз гортани, среднетяжелое обострение бронхиальной астмы, анафилактический шок). Классификация и клиническая картина острых аллергических заболеваний представлены в табл. 1.
При анализе клинической картины аллергической реакции врач СМП должен получить ответы на следующие вопросы (табл. 2).
При начальном осмотре на догоспитальном этапе следует оценить наличие стридора, диспноэ, свистящего дыхания, одышки или апноэ; гипотензии или синкопе; изменений на коже (высыпаний по типу крапивницы, отека Квинке, гиперемии, зуда); гастроинтестинальных проявлений (тошноты, болей в животе, диареи); изменений сознания. Если у больного отмечаются стридор, выраженная одышка, гипотензия, аритмия, судороги, потеря сознания или шок, то данное состояние рассматривается как угрожающее жизни.
Лечение острых аллергических заболеваний
При острых аллергических заболеваниях на догоспитальном этапе неотложная терапия строится по следующим направлениям:
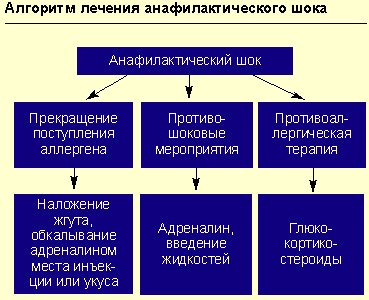
Прекращение дальнейшего поступления в организм предполагаемого аллергена.
Например, в случае реакции на лекарственный препарат, введенный парентерально, или при укусах насекомых — наложение жгута выше места инъекции (или укуса) на 25 мин (каждые 10 мин необходимо ослаблять жгут на 1-2 мин); к месту инъекции или укуса прикладывается лед или грелка с холодной водой на 15 мин; обкалывание в 5-6 точках и инфильтрация места инъекции или укуса 0,3-0,5 мл 0,1%-ного раствора адреналина с 4,5 мл изотонического раствора хлорида натрия.
Противоаллергическая терапия (антигистаминными препаратами или глюкокортикостероидами).
Введение антигистаминных препаратов (блокаторов Н1-гистаминовых рецепторов) показано при аллергическом рините, аллергическом конъюнктивите, крапивнице. Выделяют классические антигистаминные препараты (например, супрастин, димедрол) и препараты нового поколения (семпрекс, телфаст, кларотадин и др.). Необходимо отметить, что для классических антигистаминных препаратов в отличие от препаратов нового поколения характерно короткое время воздействия при относительно быстром наступлении клинического эффекта; многие из этих средств выпускаются в парентеральных формах. Антигистаминные препараты нового поколения лишены кардиотоксического действия, конкурентно влияют на гистамин, не метаболизируются печенью (например, фармакокинетика семпрекса не меняется даже у больных с нарушенными функциями печени и почек) и не вызывают тахифилаксии. Эти препараты обладают длительным воздействием и предназначаются для приема внутрь.
При анафилактическом шоке и при отеке Квинке (в последнем случае — препарат выбора) внутривенно вводится преднизолон (взрослым — 60-150 мг, детям — из расчета 2 мг на 1 кг массы тела). При генерализованной крапивнице или при сочетании крапивницы с отеком Квинке высокоэффективен бетаметазон (дипроспан в дозе 1-2 мл внутримышечно), состоящий из динатрия фосфата (обеспечивает быстрое достижение эффекта) и дипропионата бетаметазона (обусловливает пролонгированное действие). Для лечения бронхиальной астмы, аллергического ринита, аллергического конъюнктивита разработаны топические формы глюкокортикостероидов (флутиказон, будесонид). При отеке Квинке для предупреждения влияния на ткани гистамина необходимо комбинировать антигистаминные препараты нового поколения (семпрекс, кларитин, кларотадин) с глюкокортикостероидами (ГКС).
Побочные эффекты системных ГКС — артериальная гипертензия, повышенное возбуждение, аритмия, язвенные кровотечения. Побочные эффекты топических ГКС — осиплость голоса, нарушение микрофлоры с дальнейшим развитием кандидоза слизистых, при применении высоких доз — атрофия кожи, гинекомастия, прибавка массы тела и др. Противопоказания: язвенная болезнь желудка и 12-перстной кишки, тяжелая форма артериальной гипертензии, почечная недостаточность, повышенная чувствительность к глюкокортикоидам в анамнезе.
Симптоматическая терапия.
При развитии бронхоспазма показано ингаляционное введение b2-агонистов и других бронхолитических и противовоспалительных препаратов (беродуала, атровента, вентолина, пульмикорта) через небулайзер. Коррекцию артериальной гипотонии и восполнение объема циркулирующей крови проводят с помощью введения солевых и коллоидных растворов (изотонического раствора хлорида натрия — 500-1000 мл, стабизола — 500 мл, полиглюкина — 400 мл). Применение вазопрессорных аминов (допамина — 400 мг на 500 мл 5%-ной глюкозы, норадреналина — 0,2-2 мл на 500 мл 5%-ного раствора глюкозы, доза титруется до достижения уровня систолического давления 90 мм рт. ст.) возможно только после восполнения ОЦК. При брадикардии допускается введение атропина в дозе 0,3-0,5 мг подкожно (при необходимости инъекцию повторяют каждые 10 мин). При наличии цианоза, диспноэ, сухих хрипов показана также кислородотерапия.
Противошоковые мероприятия (см. рисунок).
При анафилактическом шоке больного следует уложить (голова ниже ног), повернуть голову в сторону (во избежание аспирации рвотных масс), выдвинуть нижнюю челюсть (при наличии съемных зубных протезов их нужно удалить).
Адреналин вводят подкожно в дозе 0,1-0,5 мл 0,1%-ного раствора (препарат выбора), при необходимости инъекции повторяют каждые 20 мин в течение часа под контролем уровня АД. При нестабильной гемодинамике с развитием непосредственной угрозы для жизни возможно внутривенное введение адреналина. При этом 1 мл 0,1%-ного раствора адреналина разводится в 100 мл изотонического раствора хлорида натрия и вводится с начальной скоростью 1 мкг/мин (1 мл в минуту). При необходимости скорость может быть увеличена до 2-10 мкг/мин. Внутривенное введение адреналина проводится под контролем частоты сердечных сокращений, дыхания, уровня артериального давления (систолическое артериальное давление необходимо поддерживать на уровне более 100 мм рт. ст. у взрослых и более 50 мм рт. ст. у детей).
Побочные эффекты адреналина — головокружение, тремор, слабость; сильное сердцебиение, тахикардия, различные аритмии (в том числе желудочковые), появление болей в области сердца; затруднение дыхания; увеличение потливости; чрезмерное повышение артериального давления; задержка мочи у мужчин, страдающих аденомой предстательной железы; повышение уровня сахара в крови у больных сахарным диабетом. Описаны также случаи развития некрозов тканей при повторном подкожном введении адреналина в одно и то же место вследствие местного сужения сосудов. Противопоказания — артериальная гипертензия; выраженный церебральный атеросклероз либо органическое поражение головного мозга; ишемическая болезнь сердца; гипертиреоз; закрытоугольная глаукома; сахарный диабет; гипертрофия предстательной железы; неанафилактический шок; беременность. Однако даже при этих заболеваниях возможно назначение адреналина при анафилактическом шоке по жизненным показаниям и под строгим врачебным контролем.
Типичные ошибки, допускаемые на догоспитальном этапе
Изолированное назначение Н1-гистаминовых блокаторов при тяжелых аллергических реакциях, равно как и при бронхообструктивном синдроме, не имеет самостоятельного значения, и на догоспитальном этапе это лишь приводит к неоправданной потере времени; использование дипразина (пипольфена) опасно усугублением гипотонии. Использование таких препаратов, как глюконат кальция, хлористый кальций, вообще не показано при острых аллергических заболеваниях. Ошибочным следует считать также позднее назначение ГКС, необоснованное применение малых доз ГКС, отказ от использования топических ГКС и b2-агонистов при аллергическом стенозе гортани и бронхоспазме.
Показания к госпитализации
Пациенты с тяжелыми аллергическими заболеваниями должны быть обязательно госпитализированы.
А. Л. Верткин, доктор медицинских наук, профессор
А. В. Тополянский, кандидат медицинских наук