Для чего фиксируют мазки
Для чего фиксируют мазки
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.

Окрашенные мазки. Отбор материала для микроскопии
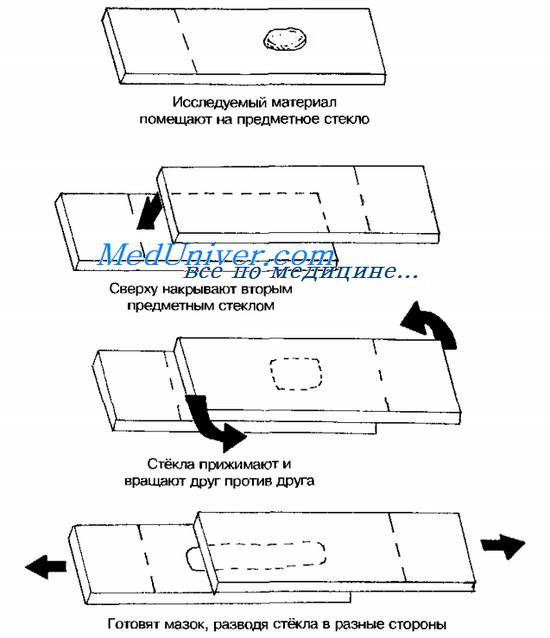
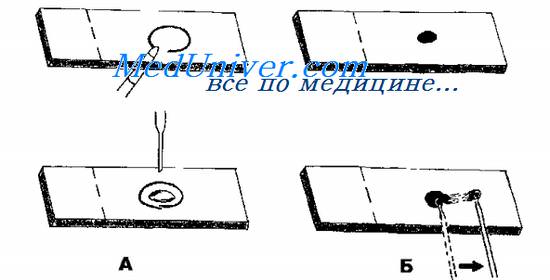
Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 11-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 11-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 11-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 11-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 11-10, Б).
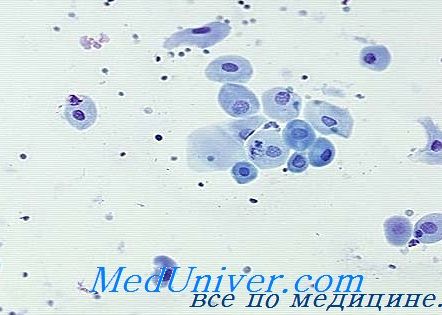
Фиксация препарата. Фиксация мазка. Фиксация бактерий
В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светоопти-ческой микроскопии используют формалин, спирты, глутараль-дегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др.
Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Для чего фиксируют мазки
Содержимое заднего свода влагалища для исследования берут браншей пинцета, узким деревянным шпателем или стеклянной пипеткей длиной 20 см, диаметром 5—7 мм с изогнутым дистальным концом и резиновым баллоном на проксимальном конце. Так как особенности влагалищного содержимого могут быть различными в зависимости от длительности пребывания во влагалище и особенностей его моторной функции, рекомендуется за 2 дня до взятия мазка механически очистить влагалище от содержимого и воздерживаться от влагалищных манипуляций и половых сношений. У девственниц содержимое влагалища берут проволочной петлей через ушное или носовое зеркало или с помощью детского вагиноскопа.
Предметные стекла для влагалищных мазков должны быть предварительно обезжирены. Мазок делают с помощью шлифопанного стекла. Он должен быть тонким. При скудном содержимом влагалища насасывают в пипетку до взятия мазка каплю изотонического раствора хлорида натрия и разведенные выделения наносят на стекло. Мазок фиксируют по влажном состоянии в течение 15 мин смесью 96% этилового спирта и диэтилового эфира (1 : 1). Мазок может оставаться в фиксирующем растворе в течение 15 дней.
При подготовке влагалищного мазка для полихромной окраски рН фиксирующего раствора снижают с 6,9—7 до 5,6—6, что способствует большей восприимчивости клеток к ацидофильной окраске. Для этого мазок фиксируют смесью из изопропилового спирта (97,5 части) и ледяной уксусной кислоты (2,5 части).
1. Упрощенный метод окраски. Высушенный на воздухе мазок окрашивают 1 % раствором метиленового синего в течение 2 мин или раствором фуксина (3 г фуксина+96 мл абсолютного спирта) в течение 1 мин. Краску смывают проточной водой и мазок высушивают.
2. Окраска гематоксилин-эозином. Фиксированный в смеси спирта с эфиром мазок окрашивают в течение 15 мин в растворе гематоксилина, смывают краску водой, окрашивают на протяжении 3—5 мин эозином и повторно смывают водой. Для обесцвечивания ядер мазок проводят последовательно через 70% (5 мин), 95% (5 мин) и 100% (8 мин) спирт, высушивают, помещают на 15 мин в ксилол и заключают в канадский бальзам.
3. Полихромная окраска. Применяются три краски — гематоксилин для окрашивания ядер клеток влагалищного эпителия, оранж 0,6 (ацидофильная) и зелень лихтгрюн Lumiere EA-31 (базофильная).
Фиксированный мазок проводят последовательно через 70% и 50% спирт, погружают в дистиллированную воду, окрашивают в течение 5— 10 мин гематоксилином. Промывают в дистиллированной воде, 4—5 раз в 0,5% водном растворе НСl, а затем проточной водой. На 1 мин мазок погружают в карбонат кальция (3 капли насыщенного водного раствора на 100 мл воды) и проводят последовательно через 50%, 70%, 80% и 95% спирт, в течение 3—4 мин окрашивают оранжем, проводят дважды через 95% спирт, погружают на 10—15 мин в краску ЕА-31, затем в 95% и абсолютный спирт и заключают в канадский бальзам.
Ядра влагалищных клеток окрашиваются интенсивно в светло-синие, темно-пурпурные тона, цитоплазма базофильных клеток — в голубовато-зеленоватые тона, цитоплазма ацидофильных клеток — в желтовато-оранжевые, розовато-красные тона.
Влажный фиксированный мазок окрашивают специальным сложным составом из ряда красок в течение 2 мин. Последовательно проводят мазок через 70%, 90% и абсолютный спирт, помещают в ксилол и заключают в канадский бальзам.
Состав краски: а) этилового спирта 100 мл, шарлаха бибиховского 0,5 г, оранжа 0,25 г, зеленой 0,075 г, фосфорно-молибденовой кислоты 0,5 мл, фосфорно-вольфрамовой кислоты 0,5 мл, ледяной уксусной кислоты 1 мл;
б) фосфорно-вольфрамовой кислоты 0,5 мл, фосфорно-молибденовой кислоты 0,5 мл, ледяной уксусной кислоты 1 мл, эритрозина 0,5 г, бриллиантового зеленого 0,075 г, 20% водного раствора анилинового синего 20 мл, 60% спирта 80 мл.
Окраска цитоплазмы и ядер клеток аналогична окраске по методу Паваниколау.
Комбинация приведенных выше методов окраски. Фиксированный мазок на 2—4 мин помещают в приготовленный полихромный протоплазменный краситель, затем последовательно помещают в 75% и 95% спирт и ксилол. Высушивают и заключают в кедровое масло.
Состав краски: оранжа 0,100 г, эритрозина 0,250 г, лихтгрюна 0,200 г, фосфорно-молибденовой кислоты 0,200 г, фосфорно-вольфрамовой кислоты 0,200 г, ледяной уксусной кислоты 1 г, 50% спирта 100 мл. Для приготовления краски 50% спирт разделяют на три равные части, в каждой из них растворяют отдельно оранж, лихтгрюн и эритрозин. После полного растворения каждой краски все смешивают и добавляют остальные реактивы.
Цитоплазма базофильных клеток окрашивается в светло-зеленые тона, ацидофильных — в золотисто-розовые.
Для лучшего прокрашивания ядер способ окраски несколько видоизменяют. Фиксированный мазок окрашивают гематоксилином в течение 1 мин, промывают проточной водой, после чего в течение 2—4 мин окрашивают описанным выше способом полихромным красителем.
Фиксированный одним из описанных выше способов мазок промывают в течение 2 мин в дистиллированной воде, окрашивают в течение 1—3 мин гематоксилином, промывают в течение 4—10 мин проточной водой, на 2 мин помещают в смесь из 70% изопропилового спирта с 2,5% уксусной кислоты; окрашивают по второму способу, промывают и снова помещают на 2 мин в смесь изопропилового спирта с уксусной кислотой (2,5%), на 2 мин в изопропиловый спирт, на 2 мин в ксилол и заключают в канадский бальзам.
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Взятие и исследование материала
Каковы общие правила взятия и сохранения материала для бактериологического исследования?
Материал для бактериологического исследования собирают в стерильную посуду и как можно быстрее доставляют в лабораторию, так как возбудители могут погибнуть при высыхании, изменении кислотности среды и от других причин. При необходимости материал для исследования хранят при низкой температуре.
Как берутся мазки из зева и носоглотки?
При подозрении на дифтерию или ангину материал берут из зева или носоглотки. Перед взятием мазка больной не должен полоскать горло дезинфицирующими растворами. Не берется мазок из-за опасности рвоты сразу после еды. Для взятия мазка прижимают язык шпателем и берут отделяемое с помощью стерильного ватного тампона, который затем опускают в закрытую стерильную пробирку. Желательно, чтобы время между взятием материала и посевом не превышало 5-6 часов во избежание высыхания тампона.
Как берутся мазки из уретры у мужчин?
Для взятия материала из уретры у мужчин заранее готовят чистые обезжиренные предметные стекла. Отделяемое из уретры берут утром до первого мочеиспускания. Наружное отверстие уретры обтирают ватой, смоченной стерильным изотоническим раствором натрия хлорида или 1 % раствором хлорамина. При скудных выделениях слегка надавливают на заднюю стенку уретры, снимают выступившую каплю и проволочной петлей готовят мазки для бактериоскопии.
Как берутся мазки из уретры, влагалища и шейки матки у женщин?
У женщин отделяемое из уретры, влагалища и шейки матки берут до мочеиспускания. Для того чтобы получить отделяемое из уретры вводят палец во влагалище и надавливают на заднюю стенку уретры. Мазок берут корнцангом, металлическим шпателем или проволочной петлей. Отделяемое размазывают тонким слоем на предметном стекле. Отделяемое из влагалища берут проволочной петлей, желобоватым зондом или тупой ложечкой. Предметные стекла с мазками маркируют буквами С (шейка) и V (влагалище). Подсохшие мазки 1-2 раза проводят для фиксации над пламенем горелки и направляют в лабораторию для микроскопии. Материал для посева берут с соблюдением всех правил стерильности в стерильные пробирки. В сопроводительном направлении указывают фамилию, имя, отчество больной, отделение или участок, цель исследования, фамилию направляющего, дату.
Каковы особенности взятия мазка с конъюнктивы глаза?
Мазок с конъюнктивы глаза берут утром до умывания и закапывания капель с помощью платиновой петли или зонда, которые стерилизуют над огнем, раскаляя докрасна. Материал берут остывшим инструментом с нижней переходной складки оттянутого нижнего века. Желательно вывернуть верхнее веко и взять слизь и с верхней переходной складки. Материал наносят тонким слоем на чистое обезжиренное предметное стекло. Когда мазок подсохнет, его фиксируют над пламенем, а место, на котором он расположен, очерчивают стеклографом. Для посева петлю с материалом над пламенем горелки опускают в стерильную пробирку с агаром или бульоном. После распределения материала в питательной среде пробирку закрывают пробкой над пламенем.
Как проводится сбор кала для исследования?
Кал для исследования собирают сразу после дефекации в чистую сухую, лучше всего стеклянную посуду. В лабораторию материал направляют как можно быстрее, желательно в теплом виде, чтобы под действием ферментов и микроорганизмов в нем не произошло существенных изменений. На сопроводительной этикетке указывают фамилию, имя, отчество больного, отделение и участок (адрес), цель исследования, дату, фамилию направляющего.
В чем особенность взятия кала для исследования на яйца глистов и при подозрении на инфекционные заболевания?
Для исследования на яйца глистов кал берут в теплом виде сразу же после опорожнения кишечника из нескольких (не менее 3-х) разных мест и доставляют в лабораторию не позднее чем через 30 минут. При подозрении на энтеробиоз стеклянной палочкой производят соскоб со складок анального отверстия и помещают его в каплю глицерина или изотонического раствора натрия хлорида на предметном стекле. Для взятия кала на дизентерию необходимо подготовить специальную пробирку со смесью глицерина и нашатырного спирта, внутри которой помещена стеклянная ректальная трубка. Больного укладывают на левый бок и вращательными движениями осторожно вводят в анальное отверстие трубку на 5-6 см. Трубку вынимают и опускают в пробирку, не прикасаясь к стенкам. Закрывают пробирку и отсылают ее в лабораторию с соответствующим направлением.
Какие исследования крови проводятся с диагностической целью?
Кровь исследуют морфологически (клинический анализ крови), бактериологически, серологически и биохимически.
Как производится забор крови для клинического анализа?
Кровь для клинического анализа берут обычно из IV пальца левой руки после предварительной обработки кожных покровов смесью спирта и эфира. Прокол иглой-скарификатором производят сбоку в мякоть первой фаланги на глубину 2,5-3 мм. Кровь после прокола должна поступать свободно, так как при сильном надавливании на палец с целью улучшения выделения крови к ней примешивается тканевая жидкость, что снижает точность исследования. Первую полученную каплю крови стирают сухой ваткой.
Какие показатели определяются при общем, клиническом анализе крови?
Общий клинический анализ крови включает в себя определение содержания гемоглобина, подсчет количества эритроцитов с последующим вычислением цветового показателя, подсчет общего числа лейкоцитов с оценкой лейкоцитарной формулы, подсчет числа тромбоцитов, определение СОЭ.
Как осуществляется определение уровня гемоглобина?
Как осуществляется подсчет числа эритроцитов?
Что представляет собой цветовой показатель крови?
Определив число эритроцитов и содержание гемоглобина в крови можно рассчитать цветовой показатель, который отражает степень насыщения эритроцита гемоглобином. Цветовой показатель определяют путем деления утроенного числа граммов гемоглобина на три первые цифры числа эритроцитов. В норме цветовой показатель находится в пределах 0,85-1,05.
Как осуществляется определение количества лейкоцитов?
Что представляет собой лейкоцитарная формула?
Лейкоцитарная формула представляет собой процентное соотношение отдельных форм лейкоцитов в крови (палочкоядерных, сегментоядерных, эозинофилов, базофилов, лимфоцитов). Для точной ее оценки после приготовления мазка крови просматривают не менее 200 лейкоцитов. Определение лейкоцитарной формулы имеет большое значение для диагностики многих заболеваний.
С какой целью проводится исследование мазка крови?
Исследование мазка крови позволяет обнаружить различные нарушения структуры эритроцитов (изменение их формы, размеров, появление не вполне зрелых форм эритроцитов и т.д.), что играет большую роль в диагностике различных видов анемий.
Каково значение определения количества тромбоцитов?
Важным для диагностики ряда заболеваний может оказаться подсчет числа тромбоцитов (в норме их количество составляет 180-300×109 в 1 л крови или 180000- 320000 в 1 мкл крови). Уменьшение числа тромбоцитов в ряде случаев является причиной повышенной кровоточивости.
Как проводится определение скорости оседания эритроцитов?
Какие дополнительные показатели состояния крови используются в клинической диагностике заболеваний?
В диагностике гематологических заболеваний широко используются оценка осмотической резистентности (устойчивости) эритроцитов, характеризующая их повышенное разрушение (гемолиз), исследование показателей свертывающей системы крови (времени свертывания крови, продолжительности кровотечения, активности различных факторов свертывания крови). Результаты этих исследований позволяют точнее дифференцировать различные формы анемий, гемобластозов, геморрагических диатезов.
Как проводится исследование крови на малярию?
Для получения толстой капли при исследовании на малярию после прокола пальца прикасаются к выступившим каплям крови 2-3 участками поверхности предметного стекла. Углом другого стекла осторожно соединяют их в одну каплю и равномерно распределяют по поверхности предметного стекла.
Каковы основные правила взятия крови для биохимических и серологических тестов?
Кровь для биохимических и серологических исследований берут натощак из вены в количестве 5-20 мл в зависимости от целей исследования. Для посева берут кровь из вены в стерильную пробирку.
Как проводится сбор мокроты больного для исследования?
Для исследования на опухолевые клетки мокроту собирают в чашку Петри и сразу же направляют в лабораторию, так как клетки новообразований быстро разрушаются. Мокроту для бактериологического исследования собирают в стерильную посуду, в частности, при исследовании на чувствительность к антибиотикам больной делает несколько плевков мокроты в стерильную чашку Петри. Если мокроты мало, используют для бактериологических исследований промывные воды бронхов.
Каковы особенности сбора мокроты при подозрении на туберкулез?
На сосуде с мокротой, посылаемой на исследование, должна быть этикетка с указанием фамилии, имени и отчества больного и цели исследования.
Как проводится сбор мочи больного для проведения общего анализа?
Для общего анализа мочи используют утреннюю порцию мочи, которую получают после тщательного туалета наружных половых органов. Мочу в количестве 100-200 мл, собранную в чистую и сухую посуду, на которой заранее делается наклейка с фамилией и инициалами больного, относят в лабораторию. При невозможности быстрого исследования мочи ее сохраняют на холоде или же с помощью добавления консерванта (например, хлороформа, формальдегида). В тех случаях, когда стремятся прицельно выявить изменения мочи, характерные для заболевания почек, рекомендуется брать среднюю порцию утренней мочи или пользоваться катетером при сборе мочи.
В каких случаях при сборе мочи используется трехстаканная проба?
Какие показатели определяются при общем анализе мочи?
При проведении общего анализа мочи учитывают ее цвет, прозрачность, запах, реакцию, а также относительную плотность.
При химическом исследовании мочи определяют наличие в ней белка (его появление в моче носит название протеинурии), сахара (гликозурии), кетоновых тел (кетонурии), билирубина и уробилиновых тел (билирубинурии и уробилинурии), минеральных веществ (хлоридов, кальция, натрия и др.).
Как проводится определение относительной плотности мочи?
В каких случаях у больных наблюдаются отклонения в анализах мочи?
С какой целью проводится микроскопия осадка мочи?
Кроме химического исследования при общем анализе мочи проводят микроскопию ее осадка, составляющими которого являются эритроциты, лейкоциты, цилиндры, эпителиальные клетки, кристаллы и аморфные массы солей.
О чем свидетельствует наличие у больного гематурии?
О чем свидетельствует наличие у больного лейкоцитурии?
Что представляют собой количественные методы определения числа форменных элементов в моче?
Помимо обычной микроскопии осадка, существуют количественные методы определения числа форменных элементов (эритроцитов, лейкоцитов, цилиндров) в осадке мочи. По сравнению с общим анализом мочи эти методы позволяют лучше распознавать скрыто протекающие (латентные) формы воспалительных заболеваний почек (гломерулонефрита и пиелонефрита), а также дают возможность достаточно объективно контролировать эффективность проводимого лечения. К методам количественного определения форменных элементов в моче относятся способы исследования мочи по Каковскому-Аддису, Нечипоренко и Амбюрже.
Как проводится исследование мочи по методу Каковского-Аддиса?
Как проводится исследование мочи по методу Нечипоренко?
Как проводится исследование мочи по методу Амбюрже?
По методу Амбюрже мочу собирают за 3 часа, а пересчет форменных элементов производят на то количество мочи, которое выделяется за 1 минуту.
При заболеваниях почек и мочевыводящих путей инфекционной природы (например, циститах, пиелонефритах) часто проводят бактериологическое исследование мочи, позволяющее не только выделить возбудителя заболеваний, но и подобрать эффективно действующий на него антибиотик. Для этого 10 мл мочи собирают в стерильную пробирку и направляют в бактериологическую лабораторию, где уже производят посев мочи на специальные питательные среды в чашки Петри. Для многих исследований (например, для определения суточной глюкозурии) необходимо собирать мочу в течение суток и учитывать ее количество. При этом подсчет начинают не с первой утренней порции (ее выливают), а с последующей и заканчивают утром следующего дня.
Как проводится проба Зимницкого?
Важное место в исследовании концентрационной функции почек занимает проба Зимницкого, которая проводится при обычном пищевом и питьевом режиме больного. Мочу собирают через каждые 3 часа в отдельную посуду, причем раздельно учитывают дневной (с 6 до 18 часов) и ночной (с 18 до 6 часов) диурез. В каждой порции определяют объем и с помощью урометра относительную плотность мочи.
Как проводится оценка функционального состояния почек с помощью пробы Зимницкого?
При анализе результатов пробы Зимницкого нужно учитывать также соотношение дневного и ночного диуреза, которое в нормальных условиях характеризуется заметным преобладанием первого над вторым. Выделение равного количества мочи в дневное и ночное время, а также преобладание ночного диуреза над дневным, т. е. никтурия, подтверждает снижение концентрационной функции почек.