Для чего используется оксид железа
Оксид железа(III)
| Оксид железа(III) | |
 | |
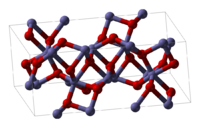 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид железа(III) |
| Традиционные названия | окись железа, колькотар, крокус, железный сурик |
| Химическая формула | Fe2O3 |
| Эмпирическая формула | Fe2O3 |
| Физические свойства | |
| Состояние (ст. усл.) | твёрдое |
| Молярная масса | 159,69 г/моль |
| Плотность | 5,242 г/см³ |
| Термические свойства | |
| Температура плавления | 1566 °C |
| Классификация | |
| Рег. номер CAS | 1309-37-1 |
Содержание
Свойства
Оксид железа(III) — амфотерный оксид с большим преобладанием основных свойств. Красно-коричневого цвета. Термически устойчив до высоких температур. Образуется при сгорании железа на воздухе. Не реагирует с водой. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели.
В природе встречается как широко распространённый минерал гематит, примеси которого обуславливают красноватую окраску латерита, красноземов, а также поверхности Марса.
Получение
Термическое разложение соединений солей железа(III) на воздухе:

Химические свойства
1. Взаимодействие с разбавленной соляной кислотой:
4. Восстановление железа водородом:
Применение
Применяется как сырьё при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель аналоговой и цифровой информации (напр. звука и изображения) на магнитных лентах, как полирующее средство (красный крокус) для стали и стекла.
В пищевой промышленности используется в качестве пищевого красителя (E172).
См. также
Литература
Полезное
Смотреть что такое «Оксид железа(III)» в других словарях:
Оксид хрома(III) — Оксид хрома(III) … Википедия
Оксид железа(II,III) — Общие Систематическое наименование О … Википедия
Оксид железа(II) — Общие Систематическое наименование Оксид железа(II) Химическая формула FeO … Википедия
Оксид железа — Оксиды железа соединения железа с кислородом. Известно 3 наиболее распространённых оксида железа: Fe3O4, Магнетит распространённый минерал железа, FeO вюстит (см. ниже) Fe2O3 гематит (см. ниже) Оксид железа(II) Оксид железа FeO чёрные кристаллы,… … Википедия
Оксид железа (II) — Оксиды железа соединения железа с кислородом. Известно 3 наиболее распространённых оксида железа: Fe3O4, Магнетит распространённый минерал железа, FeO вюстит (см. ниже) Fe2O3 гематит (см. ниже) Оксид железа(II) Оксид железа FeO чёрные кристаллы,… … Википедия
железа(III) оксид — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
Сульфат железа(III) — У этого термина существуют и другие значения, см. Сульфат железа. Сульфат железа(III) … Википедия
Бромид железа(III) — У этого термина существуют и другие значения, см. Бромид железа. Бромид железа(III) Общие Традиционные названия Трибомид железа Химическая формула FeBr3 Физические свойства Сос … Википедия
Фторид железа(III) — У этого термина существуют и другие значения, см. Фторид железа. Фторид железа(III) Общие Систематическое наименование Фторид железа(III) Традиционные названия Фтористое железо Химическая формула FeF3 … Википедия
Окись железа
Окси́ды желе́за — соединения железа с кислородом.
Известно 3 наиболее распространённых оксида железа:
Оксид железа(II)
Оксид железа FeO — чёрные кристаллы, нерастворимые в воде. Температура плавления 1420 °C
Хорошо растворимы в кислотах:
Оксид железа получают при восстановлении оксида железа (III) при +500 °C оксидом углерода(II):
Оксид железа(II) обладает основными свойствами.
Оксид железа(III)
Оксид железа Fe2O3 — красно-бурый порошок. Температура плавления 1565 °C.
Оксид железа(III) обладает слабо выраженными амфотерными свойствами:
Применение
В пищевой промышленности оксиды железа зарегистрированы в качестве пищевой добавки Е172.
Полезное
Смотреть что такое «Окись железа» в других словарях:
ОКИСЬ ЖЕЛЕЗА — ОКИСЬ ЖЕЛЕЗА, соединение, в котором железо обладает большей ВАЛЕНТНОСТЬЮ (как правило, три), чем в ЖЕЛЕЗИСТЫХ соединениях … Научно-технический энциклопедический словарь
окись железа(II) — закись железа … Cловарь химических синонимов I
окись железа(III) — полуторная окись железа … Cловарь химических синонимов I
полуторная окись железа — окись железа(III) … Cловарь химических синонимов I
красная окись железа — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
черная окись железа — Краска под названием «Черный марс». Представляет собой окись железа, является минеральным черным пигментом. В отличие от всех черных углеродистых красок (сажи, слоновой кости и др.) хорошо высыхает в масляной живописи, но уступает по глубине… … Словарь иконописца
черная окись железа — geležies juodasis statusas T sritis chemija apibrėžtis Pigmentas. formulė FeO·Fe₂O₃ atitikmenys: angl. black iron oxide; black rouge rus. черная окись железа … Chemijos terminų aiškinamasis žodynas
коричневая окись железа — geležies rudasis statusas T sritis chemija apibrėžtis Fe₂O₃, kuriame yra 6–14% FeO, pigmentas. atitikmenys: angl. brown iron oxide rus. коричневая окись железа … Chemijos terminų aiškinamasis žodynas
железа окись — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
железа сесквиоксид — geležies(III) oksidas statusas T sritis chemija formulė Fe₂O₃ atitikmenys: angl. colcothar; ferric oxide; iron minium; iron sesquioxide; ironic oxide; iron(III) oxide; Prussian red; red iron oxide; red ocher, US; red ochre, GB; Spanish oxide rus … Chemijos terminų aiškinamasis žodynas
Оксид железа (III)
| Оксид железа (III) | |
|---|---|
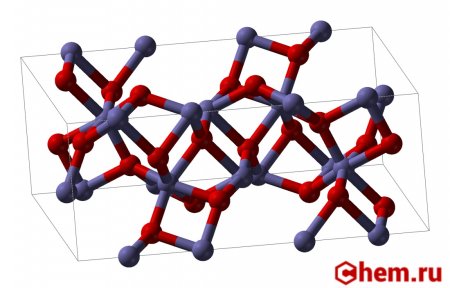 | |
| Систематическое наименование | Оксид железа (III) |
| Традиционные названия | окись железа, колькотар, крокус, железный сурик |
| Хим. формула | Fe2O3 |
| Рац. формула | Fe2O3 |
| Состояние | твёрдое |
| Молярная масса | 159,69 г/моль |
| Плотность | 5,242 г/см³ |
| Температура | |
| • плавления | 1566 °C |
| • кипения | 1987 °C |
| Давление пара | 0 ± 1 мм рт.ст. |
| Рег. номер CAS | 1309-37-1 |
| PubChem | 518696 |
| Рег. номер EINECS | 215-168-2 |
| SMILES | |
| Кодекс Алиментариус | E172(ii) |
| RTECS | NO7400000 |
| ChEBI | 50819 |
| ChemSpider | 14147 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид железа (III) — сложное неорганическое вещество, соединение железа и кислорода с химической формулой Fe2O3.
Содержание
Свойства
Оксид железа (III) — амфотерный оксид с большим преобладанием осно́вных свойств. Красно-коричневого цвета. Термически устойчив до температур выше температуры испарения (1987 °C). Образуется при сгорании железа на воздухе. Не реагирует с водой. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды — шпинели.
В природе встречается как широко распространённый минерал гематит, примеси которого обусловливают красноватую окраску латерита, краснозёмов, а также поверхности Марса; другая кристаллическая модификация встречается как минерал маггемит.
Получение
Термическое разложение соединений солей железа (III) на воздухе:
Обезвоживание метагидроксида железа прокаливанием:
В природе — оксидные руды железа гематит Fe2O3 и лимонит Fe2O3· n H2O
Химические свойства
1. Взаимодействие с разбавленной соляной кислотой:
2. Взаимодействие с карбонатом натрия:
3. Взаимодействие с гидроксидом натрия при сплавлении:
4. Восстановление до железа водородом:
Физические свойства
Применение
В пищевой промышленности используется в качестве пищевого красителя (E172).
В ракетомоделировании применяется для получения катализированного карамельного топлива, которое имеет скорость горения на 80 % выше, чем обычное топливо.
Является основным компонентом железного сурика (колькотара).
В нефтехимической промышленности используется в качестве основного компонента катализатора дегидрирования при синтезе диеновых мономеров.
Оксид железа (II): структура, номенклатура, свойства, применение
Содержание:
Оксид железа (II) может быть получен термическим вакуумным разложением оксалата железа (II) с получением пирофорного черного порошка. Этот порошок ухудшает состояние деления и становится менее реактивным при нагревании до высоких температур.
Кристаллы оксида железа (II) можно получить только в условиях высокотемпературного равновесия, быстро охлаждая систему. Если реакция проводится при более низких температурах, FeO нестабилен и превращается в железо (Fe) и оксид Fe.3ИЛИ4, поскольку медленное охлаждение способствует диспропорции.
Поскольку он пирофорен, это материал, который представляет опасность пожара. Кроме того, он опасен при вдыхании в больших количествах и в течение длительного времени, так как может вызвать заболевание легких.
Оксид железа (II) используется в качестве пигмента в керамике, эмали, стеклах и косметике. Благодаря своим магнитным свойствам он используется в медицине. Он также используется в качестве антиоксиданта в упакованных пищевых продуктах и, кроме того, он используется в реакционном катализе и в формулах пестицидов.
Состав
Оксид железа (II) (FeO) теоретически обладает кубической структурой каменной соли, содержащей 4 иона Fe. 2+ и 4 иона O 2- на элементарную ячейку, а ионы Fe 2+ занимая октаэдрические позиции.
Однако реальность такова, что она значительно отклоняется от идеальной структуры каменной соли FeO, поскольку представляет собой сложную неисправную структуру.
Оксид железа (III)
Оксид железа (III)
Оксид железа (III) – это твердое, нерастворимое в воде вещество красно-коричневого цвета.
Способы получения
Оксид железа (III) можно получить различными методами :
1. Окисление оксида железа (II) кислородом.
2. Разложение гидроксида железа (III) при нагревании :
Химические свойства
1. При взаимодействии оксида железа (III) с кислотными оксидами и кислотами образуются соли.
3. Оксид железа (III) не взаимодействует с водой.
4. Оксид железа (III) окисляется сильными окислителями до соединений железа (VI).
Нитраты и нитриты в щелочной среде также окисляют оксид железа (III):
При восстановлении оксида железа (III) водородом также возможно образование различных продуктов, например, простого железа:
Железом можно восстановить оксид железа только до оксида железа (II):
Оксид железа (III) реагирует также с некоторыми другими сильными восстановителями.
Fe2O3 + 3NaH → 3NaOH + 2Fe
6. Оксид железа (III) – твердый, нелетучий и амфотерный. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.







