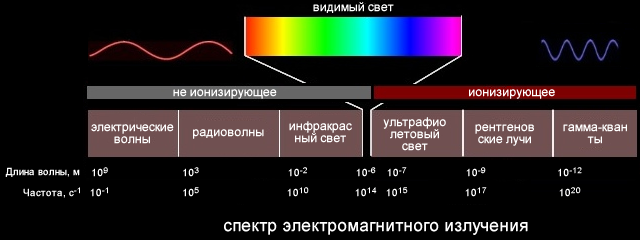
Для чего используют спектры поглощения
Применение спектров поглощения: качественный, количественные анализ, расчёт коэффициента экстинкции, исследование кинетики химических процессов.



При качественном спектральном анализе спектры проб сравнивают со спектрами известных элементов, приведенных в соответствующих атласах и таблицах спектральных линий, и таким образом устанавливают элементный состав анализируемого вещества. При количественном анализе определяют количество (концентрацию) искомого элемента в анализируемом веществе по зависимости величины аналитического сигнала (плотность почернения или оптическая плотность аналитической линии на фотопластинке; световой поток на фотоэлектрический приемник) искомого элемента от его содержания в пробе.
Эмиссионная спектроскопия. Спектральные приборы. Тепловые источники, процессы протекающие в тепловых источниках. Пламенная фотометрия, область применения. Уравнение Ломакина, качественный и количественный анализ.
Эмиссионный спектральный анализ основан на получении и изучении спектров испускания (эмиссионных спектров). По положению и относительной интенсивности отдельных линий в этих спектрах проводят качественный спектральный анализ. Сравнивая интенсивность специально выбранных спектральных линий в спектре пробы с интенсивностью тех же линий в спектрах эталонов, определяют содержание элемента, выполняя, таким образом, количественный спектральный анализ.
Для чего используют спектры поглощения
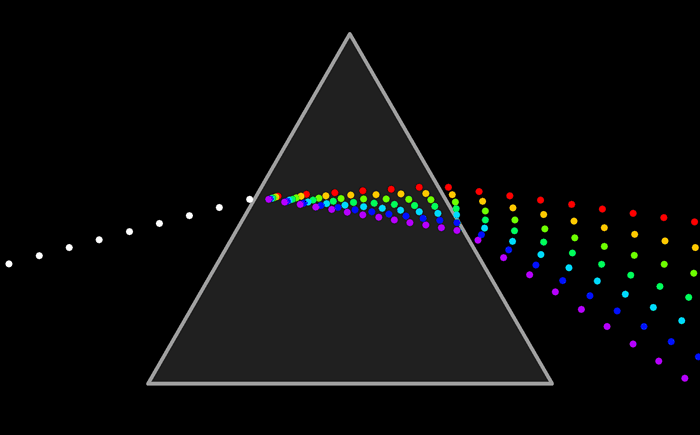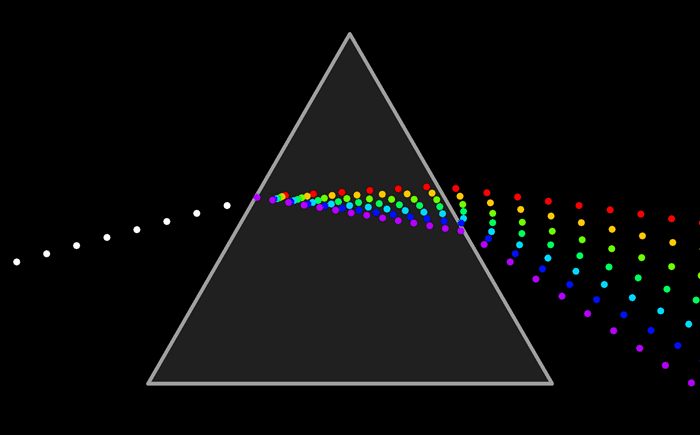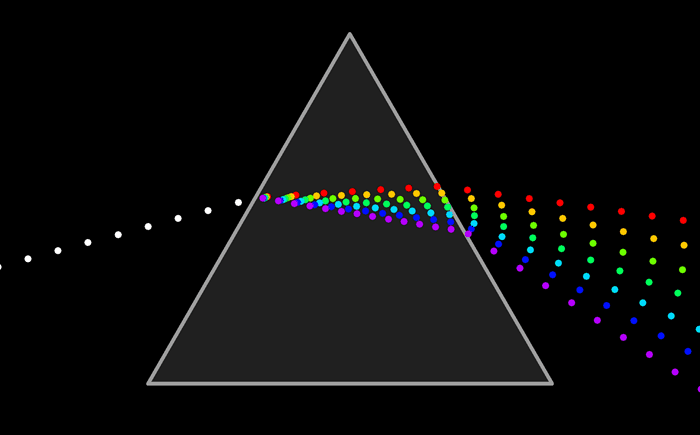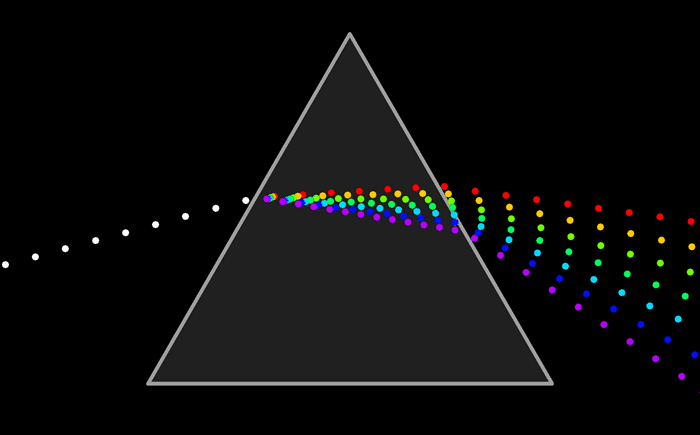
Ни один из источников не дает монохроматического света, т.е. света строго определенной длины волны. В этом можно убедиться на опытах по разложению света в спектр с помощью призмы, а также опыты по интерференции и дифракции.
Та энергия, которую несет с собой свет от источника, определенным образом распределена по волнам всех длин, входящим в состав светового пучка.
Для характеристики распределения излучения по частотам нужно ввести новую величину: интенсивность, приходящуюся на единичный интервал частот. Эту величину называют спектральной плотностью интенсивности излучения.
Спектральную плотность потока излучения можно найти экспериментально. Для этого надо с помощью призмы получить спектр излучения, например, электрической дуги, и измерить плотность потока излучения, приходящегося на небольшие спектральные интервалы шириной Δν.
Полагаться на глаз при оценке распределения энергии нельзя. Глаз обладает избирательной чувствительностью к свету: максимум его чувствительности лежит в желто-зеленой области спектра. Лучше всего воспользоваться свойством черного тела почти полностью поглощать свет всех длин волн. При этом энергия излучения (т.е. света) вызывает нагревание тела. Поэтому достаточно измерить температуру тела и по ней судить о количестве поглощенной в единицу времени энергии.
Спектры излучения
Спектральный состав излучения атомов различных веществ весьма разнообразен. Тем не менее, все спектры можно разделить на три сильно отличающихся друг от друга типа.
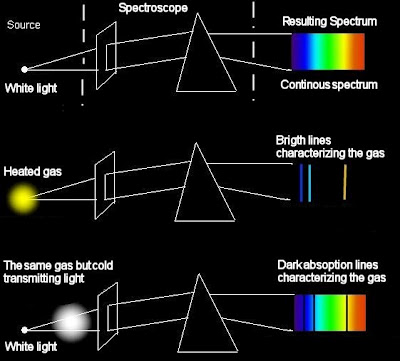
Сплошной (непрерывный) спектр
Накаленные твердые и жидкие тела и газы (при большом давлении) испускают свет, разложение которого дает сплошной спектр, в котором спектральные цвета непрерывно переходят один в другой. Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и взаимодействием атомов друг с другом. Сплошные спектры одинаковы для разных веществ, и поэтому их нельзя использовать для определения состава вещества.
Линейчатый (атомный) спектр
Возбужденные атомы разреженных газов или паров испускают свет, разложение которого дает линейчатый спектр,состоящий из отдельных цветных линий. Каждый химический элемент имеет характерный для него линейчатый спектр. Атомы таких веществ не взаимодействуют друг с другом и излучают свет только определенных длин волн. Изолированные атомы данного химического элемента излучают строго определенные длины волн. Это позволяет по спектральным линиям судить о химическом составе источника света.
Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом. При увеличении плотности атомарного газа отдельные спектральные линии расширяются и, при очень большой плотности газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Молекулярный (полосатый) спектр
Спектр молекулы состоит из большого числа отдельных линий, сливающихся в полосы, четкие с одного края и размытые с другого. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом. Серии очень близких линий группируются на отдельных участках спектра и заполняют целые полосы.
 |
| Спектр угольной дуги (полосы молекул CN и C2) |
 |
| Спектр испускания паров молекулы йода |
 |
| Спектр молекулы Н2 |
В 1860 г. немецкие ученые Г. Кирхгоф и Р. Бунзен, изучая спектры металлов, установили следующие факты:
1) каждый металл имеет свой спектр;
2) спектр каждого металла строго постоянен;
3) введение в пламя горелки любой соли одного и того же металла всегда приводит к появлению одинакового спектра;
4) при внесении в пламя смеси солей нескольких металлов в спектре одновременно появляются все их линии;
5) яркость спектральных линий зависит от концентрации элемента в данном веществе.
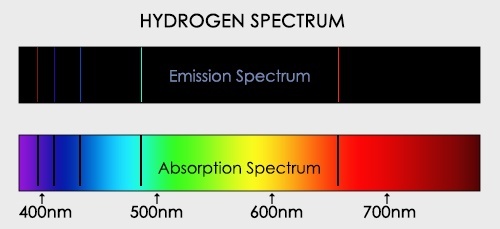
Спектры поглощения
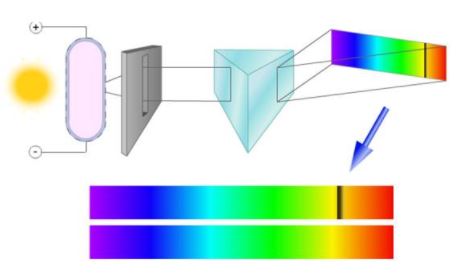
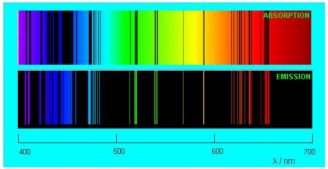
Если белый свет от источника, дающей сплошной спектр, пропускается через пары исследуемого вещества и затем разлагается в спектр, то на фоне сплошного спектра наблюдаются темные линии поглощения в тех же сам ых местах, где находились бы линии спектра испускания паров исследуемого элемента. Такие спектры получили название атомных спектров поглощения.
Все вещества, атомы которых находятся в возбужденном состоянии, излучают световые волны, энергия которых определенным образом распределена по длинам волн. Поглощение света веществом также зависит от длины волны. Атомы поглощают излучение лишь тех длин волн, которые они могут испускать при данной температуре.
Спектральный анализ
Спектральным анализом называется метод изучения химического состава вещества, основанный на исследовании его спектров. Отдельные линии в спектрах различных элементов могут совпадать, но в целом спектр каждого элемента является его индивидуальной характеристикой.
Спектральный анализ сыграл большую роль в науке. Например, в спектре Солнца (1814) были открыты фраунгоферовы темные линии, происхождение которых объясняется следующим образом. Солнце, являясь раскаленным газовым шаром (Т
6000 °С), испускает сплошной спектр. Солнечные лучи проходят через атмосферу Солнца (солнечную корону, температура которой
2000— 3000 °С. Корона поглощает из сплошного спектра излучение определенной частоты, а на Земле регистрируется солнечный спектр поглощения, по которому можно определить, какие химические элементы присутствуют в короне Солнца. По спектрам поглощения на Солнце были обнаружены все земные элементы, а также неизвестный ранее элемент, который назвали гелий. Через 26 лет (1894) открыли гелий на Земле. Благодаря спектральному анализу на Земле было открыто еще 25 химических элементов.
Фраунгоферовы линии дают информацию не только о химическом составе звезды, но и о ее температуре и давлении на поверхности. Более того, спектральный анализ Солнца и звезд показал, что входящие в их состав химические элементы имеются и на Земле, т.е. вещество Вселенной состоит из одного и того же набора элементов.
Спектральные аппараты
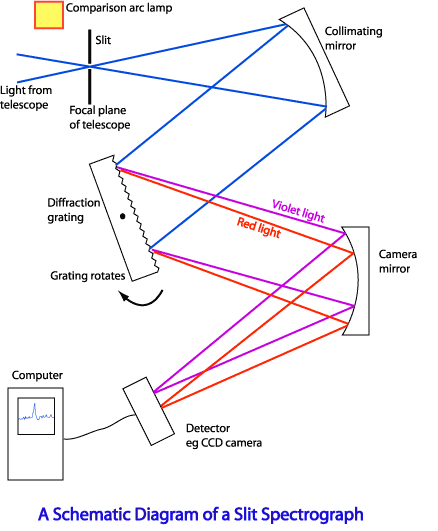
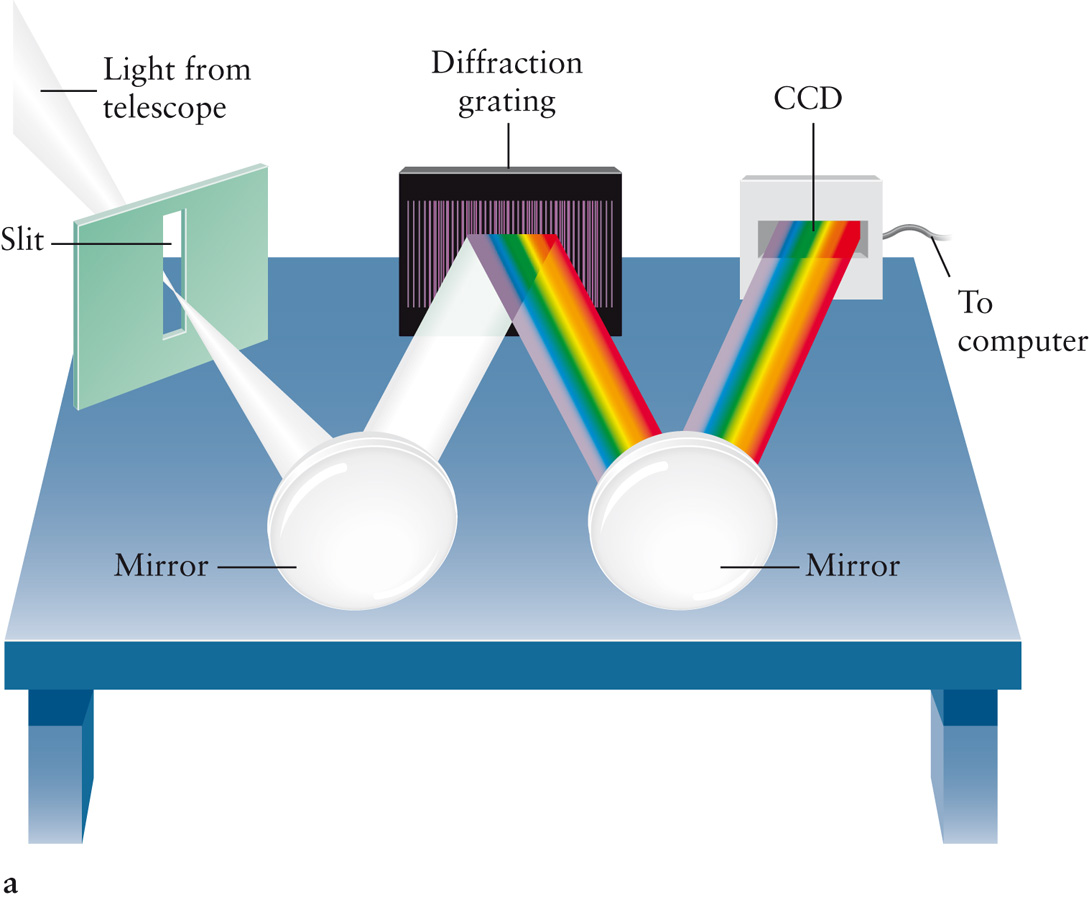
Спектроскопом называется прибор, с помощью которого визуально исследуется спектральный состав света, испускаемого некоторым источником. Если регистрация спектра происходит на фотопластинке, то прибор называется спектрографом.
Для точного исследования спектров такие простые приспособления, как узкая щель, ограничивающая световой пучок, и призма, уже недостаточны. Необходимы приборы, дающие четкий спектр, т.е. приборы, хорошо разделяющие волны различной длины и не допускающие перекрытия отдельных участков спектра. Такие приборы называют спектральными аппаратами. Чаще всего основной частью спектрального аппарата является призма или дифракционная решетка.
Применение спектрального анализа
Линейчатые спектры играют особо важную роль, потому что их структура прямо связана со строением атома. Ведь эти спектры создаются атомами, не испытывающими внешних воздействий. Состав сложных, главным образом органических смесей анализируется по их молекулярным спектрам.
Спектральный анализ можно проводить и по спектрам поглощения. В астрофизике по спектрам можно определить многие физические характеристики объектов : температуру, давление, скорость движения, магнитную индукцию и др. с помощью спектрального анализа определяют химический состав руд и минералов.
Основные направления применения спектрального анализа таковы: физико-химические исследования; машиностроение, металлургия; атомная индустрия; астрономия, астрофизика; криминалистика.
Современные технологии создания новейших строительных материалов (металлопластиковые, пластиковые) непосредственно взаимосвязаны с такими фундаментальными науками как химия, физика. Данные науки используют современные методы исследования веществ. Поэтому спектральный анализ можно применять для определения химического состав состава строительных материалов по их спектрам.
Линейчатые спектры
теория по физике 🧲 оптика
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то на экране получится хорошо известный нам спектр. Спектр, который вы видите ниже, называется непрерывным спектром. Он представляет собой сплошную полосу, состоящую из разных цветов, плавно переходящих друг в друга.
Непрерывный (сплошной) спектр — разновидность спектра, в которой присутствуют все длины волн видимого диапазона (от красной границы до фиолетовой).
Излучения, обладающие непрерывным спектром:
Пример №1. Будет ли излучать свет в непрерывном спектре спираль работающей электроплиты?
В данном случае да, поскольку спирать — твердое тело, нагретое до высокой температуры.
Линейчатый спектр и его виды
Картина резко меняется, когда мы наблюдаем свечение, излучаемое разреженными газами. Спектр перестает быть непрерывным: в нём появляются разрывы, которые увеличиваются по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым.
Линейчатый спектр — спектр, который состоит из отдельных достаточно тонких линий.
Линейчатый спектр бывает двух видов:
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до очень высокой температуры), мы сможем наблюдать такую картину, как на картинке ниже.
Спектр испускания — линейчатый спектр, который состоит из тонких изолированных разноцветных линий, соответствующих тем длинам волн света, который излучается атомами.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Но наибольшую важность имеет то, что для любого химического элемента спектр испускания является уникальным. Поэтому по нему можно устанавливать, какой химический элемент находится перед нами. Он является своего рода идентификатором.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем сделать следующий вывод:
Свет излучают атомы сами по себе. Следовательно, каждый атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента этот набор свой.
Спектр поглощения
Атомы излучают свет в процессе перехода из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. При поглощении света атом совершает обратный процесс — он переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но теперь в охлажденном состоянии (при довольно низкой температуре). Свечения газа в этом случае мы не увидим. В не нагретом состоянии газ не излучает свечение, так как атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь охлажденный газ пропустить свет с непрерывным спектром, мы увидим следующую картину (см. рисунок ниже).
Спектр поглощения — темные линии на фоне непрерывного спектра, соответствующие тем длинам волн света, которые поглощаются атомами и излучаются впоследствии при сильном нагревании.
Объясним, откуда берутся темные линии. Под действием падающего света газовые атомы переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов нужны не любые длины волн, а лишь некоторые, строго определённые для данного вида газа. Именно эти длины волн газ поглощает из падающего на него света.
Внимание! Газ поглощает те длины волн, которые излучает сам. Поэтому, цветные линии на спектре испускания соответствуют темным линиям на спектре поглощения. Если их сложить, можно получить непрерывный спектр.
На рисунке ниже сопоставлены спектры испускания и поглощения разреженных паров натрия.
Глядя на спектры испускания и поглощения, ученые XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. Ведь что-то внутри атома должно обеспечивать процессы излучения и поглощения света.
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов. Поэтому атомы разных химических элементов должны отличаться по своему внутреннему устройству.
Спектральный анализ
Использование линейчатых спектров в качестве идентификаторов химических элементов лежит в основе спектрального анализа.
Спектральный анализ — метода исследования химического состава вещества по его спектру.
Идея спектрального анализа заключается в следующем. Спектр излучения исследуемого вещества сопоставляется с эталонными спектрами химических элементов. Затем делается вывод о присутствии или отсутствии различных химических элементов в исследуемом образце. При определённых условиях посредством спектрального анализа можно определить химический состав не только качественно, но и количественно.
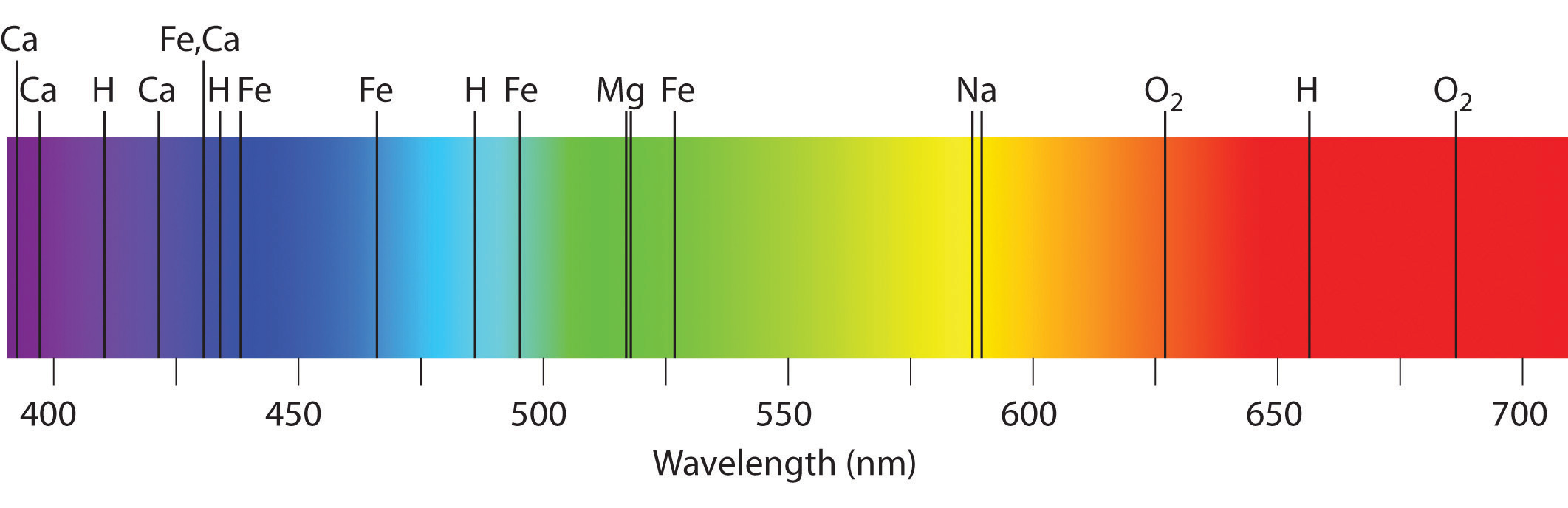
В результате наблюдения различных спектров были открыты новые химические элементы. Первыми из таких элементов были цезий и рубидий. Названия эти элементы получили по цвету линий своего спектра. Так, в спектре цезия больше всего выражены две линии небесно-синего цвета, который на латинском языке звучит как caesius. Рубидий же даёт две отчетливые линии рубинового цвета.
В 1868 году в спектре солнечного света были обнаружены линии, не соответствующие ни одному из известных химических элементов. Этот элемент был назван гелием (от греческого гелиос — солнце). Впоследствии гелий был найден в атмосфере нашей планеты. Спектральный анализ излучения Солнца и других звезд показал, что все входящие в их состав входят элементы имеются и на Земле. Таким образом, оказалось, что все объекты Вселенной собраны из одного и того же набора элементов.
Пример №2. Какую картинку можно получить, если провести спектральный анализ вещества, состоящего из двух химических элементов?
Спектры испускания и спектры поглощения будут накладываться друг на друга. В итоге можно будет получить спектр испускания, в котором будут присутствовать все длины волн, соответствующие тем, что испускаются первым и вторым химическим элементом. В спектре поглощения эти же длины волн будут отсутствовать.
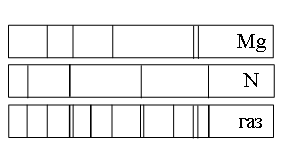
а) азота (N), магния (Mg) и другого неизвестного вещества
в) только магния (Mg)
г) только магния (Mg) и азота (N)
Алгоритм решения
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит этот элемент.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения магния. Следовательно, этот газ содержит магний.
Видно, что спектр поглощения неизвестного газа включает в себя все линии, которые есть в спектре поглощения азота. Следовательно, этот газ также содержит азот.
Но кроме линий, соответствующих азоту и магнию, на спектре поглощения газа наблюдаются другие линии. Следовательно, газ содержит как минимум еще один элемент.
pазбирался: Алиса Никитина | обсудить разбор | оценить
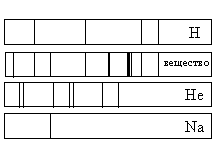
а) только натрий (Na) и водород (Н)
б) только водород (Н) и гелий (Не)
в) водород (Н), гелий (Не) и натрий (Na)
г) натрий (Na), водород (H) и другие элементы, но не гелий (He)
Алгоритм решения
Решение
Если спектр поглощения неизвестного газа содержит все линии, которые есть на спектре известного элемента, то этот газ содержит данный элемент.
Видно, что спектр поглощения неизвестного вещества включает в себя все линии, которые есть в спектре поглощения водорода и натрия. Но линий, соответствующих спектру поглощения гелия, в нем нет. Следовательно, это вещество содержит водород, натрий, но не содержит гелий.
Кроме линий, соответствующих водороду и натрию, на спектре поглощения вещества наблюдаются другие линии. Следовательно, оно содержит как минимум еще один элемент.
pазбирался: Алиса Никитина | обсудить разбор | оценить

Можно утверждать, что в неизвестном образце
а) не содержится стронция
б) не содержится кальция
в) содержатся кальций и ещё какие-то элементы
г) содержится только кальций
Алгоритм решения
Решение
Если спектр излучения неизвестного образца содержит все линии, которые есть на спектре излучения известного элемента, то этот образец содержит данный элемент.
Видно, что спектр излучения неизвестного образца включает в себя все линии, которые есть в спектре излучения стронция. Но линий, соответствующих спектру излучения кальция, в нем нет. Следовательно, этот образец не содержит кальций.
Кроме линий, соответствующих стронцию, на спектре излучения неизвестного образца наблюдаются другие линии. Следовательно, он содержит как минимум еще один элемент.
Из всех перечисленных утверждений верным является только одно — образец не содержит кальция.
pазбирался: Алиса Никитина | обсудить разбор | оценить
Спектр поглощения

Всего получено оценок: 46.
Всего получено оценок: 46.
Спектры, испускаемые нагретыми веществами – это спектры излучения. Существует еще один тип спектров – спектры поглощения. Поговорим о них более подробно.
Виды спектров
Свет, с которым имели дело первые исследователи, начиная с И.Ньютона, был светом нагретых предметов – Солнца или огня.
Ньютон показал, что белый свет представляет собой смесь различных цветов, которые могут быть разложены в спектр – в радужную полоску непрерывно изменяющегося цвета.
Позже было установлено, что такая радужная полоска характерна для излучения нагретых твердых и жидких веществ. Спектр такого типа был назван непрерывным.
Однако, нагретые газы при невысоких давлениях – дают совсем другую картину. Спектры нагретых газов дают не непрерывно изменяющуюся цветную полосу, а ряд узких линий, между которыми почти нет излучения. Такие спектры были названы линейчатыми.
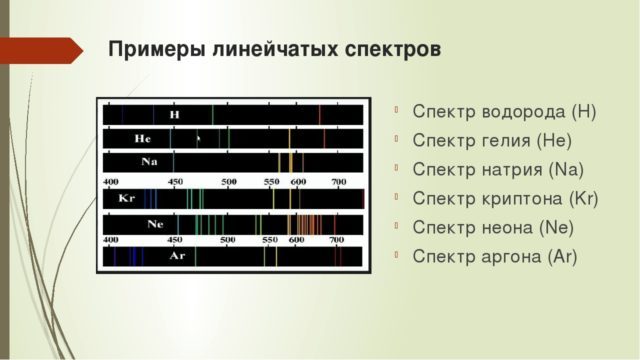
Особым видом линейчатых спектров являются полосатые спектры. Если газ находится под большим давлением, или состоит из многоатомных молекул, то его спектр представляет собой не узкие линии, а широкие полосы. Такие спектры были названы полосатыми.
Спектры поглощения
Вид спектров был объяснен в модели атома Н. Бора. Тепловое излучение испускает кванты света (фотоны) любых длин волн около какого-то среднего значения, спектр получается непрерывным. Атомы возбужденного газа излучают лишь при переходах электронов с одного энергетического уровня на другой. Поэтому на спектре присутствуют только узкие полоски. Если газы находятся под большим давлением, их атомы начинают взаимодействовать, и электроны могут переходить между соседними атомами, энергия таких переходов лежит в более широком диапазоне, в результате в спектре получаются широкие полосы. Тоже самое происходит, если атомы находятся в составе молекул.
Теория Н. Бора предсказывала не только излучение при переходе с более высокого уровня на более низкий. Электроны могут переходить с более низкого уровня на более высокий, если они поглощают определенное количество энергии. Таким образом, если газ облучать белым светом с непрерывным спектром, то фотоны, обладающие энергией перехода с более низкого уровня на более высокий, будут поглощаться электронами. В составе спектра энергии этой длины волны будет меньше, в спектре появятся темные полосы.
Проведенные эксперименты подтвердили это предположение. Если белый свет пропускать через холодный газ, а потом разлагать в спектр – то в непрерывном спектре появляются темные полосы как раз в тех местах, где кванты света поглощались атомами газа. Такие спектры были названы спектрами поглощения.
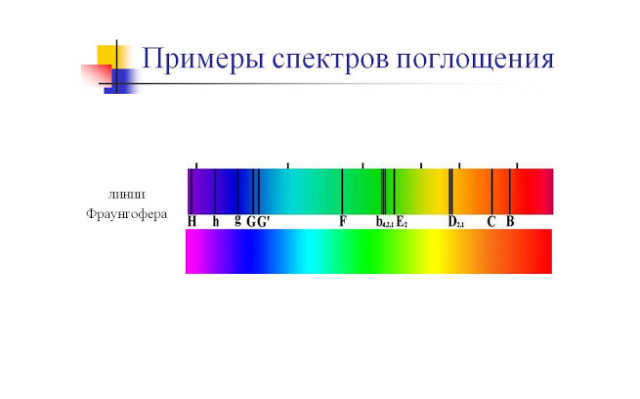
Спектры поглощения газов бывают тех же типов, что и спектры излучения – линейчатые и полосатые. Первые образуют газы при низких давлениях. Вторые – это спектры газов при высоких давлениях или молекулярные спектры поглощения.
Именно спектр поглощения позволяет исследовать химический состав Солнца. Нагретая поверхность Солнца излучает непрерывный спектр, а внешние слои солнечной атмосферы избирательно поглощают свет, образуя спектр поглощения, который может быть исследован. При таком исследовании был открыт элемент гелий.
Что мы узнали?
Согласно теории Н. Бора, электроны атомов излучают свет, переходя с более высоких на более низкие энергетические уровни. При переходах на более высокий уровень, электроны поглощают свет. Таким образом, если облучать газ непрерывным спектром – в нем появятся темные линии поглощения. Такой спектр называется спектром поглощения.