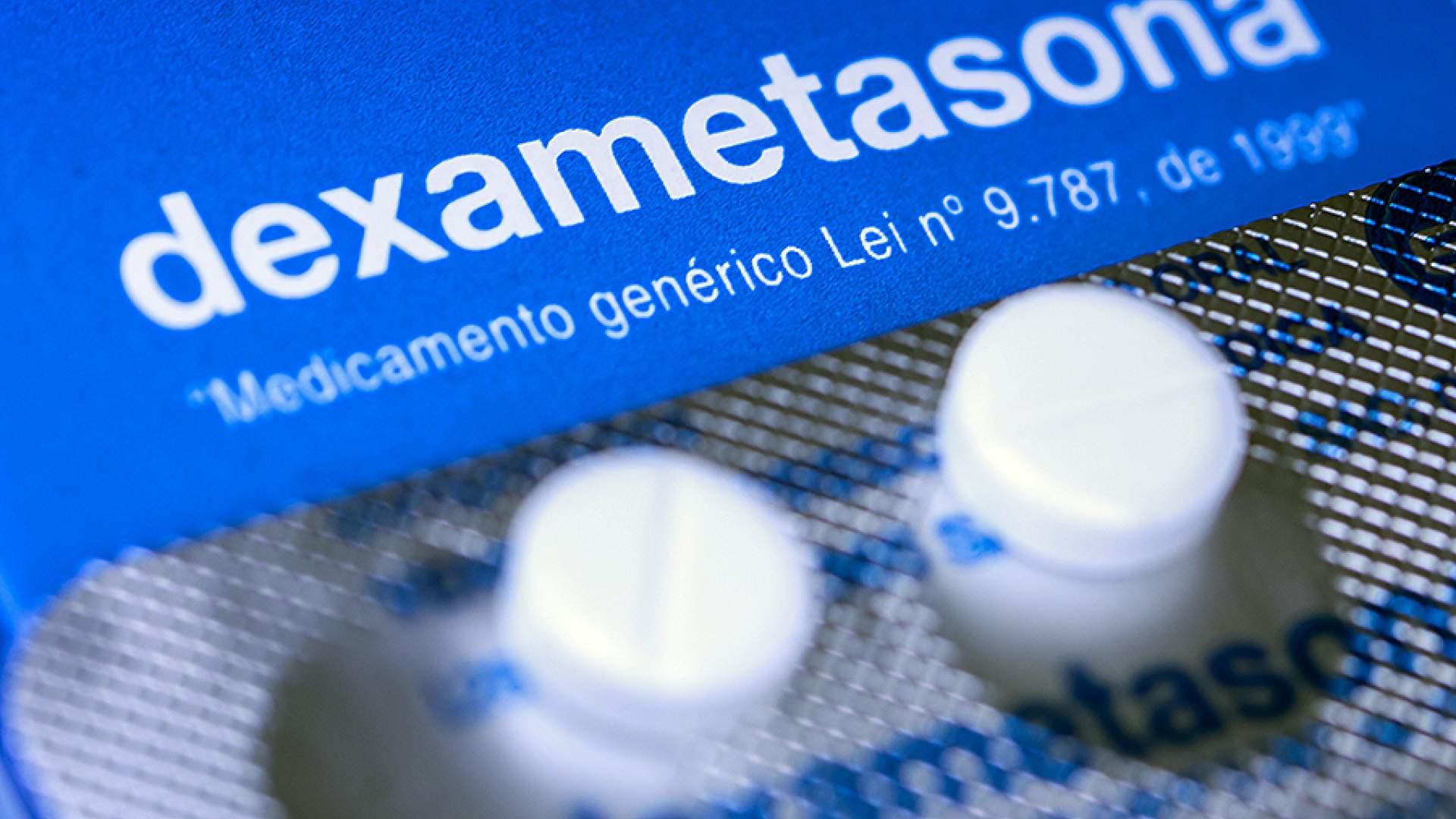
Для чего колят дексаметазон при пневмонии
Мера отчаяния: дексаметазон при COVID-19 поможет лишь тяжелым больным
Препарат дексаметазон, успешные клинические испытания которого глава ВОЗ назвал научным прорывом, действительно может быть эффективен для пациентов, находящихся в реанимации. Он подавляет активность иммунитета и останавливает «цитокиновый шторм», от которого сегодня умирают многие инфицированные COVID-19. Однако его ни в коем случае нельзя принимать людям с симптомами легкой и средней тяжести заболевания, предупреждают ученые. Если человек начнет использовать его раньше времени, то просто уничтожит свою иммунную систему и спасти его будет практически невозможно. Также при длительном применении данное противовоспалительное средство может вызывать ожирение, диабет, остеопороз, глаукому и даже психические отклонения. Поэтому использовать препарат нужно с большой осторожностью под строгим врачебным контролем.
Прорыв из прошлого
Иммунодепрессанты, к которым относится противовоспалительный препарат дексаметазон, могут помочь бороться с тяжелой формой течения коронавирусной инфекции. Как сообщил «Известиям» заместитель директора по научной работе ИФХЭ РАН Олег Батищев, это средство помогает при осложнениях, вызванных гиперактивностью иммунной системы (так называемым цитокиновым штормом).
— Насколько мне известно, проверялось достаточно много препаратов, которые должны были помочь в борьбе с развитием такого пути протекания заболевания. Все они существуют давно, и их использовали при лечении ряда других, в основном аутоиммунных, патологий, — рассказал ученый. — Тот факт, что дексаметазон показал свою эффективность, безусловно, важная находка. Надеюсь, это поможет в лечении тяжелых форм COVID-19.
О прорывных результатах ранее заявили сотрудники Оксфордского университета. В сообщении на их сайте говорится о том, что недорогой и давно известный дексаметазон снижает смертность у госпитализированных пациентов с тяжелыми респираторными осложнениями COVID-19. Британские инфекционисты провели рандомизированное исследование, в рамках которого 2104 пациента получали по 6 мг этого препарата один раз в сутки (в виде таблеток или внутривенно) в течение десяти дней.
Результаты оказались настолько впечатляющими, что о них тут же сообщила ВОЗ. И это несмотря на то, что само исследование еще не опубликовано. Генеральный директор ВОЗ назвал «научным прорывом» полученные данные об эффективности дексаметазона. По его словам, противовоспалительный препарат снижает риск смерти пациентов с COVID-19, подключенных к аппаратам ИВЛ, на 35%. А среди больных, получающих кислород, — на 20%.
Дексаметазон широко применяется с 1980-х годов. Это лекарство из группы глюкокортикостероидов, которое оказывает выраженное противовоспалительное, противоаллергическое, противоотечное и иммуносупрессивное ( подавляющее иммунитет ) действие на организм. Средство имеет синтетическое происхождение, по сути это аналог собственных гормонов человека, выделяемых надпочечниками. Оно подавляет функции тканевых макрофагов, а также ограничивает миграцию лейкоцитов в область воспаления. Как подчеркивают специалисты, использование данного препарата опасно, так как все стероиды имеют большое количество серьезных побочных эффектов.
Неволшебная палочка
Несмотря на заявления ВОЗ, сам препарат не станет «волшебной палочкой» при коронавирусе, сообщил «Известиям» ведущий научный сотрудник лаборатории молекулярной биологии МГУ им. М.В. Ломоносова Роман Зиновкин.
— Научным прорывом его применение считать нельзя, это просто довольно логичный ход, продиктованный особенностями COVID-19, — подчеркнул ученый. — В первую очередь препарат представляет собой иммунодепрессант. Когда у человека есть инфекция, давать ему подавители иммунитета — нестандартное решение. Но в тяжелых случаях COVID-19, когда собственная иммунная система начинает разрушать организм, такой подход, видимо, работает.
При этом у пациентов, к которым применяют дексаметазон, повышается риск получения вторичной бактериальной пневмонии, которая будет активнее развиваться на фоне подавленного иммунитета. Кроме того, возможно, будут хуже синтезироваться антитела к SARS-Cov-2 — в меньшем количестве, чем без этого препарата. В итоге у человека, перенесшего инфекцию и принимавшего дексаметазон, шанс заболеть второй раз становится выше. Использовать это лекарство можно только в отношении пациентов в тяжелом состоянии — на ИВЛ и при кислородной поддержке, пояснил Роман Зиновкин.
Сами медики говорят, что ничего неожиданного в том, что данное лекарство оказалось эффективным, нет. Его применяют при различных угрожающих жизни состояниях, в том числе патологиях легких, рассказал «Известиям» врач скорой помощи Андрей Игнатов.
— Дексаметазон — это препарат выбора, так называемая терапия отчаяния. Его используют по жизненным показаниям, чтобы остановить острое воспаление, — отметил специалист. — При этом, как и у любых гормонов, у данного лекарства есть серьезные побочные эффекты.
В частности, при длительном применении, может нарушиться нормальная работа собственных надпочечников организма пациента. Также прием препарата временно повышает сахар крови, что будет способствовать набору веса и в крайнем случае — развитию диабета. Еще одно серьезное ограничение связано с тем, что глюкокортикостероиды способны вызывать остеопороз. Дексаметазон вымывает кальций из костей, из-за чего повышается их ломкость. В связи с чем возможно развитие катаракты, глаукомы, могут даже возникнуть проблемы с психикой.
Применять с осторожностью
В целом кортикостероиды вызывают ряд опасений у медицинского сообщества. В научной периодике встречается множество статей с критикой использования этих лекарств при атипичной пневмонии. Так, в мае в журнале Nature вышла статья группы ученых из КНР, в которой был проведен анализ имеющихся научных данных о влиянии терапии кортикостероидами на людей с коронавирусной инфекцией. «Использование кортикостероидов у субъектов с инфекциями SARS-CoV-2, SARS-CoV и MERS-CoV задержало очистку от вирусов и не привело к убедительному улучшению выживаемости, уменьшению продолжительности госпитализации или меньшему использованию искусственной вентиляции легких», — сказано в статье.
— SARS ранее действительно лечили с использованием кортикостероидов, причем высокими дозами, вплоть до такого побочного эффекта, как асептические некрозы головки бедренной кости, — рассказал «Известиям» научный сотрудник лаборатории анализа показателей здоровья населения и цифровизации здравоохранения МФТИ (вуз — участник проекта «5-100»), младший научный сотрудник лаборатории экспериментальной хирургии и онкологии Курского государственного медицинского университета Давид Наимзада.
Более того, использовать данное лекарство можно только в отношении пациентов в тяжелом состоянии — на ИВЛ и при кислородной поддержке.
— Для них этот препарат действительно нужен, — подчеркнул Роман Зиновкин. — Пациентам с легкими формами COVID-19 это средство безумно опасно. Возможно, у них даже есть тенденция к увеличению смертности при применении данного препарата. Если человек начнет применять его раньше времени, то просто уничтожит свою иммунную систему и спасти его будет практически невозможно. Так что использовать дексаметазон следует только под строгим врачебным надзором.
В России дексаметазон широко применяют. Лекарство продается по рецепту в любой аптеке. Рекомендация использовать его присутствует и во временных методических руководствах для лечения коронавирусной инфекции. Средство предлагают применять при угрозе «цитокинового шторма» в сочетании с иммунодепрессантом тоцилизумабом.
Кортикостероиды при ковиде
Влияние COVID-19 на иммунную систему
У пациентов с тяжелой формой COVID-19 может развиться системная воспалительная реакция, которая способна привести к повреждению легких и дисфункции множества органов. Противовоспалительные эффекты кортикостероидов могут предотвратить или смягчить эти пагубные эффекты.
Отличие COVID-19 от других коронавирусных инфекций
Патогенез SARS-CoV-2 в корне отличается от патогенеза его предшественников SARS-CoV-1 и MERS, плохие исходы которых коррелируют с виремией и высокой вирусной нагрузкой в легких в момент смерти. В отличие от коронавируса MERS, SARS-CoV-2 редко обнаруживается в крови во время симптоматической фазы covid-19, даже у людей с тяжелым заболеванием. Кроме того, гипоксемия может развиваться, когда вирусная нагрузка в верхних дыхательных путях быстро падает или становится неопределяемой. Пациенты, госпитализированные с covid-19, обычно сообщают о появлении симптомов через 3-5 дней после заражения (усталость, озноб), прогрессирующих до лихорадки и сухого кашля через 48 часов. Переход в тяжелое состояние с гипоксемией происходит через пять-семь дней после начала симптоматического заболевания, примерно через 8-14 дней после первоначального заражения. В исследовании RECOVERY дексаметазон был полезен участникам, лечившимся в течение семи или более дней после начала симптоматической фазы с началом гипоксемии. Таким образом, данные RECOVERY поддерживают использование дексаметазона только у пациентов с гипоксемией, а не у пациентов с более легкой формой заболевания. Данные не подтверждают использование дексаметазона или других кортикостероидов в амбулаторных условиях.
Дексаметозон при ковиде
Кортикостероиды, такие как гидрокортизон и дексаметазон, обладают противовоспалительным, антифибротическим и сосудосуживающим действием, которые специалисты по интенсивной терапии десятилетиями пытались использовать для улучшения состояния пациентов с острым респираторным дистресс-синдромом и септическим шоком. В то время как ранние данные наблюдений из Китая предполагали потенциальное повышение смертности кортикостероидов при COVID-19, в предыдущих исследованиях кортикостероидов при других вирусных пневмониях, особенно тяжелом остром респираторном синдроме (SARS) и ближневосточном респираторном синдроме (MERS), обнаружили связь с отсроченным клиренсом вируса и усиленные опасения, что кортикостероиды могут ухудшить реакцию хозяина на SARS-CoV-2
Рандомизированная оценка терапии COVID-19 (RECOVERY), многоцентровое рандомизированное открытое исследование с участием госпитализированных пациентов с COVID-19, показало, что смертность от COVID-19 была ниже среди пациентов, которые были рандомизированы для приема дексаметазона, чем среди тем, кто получил стандартную помощь. В рекомендациях Центров США по профилактике и контролю заболеваний (CDC) рекомендуется отказаться от терапии кортикостероидами при коронавирусных инфекциях, поскольку стероиды «продлевают репликацию вируса » у пациентов с MER, хотя разница во времени до выведения вируса не была статистически значимой в первичных данных.
Хорошо или плохо?
Метаанализ результатов испытаний при стресс респираторным синдромом показал, что по сравнению с плацебо терапия кортикостероидами снижает риск общей смертности. Никаких преимуществ от дексаметазона не наблюдалось у пациентов, которым не требовался дополнительный кислород при включении.
Кортикостероиды отличные от дексаметозона
Побочные эффекты дексаметозона
Взаимодействие дексаметозона с другими препаратами
Дексаметазон является умеренным индуктором цитохрома P450 (CYP) 3A4. Таким образом, он может снизить концентрацию и потенциальную эффективность сопутствующих лекарств, которые являются субстратами CYP3A4. Клиницисты должны пересмотреть схему приема лекарств пациента, чтобы оценить возможные взаимодействия. Совместное применение ремдезивира и дексаметазона официально не изучалось, но клинически значимое фармакокинетическое взаимодействие не прогнозируется.
Период полувыведения, продолжительность действия и частота приема варьируют в зависимости от кортикостероидов.
Кортикостероид длительного действия : дексаметазон; период полувыведения: от 36 до 72 часов, применять один раз в день. Кортикостероиды средней продолжительности действия : преднизон и метилпреднизолон; период полувыведения: от 12 до 36 часов, применять один раз в день или в два приема ежедневно. Кортикостероид короткого действия : гидрокортизон; период полувыведения: от 8 до 12 часов, вводить в два-четыре приема ежедневно.
Дексаметозон при беременности
Короткий курс приема бетаметазона и дексаметазона, которые, как известно, проникают через плаценту, обычно используется для уменьшения неонатальных осложнений недоношенности у женщин с угрозой преждевременных родов.
Дексаметозон у детей
Дексаметазон может быть полезен для педиатрических пациентов с респираторным заболеванием COVID-19, которым требуется искусственная вентиляция легких. Использование дексаметазона у пациентов, которым требуются другие формы дополнительной кислородной поддержки, следует рассматривать в индивидуальном порядке и, как правило, не рекомендуется для педиатрических пациентов, которым требуется только низкий уровень кислородной поддержки (например, только назальная канюля).
Исходная тяжесть ковида и эффективность дексаметозона
Расширенный курс кортикостероидов
В настоящее время расширенный курс кортикостероидов сверх 10 дней рассматривается только в отдельных случаях тяжелой формы COVID-19.3 Одним из аргументов в пользу длительного лечения является профилактика фиброза после заболевания у пациентов с COVID-19, для которых могут быть установлены факторы риска фиброза легких. Однако при COVID-19 такой продолжительный курс кортикостероидов может непреднамеренно привести к плохим результатам лечения. Следует учитывать возможное влияние стероидов в прокоагулянтной среде пациентов с COVID-19, когда даже антикоагулянтная терапия недостаточно защищает от тромботических осложнений, обнаруживаемых у умерших пациентов. Состояние гиперкоагуляции с глубоким повреждением эндотелия после инфицирования коронавирусом 2 тяжелого острого респираторного синдрома (SARS-CoV-2) играет важную роль в развитии тромбоза. В исследованиях аутопсии пациентов с COVID-19 были замечены диффузные альвеолярные нарушения с тромбами крупных сосудов и микротромбами. Дексаметазон (6 мг в день) демонстрирует тенденцию увеличивать концентрацию фактора свертывания и фибриногена. Кроме того, длительная кортикостероидная терапия может способствовать так называемому синдрому длительного COVID, который проявляется усталостью и психологическими симптомами, в которых могут иметь место побочные реакции на лекарства, связанные со стероидами, такие как миопатия, нервно-мышечная слабость и психиатрические симптомы. Начало терапии метилпреднизолоном более чем через 2 недели после начала острогореспираторного дистресс синдрома может увеличить риск смерти. Протромботическое влияние стероидов в сочетании с их побочными реакциями на лекарства могло способствовать увеличению смертности.
Кортикостероиды, таким образом, кажутся палкой о двух концах в борьбе с COVID-19, и их следует использовать разумно, учитывая соотношение риска и пользы, в качестве краткосрочного (например, до 10 дней) терапевтического средства в избранной группе. пациентов с COVID-19, у которых зарегистрировано улучшение выживаемости. Нет доказательств, подтверждающих долгосрочное использование стероидов у пациентов с COVID-19 для предотвращения потенциальных неблагоприятных последствий, таких как фиброз легких. Напротив, такой продолжительный курс стероидов мог быть вредным.
Высокие дозы глюкокортикоидов усугубляют гипергликемию у людей с диабетом, могут выявить недиагностированный диабет, а у лиц с риском диабета могут спровоцировать гипергликемию и впервые возникший диабет (обычно называемый «стероид-индуцированный диабет»). Кроме того, глюкокортикоиды являются наиболее частой причиной развития у людей с диабетом потенциально опасного для жизни гипергликемического гиперосмолярного состояния
Терапия острого обструктивного синдрома у детей с острыми респираторными заболеваниями
Современная терапия острого обструктивного синдрома дыхательных путей (ООСДП) у детей включает, наряду с бронхолитическими препаратами, противовоспалительную терапию. В качестве противовоспалительных препаратов выбора при ООСДП у детей являются глюкокорти
Today therapy of acute obstructive syndrome of respiratory tract (AOSRT) of children includes antiphlogistic therapy together with bronchial spasmolytic drugs. Glukocorticosteroids are preparations of choice in treatement of AOSRT of children. Effectiveness of treatment defines both correct choice of preparations and optimal means of their release in respiratory tract. In resent years high-active pathogenetically justified effective and safe preparations have been introduced into clinical practice. They allow promptly reserve acute obstruction of upper and lower air passages and substantially control clinical course of disease and support relatively high quality of life.
Несмотря на современные достижения медицины, в ХХI веке распространенность инфекций не только не снижается, а все больше возрастает. Длительное время первое место в структуре инфекционной заболеваемости у детей занимают острые респираторные заболевания (ОРЗ) [1, 2]. Согласно данным государственного отчета Роспотребнадзора, в России заболеваемость ОРЗ у детей за 2012 год составила более 28 млн (28 423 135), или 19 896,3 случая на 100 тыс. детей [3]. Такая высокая распространенность ОРЗ в детском возрасте обусловлена как контагиозностью инфекционного фактора, так и анатомо-физиологическими особенностями детского организма. Значительное место в этиологической структуре ОРЗ отводится вирусным инфекциям. За последние десятилетия идентифицированы новые вирусы, определяющие тяжелое течение ОРЗ с обструкцией дыхательных путей, особенно у детей первых лет жизни. Особое внимание уделяется роли метапневмовируса, короновируса, бокавируса, риновируса, реассортантам вируса гриппа, респираторно-синцитиальному вирусу в развитии обструктивного синдрома дыхательных путей. Их роль в развитии острого обструктивного синдрома дыхательных путей (ООСДП) у детей неоспорима, вместе с этим существуют данные, свидетельствующие о возможной их роли в развитии бронхиальной астмы (БА) у генетически предрасположенных лиц [1, 4].
Острые обструктивные состояния дыхательных путей у детей встречаются достаточно часто и иногда протекают тяжело, сопровождаясь признаками дыхательной недостаточности. Самыми распространенными из них является острый стенозирующий ларинготрахеит (круп), обусловленный воспалением слизистой и подслизистого пространства гортани и трахеи, с вовлечением в процесс тканей и структур подсвязочного пространства и развитием стеноза гортани. Также достаточно часто причиной острых обструктивных состояний дыхательных путей на фоне острой респираторной вирусной инфекции (ОРВИ) у детей являются острый обструктивный бронхит, бронхиолит и БА [5].
Под термином «круп» понимают клинический синдром, сопровождающийся хриплым или сиплым голосом, грубым «лающим» кашлем и затрудненным (стенотическим) дыханием. В отечественной литературе это заболевание описывается под названием «стенозирующий ларинготрахеит», в Международной классификации болезней 10-го пересмотра (МКБ-10) — «острый обструктивный ларингит». Однако в практической работе наибольшее распространение получил термин «круп», который рекомендуется ведущими детскими инфекционистами использовать в качестве общей терминологии.
Бронхообструктивный синдром — это симптомокомплекс функционального или органического происхождения, клинические проявления которого складываются из удлиненного выдоха, свистящего, шумного дыхания, приступов удушья, кашля и др. Термины «бронхообструктивный синдром» и «круп» не могут быть использованы как самостоятельный диагноз.
Распространенность обструктивных состояний дыхательных путей на фоне ОРВИ достаточно высока, особенно у детей первых 6 лет жизни. Это связано с анатомо-физиологическими особенностями респираторного тракта у детей раннего возраста. Так, частота развития бронхиальной обструкции на фоне острых респираторных заболеваний у детей первых лет жизни составляет, по данным разных авторов, от 5% до 50%. Наиболее часто обструктивные состояния отмечаются у детей с отягощенным семейным анамнезом по аллергии. Такая же тенденция имеется и у детей, которые часто, более 6 раз в году, болеют респираторными инфекциями. В западной литературе в настоящее время принят термин «wheezing» — синдром «шумного дыхания», объединяющий ларинготрахеальные причины ООСДП и бронхообструктивный синдром. Отмечено, что свистящие хрипы и одышку хотя бы один раз в жизни имеют 50% детей, а рецидивирующее течение бронхообструкции характерно для 25% детей [2, 6, 7].
Проведенный нами анализ распространенности обструктивного синдрома у детей с ОРЗ, являющегося причиной госпитализации в отделение респираторных инфекций детской городской клинической больницы Святого Владимира г. Москвы, свидетельствует об увеличении в последние годы пациентов с обструктивным синдромом дыхательных путей. Согласно нашим данным, в 2011 г. в респираторное отделение поступило 1348, из них 408 детей — с достаточно тяжелым течением ООСДП на фоне ОРЗ. В последующие годы мы наблюдаем увеличение роли ООСДП, определяющего тяжесть ОРЗ, так, в 2012 г. количество госпитализаций достигло 1636, а детей с ООСДП увеличилось до 669. Следует отметить, что в 90% случаев возраст детей с ООСДП был менее 5 лет. Был проведен анализ причин недостаточной эффективности терапии обструктивных состояний у детей на догоспитальном этапе. Установлено, что основными среди них являются неадекватная оценка тяжести ООСДП и соответственно отсутствие своевременной и рациональной терапии ООСДП, позднее назначение противовоспалительной терапии, отсутствие контроля за техникой выполнения ингаляции.
Высокая частота возникновения ООСДП у детей обусловлена как особенностями инфекционного фактора в современном мире, так и анатомо-физиологическими особенности детского организма. Известно, что иммунная система детей первых лет жизни отличается незрелостью и недостаточными резервными возможностями. Так, ответ врожденной иммунной системы детей первых лет жизни отличается ограниченной секрецией интерферонов (ИФН), недостаточной активностью комплемента, снижением клеточной цитотоксичности. Особенности адаптивного иммунитета в этой возрастной группе пациентов обусловлены Th2-направленностью иммунного ответа, что нередко способствует развитию аллергических реакций, незрелостью гуморального звена иммунного ответа со снижением уровня секреторного иммуноглобулина (Ig) А на слизистых, преимущественной выработкой IgМ на инфекционные патогены. Незрелость иммунного ответа способствует частым ОРЗ и нередко определяет тяжесть их течения [1].
Часто развитие ООСДП у детей первых лет жизни обусловлено анатомо-физиологическими особенностями строения дыхательных путей этой возрастной группы пациентов. Среди них особенно важными являются наличие гиперплазии железистой ткани, секреция преимущественно вязкой мокроты, относительная узость дыхательных путей, меньший объем гладких мышц, низкая коллатеральная вентиляция, особенности строения гортани. Развитие крупа у детей с ОРВИ обусловлено малыми абсолютными размерами гортани, мягкостью хрящевого скелета, рыхлым и вытянутым надгортанником. Все это создает особые предпосылки для компонентов стеноза: спазма и отека. Кроме того, в связи с тем, что пластинки щитовидного хряща у детей сходятся под прямым углом (у взрослых он острый), голосовые связки (складки) становятся непропорционально короткими, и до 7 лет глубина гортани превышает ее ширину. Чем меньше ребенок, тем больше относительная площадь, занимаемая рыхлой соединительной тканью в подскладочном пространстве, что увеличивает объем отека слизистой гортани. У детей первых трех лет жизни гортань, трахея и бронхи имеют относительно меньший диаметр, чем у взрослых. Узость всех отделов дыхательного аппарата значительно увеличивает аэродинамическое сопротивление. Для детей раннего возраста характерны недостаточная ригидность костной структуры грудной клетки, свободно реагирующей втяжением уступчивых мест на повышение сопротивления в воздухоносных путях, а также особенности положения и строения диафрагмы. Недостаточна и дифференцировка нервного аппарата вследствие того, что слиты 1-я и 2-я рефлексогенные зоны на всем их протяжении и не оформлена 3-я рефлексогенная зона, рецепторы которой обильно разветвляются на всей слизистой подскладочного пространства, что способствует возникновению длительного спазма голосовой щели и стенозу гортани. Именно эти особенности способствуют частому развитию и рецидивам обструкции дыхательных путей у детей первых лет жизни, особенно на фоне ОРЗ [1, 5, 8].
Прогноз течения ООСДП может быть довольно серьезен и зависит от формы заболевания, ставшего причиной развития обструкции, и своевременного проведения патогенетически обусловленных схем терапии и профилактики.
Основными направлениями терапии ООСДП у детей являются собственно лечение респираторной инфекции и лечение обструкции дыхательных путей.
Согласно современным данным в механизме развития ООСДП основное место отводят воспалению. Развитие воспаления слизистой оболочки верхних и нижних дыхательных путей способствует гиперсекреции вязкой слизи, формированию отека слизистой оболочки респираторного тракта, нарушению мукоцилиарного транспорта и развитию обструкции. Соответственно, основным направлениям терапии ООСДП является противовоспалительная терапия [9–11].
Воспаление является важным фактором бронхиальной обструкции детей раннего возраста и может быть вызвано различными факторами. В результате их воздействия запускается каскад иммунологических реакций, способствующих выходу в периферический кровоток медиаторов 1-го и 2-го типов. Именно с этими медиаторами (гистамином, лейкотриенами, простагландинами) связаны основные патогенетические механизмы обструктивного синдрома — усиление проницаемости сосудов, появление отека слизистой оболочки бронхов, гиперсекреции вязкой слизи, развитие бронхоспазма.
У детей первых лет жизни именно отек и гиперплазия слизистой оболочки дыхательных путей являются основной причиной обструкции дыхательных путей на разном уровне. Развитые лимфатическая и кровеносная системы респираторного тракта ребенка обеспечивают ему многие физиологические функции. Однако в условиях патологии характерным для отека является утолщение всех слоев бронхиальной стенки (подслизистого и слизистого слоя, базальной мембраны), что ведет к нарушению проходимости дыхательных путей. При рецидивирующих бронхолегочных заболеваниях нарушается структура эпителия, отмечается его гиперплазия и плоскоклеточная метаплазия.
Другим не менее важным механизмом ООСДП у детей первых лет жизни является нарушение бронхиальной секреции, которое развивается при любом неблагоприятном воздействии на органы дыхания и в большинстве случаев сопровождается увеличением количества секрета и повышением его вязкости. Функция слизистых и серозных желез регулируется парасимпатической нервной системой, ацетилхолин стимулирует их деятельность. Такая реакция изначально носит защитный характер. Однако застой бронхиального содержимого приводит к нарушению вентиляционно-респираторной функции легких. Продуцируемый густой и вязкий секрет, помимо угнетения цилиарной активности, может вызвать бронхиальную обструкцию вследствие скопления слизи в дыхательных путях. В тяжелых случаях вентиляционные нарушения сопровождаются развитием ателектазов.
Немалая роль в развитии бронхообструктивного синдрома (БОС) отводится гиперреактивности бронхов. Гиперреактивность бронхов — это повышение чувствительности и реактивности бронхов к специфическим и неспецифическим раздражителям. Причиной гиперреактивности бронхов является нарушение равновесия между возбуждающими (холинергическая, нехолинергическая и α-адренергическая системы) и ингибирующими (β-адренергическая система) влияниями на тонус бронхов. Известно, что стимуляция β2-адренорецепторов катехоламинами, также как повышение концентрации цАМФ и простагландинов Е2, уменьшает проявления бронхоспазма. Согласно классической теории A. Szentivanyi (1968 г.) у больных с гиперреактивностью бронхов имеется дефект в биохимической структуре β2-рецепторов, сводящийся к недостаточности аденилатциклазы. У этих пациентов снижено число β-рецепторов на лимфоцитах, имеется дисбаланс адренорецепторов в сторону гиперчувствительности α-адренорецепторов, что предрасполагает к спазму гладких мышц, отеку слизистой оболочки, инфильтрации и гиперсекреции. Наследственно обусловленная блокада аденилатциклазы снижает чувствительность β2-адренорецепторов к адреномиметикам, что достаточно часто встречается у больных БА. В то же время некоторые исследователи указывают на функциональную незрелость β2-адренорецепторов у детей первых месяцев жизни.
Установлено, что у детей раннего возраста достаточно хорошо развиты М-холинорецепторы, что, с одной стороны, определяет особенности течения бронхообструктивных заболеваний у этой группы пациентов (склонность к развитию обструкции, продукция очень вязкого бронхиального секрета), с другой стороны, объясняет выраженный бронхолитический эффект М-холинолитиков у них.
Таким образом, анатомо-физиологические особенности детей раннего возраста определяет как высокую распространенность ООСДП у детей первых лет жизни, так и механизмы его развития с соответствующей клинической картиной «влажной астмы».
Терапия ООСДП должна быть начата непосредственно после выявления симптомов у постели больного. Необходимо безотлагательно начинать неотложную терапию и одновременно выяснять причины бронхообструкции.
Основные направления неотложной терапии ООСДП включают в себя мероприятия по бронхолитической, противовоспалительной терапии, улучшению дренажной функции бронхов и восстановлению адекватного мукоцилиарного клиренса. Тяжелое течение приступа бронхообструкции требует проведения оксигенации вдыхаемого воздуха, а иногда искусственной вентиляции легких.
Проведение неотложной терапии ООСДП у детей должно проводиться с учетом патогенеза формирования обструкции в различные возрастные периоды. В генезе БОС у детей раннего возраста преобладают воспалительный отек и гиперсекреция вязкой слизи, а бронхоспазм выражен незначительно. С возрастом увеличивается гиперреактивность бронхов и вместе с этим возрастает роль бронхоспазма.
Основными направлениями терапии острых обструктивных состояний верхних и нижних дыхательных путей у детей с ОРЗ являются лечение самой респираторной инфекции и лечение обструкции дыхательных путей [12]. Безусловно, лечение ОРЗ должно быть комплексным и индивидуальным в каждом конкретном случае.
Этиотропная терапия наиболее частых вирусных инфекций в настоящее время является затруднительной в силу узости спектра действия противовирусных препаратов, возрастного ограничения их применения у детей в первые годы жизни, недостаточности доказательной базы эффективности данной группы препаратов. В настоящее время активно используются в терапии ОРЗ вирусной этиологии препараты рекомбинантного интерферона и препараты, стимулирующие синтез эндогенного интерферона. Назначение антибактериальных препаратов показано в случае длительной лихорадки (более 3–4 суток), и/или наличии признаков дыхательной недостаточности при отсутствии БОС, и/или при подозрении на пневмонию, и/или выраженных изменений в клиническом анализе крови.
Современные стандарты терапии обструктивных состояний респираторного тракта определены в международных и национальных программных документах [5, 9, 13], согласно которым основными препаратами в терапии ООСДП являются бронхолитические препараты и препараты с противовоспалительным действием. В качестве эффективной противовоспалительной терапии рекомендуют широкое использование ингаляционных глюкокортикостероидов (ИГКС). ИГКС являются наиболее эффективным средством лечения острого стенозирующего ларинготрахеита, бронхиальной астмы и острого обструктивного бронхита. Механизм их лечебного действия связан с мощным противовоспалительным эффектом. Противовоспалительный эффект ИГКС связан с ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов (интерлейкинов), провоспалительных медиаторов и их взаимодействия с клетками-мишенями. ИГКС оказывают влияние на все фазы воспаления, независимо от его природы, при этом ключевой клеточной мишенью могут являться эпителиальные клетки дыхательных путей. ИГКС прямо или косвенно регулируют транскрипцию генов клеток-мишеней. Они увеличивают синтез противовоспалительных белков (липокортина-1) или снижают синтез провоспалительных цитокинов — интерлейкинов, фактора некроза опухолей и др. При длительной терапии ИГКС у больных с бронхиальной астмой значительно снижается количество тучных клеток и эозинофилов на слизистых дыхательных путей, происходит стабилизация клеточных мембран, мембран лизосом и уменьшается проницаемость сосудов.
Помимо уменьшения воспалительного отека слизистой оболочки и гиперреактивности бронхов ИГКС улучшают функцию β2-адренорецепторов как путем синтеза новых рецепторов, так и повышая их чувствительность. Поэтому ИГКС потенцируют эффекты β2-агонистов.
Ингаляционное применение ГКС создает высокие концентрации препаратов в дыхательных путях, что обеспечивает максимально выраженный местный противовоспалительный эффект и минимальные проявления системных (нежелательных) эффектов.
Однако эффективность и безопасность ИГКС в терапии ООСДП у детей во многом определяется способом доставки их непосредственно в дыхательные пути и техникой выполнения ингаляции [14, 16]. В качестве средств доставки в настоящее время имеются дозирующие аэрозольные ингаляторы (ДАИ), ДАИ со спейсером и лицевой маской (аэрочэмбер, бебихалер), ДАИ, активируемые вдохом пациента, порошковые ингаляторы и небулайзеры. В настоящее время признано, что оптимальной системой доставки лекарственных препаратов в дыхательные пути при ООСДП у детей раннего возраста является небулайзер. Его использование способствует наилучшей положительной динамике клинических данных, достаточному бронхорасширяющему эффекту периферических отделов бронхов, и техника его использования практически безошибочна. Основной целью небулайзерной терапии является доставка терапевтической дозы требуемого препарата в аэрозольной форме за короткий период времени, обычно за 5–10 мин. К ее преимуществам относятся: легко выполнимая техника ингаляции, возможность доставки более высокой дозы ингалируемого вещества и обеспечение проникновения его в плохо вентилируемые участки бронхов. У детей раннего возраста необходимо использовать маску соответствующего размера, с 3–4 лет лучше использовать мундштук, чем маску, т. к. применение маски снижает дозу ингалируемого вещества за счет его оседания в носоглотке.
В настоящее время в практической деятельности врача могут быть использованы следующие ИГКС: беклометазон, будесонид, флутиказона пропионат, мометазона фуроат и циклесонид. Необходимо отметить возрастные аспекты назначения ИГКС у детей. Так, у детей с 6-месячного возраста разрешен к применению в ингаляциях через компрессорный небулайзер препарат суспензия будесонида, с 12 месяцев — флутиказона пропионат через спейсер, беклометазона пропионат разрешен для использования в детской практике с 4 лет, циклесонид с 6 лет, а мометазона фуроат с 12-летнего возраста.
Для проведения небулайзерной терапии используются только специально предназначенные для этих целей растворы лекарственных средств, разрешенные Фармакологическим комитетом РФ для небулайзеров. При этом даже маленькая частица раствора в аэрозоле сохраняет все лекарственные свойства вещества, сами растворы для небулайзерной терапии не вызывают повреждения слизистой бронха и альвеол, а упаковка в виде флаконов или небул позволяет удобно дозировать препараты как в стационарных, так и в домашних условиях.
Совсем недавно в нашей стране была зарегистрирована целая линейка препаратов, предназначенных для небулайзерной терапии, включающая ИГКС — будесонид (Буденит Стери-Неб) и 3 бронхолитика: сальбутамол (Саламол Стери-Неб), ипратропия бромид (Ипратропиум Стери-Неб) и комбинацию сальбутамол/ипратропия бромид (Ипрамол Стери-Неб).
Препарат Буденит Стери-Неб (будесонид) является генериком оригинального препарата будесонида Пульмикорт суспензия. Согласно определению Управления по надзору за качеством пищевых продуктов и лекарственных средств США (Food and Drugs Administration of the United States, FDA), генерик (дженерик) — это лекарственный препарат, сравнимый с оригинальным лекарственным препаратом по лекарственной форме, силе действия, способу назначения, качеству, фармакологическим свойствам и показаниям к назначению. Для препаратов-генериков, соответствующих этому определению, характерно: соответствие фармакопейным требованиям, производство в условиях GMP (Good Manufacturing Practice — надлежащая производственная практика), почти полное соответствие оригинальному продукту по составу (вспомогательные вещества могут быть иными) и производимым эффектам, отсутствие патентной защиты, более доступная цена, чем у оригинального препарата.
Все вышеперечисленные характеристики можно отнести к Стери-Небам. Препараты в небулах созданы по передовой технологии 3-ступенчатого «горячего запечатывания, что позволяет достигать максимальной стерильности. В каждом Стери-Небе содержится одна доза лекарственного вещества, и препарат полностью готов к применению (не требует разведения), что исключает ошибки дозирования [15]. Пластиковые ампулы Стери-Неба легко открываются. Лекарственные препараты, находящиеся в Стери-Небах, не содержат бензалкония хлорида и прочих консервантов, что делает их более безопасными, а это очень важно при использовании, особенно в педиатрической практике.
Таким образом, основные принципы терапии бронхообструкции — противовоспалительное лечение и применение бронхолитиков. Именно ИГКС являются важной составляющей противовоспалительной терапии БОС. В настоящее время небулизированный будесонид при обострении БА рассматривается в качестве альтернативы системным глюкокортикостероидам [13]. Преимуществом будесонида при ингаляционном назначении является более быстрое действие ГКС (в течение 1–3 ч), максимальное улучшение бронхиальной проходимости через 3–6 часов, снижение гиперреактивности бронхов и гораздо более высокий профиль безопасности.
С учетом того факта, что в большинстве клинических исследований небулайзерной терапии будесонидом использовался оригинальный препарат Пульмикорт (суспензия), для оценки сопоставимости результатов этих исследований в отношении Буденита Стери-Неб было выполнено сравнение фармацевтической эквивалентности данных препаратов.
Прямое сравнение терапевтической эффективности и безопасности Буденита Стери-Неб (ТEVA, Израиль) и Пульмикорта (суспензии) (AstraZeneca, Великобритания) было проведено в многоцентровом рандомизированном плацебо-контролируемом исследовании в когорте детей (от 5 лет до 11 лет 8 мес), доставленных в отделения неотложной помощи в связи с обострением бронхиальной астмы (исследование III фазы в параллельных группах; 23 исследовательских центра набирали пациентов в 6 странах — Эстонии, Израиле, Латвии, Польше, Колумбии и Мексике). В исследование было включено 302 ребенка. Буденит Стери-Неб (0,5 мг/2 мл и 1 мг/2 мл) и Пульмикорт суспензия (0,5 мг/2 мл и 1 мг/2 мл) значимо не различались по компонентному составу, размеру частиц суспензии, распределению частиц генерируемого аэрозоля по размерам, количеству будесонида во вдыхаемой смеси. Таким образом, химико-фармакологические исследования Буденита Стери-Неб и оригинального препарата Пульмикорт выявили эквивалентность суспензии будесонида двух производителей по основным показателям, влияющим на терапевтический эффект ИГКС. Была продемонстрирована терапевтическая эквивалентность и схожий профиль безопасности Буденита Стери-Неб и оригинального препарата Пульмикорт (суспензия), что позволяет экстраполировать данные, полученные в исследованиях небулизированного будесонида [16].
Таким образом, согласно международным и национальным рекомендациям, наиболее оптимальным, доступным и эффективным препаратом противовоспалительной терапии острого стенозирующего ларинготрахеита, бронхообструктивного синдрома у детей с 6 месяцев жизни является суспензия будесонида с ингаляционным использованием через небулайзер. Появление на фармацевтическом рынке качественных генериков в форме Стери-Небов, в том числе и будесонида (Буденит Стери-Неб), расширяет выбор врача-педиатра при терапии острого стенозирующего ларинготрахеита и бронхообструктивного синдрома у детей. Раннее назначение данного препарата при ООСДП является залогом благоприятного прогноза и предупреждения осложнений.
Данные регламентирующих документов [5, 9, 13] и результаты собственных клинических наблюдений свидетельствуют, что назначение современных ИКС является высокоэффективным и безопасным методом терапии ООСДП тяжелого течения. У детей с 6-месячного возраста и старше наилучшим является ингаляционное введение будесонида через небулайзер в суточной дозе 0,25–1 мг/сутки (объем ингалируемого раствора доводят до 2–4 мл, добавляя физиологический раствор). Препарат можно назначать 1 раз в сутки, однако, как свидетельствует наш опыт, на высоте тяжелого приступа бронхообструкции или стенозе гортани 2–3 степени у детей первых лет жизни более эффективны ингаляции препарата 2 раза в сутки. У больных, ранее не получавших ИКС, целесообразно начать с дозы 0,5 мг через каждые 12 часов, а на 2–3 день, при хорошем терапевтическом эффекте, переходят на 0,25–0,50 мг 1 раз в сутки. Целесообразно назначать ИГС через 15–20 минут после ингаляции бронхолитика, однако возможно и одновременное использование обоих препаратов в одной камере небулайзера. Продолжительность терапии ингаляционными кортикостероидами определяется характером заболевания, длительностью и тяжестью течения обструкции, а также эффектом от проводимой терапии. У детей при остром обструктивном бронхите с тяжелой бронхиальной обструкцией необходимость в терапии ИКС обычно составляет 5–7 дней, а у детей с крупом — 2–3 дня.
Брнхолитическая терапия
В качестве препаратов бронхолитической терапии при БОС могут быть использованы β2-адреномиметики, антихолинергические препараты и их сочетание, а также теофиллины короткого действия.
Согласно национальным рекомендациям препаратами первого выбора являются β2-адреномиметики короткого действия (сальбутамол, тербуталин, фенотерол). Действие данной группы препаратов начинается через 5–10 минут после ингаляции и продолжаются 4–6 часов. Разовая доза сальбутамола, ингалируемого через ДАИ, составляет 100–200 мкг (1–2 дозы), при использовании небулайзера разовая доза может быть значительно увеличена и составляет 2,5 мг (небулы по 2,5 мл 0,1% раствора). Алгоритм неотложной терапии тяжелого БОС предполагает проведение трех ингаляций β2-агониста короткого действия в течение 1 часа с интервалом в 20 минут. Препараты этой группы высокоселективны, следовательно, имеют минимальные побочные эффекты. Однако при длительном бесконтрольном применении β2-агонистов короткого действия возможно усиление бронхиальной гиперреактивности и снижение чувствительности β2-адренорецепторов к препарату.
В качестве бронхолитической терапии с учетом патогенетических механизмов БОС могут быть использованы антихолинергические препараты (ипратропиума бромид). Эта группа препаратов блокируют мускариновые М3-рецепторы для ацетилхолина. Бронходилатирующий эффект ингаляционной формы ипратропиума бромида развивается через 15–20 минут после ингаляции. Через ДАИ со спейсером однократно ингалируют 2 дозы (40 мкг) препарата, через небулайзер — 8–20 капель (100–250 мкг) 3–4 раза в сутки. Антихолинэргические препараты в случаях БОС, возникших на фоне респираторной инфекции, несколько более эффективны, чем α2-агонисты короткого действия.
В настоящее время установлено, что физиологической особенностью детей раннего возраста является наличие относительно небольшого количества адренорецепторов, с возрастом отмечается увеличение их числа и повышение чувствительности к действию медиаторов. Чувствительность М-холинорецепторов, как правило, достаточно высока с первых месяцев жизни. Эти наблюдения послужили предпосылкой для создания комбинированных препаратов. Наиболее часто в комплексной терапии БОС у детей раннего возраста в настоящее время используется комбинированный препарат, сочетающий 2 механизма действия: стимуляцию адренорецепторов и блокаду М-холинорецепторов. При совместном применении ипратропия бромида и фенотерола бронхорасширяющий эффект достигается путем воздействия на различные фармакологические мишени [9, 11, 13].
Муколитическая и отхаркивающая терапия
Муколитическая и отхаркивающая терапия детям с ООСДП инфекционного генеза проводится с учетом возраста ребенка, тяжести течения респираторной инфекции, количества продуцируемой мокроты и ее реологических свойств. Основной целью является разжижение мокроты, снижение ее адгезивности и увеличение эффективности кашля.
При наличии у детей малопродуктивного кашля с вязкой мокротой целесообразно сочетать ингаляционный (через небулайзер) и пероральный путь введения муколитиков, наилучшими из которых являются препараты амброксола (Лазолван, Амбробене, Амброгексал и др.). Эти препараты хорошо зарекомендовали себя в комплексной терапии бронхообструктивного синдрома у детей. Они обладают выраженным муколитическим и мукокинетическим эффектом, умеренным противовоспалительным действием, увеличивают синтез сурфактанта, не усиливают бронхообструкцию, практически не вызывают аллергических реакций. Препараты амброксола при респираторной инфекции детям назначают по 7,5–15 мг 2–3 раза в сутки в виде сиропа, раствора и/или ингаляционно.
Детям с навязчивым малопродуктивным кашлем, отсутствием мокроты целесообразно назначение отхаркивающих лекарственных средств: щелочного питья, фитопрепаратов и др. Фитопрепараты детям с аллергией надо назначать с осторожностью. Можно рекомендовать препараты, созданные из натурального растительного сырья с использованием современных технологий (экстракт листьев плюща — Проспан, Бронхипрет и др.). Возможно сочетание отхаркивающих и муколитических лекарственных средств.
Таким образом, особенностью течения ОРЗ у детей первых лет жизни является частое развитие острых обструктивных состояний дыхательных путей. Основные причины острых обструктивных состояний дыхательных путей у детей с ОРВИ — острый стенозирующий ларинготрахеит, острый обструктивный бронхит, бронхиолит и бронхиальная астма. Эти состояния требуют неотложного проведения терапии. Основным способом доставки препаратов в период обострения заболевания является ингаляционный с использованием небулайзеров. Основными направлениями терапии при ООСДП являются назначение противовоспалительных препаратов, бронхолитических и муколитических препаратов. Препаратами выбора противовоспалительной терапии при ООСДП являются ИГКС. Своевременно назначенная рациональная терапия ООСДП — залог быстрого купирования ООСДП и предупреждения жизнеугрожающих состояний.
При информационной поддержке ООО «ТЕВА»
Литература
С. В. Зайцева, кандидат медицинских наук
С. Ю. Снитко
О. В. Зайцева, доктор медицинских наук, профессор
Э. Э. Локшина, кандидат медицинских наук
ГБОУ ВПО МГМСУ им А. И. Евдокимова МЗ РФ, Москва