Для чего нужен аппарат кирюшкина в химии кратко
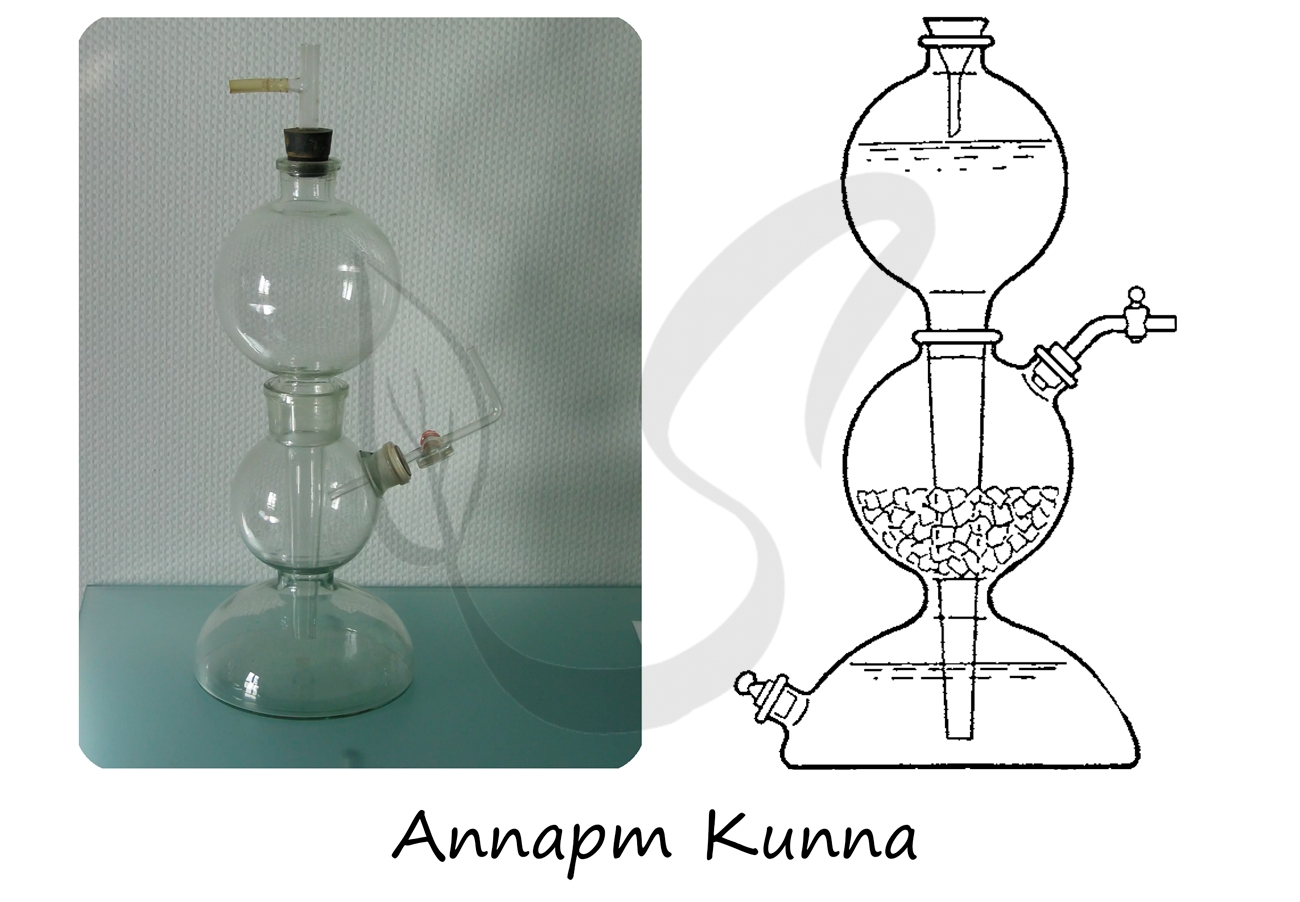
Аппарат Киппа — прибор для получения газов
Аппарат Киппа — прибор автоматического действия для получения газов путем 
Аппарат Киппа — его еще называют газогенератор Киппа, назван по фамилии голландского аптекаря Петера-Якоба Киппа. Он владел компанией, которая в XIX веке разработала и выпускала эти приборы. Газогенератор Киппа был основан на похожем устройстве, которое массово выпускалось в Германии — на огниве Дёбернейера (зажигалке Дёбернейера). Там использовался тот же принцип, на котором стал работать аппарат Киппа: водород, который потом самоподжигался на воздухе в присутствии катализатора, получался при взаимодействии серной кислоты и цинковой пластины. Чтобы остановить горение и химическую реакцию, достаточно было перекрыть выпускной клапан и давление газа оттесняло кислоту от пластины. В отличие от огнива Дёбернейера, аппарат Киппа более универсален и подходит для получения различных газов.
Для чего пригоден газогенератор Киппа

Прибор подходит для получения разных газов. Чаще всего с его помощью получают:
— водород (взаимодействием цинка и соляной кислоты);
— углекислый газ CO2 (мрамор, мел или известняк CaCO3 и соляная кислота);
— ацетилен C2H2 (карбид кальция CaC2 и вода);
— хлор (перманганат калия KMnO4 и соляная кислота);
— сероводород H2S (сульфид железа FeS и соляная кислота);
— оксид азота NO (медь и азотная кислота).
Как устроен аппарат Киппа
Прибор состоит из трех основных частей:
1. Внизу: полусферический резервуар, соединенный горловиной с шаром-реактором, расположенным над резервуаром.
2. Газоотводная трубка со стеклянным краном или зажимом Мора, которая подсоединяется к отводу реактора.
3. Вверху: воронка со сферическим расширением и с длинным носиком-стоком, который проходит через весь прибор до самого дна. Воронка вставляется в горловину реактора герметично.
Дополнительно используются:
— Предохранительная склянка Вульфа, через которую пропускается получаемый газ, 
— В верхнюю воронку обычно вставляют предохранительную воронку, которая поглощает пары кислоты.
— Резервуар часто тоже снабжают отводом с пробкой, через который удобно сливать использованную кислоту и промывать аппарат.
— Между резервуаром и реактором устанавливают или решетку, на которую насыпают твердый реагент, или пробку с перфорацией, которая не мешает кислоте взаимодействовать с твердым реагентом в реакторе.
— Манометр и другие приспособления для того, чтобы обеспечить поддержание определенного давления газа.
Как действует газогенератор Киппа
В собранный прибор через боковой отвод реактора насыпают твердый реактив. Реактив должен быть в виде кусочков, а не мелкого порошка (порошок вступает в реакцию слишком быстро). Потом на отвод надевается резиновая трубка с открытым краном или зажимом.
Следующий шаг — залить через воронку жидкий реактив, так чтобы его уровень достиг твердого реактива в реакторе и началась химическая реакция.
Примерно в течение 5 минут ждут, чтобы газ полностью вытеснил воздух из аппарата, и закрывают кран (зажим) на газоотводной трубке. Давление газа вытеснит всю жидкость из реактора обратно в воронку и реакция прекратится.
Аппарат готов к работе. Стоит открыть газоотводную трубку, как давление газа уменьшится, жидкость поднимется до реактора, химическая реакция запустится вновь и газ будет генерироваться до тех пор, пока не закончится весь реактив. Чтобы прекратить выделение газа, достаточно перекрыть газоотводную трубку, поэтому этот газогенератор и называют аппаратом автоматического действия.
Урок Практическая работа «Получение водорода и исследование его свойств.»
Тема: Практическая работа № 4 Получение водорода и исследование его свойств.
МБОУ «С(К)ОШ №16», учитель химии Березинская А.А.
работа над развитием навыков умелого обращения с огнем, опасными веществами.
умение составлять уравнения химических реакций, умение делать выводы, соблюдать правила техники безопасности;
расширение кругозора обучающихся, формирование уважения к истории науки.
Коррекционные цели: коррекция и развитие связной устной и письменной речи, коррекция и развитие моторной памяти, развитие умений делать выводы.
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
гранулы цинка, соляная кислота (разб.), оксид меди (II).
Тип урока : урок- практикум (виртуальная лаборатория)
Правила техники безопасности : Работа со спиртовкой; р абота со стеклом; Проверка прибора на герметичность.
I. Подготовка к проведению практической работы.
Инструктаж по технике безопасности при работе с сухим горючим.
Технический инструктаж о проведении практической работы.
II. Актуализация знаний
Какие исходные вещества будем использовать мы для получения водорода?
Необходимо ли нагревать реакционную смесь?
На что обратить внимание при записи наблюдений?
Какой прибор будем использовать для получения водорода?
Какими способами можно собрать водород, почему?
Знакомство с инструкцией: учебник стр. ________
III. Проведение практической работы (просмотр видео: Получение водорода.)
III. Закрепление знаний, умений, навыков.
После проведения работы сделать вывод, записать все результаты в тетрадь.
Домашнее задание: § ________.
Практическая работа № 4.Получение водорода и исследование его свойств.
С правилами ТБ ознакомлен (а)
Цель: научиться получать, собирать водород; изучить физические и химические свойства водорода.
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага,спиртовка, спички, автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой.
Реактивы: гранулы цинка, соляная кислота (разб.), оксид меди (II).
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
из газоотводной трубки выделяется бесцветный газ
при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.

3. Обнаружение водорода – проверка его на чистоту
при сжигании первой порции газа раздается резкий лающий звук
при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
порошок меняет цвет с черного на медный
на стенках пробирки появляются бесцветные капельки жидкости
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разбавленной соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-446860
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Класс: 8
Презентации к уроку
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
Планируемые результаты обучения:
Оборудование:
Методы и приемы:
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:
На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:
Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
Просмотр двух видеороликов.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.

3. Обнаружение водорода – проверка его на чистоту
4. Свойство водорода – активный восстановитель
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Зачем в аппарате кирюшкина резиновое кольцо?
Зачем в аппарате кирюшкина резиновое кольцо?
Нижний резервуар и колба реактор разделены на резиновый или пластиковой прокладкой отверстием через который проходит в нижний резервуар длинная трубка.
Какой лабораторное оборудование можно закрепить с помощью кольца на штативе?
Какой лабораторное оборудование можно закрепить с помощью кольца на штативе.
Растяните и сожмите сначала резиновый ластик, потом мяч?
Растяните и сожмите сначала резиновый ластик, потом мяч.
Почему мяч удается сдать сильнее?
Серебряное кольцо весит 4 г сколько атомов серебра в этом кольце.
Из углерода нужно получить бензольное кольцо?
Из углерода нужно получить бензольное кольцо.
В золотом кольце 4 г золота?
В золотом кольце 4 г золота.
Какое количество вещества чистого золота в таком кольце?
Можно пожалуйста с дано и решением.
Опишите принцип работы аппарата Киппа?
Опишите принцип работы аппарата Киппа.
Анализ показал, что золотое кольцо массой 3?
Анализ показал, что золотое кольцо массой 3.
5г на 95% состоит из золота а остальные примеси какова масса примесей в кольце.
Ароматическое кольцо СН2СН2СН3 (пропилбензол)?
Ароматическое кольцо СН2СН2СН3 (пропилбензол).
Гипохлорита кольция и хлорида хром?
Гипохлорита кольция и хлорида хром.
Sr + 2H2O→Sr(OH)2 + H2 S + 2Na→Na2S.
V(N2) = 8 моль * 22, 4 = 179, 2л V(газа) = n * 22, 4.
А), д) и может быть, б)(но скорее всего это больше для морской воды, которая не пригодна, как сами решите).
А) 2 2NaOH + Zn = >Na2ZnO2 + H2 бесцветный газ водород б) 4 CuSO4 + Zn = >ZnSO4 + Cu красный осадок медь в)1 Ag + 2HNO3(конц) = >AgNO3 + NO2 + H2O бурый газ оксид азота(IV).
1. Соединение. 2. Обмен. 3. Замещение. 4. Обмен. 5. Замещение. 6. Обмен.
Химическое соединение Химическое соединение (hs) Химическое соединение (сложное вещество) — сложное вещество, состоящее из химически связанных атомов двух или нескольких элементов. Некоторые простые вещества также могут рассматриваться как химически..
Лабораторная посуда
Требования, которым должна соответствовать химическая посуда:
В данной статье мы классифицируем всю химическую посуду на три группы по ее назначению: мерная, немерная и специального применения.
Мерная химическая посуда
Мерная посуда имеет точную градуировку, нагреванию ее не подвергают.
Пипетки служат для отбора жидкостей (до 100 мл) и газов (от 100 мл)
Применяются для измерения точных объемов, титрования (метод количественного/качественного анализа в аналитической химии)
С помощью мерных колб, мензурок и цилиндров отмеривают и хранят определенные объемы жидкостей.
Немерная химическая посуда (общего назначения)
К такой химической посуде относятся изделия, многие из которых употребляются с нагревом: пробирки, стаканы, колбы (плоскодонные, круглодонные, конические), реторты.
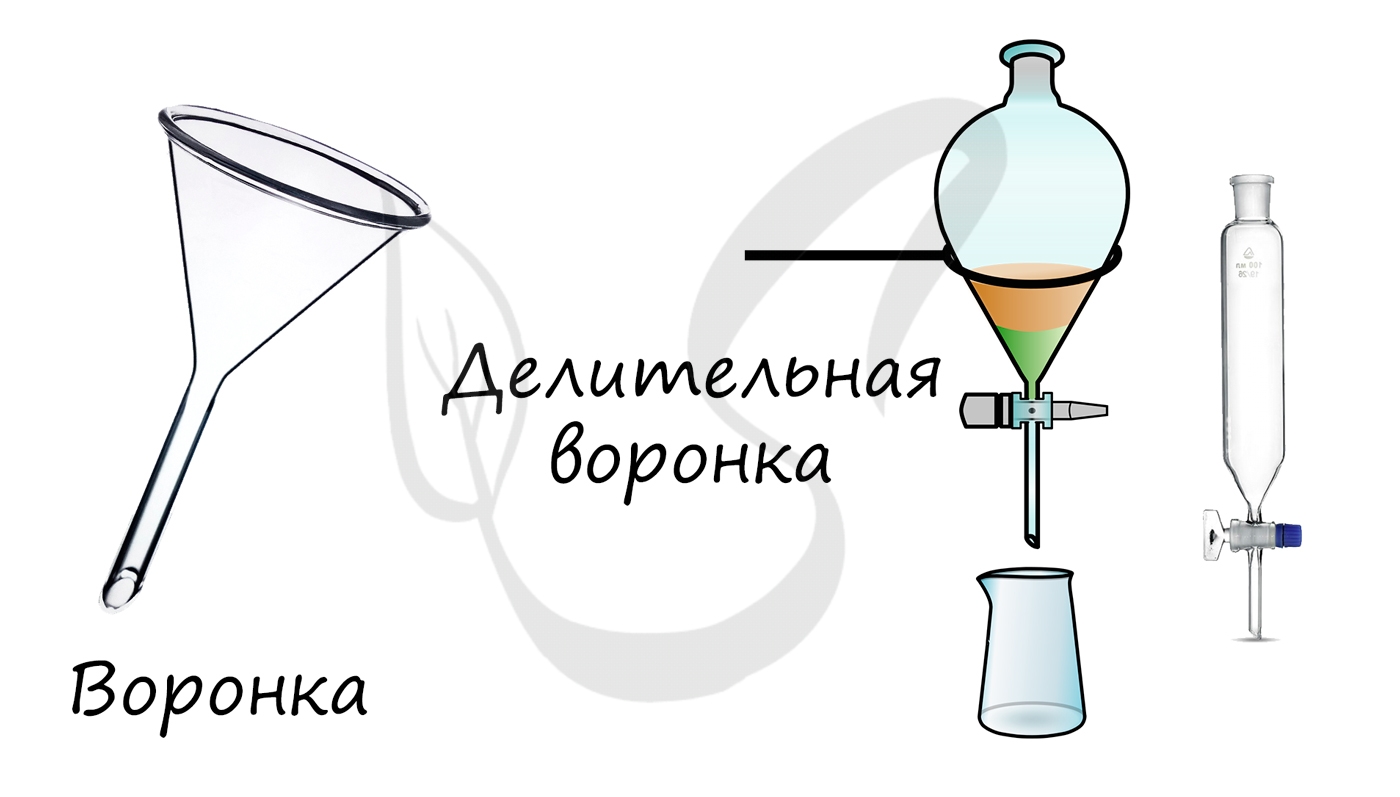
Служат для переливания и фильтрования жидкостей. Делительные воронки применяются для разделения несмешивающихся жидкостей.
Сифон химический применяется для безопасного перекачивания жидких сред из бутылей, бочек, канистр. Особенно важен сифон в работе с агрессивными опасными химическими веществами.
Химическая капельница применяется для дозирования растворов и индикаторов.
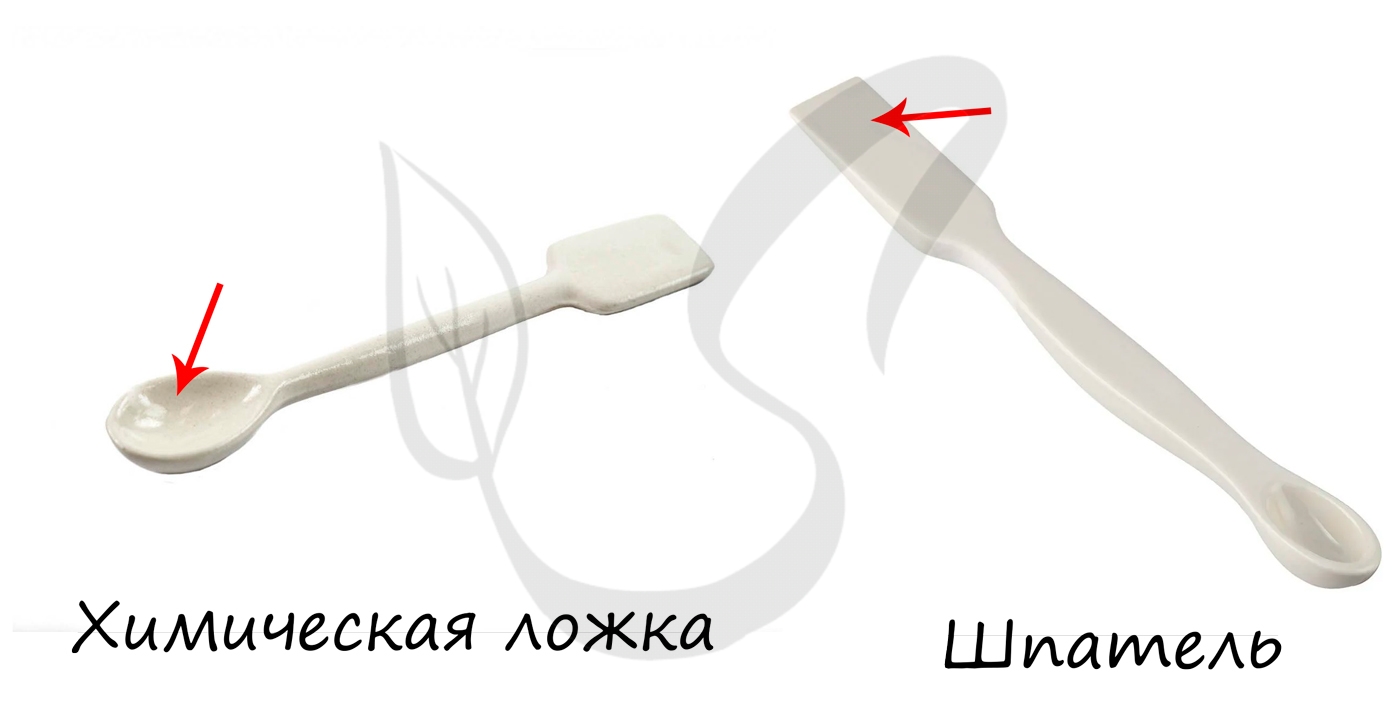
Используются с целью взятия твердых и сыпучих веществ. Могут служить для перемешивания жидкостей.
Применяется для одновременного размещения и закрепления множества пробирок.
Химическая посуда специального назначения
Данная посуда отличается тем, что предназначена для какой-либо одной цели.
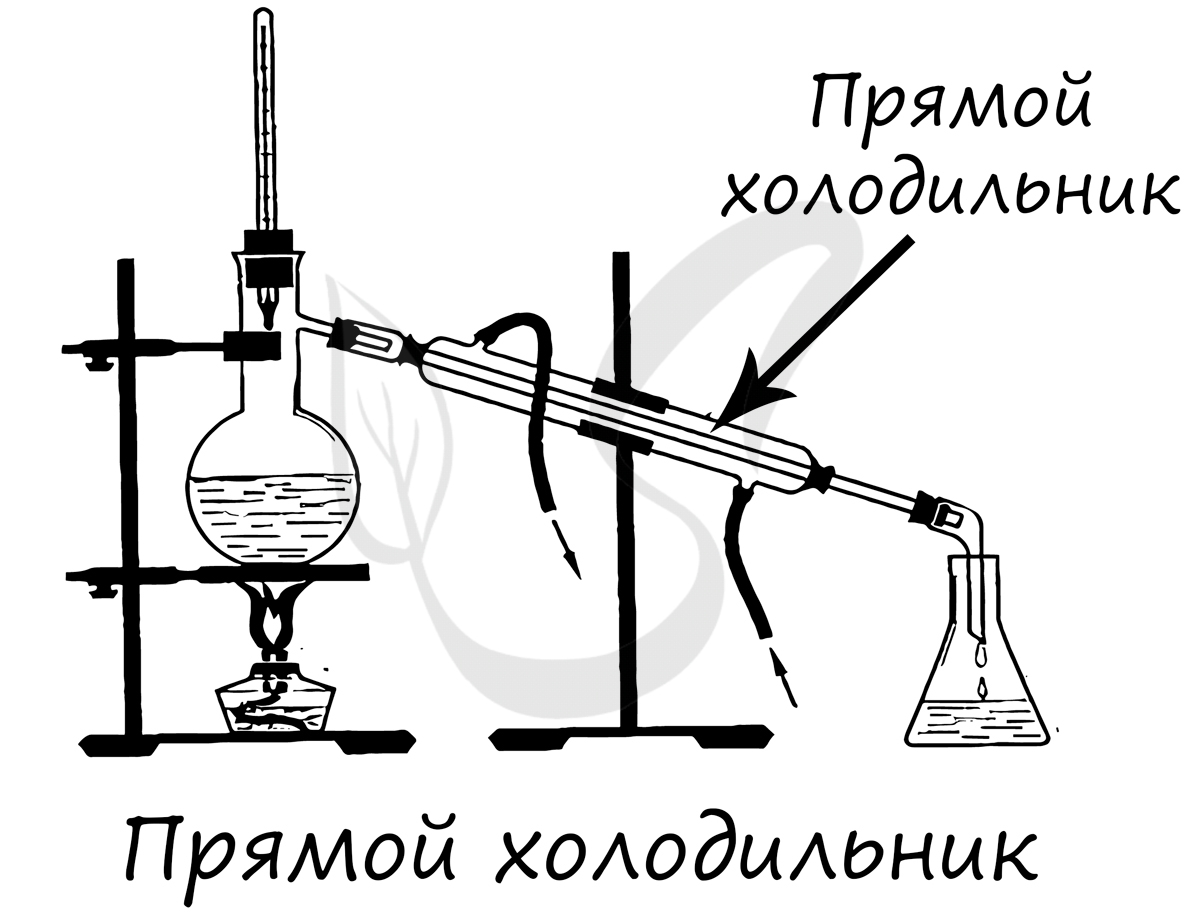
Круглодонная колба с отводом для вставки прямоточного холодильника. Используется для перегонки различных веществ.
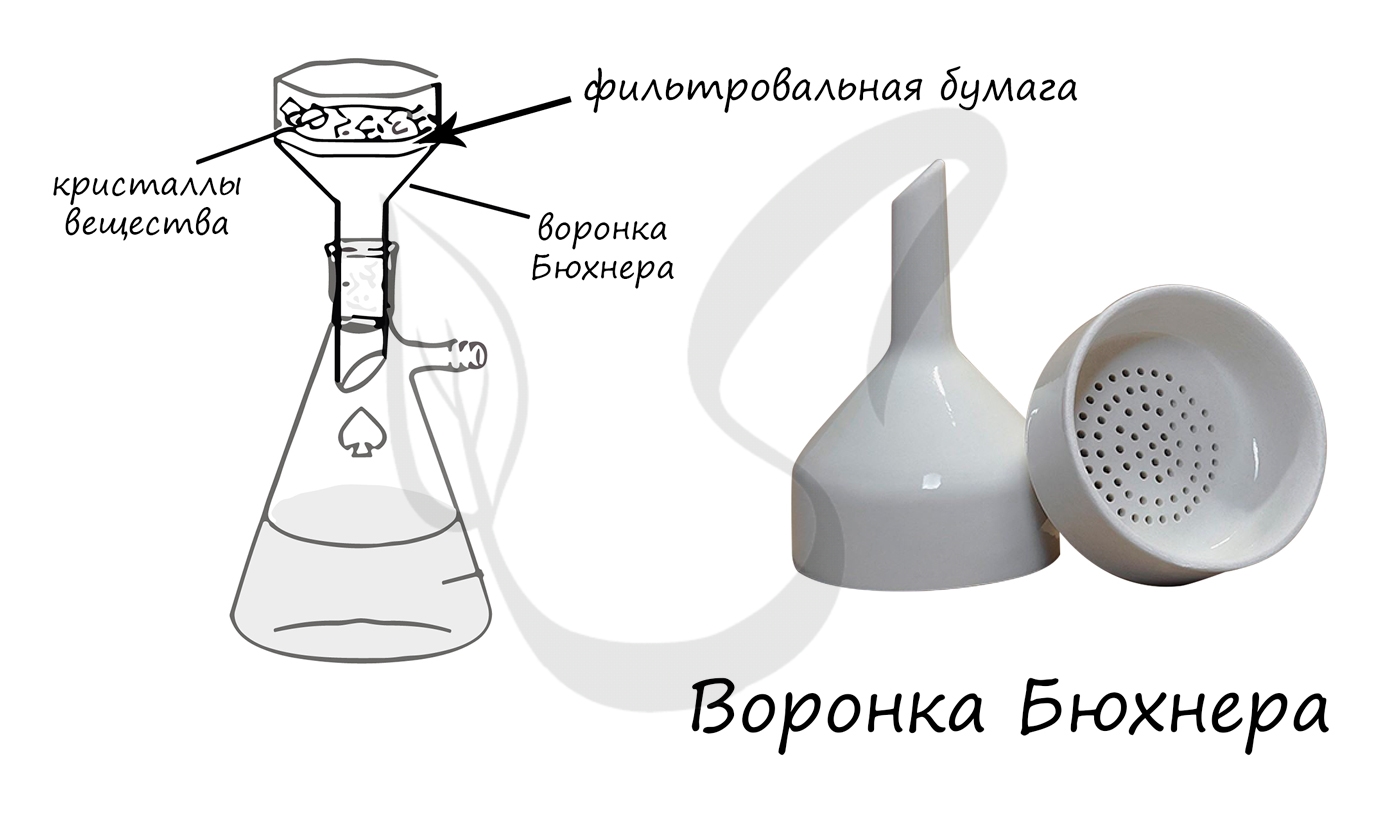
Плоскодонная коническая колба, которая применяется для вакуумного фильтрования.
Применяется для фильтрования растворов при помощи фильтровальной бумаги под вакуумом.
Фильтр Шотта представляет собой стеклянную пористую пластинку. Фильтр Шотта используют в ходе вакуумного фильтрования.
Применяется для конденсирования паров и отвода образовавшегося конденсата из системы, сбор конденсата происходит в колбу-приемник.
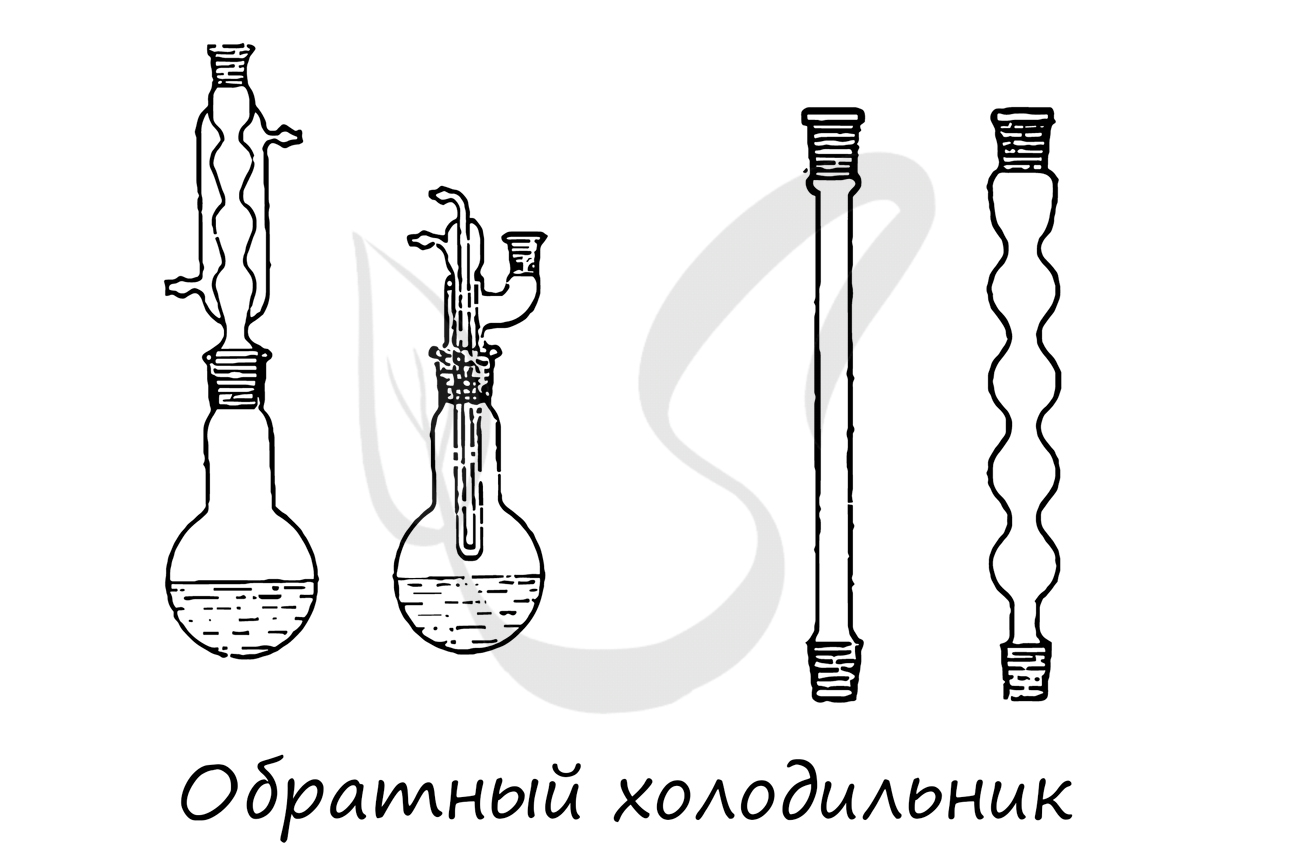
Применяется для конденсирования паров и возврата конденсата в реакционную массу. Обычно устанавливается вертикально.
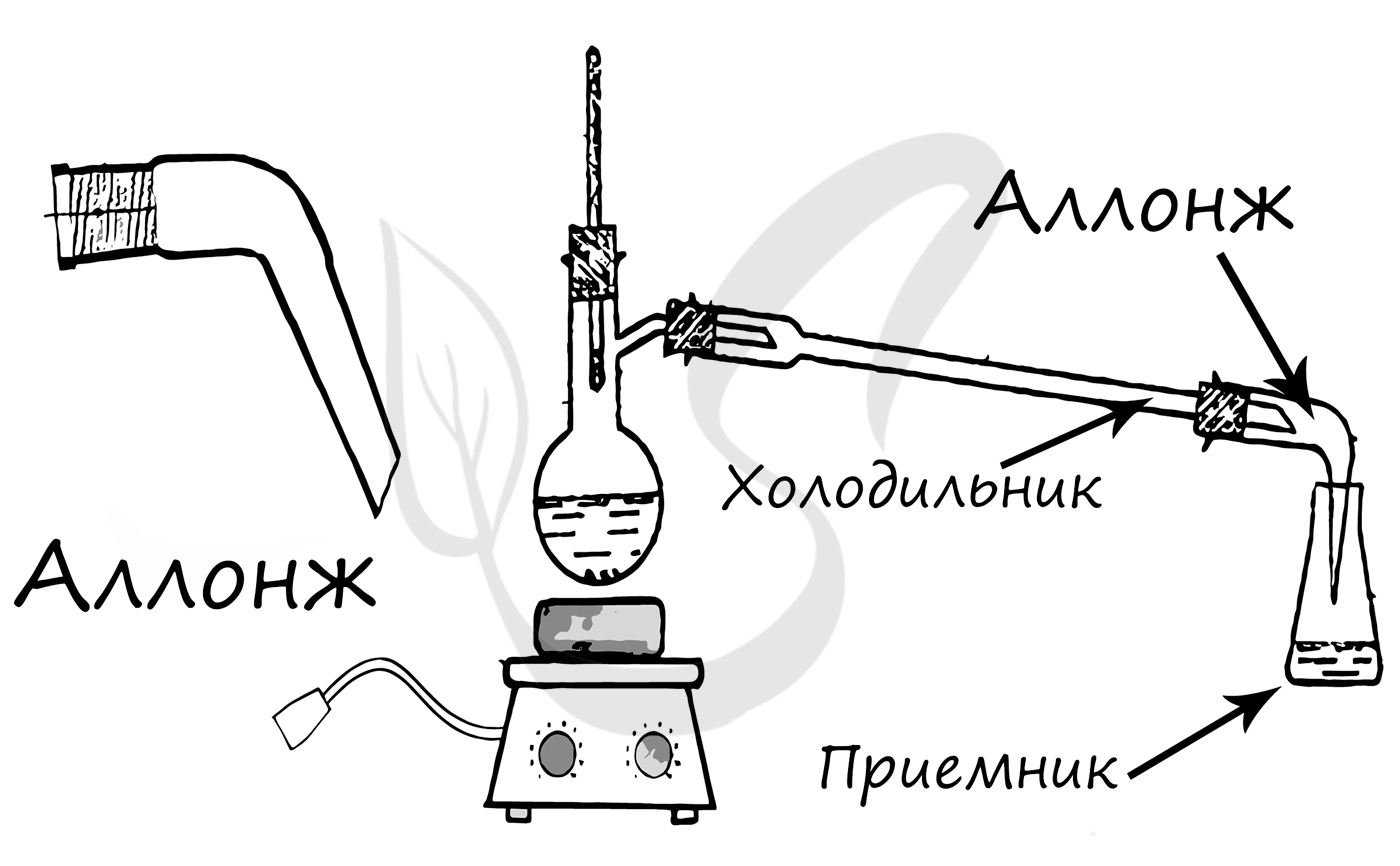
Конструктивный элемент химических приборов, чаще всего используется для соединения холодильника с приемником.
Используется в качестве приемника при перегонке. Одним из предназначений колбы Кьельдаля является определения азота в веществах по методу Кьельдаля.
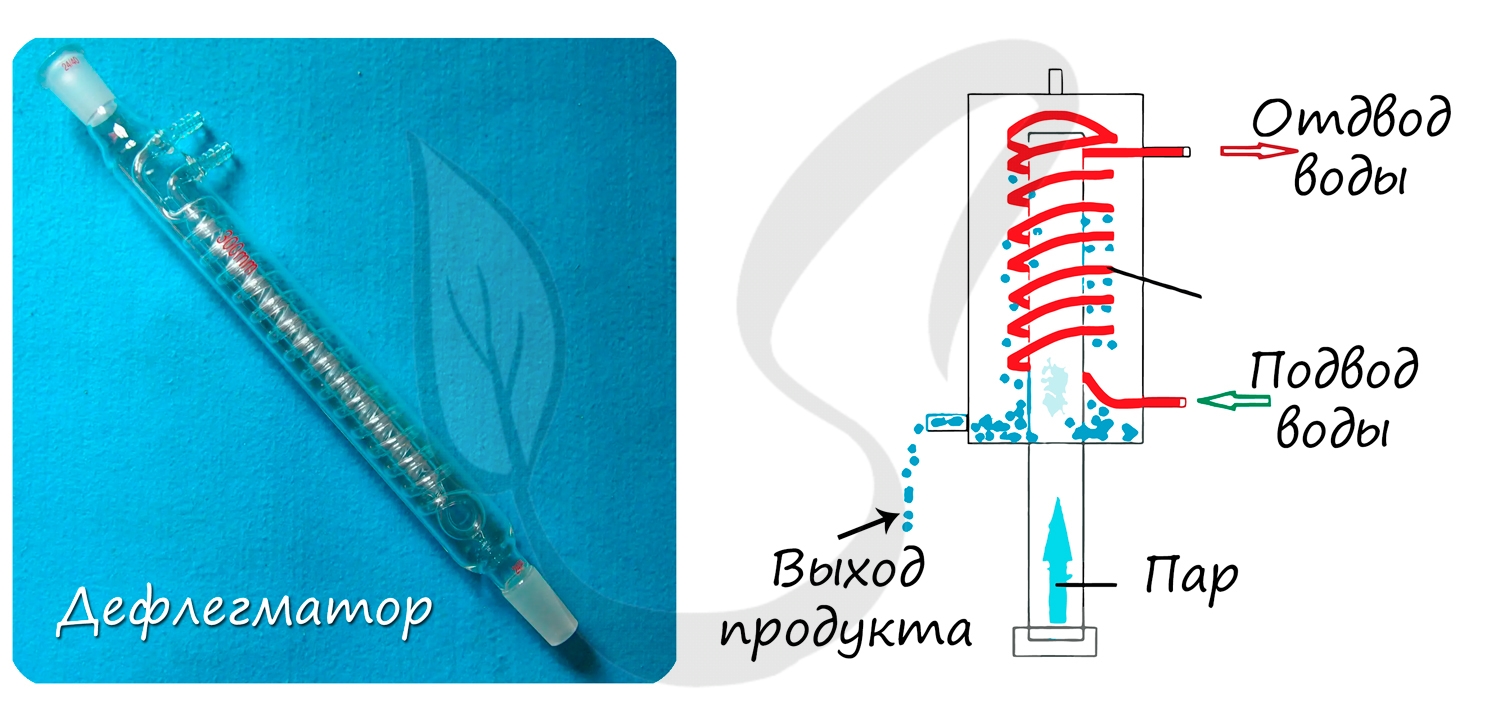
Используется для частичной или полной конденсации паров жидкостей, которые разделяют перегонкой или ректификацией (разделение, основанное на многократной дистилляции.)
Толстостенный стеклянный сосуд, с пришлифованной крышкой, на дно которого помещают влагопоглощающее вещество, в результате чего в эксикаторе поддерживается влажность воздуха приблизительно равная нулю. Эксикатор используется для высушивания и хранения различных веществ.
Служат для очистки газов от механических примесей. Также хлоркальцевые трубки применяют для предохранения растворов от попадания в них воды и углекислого газа: с этой целью их заполняют нужным поглотителем.
Применяется для получения газов при действии на твердые вещества растворов кислот и щелочей.
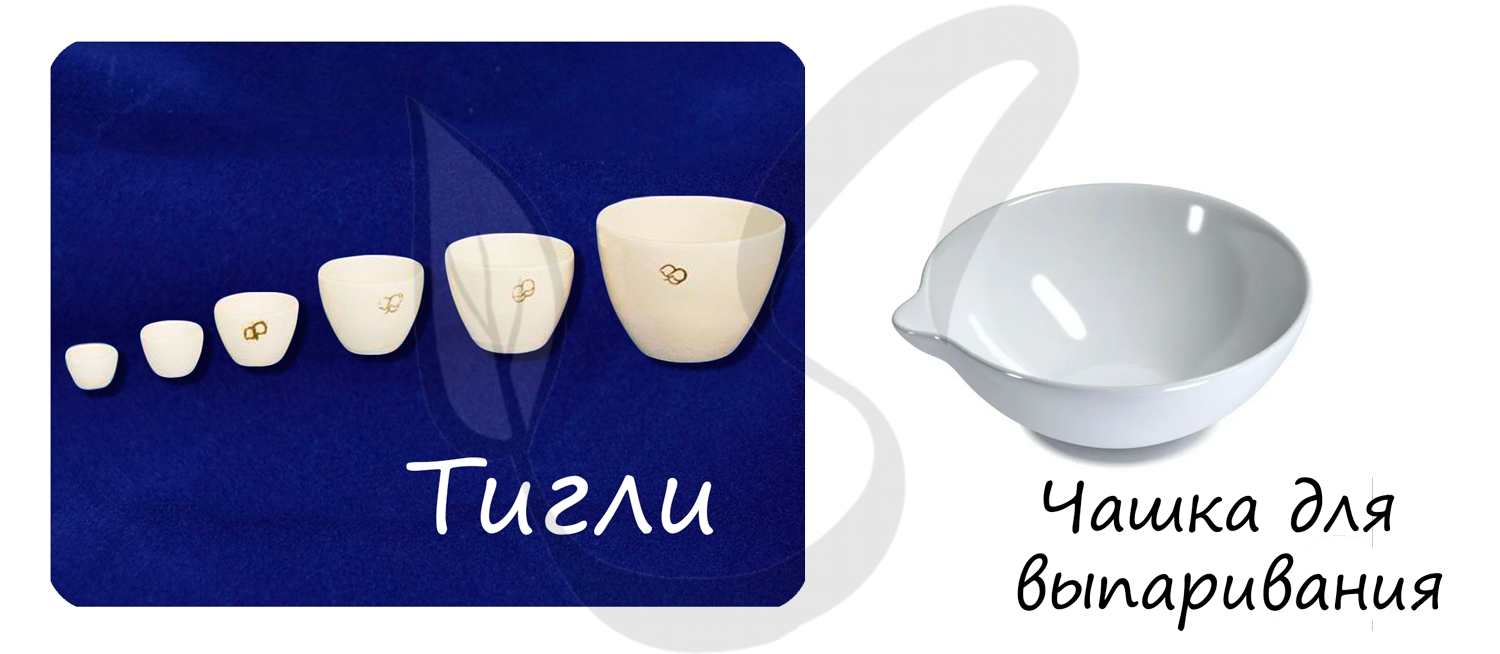
Чашки для выпаривания используют для выпаривания (упаривания) растворов.
Применяется для измельчения твердых веществ.
Применяются для прокаливания веществ в печи.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.