Для чего нужен иммуноглобулин для ребенка
ИММУНОГЛОБУЛИН ЧЕЛОВЕКА ПРОТИВ КЛЕЩЕВОГО ЭНЦЕФАЛИТА
Лекарственная форма: Р-Р ДЛЯ В/М ВВЕД
Производители
Инструкция по применению
Состав
Активный компонент: иммуноглобулин человека в концентрации по белку от 100 до 160 мг /мл;
вспомогательные вещества: аминоуксусная кислота (глицин) от 15 до 30 мг /мл, вода для инъекций до 1 мл.
Описание
Прозрачная или слегка опалесцирующая жидкость, бесцветная или слабо желтой окраски. Допускается появление незначительного осадка, исчезающего при встряхивании.
Фармакотерапевтическая группа
Фармакодинамика
Иммунологически активное средство, получаемое путем фракционирования человеческой плазмы, содержащей антитела к вирусу клещевого энцефалита, проверенной индивидуально от каждого донора на отсутствие антител к ВИЧ-1, ВИЧ-2, к вирусу гепатита С и поверхностного антигена вируса гепатита В. Препарат повышает также неспецифическую резистентность организма.
Фармакокинетика
Максимальная концентрация антител в крови достигается через 24-48 часов после введения; период полувыведения антител из организма составляет 4-5 недель.
Показания
Препарат предназначен для экстренной профилактики и лечения клещевого энцефалита у взрослых и детей.
Противопоказания
Противопоказанием для применения иммуноглобулина являются тяжелые аллергические реакции в анамнезе на введение препаратов крови человека.
Лицам, страдающим аллергическими заболеваниями или имевшим в анамнезе клинически выраженные реакции на какие-либо аллергены (пищевые, лекарственные и др.), в день введения иммуноглобулина и в течение последующих 8 дней рекомендуется назначение антигистаминных средств.
Если у Вас одно из перечисленных заболеваний, перед применением препарата обязательно проконсультируйтесь с врачом.
Беременность и лактация
Исследования по влиянию иммуноглобулина на репродуктивную функцию не проводились, опыт применения у беременных женщин ограничен. Иммуноглобулин следует применять только при убедительных показаниях. Следует с осторожностью применять в период лактации (грудного вскармливания). Иммуноглобулины переходят в материнское молоко и могут способствовать передаче защитных антител новорожденным.
Способы применения и дозы
Вводят внутримышечно, в верхний наружный квадрант ягодичной мышцы или в наружную поверхность бедра. Запрещается вводить препарат внутривенно!
Перед инъекцией ампулу с препаратом выдерживают в течение 2 часов при комнатной температуре (20±2)°С. Вскрытие ампул и процедуру введения осуществляют при строгом соблюдении правил асептики и антисептики. Во избежание образования пены препарат набирают в шприц иглой с широким просветом.
Препарат во вскрытой ампуле хранению не подлежит.
Доза иммуноглобулина и кратность его введения зависят от показаний к применению.
Профилактика до укуса клеща
С целью профилактики препарат вводят внутримышечно однократно из расчета 0,1 мл на 1 кг массы тела.
Таблица профилактических дозировок препарата иммуноглобулина против клещевого энцефалита
Профилактика после укуса клеща
С целью экстренной профилактики препарат вводят в первую очередь непривитым против клещевого энцефалита или получившим неполный курс вакцинации, отмечавшим присасывание клещей в эндемических районах, а также при подозрении на лабораторное заражение вирусом клещевого энцефалита.
В случае нового контакта с клещами возможно повторное применение препарата через один месяц после первого введения.
Во всех случаях препарат следует вводить в возможно более ранние сроки с момента предполагаемого заражения, не позднее 4 дней после укуса клеща.
С лечебной целью иммуноглобулин вводят в возможно более ранние сроки после начала заболевания в различных дозировках в зависимости от массы тела, клинической формы инфекции, тяжести течения и периода болезни.
— Больным со стертой и абортивной формами клещевого энцефалита (лихорадочные формы инфекции) иммуноглобулин вводят ежедневно в разовой дозе 0,1 мл/кг массы тела, на протяжении 3-5 дней до регресса общеинфекционных симптомов (улучшение общего состояния, исчезновение лихорадки). Курсовая средняя доза для взрослого составляет при этих формах не менее 21,0 мл препарата.
— При менингеальной форме клещевого энцефалита препарат применяется ежедневно в разовой дозе 0,1 мл/кг массы тела с интервалом 10-12 часов в течение не менее 5 дней до улучшения общего состояния пациента по объективным показателям (исчезновение лихорадки, регресс общеинфекционных симптомов, стабилизация и уменьшение менингеальных симптомов). Курсовая средняя доза иммуноглобулина для взрослого составляет при менингеальной форме инфекции не менее 70,0 мл.
— Больным с очаговыми формами клещевого энцефалита в зависимости от тяжести течения заболевания препарат вводят ежедневно в разовой дозе 0,1 мл/кг массы тела с интервалом 8-12 часов на протяжении не менее 5-6 дней до снижения температуры и стабилизации неврологических симптомов. Курсовая средняя доза для взрослого пациента составляет в среднем не менее 80,0-130,0 мл иммуноглобулина.
При крайне тяжелом течении заболевания разовая доза препарата может быть увеличена до 0,15 мл/кг массы тела.
Если больным менингеальной и очаговой формами клещевого энцефалита по каким-либо причинам в лихорадочной стадии заболевания специфическая терапия не проводилась, возможно введение иммуноглобулина и на стадии апирексии острого периода болезни с лечебной целью на протяжении 5-6 дней в разовой дозе 0,1 мл/кг массы тела через 10-12 часов.
В случае двухволнового течения клещевого энцефалита препарат применяют повторно по схеме лечения менингеальной или очаговой форм в зависимости от характера клинических проявлений.
Побочные эффекты
Если при использовании препарата соблюдены все рекомендации по введению, дозировке и меры предосторожности, реакции на введение иммуноглобулина, как правило, отсутствуют.
В редких случаях может появиться гиперемия в месте введения и повышение температуры до 37 °С в течение первых суток после введения.
Передозировка
В настоящее время о случаях передозировки препарата не сообщалось.
Взаимодействие
Препарат можно использовать в комплексе с любыми другими лекарственными средствами при условии введения его в виде отдельной инъекции, не смешивая с другими препаратами.
Особые указания
Лечение препаратами иммуноглобулина снижает эффективность вакцинации, поэтому прививки проводят не ранее, чем через 2-3 месяца после введения иммуноглобулина.
Лицам, страдающим аллергическими заболеваниями или склонным к аллергическим реакциям, в день введения иммуноглобулина и в течение последующих 8 дней рекомендуется назначение антигистаминных препаратов. В период обострения аллергического процесса введение препарата осуществляется по заключению аллерголога.
При развитии анафилактоидных реакций применяют антигистаминные препараты, глюкокортикостероиды и адреномиметики.
Лицам, страдающим аутоиммунными заболеваниями (болезни крови, соединительной ткани, нефрит и другие) препарат следует вводить на фоне соответствующей терапии.
Иммуноглобулины для внутримышечного введения категорически запрещено вводить внутривенно.
Не пригоден к применению препарат в ампулах с нарушенной целостностью и маркировкой, при изменении физических свойств (мутность, интенсивное окрашивание, наличие не разбивающихся при встряхивании хлопьев).
Влияние на способность управлять трансп. ср. и мех.
Не выявлено влияние иммуноглобулина на способность к выполнению работы, требующей повышенного внимания и быстроты психомоторных реакций.
Условия хранения и срок годности
В сухом защищенном от света месте при температуре от 2 до 10 °С. Не замораживать.
Хранить в недоступном для детей месте.
Транспортировать любым видом крытого транспорта при температуре от 2 до 10 °С.
Не использовать по истечении срока годности, указанного на упаковке.
Иммунодефицит у ребенка
Содержание статьи
Такой диагноз у детей означает, что поражен один или несколько элементов системы иммунитета. При такой патологии тяжело протекают инфекционные заболевания, часто проявляются аутоиммунные болезни, возникают опухоли, могут быть аллергии.
Виды заболеваний
Данный синдром может быть как первичным (генетически обусловленным), так и вторичным (появляется ввиду внешних факторов или заболеваний).
Первичный иммунодефицит у детей – что это и откуда берется?
Врожденный иммунодефицит (ИД) у ребенка – это то, что развивается из-за генетических факторов, это первичные нарушения работы иммунной системы. В результате развиваются тяжелые инфекции, быстро переходящие в хроническую форму, а органы и ткани поражаются воспалительными процессами. Без лечения первичный иммунодефицит приводит к смертности детей от осложнений различных инфекционных болезней.
Симптомы первичного иммунодефицита могут не обнаруживаться у детей, потому что болезнь не имеет уникальных признаков. Это может быть простая, но часто повторяющаяся инфекция, например легких или ЛОР-органов, или проблемы с ЖКТ, воспаления суставов. Часто ни родители, ни врачи не осознают, что все эти проблемы – результат дефекта иммунной системы ребенка. Инфекционные заболевания становятся хроническими, проявляются осложнения, нет реакции на курс антибиотиков. Обычно тяжелые формы иммунодефицита видны сразу после рождения младенца или через некоторое время. Источник:
Доан Тхи Май
Рецидивирующие инфекции у детей – риск иммунодефицита
// Педиатр, 2017, т.8, спецвыпуск, с.109-110
Важно отличать первичный иммунодефицит от СПИДа. Второй – это вирусное, приобретенное заболевание, а первичная форма уже «вживлена» в тело из-за генетических дефектов.
Почему у ребенка появляется вторичный иммунодефицит, и что это такое?
Такое заболевание – это тоже нарушение в работе иммунной системы, оно появляется у детей и взрослых и не является результатом дефектов в генах. Вторичный иммунодефицит может вызывать ряд факторов – внешних и внутренних. Любые внешние неблагоприятные факторы, которые нарушают процесс обмена веществ в организме, могут привести к развитию такой патологии. Самые распространенные из них:
Все эти факторы комплексно воздействуют на организм и все его системы, включая иммунную. А такие, как ионизирующее излучение, избирательно угнетают систему кроветворения. У людей, живущих в условиях загрязненности окружающей среды, снижен иммунитет, они чаще переносят инфекции, увеличиваются риски развития онкологии.
Диагностика ИД
Проводится сбор семейного анамнеза и жалоб ребенка (если он не новорожденный), осмотр, а также ряд лабораторных исследований: молекулярно-генетическое, клинический анализ крови и др.
Важно! Если в семье уже есть ребенок с первичной иммунной недостаточностью, то при вынашивании второго крайне важна пренатальная диагностика.
Признаки и симптомы первичного иммунодефицита обнаруживаются у детей уже в первые недели жизни. Когда врач собирает анамнез, особое внимание он обращает на частую заболеваемость вирусами и бактериальными инфекциями, на наследственность, отягощенную нарушениями работы иммунитета, на врожденные пороки развития.
Нередко такую патологию выявляют намного позже и случайно, когда проводят другие анализы.
Основные методы диагностики как врожденных, так и приобретенных нарушений работы иммунитета:
Лечение заболевания
Первичная форма заболевания предполагает:
Скорректировать иммунодефицит можно, применяя иммунореконструкцию, заместительное лечение, иммуномодуляторы. При первичной форме патологии применяют иммуноглобулины, при вторичной используют иммунотропы, заместительную терапию, иммунизацию.
Крайне важна при первичной патологии изоляция ребенка от всех источников заражения. Когда нет обострений инфекций, ребенок может вести нормальный образ жизни. При первичном иммунодефиците на фоне общей недостаточности антител детей нельзя прививать от:
Проживающим вместе с ребенком можно делать прививки только инактивированными вакцинами.
Противомикробное лечение заключается в приеме антибиотиков широкого спектра. При отсутствии быстрого ответа на терапию препарат меняют. Если же эффект есть, то принимать антибиотик ребенок должен минимум 3-4 недели. Лекарства вводятся внутривенно или парентерально. Одновременно назначают противогрибковые препараты и при показаниях – противовирусные, антипротозойные, антимикобактериальные лекарства. Противомикробная терапия может быть даже пожизненной.
При гриппе на фоне ИД обычно прописывают озельтамивир, ремантадин, занамивир, амантадин, ингибиторы нейраминидазы. Если ребенок заболел «ветрянкой» или герпесом, назначают ацикловир, парагрипп требует приема рибавирина. Перед стоматологическим лечением и операциями ребенок должен пройти курс антибиотиков для профилактики инфекции.
При серьезном вторичном или первичном Т-клеточном ИД нужно профилактировать пневмоцистовую пневмонию, в зависимости от показателей анализов крови. Для этого врачи обычно прописывают триметопримсульфометаксозол.
Важно! Любые лекарства должен назначать только врач, самолечение смертельно опасно для ребенка!
Способы коррекции недостаточности иммунитета:
Иммунореконструкция предполагает пересадку костного мозга или стволовых клеток, которые получают из пуповинной крови. При первичном ИД заместительная терапия – это чаще всего прием аллогенного иммуноглобулина, который в последние годы принято вводить внутривенно.
Лечение детей с первичным ИД с общими дефектами выработки антител
В этом случае проводится заместительная терапия иммуноглобулинами, которые вводятся внутривенно, и антибиотиками. Иммуноглобулины вводятся один раз в три-четыре недели пожизненно. Постоянная терапия антибиотиками нужна для профилактики бактериальных инфекций.
При обострении бактериальной инфекции назначаются антибиотики широкого спектра, вводимые парентерально. При гипер IgM-синдроме и общей вариабельной иммунной недостаточности (ОВИН) нужно постоянно принимать противогрибковые и противовирусные препараты. Они могут назначаться курсами. Это определяется врачом индивидуально. Если у ребенка Х-сцепленный гипер IgM-синдром, то ему показана пересадка костного мозга от HLA-идентичного донора.
Методы лечения вторичного ИД
В основном применяется иммунотропная терапия, которая может быть разных направлений:
Выбор иммунотропной терапии зависит от того, насколько остро выражен воспалительно-инфекционный процесс и какой иммунологический дефект выявлен. Когда симптомы болезни отступают, для профилактики может проводиться вакцинотерапия.
В качестве заместительной терапии применяются иммуноглобулины, вводимые внутривенно. Основное их действующее вещество – специальные антитела, получаемые от доноров. Часто назначаются иммуноглобулины, содержащие только IgG.
Иммунотропное лечение вторичного ИД
С помощью иммуномодуляторов можно повысить эффективность антимикробной терапии. Иммуномодуляторы должны быть частью комплексной терапии совместно с этиотропным лечением инфекции. Схемы и дозировку рассчитывает врач индивидуально.
Во время приема иммуномодуляторов должен проводиться иммунологический мониторинг. Если инфекция находится в острой стадии, иммуномодуляторы применяют с осторожностью. Иначе можно вызывать тяжелый общий воспалительный ответ и септический шок в результате него. Источник:
Г.А. Самсыгина, Г.С. Коваль
Проблемы диагностики и лечения часто болеющих детей на современном этапе
// Педиатрия, 2010, т.89, №2, с.137-145
Способы профилактики
ИД проще предупредить, чем лечить. Важно помнить, что состояние ребенка напрямую зависит от того, насколько правильно планировалась беременность. Если у одного из родителей есть проблемы с иммунитетом, он должен пройти специальные процедуры, чтобы исключить подобную патологию у ребенка.
В первые шесть месяцев жизни рекомендуется только грудное вскармливание, потому что в материнском молоке есть все нужные элементы, способствующие выработке полноценного иммунитета. Если нет лактации, нужны качественные искусственные смеси, но обязательно дополняемые поливитаминами.
Источники:
Подкожное введение иммуноглобулина при заместительной терапии у детей с первичными иммунодефицитами. Углова Т.А.
Углова Т.А.
Подкожное введение иммуноглобулина при заместительной терапии у детей с первичными иммунодефицитами
Республиканский научно-практический центр детской онкологии,
Uglova T.A.
Belarusian Research Center for Pediatric Oncology Hematology and Immunology, Borovlyani, Minsk region
Subcutaneous immunoglobulin as replacement therapy of children with primary immunodeficiencies
Резюме. Подкожное введение препаратов «Иммуноглобулин человека нормальный» при заместительной терапии у пациентов с первичными иммунодефицитами – эффективный, безопасный и хорошо переносимый метод терапии. Представлен анализ эффективности и безопасности 52-недельного применения препарата иммуноглобулина для подкожного введения «Гамманорм» в домашних условиях у 8 пациентов детского возраста с врожденным нарушением образования антител. Все пациенты предварительно получали в течение не менее 52 недель препараты иммуноглобулина для внутривенного введения. Медиана уровней IgG в сыворотке крови была выше в период применения Гамманорма (6,9 г/л) по сравнению с периодом применения иммуноглобулина для внутривенного введения (4,1 г/л). В период применения иммуноглобулина для подкожного введения ни у одного пациента не было тяжелых инфекций, частота инфекционных осложнений составила 2,1 эпизод/пациент/год. Профиль нежелательных явлений и реакций свидетельствует о хорошей толерантности и безопасности у детей препарата иммуноглобулина для подкожного введения «Гамманорм».
Ключевые слова: иммуноглобулин, подкожное введение, внутривенное введение, дети, первичный иммунодефицит, заместительная терапия.
Медицинские новости. – 2014. – №5. – С. 47–51.
Summary. Subcutaneous immunoglobulin infusions are effective, safe and well-tolerated in the treatment of primary immunodeficiencies. We investigated the efficacy and safety of home therapy with human immunoglobulin G preparation (Gammanorm) during subcutaneous infusions in 8 children with primary immunodeficiencies. All children had previously received intravenous immunoglobulins (no less than 52 weeks). Median serum IgG levels exceeded those during previous intravenous therapy (6.9 g/l and 4.1 g/l respectively). During the efficacy evaluation period none of the children had a serious bacterial infection, the mean overall infection rate/patient/year was 2.1. The adverse event profile confirmed the tolerance and safety of subcutaneous immunoglobulin therapy in children.
Keywords: immunoglobulin, subcutaneous, intravenous, children, primary immunodeficiency, replacement therapy
Meditsinskie novosti. – 2014. – N5. – P. 47–51.
Первичные иммунодефициты (ПИД) – гетерогенная генетически детерминированная группа нарушений одного или нескольких компонентов иммунной системы, которые могут манифестировать в различном возрасте [20]. Описано около 200 первичных иммунодефицитов, генетические дефекты идентифицированы более чем у 140. По данным ESID (Европейского общества по первичным иммунодефицитам), распространенность ПИД составляет 1 случай на 25 000–100 000 населения, а селективный дефицит IgА – 1 случай на 500–700 человек.
Более 50% в структуре ПИД приходится на ПИД с нарушением антителообразования (табл. 1), которые чаще диагностируются в детском возрасте [22]. Помимо частых тяжелых рецидивирующих инфекций респираторного и желудочно-кишечного трактов, обусловленных бактериальными или оппортунистическими инфекционными агентами, у пациентов с нарушением антителообразования отмечается повышенная частота аутоиммунных и лимфопролиферативных заболеваний [5, 7, 8, 16, 17], что связывают со снижением функции дендритных клеток [4, 19].
Таблица 1. Первичные иммунодефициты с нарушением продукции антител [2]
Нарушение
Мутация (ген)
Показания
к заместительной терапии
препаратами Ig
агаммаглобулинемия
IGHM, CD79A, CD79B, BLNK
у пациентов с низким уровнем IgG
у пациентов с низким уровнем IgG
у пациентов с низким уровнем IgG
П р и м е ч а н и е : Btk – тирозин киназа Брутона; TACI – трансмембранный активатор и партнер кальциевого модулятора и лиганда циклофиллина; TNFRSF – рецепторы семейства фактора некроза опухолей; BAFF – фактор активации В-клеток; CD40L – лиганд CD40, AID – активация индуцированной цитидиндезаминазы; UNG – глюкозилаза урацил-ДНК; WASP – протеин синдрома Вискотта–Олдрича; ATM – ген «атаксия телеангиэктазия мутировал», АК2 – аденилкиназа 2.
Стандартная лечебная тактика у пациентов с врожденным нарушением антителообразования – пожизненная заместительная терапия препаратами «Иммуноглобулин человека нормальный», которые вводятся внутривенно или подкожно.
Внутривенное введение препаратов иммуноглобулина (Ig) у данной категории пациентов применяется с 80-х годов прошлого столетия в дозе 0,3–0,4 г/кг каждые 3–4 недели. Установлено, что 10-летняя выживаемость больных с ОВИН при регулярном внутривенном введении Ig в дозе 0,4 г/кг/мес. составляет 78% при 10-летней выживаемости в общей популяции 97% [11]. Задержка начала заместительной терапии приводит к увеличению заболеваемости бактериальными инфекциями. Так, эпизод пневмонии перед началом заместительной терапии приводит к 10-кратному увеличению риска пневмонии после терапии [9, 14]. При постановке диагноза в 5 и 15 лет и, следовательно, позднем начале заместительной терапии кумулятивный риск развития хронического бронхолегочного процесса составляет 0,17 и 0,87 соответственно [18].
Препараты «Иммуноглобулин человека нормальный» для внутривенного введения (ВВИГ) получают из сыворотки большого количества доноров, что обеспечивает разнообразие антител [13]. Совершенствование процессов очистки при производстве ВВИГ позволило улучшить переносимость препаратов, а процессы инактивации и удаления вирусов и прионов снижают вероятность передачи заболеваний. Однако на каждом этапе производственного процесса, особенно при его модернизации, а также при изменении условий упаковки и транспортировки существует вероятность изменения структуры белка и, следовательно, биологической активности препарата ВВИГ, что может привести к изменению эффективности и переносимости [15, 21]. Различные препараты ВВИГ различаются по своему составу, что также обусловливает их различную эффективность и переносимость. Поэтому каждый препарат ВВИГ следует расценивать как уникальный. Препараты иммуноглобулина для внутривенного введения не являются генерическими и не являются взаимозаменяемыми.
Применение препаратов ВВИГ может сопровождаться развитием системных нежелательных явлений. Частота легких и умеренных системных нежелательных явлений (озноб, головная боль, лихорадка, миалгии, экзема, петехии, крапивница, боль в спине, тошнота, алопеция, изменения артериального давления, диарея) на одну инфузию составляет 5–15% [6]. Наиболее часто они встречаются у пациентов с врожденными нарушениями антителообразования при первых введениях препарата, а также у пациентов при наличии исходного хронического инфекционного процесса, и могут развиваться спустя несколько суток после инфузии ВВИГ [3]. Серьезные нежелательные явления, включающие в себя острую почечную недостаточность, инсульт, инфаркт миокарда, венозную тромбоэмболию, окклюзию центральной вены сетчатки, гемолиз, анафилактический шок, асептический менингит, встречаются редко, но потенциально опасны для жизни. Как правило, они развиваются у пациентов, имеющих факторы риска или предрасполагающие сопутствующие состояния (низкий уровень IgA, положительные серологические воспалительные маркеры, воспалительные заболевания, заболевания почек, наличие мигрени в анамнезе, не I (0) группа крови и др.). Вследствие потенциальной опасности развития тяжелых системных нежелательных явлений препараты ВВИГ вводятся в условиях дневного стационара или в стационаре круглосуточного пребывания, что не только приводит к увеличению затрат на лечение данной категории пациентов (прямых медицинских, выплат из социальных фондов), но и осложняет качество жизни как самого пациента, так и его близких родственников. Кроме того, внутривенное введение препаратов иммуноглобулина может быть проблематичным у некоторых пациентов из-за плохого венозного доступа, особенно в детском возрасте.
Применение препаратов иммуноглобулина для подкожного введения (ПКИГ) позволяет преодолеть эти ограничения. Многочисленными исследованиями доказана одинаковая эффективность в предотвращении инфекций у пациентов с врожденным нарушением образования антител препаратов иммуноглобулина для подкожного и для внутривенного введения, так как подкожное введение позволяет поддерживать стабильные уровни иммуноглобулина в сыворотке крови пациента без «эффекта впадины» в конце интервала введения [1, 10, 12]. Кроме того, отсутствие необходимости каждые 3–4 недели посещать лечебное учреждение для проведения внутривенной инфузии существенно снижает риск инфицирования, что актуально для пациентов с дефектами иммунитета. Более высокая концентрация иммуноглобулина в препарате (16,5%) по сравнению с препаратами ВВИГ (5–10%) позволяет уменьшить время проведения инфузии и сократить объем вводимой жидкости.
Подкожное введение – это удобный и безопасный путь введения, позволяющий родителям пациента или ему самому после обучения проводить инъекции в домашних условиях в удобное для всех время, таким образом значительно улучшая качество жизни больного и всей его семьи.
В Республике Беларусь зарегистрирован и разрешен к применению у детей только один препарат «Иммуноглобулин человека нормальный» для подкожного введения – Гамманорм, производства «Octapharma AB» (Швеция). Это готовый к употреблению прозрачный или слегка опалесцирующий раствор, производится из пула плазмы не менее 1000 доноров и содержит широкий спектр антител против инфекционных агентов. Распределение подклассов IgG близко к таковым в плазме здорового человека: IgG1 – 59%, IgG2 – 36%, IgG3 – 4,9%, IgG4 – 0,5%, IgA – до 82,5 мкг/мл. 1 мл Гамманорма содержит 165 мг нормального человеческого иммуноглобулина, 20 мг глицина, 2,5 мг натрия (натрия ацетата, натрия хлорида), полисорбат 80, воду для инъекций
Нами пронализирована эффективность и переносимость подкожного введения препарата «Гамманорм» у пациентов детского возраста с врожденным нарушением антителообразования.
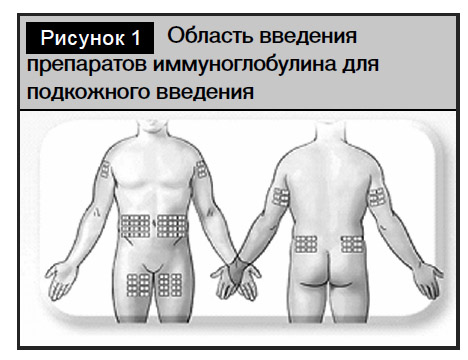
Обследовано 8 пациентов в возрасте 7–18 лет (медиана 12 лет) с врожденным нарушением образования антител, которые в течение 52 недель получали Гамманорм. До начала терапии Гамманормом все пациенты получали регулярную заместительную терапию препаратами иммуноглобулина для внутривенного введения (Октагам) не менее 1 года (52 недель) и имели стабильный уровень IgG в сыворотке крови не менее 3,5 г/л. Гамманорм вводился еженедельно в дозе 0,1 г/кг (0,4 г/кг/мес.). Первое введение препарата осуществлялось через 3–4 недели после внутривенного введения Октагама. После нескольких введений в условиях дневного стационара под наблюдением медицинского персонала (от 2 до 4 недель) родители и пациенты сами вводили Гамманорм с использованием портативного насоса в домашних условиях, фиксируя дозу, время введения и нежелательные реакции в «Дневнике пациента». Препарат вводился в один или несколько участков, объем не превышал 15 мл на участок у детей с весом до 40 кг, и 25 мл на участок с весом более 40 кг (рис. 1). Скорость введения препарата составляла 15–20 мл/час на каждом участке инъекции.
Уровень IgG в сыворотке крови определяли иммунотурбодиметрическим методом на 0 день (остаточный уровень) и через 4, 12, 24, 36 и 52 недели после начала терапии Гамманормом. Физикальное обследование с оценкой жизненно важных функций организма пациента проводилось в эти же сроки. Критериями эффективности являлись уровень IgG в сыворотке крови и частота инфекционных эпизодов, в том числе тяжелых, требующих госпитализации и длительного назначения антибактериальной терапии. Критерии переносимости – частота серьезных нежелательных явлений, частота и степень выраженности системных и местных нежелательных реакций.
Статистическая обработка материала проведена с применением методов описательной статистики.
Таблица 2. Характеристика пациентов (n = 8) с первичным иммунодефицитом с нарушением образования антител, получавших заместительную терапию препаратом «Гамманорм»