Для чего нужен секреторный компонент iga
Для чего нужен секреторный компонент iga
Автор: Зеленов Петр Васильевич
Дыхательный тракт человека – это входные ворота для веществ, загрязняющих окружающую среду, и возбудителей различных болезней, поэтому состояние иммунной защиты в этом органе должно быть решающим фактором в элиминации неблагоприятного компонента при вдыхании. Состояние местного иммунитета слизистой оболочки зависит от ее целостности, содержания иммуноглобулинов А, G и М, состояния лимфоидной ткани [Иванов В.Д. с соавт., 2006].
Защищает организм человека от проникновения инфекции слизистая оболочка верхних дыхательных путей. Она обладает весьма совершенными и сложно организованными механизмами защиты от неблагоприятного внешнего воздействия [Рязанцев С.В. с соавт., 2000]. Среди этих механизмов ведущими являются мукоцилиарный барьер и иммунная защита. Дыхательные рефлексы, такие как кашель, чиханье и бронхоконстрикция, а также мукоцилиарный клиренс препятствуют адгезии и обеспечивают удаление микроорганизмов и инородных частиц с поверхности респираторного эпителия. Важным защитным фактором является секретируемая бокаловидными клетками и эпителиоцитами слизь, в состав которой входят обладающие антибактериальной активностью лизоцим, лактоферрин, cекреторный иммуноглобулин А (sIgA) [Лучихин Л.А., 2003].
Если возбудителю удается преодолеть мукоцилиарный барьер, срабатывают неспецифические механизмы защиты – нейтрофилы и макрофаги, мигрирующие из кровеносного русла и способные уничтожать микроорганизмы путем фагоцитоза, за счет секреторной дегрануляции, продукции активных форм кислорода и оксида азота. В противовирусных реакциях принимают участие также естественные клетки-киллеры, располагающиеся в подслизистом слое и тесно связанные с внутриэпителиальными лимфоидными фолликулами. Наконец, иммунная защита слизистой оболочки обеспечивается многими гуморальными и клеточными факторами, среди которых наиболее важную роль играет синтезируемый в ответ на воздействие специфических антигенов sIgA [Лучихин Л.А., 2003].
В дальнейшем, при продолжении контакта с неблагоприятными факторами, развивается состояние нарушения процесса адаптации (донозологическое), которое характеризуется преобладанием неспецифических изменений над специфическими. В случае дальнейшего развития патологических процессов наступает состояние срыва адаптации и развитие клинических симптомов болезни. При этом наступает повреждение внутриклеточных структур, нарушаются межклеточные кооперативные связи, развиваются аутоиммунные реакции, иммунодепрессия, формируется сенсибилизация организма, накапливаются токсичные метаболиты [Иванов В.Д. с соавт., 2006, Хаитов Р.М. с соавт., 1995].
Последние исследования показали, что уровень sIgA может иметь и прогностическую значимость в оценке состояния здоровья населения при массовых обследованиях [Иванов В.Д. с соавт., 2006]. Так установлено, что снижение sIg А может указывать на недостаточность функции местного иммунитета, а его повышенное количество – на дисбаланс в иммунной системе [Маковецкая А.К. с соавт., 2005].
В ряде исследований показано, что при снижение местного иммунитета, и в частности sIgA, возможно приводит к хронической патологии. Например, в исследовании Calvo M. с соавт. (1990) показано, что у здоровых детей, имеющих нормальный уровень sIgA, риск развития хронической легочной патологии, в том числе и бронхиальной астмы, составляет 46%, а при низком уровне sIgA повышается до 86%. В исследовании Бяховой М.М. (2008) показано, что у здоровых детей с низким sIgA повышается уровень цитогенетических показателей буккального эпителия на фоне снижения апоптического индекса, т.е. нарушается процесс удаления генетически не полноценных эпителиальных клеток.
sIgA может изменяться и при различных патологических состояниях бронхолегочной системы, и в частности при бронхиальной астме. Так известно, что у детей с этим заболеванием отмечаются различные изменения иммунной системы, сопровождающимися склонностью к частым вирусным и бактериальным инфекциям. Развитию бронхиальной астмы у детей способствуют перенесенные ранее ребенком острые респираторные инфекции, бронхиты, пневмонии. У половины детей с бронхиальной астмой первый приступ затрудненного дыхания часто возникает на фоне ОРЗ или в период реконвалесценции после него. У часто болеющих детей с этим заболеванием отмечается снижение sIgA в секрете ротоглотки [Рылеева И.В., 2003]. Так же в работе Кузьменко Л.Г. и соавторов (1999) показано, что у детей, больных бронхиальной астмой с частыми обострениями, вызываемыми вирусной инфекцией, sIgA в слюне ниже, чем у здоровых. Скорей всего, низкий уровень этого иммуноглобулина может быть связан с угнетающим действием вирусов на его синтез или истощением его продукции при чрезвычайно высокой потребности в условиях частого возникновения вирусных инфекций.
Подводя итог, можно сказать, что sIgA играет не мало важную роль в защите организма от различных факторов окружающей среды, а кроме того он имеет прогностическое значение в массовых исследованиях.
2. Бяхова М.М Цитогенетический статус, показатели пролиферации и апоптоза у детей с бронхиальной астмой, проживающих в условиях загрязнения атмосферного воздуха. Автореферат на соискание ученой степени кандидата медицинских наук. – Москва. – 2008. – 22 с.
3. Зайцева О.В. Противовоспалительная терапия в лечении заболеваний органов дыхания. // Consilium provisorum. – Том 5, №6. – 2005.
4. Иванов В.Д., Маковецкая А.К. Возможности использования неинвазивных иммунологических методов в оценке здоровья населения. // Неинвазивные методы в оценке здоровья населения. Под ред. Академика РАМН Ю.А. Рахманина. – М. – 2006. – С. 112-125.
5. Кузьменко Л.Г., Баталова Т.Н., Сойджодах Р. И др. Содержание иммуноглобулинов в слюне детей с хроническим тонзиллитом и бронхиальной астмой. // Вестник РУДН Серия «Медицина». – 1999. – №2. – С. 73-79.
7. Лучихин Л.А. Рациональные подходы к лечению и профилактики респираторных инфекций // Consilium Medicum. – 2003. – Том. 5, № 2.
8. Маковецкая А.К., Высоцкая О.В., Иванов В.Д. Изучение состояния местного иммунитета слизистых оболочек дыхательного тракта у лиц с аллергической патологией.//Материалы пленума «Экологически обусловленные ущербы здоровью: методология, значение и перспективы оценки. – Москва. – 22-23 декабря 2005г. – С.436-438.
9. Методические рекомендации. – Оценка состояния здоровья и выявления предпатологических состояний у детей. – М. – 1999. – 36 с.
14. Рылеева И.В., Балаболкин И.И. Бактериальные иммуномодуляторы ИРС19 и Имудон в педиатрической практике. // Вопросы современной педиатрии. – 2003. – Т. 2, №2. – С 78-81.
16. Хаитов Р.М., Пинегин Б.В., Истамов Х.И. Экологическая иммунология. – М.: Издательство ВНИРО. – 1995.
17. Balzar S., Strand M., Nakano T. et al. Subtle immunodeficiency in severe asthma: IgA and IgG2 correlate with lung function and symptoms. // Int. Arch. Allergy Immunol. – 2006. – Vol. 104,№2. – P. 96-102.
18. Calvo M., Grob K., Bertoglio J et al. Secretory IgA deficiency in pediatric patients: clinical and laboratory follow-up. // Allergol Immunopathol (Madr.) – 1990. – Vol. 18,№3. – P. 149-153.
20. Eccles R Rhinitis as a mechanism of respiratory defence. Eur Arch Otorhinolaryng 1995; 252: Suppl 1: 2-7.
21. Handzel Z.T. effects of environmental pollutants on airways, allergic inflammation, and the immune response. // Rev Environ Health. – 2000. – Vol. 15, №3. – P. 325-336.
22. Peebles RS Jr., Liu MC, Lichtenstein L.M. et al. IgA, IgG and IgM quantification in bronchoalveolar lavage fluids from allergic rhinitics, allergic asthmatics, and normal subjects by monoclonal antibody-based immunoenzymetric assays. // J Immunol Methods. – 1995. – Vol 179, № 1. – P. 77-86.
23. Richter J., Pelech L. Immunological findings in groups of children after compensatory measures. // Toxicol Lett. – 1996. – Vol. 88, № 1-3. – P. 165-168.
24. Salvi S., Holgate S.T. Could the airway epithelium play an important role in mucosal immunoglobulin A production? // Clin. Exp. Allergy. – 1999. – Vol. 29, №12. P. 1597-1605.
25. V.H.J. van der Velden, Savelkoul H.F.J., Versnel M.A. Bronchial epithelium: morphology, function, and pathophysiology in asthma. // Eur. Cytokine Netw. – Vol. 9,№4. – P. 585-597.
26. Wines B.D., Hogarth P.M. IgA receptors in health and disease. // Tissue Antigens. – 2006. – Vol. 68,№2. – P. 103-114.
27. Wilson R, Dowling RB, Jackson AD. The biology of bacterial colonization and invasion of the respiratory mucosa. Eur Respir J 1996; 30: 289-9.
Для чего нужен секреторный компонент iga
Антитела класса IgA, основной функцией которых является местная гуморальная защита слизистых оболочек.
Иммуноглобулины (антитела) класса А.
Синонимы английские
Immunoglobulin A; IgA, total, Serum.
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Иммуноглобулины класса А – гликопротеины, которые синтезируются в основном плазматическими клетками слизистых оболочек в ответ на местное воздействие антигена.
В организме человека IgA существует в двух формах – сывороточной и секреторной. Время их полужизни – 6-7 суток. Секреторный IgA обладает димерной структурой и устойчив к воздействию ферментов благодаря особенностям строения. Секреторный IgA находится в слезах, поте, слюне, молоке и молозиве, секретах бронхов и желудочно-кишечного тракта и защищает слизистые оболочки от инфекционных агентов. 80-90 % циркулирующих в крови IgA состоят из сывороточной мономерной формы данного класса антител. IgA входят во фракцию гамма-глобулинов и составляют 10-15 % от всех иммуноглобулинов крови.
Антитела класса IgA являются важным фактором местной защиты слизистых оболочек. Они связываются с микроорганизмами и предотвращают их проникновение с внешних поверхностей вглубь тканей, усиливают фагоцитоз антигенов путем активации комплемента по альтернативному пути. Достаточный уровень IgA в организме препятствует развитию IgЕ-зависимых аллергических реакций. IgA не проникают через плаценту, но поступают в организм ребенка с молоком матери при кормлении.
Селективный дефицит IgA является одним из наиболее распространенных иммунодефицитов в популяции. Частота – 1 случай на 400-700 человек. Данная патология часто протекает бессимптомно. Дефицит IgA может проявиться аллергическими заболеваниями, рецидивирующими респираторными или желудочно-кишечными инфекциями, нередко ассоциируется с аутоиммунной патологией (сахарным диабетом, системной красной волчанкой, ревматоидным артритом, пернициозной анемией). Дефицит IgA иногда сочетается с недостаточным уровнем IgG-2 и IgG-4, что приводит к более выраженным клиническим признакам иммунодефицита.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Возраст
Референсные значения
Причины понижения уровня IgА в сыворотке и состояния, ассоциированные с дефицитом данного класса антител:
Что может влиять на результат?
Факторы, повышающие уровни иммуноглобулинов в крови:
Факторы, снижающие уровни IgA в крови:
Кто назначает исследование?
Иммунолог, инфекционист, гематолог, онколог, ревматолог.
Иммуноглобулины A (IgA)
Синонимы : Immunoglobulin A
Мы сократили затраты на рекламу и содержание точек забора биоматериала. Поэтому цена на анализы для вас в 2 раза ниже. Мы сделали это, чтобы вы сдавали анализы легко и управляли своим здоровьем
Срок исполнения
Анализ будет готов в течение 1 дня, исключая день забора. Срок может быть увеличен на 1 день в случае необходимости. Вы получите результаты на эл. почту сразу по готовности.
Срок исполнения: 2 дня, исключая субботу и воскресенье (кроме дня взятия биоматериала)
Подготовка к анализу
Обсудите с врачом прием лекарственных препаратов накануне и в день проведения исследования крови, а также другие дополнительные условия подготовки.
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
За 24 часа до взятия крови:
Не менее 8 часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
Перед забором крови
Информация об анализе
Иммуноглобулины A (IgA) присутствуют в сыворотке здорового человека как в виде секреторного IgA, так и в виде сывороточного IgA. Основными функциями секреторного IgA являются связывание микроорганизмов на поверхности слизистых оболочек, активация воспалительных реакций и активация альтернативного пути комплемента. Особо важную роль он играет в защите от инфекций респираторной, желудочно-кишечного тракта и мочеполовой систем.
Метод исследования — Иммунотурбидиметрия
Материал для исследования — Сыворотка крови
Состав и результаты
Иммуноглобулины A (IgA)
Иммуноглобулины A (IgA) присутствуют в сыворотке здорового человека как в виде секреторного IgA, так и в виде сывороточного IgA. Специфическая роль сывороточного IgA не ясна в отличие от IgA секреторного. IgA не обнаруживается в крови плода, т.к. не проходит через плаценту. Секреторный IgA имеет секреторный компонент и состоит из димера, соединенного J-цепью, защищающий молекулу от протеолитических ферментов. Секреторный IgA является основным секреторным иммуноглобулином, содержащимся в секретах организма, таких как слезы, слюна, молозиво, выделения из носа, секрет желудочно-кишечного тракта и трахеобронхиальная слизь. Основными функциями секреторного IgA являются связывание микроорганизмов на поверхности слизистых оболочек, активация воспалительных реакций и активация альтернативного пути комплемента. Особо важную роль он играет в защите от инфекций респираторной, желудочно-кишечного тракта и мочеполовой систем.
Изменение концентрации иммуноглобулина в сыворотке можно классифицировать следующим образом:
Интерпретация результатов исследования «Иммуноглобулины A (IgA)»
Интерпретация результатов анализов носит информационный характер, не является диагнозом и не заменяет консультации врача. Референсные значения могут отличаться от указанных в зависимости от используемого оборудования, актуальные значения будут указаны на бланке результатов.
Для чего нужен секреторный компонент iga
Ротовая полость обладает как твердой (зубы), так и мягкой (слизистая) тканями. Зубы можно описать как неизменяемую твердую поверхность, которая имеет много разных мест для адгезии и колонизации бактерий ниже (сабгингивиал) и выше (супрагингивиал) гингивиального края. Напротив, слизистая оболочка характеризуется сплошной (непрерывной) десквамацией ее поверхностных эпителиальных клеток, которые способствуют быстрой элиминации адгезирующих бактерий. Слизистая оболочка полости рта, которая покрывает щеки, язык, десны, небо, а также полости рта, в зависимости от ее анатомической локализации существенно отличается. Например, эпителиальные клетки в слизистой могут быть кератинизированными (небо), некератинизированными (гингивиальная щель). Язык с его сосковидной поверхностью благоприятствует колонизации микроорганизмов на отдельных местах, при этом сосковидные структуры предохраняют от механического удаления бактерий.
Гингивиальная жидкость является транссудат экссудатом, происходящим из плазмы, которая проходит через гингивиа (соединяющие эпителии) в гингивиальную щель и далее течет вдоль зубов. Диффузия гингивиальной жидкости у здоровых десен происходит медленно, а в период воспаления она увеличивается. Состав гингивиальной жидкости одинаков с таковой у плазмы: он содержит протеины, альбумины, лейкоциты, иммуноглобулины, а также комплемент [4,5,6].
Слюна помогает поддерживать целостность зубов, обеспечивая такими ионами, как кальций фосфат, магнезиум, фтор. Также в составе слюны содержатся иммуноглобулины (А, М, G). Между микробной флорой челюстно-лицевой области и факторами организма существует постоянное равновесие. Однако эти факторы часто подвергаются атаке как вследствие размножения и ускоренного развития микробов (зубные отложения), так и из-за ослабления самих факторов общей и особенно местной иммунной защиты.
Специфическим иммунитетом является способность микроорганизма избирательно реагировать на попавшие в него антигены. Главным фактором специфической антимикробной защиты являются иммуноглобулины.
Секреторный IgA представляет собой один из основных иммуноглобулиновых изотипов слюны и всех других секретов слизистых оболочек организма. SIgA состоит из двух пар полипептидных цепей, соединенных дисульфидными связями.
Секреторный IgA устойчив к действию различных протеолитических ферментов. Существует предположение, что чувствительные к действию ферментов пептидные связи в молекулах секреторного IgA закрыты вследствие присоединения секреторного компонента. Эта устойчивость к протеолизу имеет важное биологическое значение. SIgA секретируются плазмоцитами подслизистого слоя миндалин и клетками Lamino propra. В слюне содержится гораздо больше секреторного IgA, чем других иммуноглобулинов: например, в слюне, выделяемой околоушными железами, соотношение IgA/IgG в 400 раз превышает таковое в сыворотке крови.
Одним из важных вопросов, имеющих отношение к роли секреторного IgA в микробной экологии полости рта, и в частности, патологии ротовой полости, является вопрос о влиянии этих иммуноглобулинов на местную микрофлору. Несмотря на присутствие высокого уровня секреторного IgA в слюне, местная бактериальная микрофлора все еще персистирует в полости рта. Отсюда можно предположить, что выжившей в полости рта микробиоте свойственна пониженная чувствительность к секретору IgA, а также способность избегать действия иммунных механизмов. По мнению некоторых авторов [2, 4], аутохтонные бактерии не иммуногенны в организме хозяина, и поэтому эти микроорганизмы в период продолжительной эволюционной адаптации достигли симбиоза с организмом хозяина. Вместе с тем другие микроорганизмы резисдентной микробиоты, которые потенциально патогенны, могут индуцировать протективную ответную реакцию и элиминироваться из организма или же сохраняться в небольшом количестве при нормальных условиях. Некоторые экспериментальные исследования подтверждают гипотезу о том, что иммунная система относительно толерантна к аутохтанным микроорганизмам [7, 8, 9, 10]. Правомерно считать, что подобная толерантность может быть результатом клональной элиминации (гибель клеток), клональной энергии (функциональной инактивации клеток без их гибели) или активной супрессии антиген-реактивных В- и Т-клеток. Предполагается также, что местные резисдентные бактерии со своими поверхностными антигенами, имея сходство с тканевыми хозяина или покрываясь молекулами тканевой природы, могут не восприниматься иммунной системой как чужеродные [9, 10].
Изучению формирования SIgA антительного ответа к оральной микрофлоре у людей посвящено много работ. Так, Смит и коллеги подчеркивают, что появление IgA антител к стрептококкам (S.salivaris и S.mitis) у новорожденных и детей старшего возраста непосредственно коррелирует с колонизацией этими бактериями полости рта у детей. При этом показано, что секреторные антитела, продуцируемые иммунной системой слизистых полости рта против стрептококков в период колонизации слизистой ротовой полости, могут повлиять на степень и продолжительность колонизации, способствуя при этом специфической элиминации этих микроорганизмов [11].
Можно предположить, что эти естественно обнаруживаемые SIgA антитела могут играть важную роль в гомеостазе резидентной микрофлоры полости рта, а также в профилактике кариесов и периодонтальных, а также челюстно-лицевых заболеваний (актиномикоз, флегмоны, абсцессы и др.). Эти антитела были определены к S.mutans, A.actinomysetemcomitans и Porphyromonas gingivalis, которые строго ассоциировали с патологическими процессами в ротовой полости. Также известно, что при возникновении болезней ротовой полости и челюстно-лицевой области (особенно актиномикотических патологических) немаловажную роль играют именно актиномицеты, такие, как Act.israelii, Act.odontolyticus, и так называемые «сопутствующие микроорганизмы» (бактерии и грибы) [16, 17, 18, 19, 20]. Надо отметить, что у больных, особенно с актиномикотическими патологиями, у которых были выделены актиномицеты, отмечаются существенные изменения состояния иммунных механизмов защиты ротовой полости, проявляющиеся местными изменениями, особенно в составе слюны SIgA. У больных, у которых выделены актиномицеты, концентрация SIgA относительно понижена [17].
Таким образом, надо отметить, что в возникновении инфекционной патологии полости рта и челюстно-лицевой области значительную роль в местной иммунной защите слизистых оболочек играет концентрация секреторного IgA.
Для чего нужен секреторный компонент iga
Известно, что степень защиты от локальных вирусных инфекций респираторного и желудочно-кишечного трактов прежде всего зависит от содержания в организме специфического секреторного IgA, а не от наличия сывороточного IgG к энтеропатогенным или пневмотропным вирусам.
Стабильная структура, выраженный аффинитет к поверхности слизистых оболочек, преобладающее содержание в секрете молочной железы обусловливают биологическую роль секреторного IgA в защите организма от неблагоприятного воздействия различных патогенных агентов, в том числе вирусов.
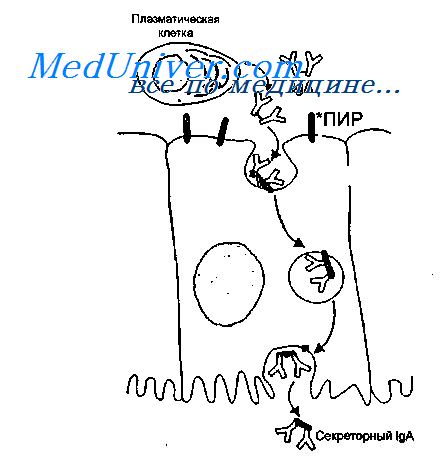
IgA синтезируется в димерной форме в клетках lamina propria и после связывания с иммуноглобулиновым рецептором, синтезированным в эпителиальных клетках, транспортируется на поверхность слизистой оболочки. В момент выхода IgA в просвет кишечника рецептор частично расщепляется, в результате чего в составе IgA остается фрагмент рецептора, который называют секреторным компонентом.
Таким образом, секреторный IgA является продуктом кооперации двух типов клеток — плазматических и эпителиальных.
Секреторный IgA образуется не только в димерной, но и в тетрамерной форме, что усиливает его вируснейтрализующую способность. Секреторный компонент предохраняет IgA от расщепления протеолитическими ферментами, что обусловливает его значительные преимущества перед антителами других классов. Секреторный IgA нейтрализует вирус не только в просвете кишечника, но и при транспортировке его внутрь клетки. Димер IgA может нейтрализовать вирус в подслизистой оболочке кишечника, а затем, связавшись с рецептором, транспортировать его в просвет кишечника.
Димерные иммуноглобулины класса A (US IgA), соединенные посредством j-цепи в единую структуру с секреторным компонентом, представляют собой уникальный пример эволюционной адаптации иммуноглобулинов на слизистых покровах для эффективного функционирования в условиях постоянного воздействия антигенов различной природы.
Исходя из способности к локальному синтезу молекул секреторного компонента, а также димерной формы IgA-местно расположенными плазматическими клетками, ткани слизистых покровов можно разделить на три основных класса.
В слизистых оболочках индуктивная и продуктивная фазы гуморального иммунного ответа разобщены пространственно в большей степени, чем в других отделах иммунной системы.
Клеточные и гуморальные превращения, связанные с появлением IgA во внешних секретах, представлены на рисунке.
В молоко и, по-видимому, в другие внешние секреты молекулы IgA поступают из двух главных источников. Большая часть IgA, выделяемого со слюной, секретами слезной и молочной желез, а также пищеварительного и респираторного трактов, образуется плазматическими клетками. Однако IgA, обнаруживаемые в различных внешних секретах, могут иметь и системное происхождение. Продуцируясь клетками слизистых оболочек одних органов, они поступают в кровь и переносятся в слизистые покровы других органов.
Антиген после проникновения внутрь пейеровой бляшки активирует Т- и В-лимфоциты, которые по лимфатическому протоку поступают в мезентериальный лимфатический узел, а затем в кровь, селезенку, снова в кровь и селективно локализуются в лимфатических образованиях всех слизистых оболочек и экзокринных секреторных железах — молочных, слюнных и слезных. При этом Т-лимфоциты локализуются преимущественно между эпителиальными клетками слизистой оболочки, обеспечивая клеточный иммунный ответ, а В-лимфоциты — в lamina propria, где они дифференцируются в плазматические клетки и синтезируют IgA.
Около 90% плазматических клеток в lamina propria продуцируют IgA, в то время как в лимфатических узлах доля таких клеток составляет всего 2—5%.
Уникальна в этом отношении роль печени. Имеются убедительные данные, свидетельствующие о том, что гепатоциты избирательно связывают и в последующем транспортируют IgA в желчь, тем самым усиливая систему секреторного IgA кишечника.