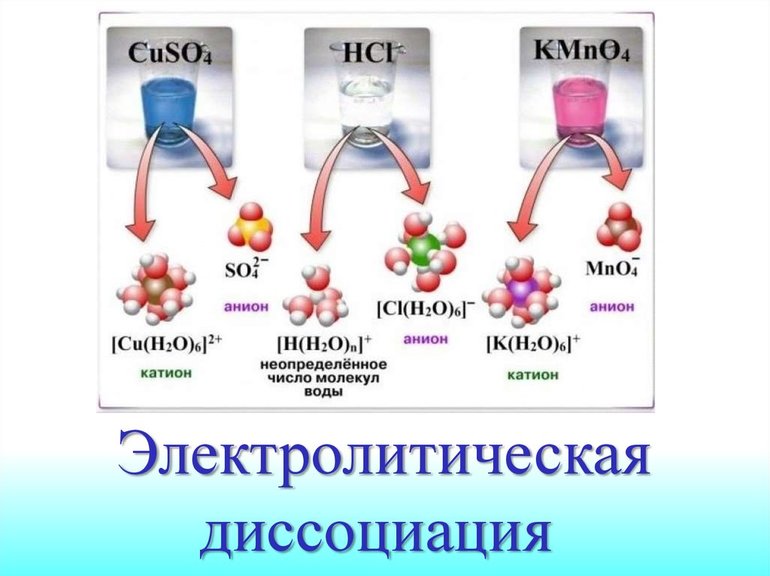
Для чего нужна электролитическая диссоциация
Электролитическая диссоциация (общие сведения, процесс, свойства, термин, применение)
Общие сведения
Терминология
Свойства электролитов
Константа диссоциации
Константа диссоциации является количественной мерой диссоциации электролита. Чем больше значение КД электролита, тем лучше он распадается в растворе и тем больше концентрация ионов.
Классическая теория электролитической диссоциации
Активность ионов означает эффективную условную концентрацию, согласно которой ионы действуют в химических реакциях. Напр. активность ионов Na + i Cl- в 1 М растворе NaCl равна 0,65 моль / л. Отношение активности ионов к концентрации растворов называют коэффициентом активности и обозначают f: f = a-CМ, отсюда а = f ⋅ CМ. В очень разбавленных растворах сильных электролитов f приближается к 1 (а ≈ СМ). Для растворов сильных электролитов на основе закона действующих масс по значению активности ионов вычисляют константы диссоциации. Например, для соляной кислоты: HCl → H + + Cl-.Electrolit_3.eps.
Экспериментально установлено, что с увеличением ионной силы раствора коэффициент активности снижается.
Определение ионной силы растворов сильных электролитов необходимо при количественных определениях веществ в химическом анализе, а также для проведения биологических исследований. Такие сильные электролиты, как NaCl, KCl, CaCl2, MgCl2, содержатся в крови и лимфе живых существ. Поэтому при изучении действия растворов сильных электролитов на организм следует применять растворы одинаковой ионной силы.
Литература
Полезно знать
© VetConsult+, 2015. Все права защищены. Использование любых материалов, размещённых на сайте, разрешается при условии ссылки на ресурс. При копировании либо частичном использовании материалов со страниц сайта обязательно размещать прямую открытую для поисковых систем гиперссылку, расположенную в подзаголовке или в первом абзаце статьи.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
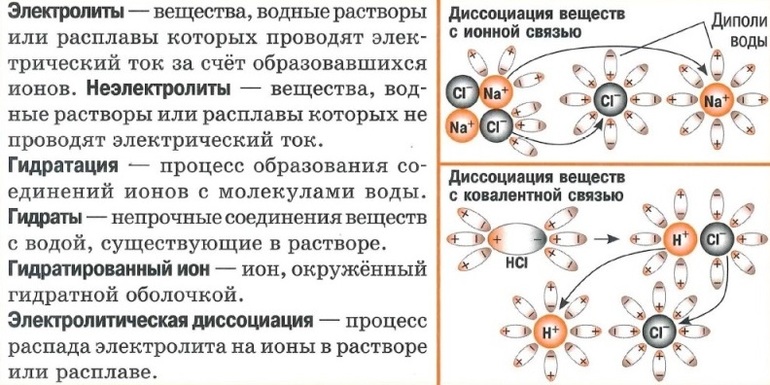
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
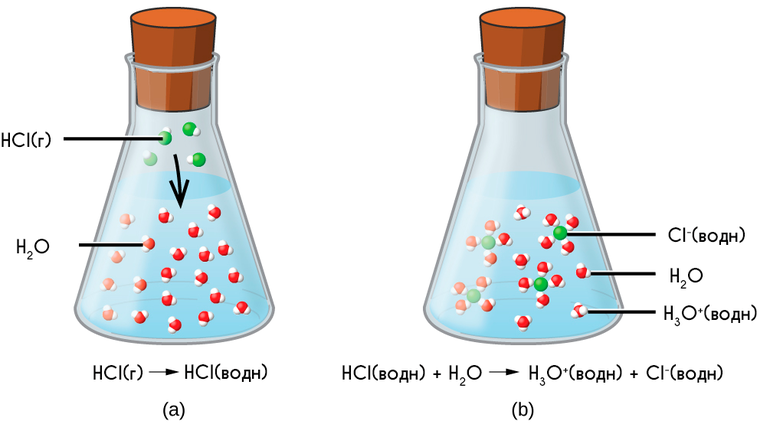
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:
Свойства ионов
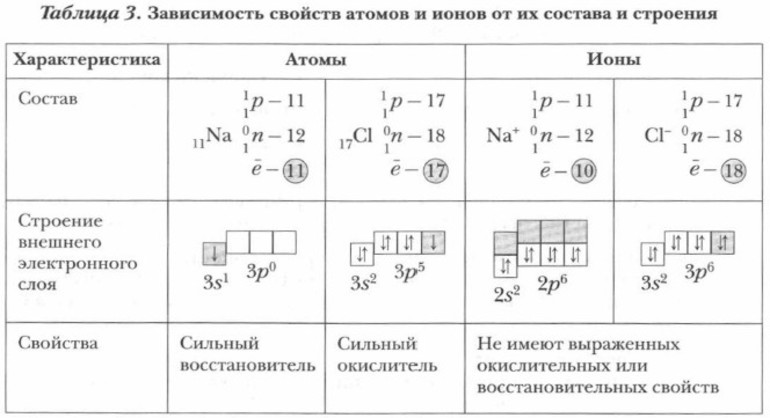
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:
Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.
Значение электролитов для живых организмов
Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
NaCl = Na + + Cl –
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
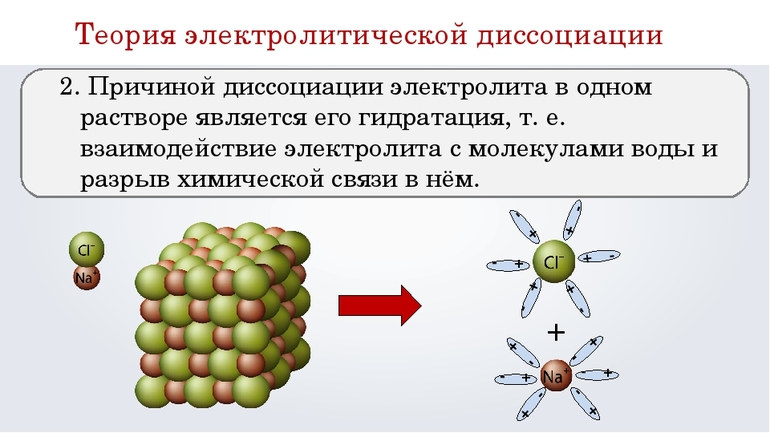
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
Электролитическая диссоциация
К соединениям, что отлично пропускают через себя ток, причисляют сильные кислоты, основания и соли, способные активно растворяться в H2O. Примеры веществ, водные соединения которых не в состоянии проводить электрический ток:
Причина электропроводности открыта в 1877 году шведским учёным С. Аррениусом. Он долго изучал свойства разнообразных соединений и наконец обнаружил, что в некоторых из них наличествуют ионы. Именно они проводят электрический ток. Частицы образуются, когда в воде растворяются определённые ингредиенты. Этот процесс называется электролитической диссоциацией.
С. Аррениус полагал, что частицы изначально находятся в растворах. Он не учитывал, что при взаимодействии электролита и воды происходит химическая реакция. Пытаясь объяснить процесс диссоциации, этот учёный опирался на физическую теорию растворов.
В отличие от него, русские физикохимики Вадимир Александрович Кистяковский и Иван Алексеевич Каблуков применили подход Д. И. Менделеева. Опираясь на химическую теорию, они сумели разработать доказательство того, что реакция является ступенчатой. Когда компонент растворяется в воде, сначала образуются гидраты. Следующая ступень — высвобождение ионов. Атомы водорода в молекуле воды расположены под углом 104,5°. При этом они как бы окутывают элемент, который впоследствии переходит в свободное состояние.
Обратимость реакции
Вещества, имеющие ионную кристаллическую решётку, диссоциируют активнее. Они уже состоят из мельчайших элементов, среди которых есть положительно и отрицательно заряженные. Молекула воды представляет собой диполь — 2 противоположно заряженных полюса. К ним притягиваются частицы вещества при растворении. Одновременно ослабевают связи в кристаллической решётке. Кристалл распадается и раствор насыщается элементами. Схематично процесс электролитической диссоциации можно представить так:
Диссоциация электролитов, состоящих из молекул с ковалентной связью, происходит аналогично. Диполи воды оказывают влияние на молекулы вещества. При этом ковалентная связь преобразуется в ионную. Механизм диссоциации выглядит так:
В естественных условиях частицы в растворе перемещаются хаотично. При этом некоторые из них сталкиваются и объединяются. Такой процесс называется ассоциацией. Отображая эти реакции в виде формулы или уравнения электролитической диссоциации, ставят знак обратимости. Он показывает, что противоположно направленные реакции происходят одновременно. Гидроокиси, обладающие подобным свойством, называют амфотерными.
Некоторые слабые электролиты диссоциируют обратимо и ступенчато. К таким относятся угольная и сероводородная кислоты, гидроксид магния. Гидратированные и негидратированные частицы имеют разные свойства. Например, подвергаясь гидратации, катион или анион меди приобретает голубой цвет. Будучи негидратированным — белый.
В гидратированном элементе количество молекул воды может быть как постоянным, так и изменчивым.
Определение степени
В водном растворе вещества одновременно присутствуют ионы и молекулы. Их количество различается. Для понимания, сколько частиц в растворе в текущий момент, в химии стали использовать специальный показатель — степень диссоциации. Его принято обозначать буквой «альфа» (a). Определение этого показателя выглядит так: с. д. — это отношение ионов к общему количеству частиц, растворившихся в жидкости. Степень д. выражается в процентах (%) или долях.
Когда a=100% или 1, это означает, что электролит целиком распался на ионы. Если a=0, реакция отсутствует. Степень диссоциации неодинакова у разных жидкостей. Она обусловлена тем, каким свойствами обладает электролит изначально. Также интенсивность распада обусловлена тем, сколько в растворе электролита и воды. Чем концентрированнее соединение, тем ниже показатель степени, и наоборот.
Типы электролитов
По способности диссоциировать на ионы жидкости с электролитическим компонентом делят на сильные и слабые. К первым относят те, что полностью вступают в реакцию. Их степень диссоциации равна единице или 100%. Список электролитов, относящихся к сильным:
У слабых электролитов показатель степени диссоциации почти всегда минимален или стремится к нулю. Такие вещества практически не распадаются на элементарные частицы. Категории соединений, отнесённых к слабым электролитам:
Динамическое равновесие
Слабые электролиты диссоциируют не полностью. Когда они находятся в растворе, процесс диссоциации происходит до определённого момента, потом прекращается. Устанавливается динамическое равновесие. Это явление можно выразить в виде уравнения. Способность вещества диссоциировать на мельчайшие частицы называют константой диссоциации или равновесия.
Чем активнее электролит образует ионы, тем он сильнее, а значит, константа выше. У слабых этот показатель будет ниже. Значения констант диссоциации для разных элементов, из которых состоит таблица Менделеева, приводятся в справочной литературе. Эти показатели применимы только к водным растворам. В неводных химические элементы ведут себя иначе.
Кроме воды, вещества могут растворяться в ацетоне, эфире, бензоле, спирте и многих других жидкостях.
Основные положения теории
Электролитической диссоциации посвящена научная теория, состоящая из 5 постулатов. Первый гласит, что электролиты, растворяясь в воде, распадаются на 2 категории ионов — положительно и отрицательно заряженные. Этот вид частиц представляет собой одну из форм, в которой может существовать химический элемент.
Свойства атомов и ионов различаются. Например, ионы натрия не образуют соединений с водой, а атомы этого же элемента вступают с ней в реакцию. Результатом взаимодействия становятся водород и щёлочь. Атомы и ионы хлора различаются по свойствам: первые токсичны, окрашены в жёлто-зелёный цвет и издают резкий запах, а вторые не пахнут, бесцветны и неядовиты.
Когда один или группа атомов присоединяют или отдают электроны, образуются ионы, несущие отрицательный или положительный заряд. По составу они подразделяются на простые и сложные. Находясь в растворе, эти частицы хаотично и непрерывно движутся.
Суть следующего положения теории заключается в том, что причиной диссоциации является взаимодействие молекул воды и электролита, сопровождающееся разрывом химической связи в последнем. В результате гидратации образуются ионы, связанные с молекулами H2O. По-другому эти частицы называют гидратированными. От негидратированных их отличает наличие водной оболочки.
Третье положение объясняет, как образуются катионы и анионы. Под воздействием электротока отрицательные ионы перемещаются к аноду. Он представляет собой положительный полюс. Эти ионы называют анионами.
Положительно заряженные частицы движутся к катоду — отрицательному полюсу источника электротока. Эти частицы называются катионами. Таким образом, ионы могут классифицироваться по знаку заряда. Растворы электролитов всегда электронейтральны, потому что суммы зарядов катионов и анионов равны.
Согласно четвёртому положению теории, электролитическая диссоциация, происходящая с участием слабых электролитов, является обратимым процессом. Одновременно с распадом вещества на ионы происходит соединение последних.
Согласно пятому положению, степень электролитической диссоциации отличается у разных элементов. Она зависит от природы вещества и его концентрации в растворе.
Ионный обмен
В процессе распада кристаллической решётки образуются ионы и молекулы. Состояние, в котором они пребывают, называют динамическим равновесием. Жидкость, содержащая растворившийся сильный электролит, имеет свойства, обусловленные ионами, а та, в которой присутствует слабый, — ещё и молекулами. Например, уксусная кислота обладает характерными вкусом и запахом. Первое свойство объясняется присутствием ионов, второе — содержанием молекул.
Есть ряд характеристик, общих для всех растворов, содержащих сильный электролитический компонент. Так, щёлочи мыльные на ощупь, при этом они способны изменять цвет индикаторов. Эти характеристики объясняются наличием гидроксид-ионов. Растворимые соли приобретают свои характеристики в связи с тем, что в растворенном виде они распадаются на анионы и катионы. Идентичные характеристики кислот обусловлены тем, что в их составе присутствуют ионы оксония H3O.
Некоторые реакции в электролитных растворах протекают с высокой скоростью. Это обусловлено тем, что в них участвуют ионы. Формулы, описывающие эти процессы, называют ионными. Так же именуют и реакции, при этом их классифицируют на обратимые, протекающие до конца, и необратимые. Во втором случае процесс одновременно протекает в прямом и обратном направлениях. Когда ионы вступают в необратимую реакцию, они соединяются и образуют следующие типы элементов и соединений:
Будет ли реакция обратимой, зависит от того, какие химические элементы есть среди исходных. Если это малорастворимые компоненты или слабые электролиты, диссоциация протекает одновременно с ассоциацией. Следовательно, наблюдается обратимое явление. Для него характерно смещение равновесия. Образуется слабый электролит, при этом остаются гидроксид-ионы и недиссоциированные молекулы.
Если исходные компоненты представляют собой сильные электролиты, диссоциация не происходит. При взаимодействии образуется смесь ионов, при этом реакция не протекает. Сильные электролиты не образуют газов, малодиссоциирующих или нерастворимых веществ. Сколько и какого вещества образуется в результате реакции, определяют с помощью уравнений. Например, при распаде 1 моль нитрата аммония возникает 2 моль анионов и катионов.