Для чего нужна гибридизация в химии
Гибридизация (химия)
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Содержание
Концепция гибридизации
Концепция гибридизации валентных атомных орбиталей была предложена американским химиком Лайнусом Полингом для ответа на вопрос, почему при наличии у центрального атома разных (s, p, d) валентных орбиталей, образованные им связи в многоатомных молекулах с одинаковыми лигандами оказываются эквивалентными по своим энергетическим и пространственным характеристикам.
Представления о гибридизации занимают центральное место в методе валентных связей. Сама гибридизация не является реальным физическим процессом, а только удобной моделью, позволяющей объяснить электронное строение молекул, в частности гипотетические видоизменения атомных орбиталей при образовании ковалентной химической связи, в частности, выравнивание длин химических связей и валентных углов в молекуле.
Концепция гибридизации с успехом была применена для качественного описания простых молекул, но позднее была расширена и для более сложных. В отличие от теории молекулярных орбиталей не является строго количественной, например она не в состоянии предсказать фотоэлектронные спектры даже таких простых молекул как вода. В настоящее время используется в основном в методических целях и в синтетической органической химии.
В 1954 году Нобелевский комитет удостоил Л.Полинга премии по химии «За изучение природы химической связи и его применение к объяснению строения сложных молекул». Но сам Л.Полинг не был удовлетворён введением σ,π — описания для двойной и тройной связи и сопряжённых систем.
В 1958 году на симпозиуме, посвящённом памяти Кекуле, Л.Полинг развил теорию изогнутой химической связи, учитывающую кулоновскую электронную корреляцию. По этой теории двойная связь описывалась как комбинация двух изогнутых химических связей, а тройная связь как комбинация трёх изогнутых химических связей. [1]
Этот принцип нашёл отражение в теории отталкивания электронных пар Гиллеспи — Найхолма. Первое и наиболее важное правило которое формулировалось следующим образом:
Второе правило состоит в том, что «все электронные пары, входящие в валентную электронную оболочку, считаются расположенными на одинаковом расстоянии от ядра». [2]
Виды гибридизации
sp-гибридизация
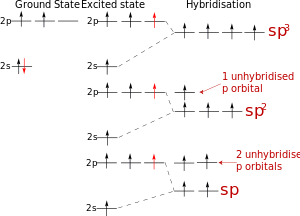
Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей
Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28′, что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
Гибридизация и геометрия молекул
Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
Гибридизация атомных орбиталей
Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
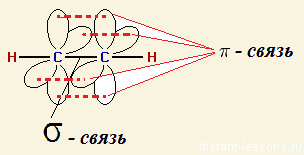
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
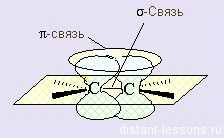
| σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов. |
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
 |  |
 |  |
 |  |
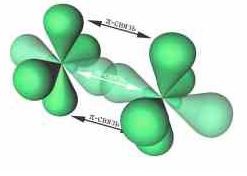
| π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи. |
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
С–С, С–Н, С–О
С=С, С=О
С≡С, С≡N
Гибридизация атомных орбиталей углерода
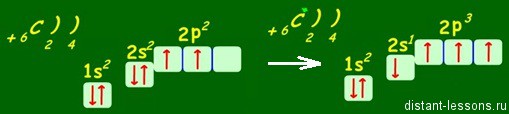
Электронная формула атома углерода в основном состоянии:
+6С 1s 2 2s 2 2p 2
+6С 1s 

В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С * 1s 2 2s 1 2p 3
+6С * 1s 2 

Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
| Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы. |
Изображение с портала orgchem.ru
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109 о 28’ |
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
| Например, пространственное строение н-бутана |
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp 2 — орбитали.
Изображение с портала orgchem.ru
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
| Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180 о друг к другу, что соответствует линейному строению. |
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
| Например, молекула ацетилена имеет линейное строение. |
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Гибридизация электронных орбиталей: sp3, sp2 и sp.
Гибридизация sp3, sp2 и sp в органической химии с практическими примерами.
Введение
Зачем нам теория гибридизации?
Вот один ответ на это. Экспериментально подтверждено, что атом углерода в метане (CH4) и других алканах имеет тетраэдрическую структуру.
Итак, чтобы предсказать валентность и геометрию атома углерода, мы рассмотрим его электронную конфигурацию и орбитали.
На первом этапе один электрон перепрыгивает с 2s на 2p орбиталь. Это приводит к возбужденному состоянию углерода:
Количество гибридных орбиталей всегда совпадает с количеством смешанных орбиталей.
Связи, которые образуются путем встречного перекрытия орбиталей, называются σ (сигма) связями, потому что электронная плотность сосредоточена на оси, соединяющей атомы C и H.
Чтобы обобщить это, любой атом с четырьмя группами (или атом или одинокая пара) является sp3 гибридизированным.
Например, какая гибридизация кислорода в следующей молекуле?
Получающиеся 3 sp2 — орбитали затем располагаются в тригональной плоской геометрии (120°).
Это создает три связи для каждого углерода и одну орбиталь слева.
Итак, два атома углерода в этилене, который является первым членом семейства алкенов, имеют двойную связь.
Вот некоторые ключевые параметры гибридизации sp2 и двойных связей, которые вам необходимо знать:
* Все атомы на двойной связи находятся в одной плоскости;
* Угол между атомами составляет 120°;
Один водород связывается с каждым атомом углерода, перекрывая его орбиталь с другой орбиталью.
Основные параметры sp гибридизации и тройной связи:
* Все атомы имеют линейную структуру;
* Угол между атомами составляет 180°;
* В тройной связи есть одна σ (сигма) и две π (пи) связи.
Гибридизация других элементов
В заключение, все, что мы обсуждали выше, относится не только к углероду.
Теория гибридизации работает с тем же принципом для всех других важных элементов в органической химии, таких как кислород, азот, галогены и многие другие.
Химия, Биология, подготовка к ГИА и ЕГЭ
В органической ( и неорганической химии мы часто встречаем понятие
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Обратите внимание на слово «гипотетический» — это значит предположительный, т.е. так химики попытались объяснить явление, когда атом образует большее количество связей, чем он может образовать в основном (невозбужденном) состоянии, когда есть определенное неспаренное число электронов.
Например, возбужденное состояние атома углерода — основа органической химии:
Гибридизация атомных орбиталей происходит когда образуется ковалентная связь, и образуется она тогда, когда это энергетически более выгодно.
1 пример: смешение s- и двух p-орбиталей (2 другие остаются негибридными): Sp-гибридизация атомных орбиталей: молекула будет иметь линейную форму (180 o ) (у алкинов)
Возможна гибридизация атомных орбиталей, затрагивающая и d-орбиталь:
Чтобы определить тип гибридизации и форму химической частицы, поступают следующим образом:
Гибридизация атомных орбиталей

Всего получено оценок: 884.
Всего получено оценок: 884.
Гибридизация атомных орбиталей – процесс, позволяющий понять, как атомы видоизменяют свои орбитали при образовании соединений. Так, что же такое гибридизация, и какие ее типы существуют?
Общая характеристика гибридизации атомных орбиталей
Гибридизация атомных орбиталей – это процесс, при котором смешиваются различные орбитали центрального атома, в результате чего образуются одинаковые по своим характеристикам орбитали.
Гибридизация происходит в процессе образования ковалентной связи.
Гибридная орбиталь имеет фору знака бесконечности или несимметричной перевернутой восьмерки, вытянутой в сторону от атомного ядра. Такая форма обусловливает более сильное, чем в случае чистых атомных орбиталей, перекрывание гибридных орбиталей с орбиталями (чистых или гибридных) других атомов и приводит к образованию более прочных ковалентных связей.
Впервые идею о гибридизации атомных орбиталей выдвинул американский ученый Л. Полинг. Он считал, что у вступающего в химическую связь атома имеются разные атомные орбитали (s-, p-, d-, f-орбитали), то в результате происходит гибридизация этих орбиталей. Суть процесса заключается в том, что из разных орбиталей образуются эквивалентные друг другу атомные орбитали.
Типы гибридизации атомных орбиталей
Существует несколько видов гибридизации:
sp3-гибридизация характерна для многих элементов, например, атома углерода и других веществ IVА группы (CH4, SiH4, SiF4, GeH4 и др.)
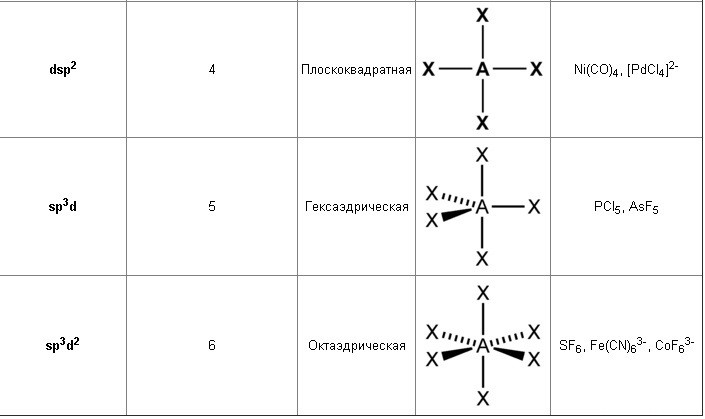
Возможны также и более сложные виды гибридизации с участием d-орбиталей атомов.
Что мы узнали?
Гибридизация – сложный химический процесс, когда разные орбитали атома образуют одинаковые (эквивалентные) гибридные орбитали. Первым теорию гибридизации озвучил американец Л. Полинг. Выделяют три основных вида гибридизации: sp-гибридизация, sp2-гибридизация, sp3-гибридизация. Существуют также более сложные виды гибридизации, в которых участвуют d-орбитали.