Для чего нужна среда кесслера
Среда Кесслера-ГРМ Оболенск
Питательная среда для обнаружения бактерий группы кишечной палочки, сухая.
Среда Кесслера-ГРМ Оболенск
ИНСТРУКЦИЯ по применению набора реагентов для бактериологических исследований «Питательная среда для обнаружения бактерий группы кишечной палочки сухая» Среда Кесслера-ГРМ Оболенск
НАЗНАЧЕНИЕ
Среда Кесслера-ГРМ Оболенск предназначена для обнаружения бактерий группы кишечной палочки при санитарном обследовании объектов внешней среды.
Среда Кесслера-ГРМ Оболенск представляет собой мелкодисперсный, гигроскопичный, светочувствительный порошок серовато-желтого цвета.
Выпускается в полиэтиленовых банках по 250 г.
2.1. ПРИНЦИП ДЕЙСТВИЯ
Совокупность компонентов, входящих в состав набора, обеспечивает питательные потребности для роста бактерий группы кишечной палочки и ингибиции отдельных видов микроорганизмов.
2.2. СОСТАВ набора
Среда Кесслера-ГРМ Оболенск представляет собой смесь сухих компонентов из расчета, г/л:
| Пептон сухой ферментативный ………………………………………………. | 3,0 |
| Панкреатический гидролизат рыбной муки (ПГРМ)………………………… | 7,0 |
| a-Д-лактоза, 1-водная, ………………………………………………………………… | 10,0 |
| Желчь очищенная сухая ………………………………………………………………… | 3,0 |
| Кристаллический фиолетовый ……………………………………………………….. | 0,04 |
| Натрий углекислый………………………………………………………………………… | 0,01-0,25 |
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Соблюдение «Правил устройства, техники безопасности, производственной санитарии, противоэпидемического режима и личной гигиены при работе в лабораториях (отделениях, отделах) санитарно-эпидемиологических учреждений системы Министерства здравоохранения» (Москва, 1981 г.).
Объекты исследований в санитарной микробиологии, научные исследования.
Исследования образцов проводятся по соответствующим Методическим указаниям и ГОСТам.
7.1. ПОДГОТОВКА К АНАЛИЗУ
Приготовление среды «Кесслера-ГРМ».
23,0 г препарата размешивают в 1 л дистиллированной воды. Кипятят 2-3 мин, фильтруют через бумажный фильтр, разливают по 5 мл в стерильные пробирки с поплавками и стерилизуют автоклавированием при температуре 112 °С в течение 20 мин.
Готовая среда имеет фиолетовый цвет. Стерильную среду можно использовать в течение 4-х недель при условии ее хранения при температуре 2-8C, в темном месте.
Диффузное помутнение питательной среды и газообразование в результате роста бактерий группы кишечной палочки, выделенных из исследуемых образцов, регистрируют визуально.
Для получения достоверных результатов посевы образцов производить не менее, чем в трех повторностях.
УСЛОВИЯ ХРАНЕНИЯ И ЭКСПЛУАТАЦИИ НАБОРА
Среда Кесслера-ГРМ Оболенск необходимо хранить в герметично закрытой упаковке в сухом защищенном от света месте при температуре от 2 до 30 С.
Срок годности – 2 года.
Для получения надежных результатов необходимо строгое соблюдение настоящей инструкции по применению.
По вопросам, касающимся качества «Среды Кесслера-ГРМ» в течение срока годности следует обращаться в адрес предприятия-изготовителя: 142279 Оболенск, Московская обл., Серпуховский р-н, ФБУН «Государственный научный центр прикладной микробиологии и биотехнологии», тел. (4967) 36-00-20, факс 36-01-16.
Кесслер
Кесслер
ТУ 9291-155-00008064-97
Номенклатурный номер: 01120201
(производство ВНИИМС – филиал ФГБНУ «ФНЦ пищевых систем им. В.М. Горбатова» РАН)
Для проведения микробиологического контроля необходимо располагать комплексом питательных сред, обеспечивающим контроль всех значимых групп микроорганизмов. Выбор питательной среды определяется специалистами предприятия, проводящими микробиологический контроль и отвечающими за безопасность и качество выпускаемой продукции.
Основное требование, предъявляемое к питательным средам, – обеспечение ростовых характеристик и специфичности на уровне арбитражных сред, т.е. сред, использование которых регламентировано нормативными документами (национальными стандартами).
Рабочие питательные среды для посевов готовят из сухих питательных сред, путем их растворения в воде с последующей стерилизацией в соответствии с инструкцией по приготовлению.
Для приготовления рабочих питательных сред используют водопроводную или дистиллированную воду. Водопроводную воду питьевого качества рекомендуется предварительно выдержать на свету в течение суток, прокипятить в открытом сосуде 30 мин и охладить до комнатной температуры. Активная кислотность воды должна составлять 7,2-7,6 ед. рН. При использовании дистиллированной воды необходимо контролировать и доводить рН среды, т.к. рН дистиллированной воды имеет кислые значения.
Подготовленную воду используют для приготовления питательных сред и растворов для разведений.
Определение активной кислотности (рН) питательных сред
Определение активной кислотности (рН) питательных сред проводят с помощью анализатора потенциометрического для контроля рН по прилагаемым инструкциям. Ориентировочное определение активной кислотности (рН) питательных сред может проводиться с помощью индикаторных бумажек или готового универсального индикатора.
Контроль качества рабочих питательных сред
Качество вновь приготовленных питательных сред проверяют путем параллельного посева одних и тех же проб на новую и ранее используемую среду. Результат считается удовлетворительным при получении данных одного порядка.
Контроль стерильности рабочих питательных сред осуществляют путем термостатирования пробы среды при 37 °С в течение 48 ч. Если после термостатирования на средах отсутствуют признаки роста, то среда считается стерильной.
Хранение рабочих питательных сред
Если особые условия хранения конкретной рабочей питательной среды не оговорены в инструкции по ее применению, то среды хранят в холодильнике не более 3 мес. или при температуре 18-23 °С не более 1 мес. при условии сохранения внешнего вида среды.
И Н С Т Р У К Ц И Я по приготовлению и использованию среды КЕССЛЕР
16 г сухой среды Кесслер растворяют в (1±0,05) дм 3 специально подготовленной питьевой воды. Смесь размешивают и кипятят при помешивании 2-5 мин. Среду охлаждают до комнатной температуры. В полученной среде проверяют активную кислотность и при необходимости доводят 20-30 %-ным раствором гидроокиси натрия или 20 %-ным раствором молочной кислоты до (7,4±0,2) ед. рН.
Среду разливают в пробирки с поплавками по (5±0,5) см 3 или колбочки с поплавками по 40-50 см 3 и стерилизуют при (121±2) °С в течение (11±1) мин.
В процессе стерилизации поплавки должны полностью заполниться средой. Наличие воздуха в поплавках до посевов не допускается.
Готовая для применения среда имеет темно-фиолетовый или синий цвет. Оттенки цвета зависят от партии индикатора и не влияют на качество среды. Допускается наличие небольшого осадка.
Определение БГКП проводят в соответствии с ГОСТ 32901-2014.
Признак роста БГКП на среде Кесслер – появление газа в поплавке.
Модифицированная среда кесслер для обнаружения бактерий группы кишечной палочки
Изобретение относится к санитарной микробиологии. Среда для обнаружения бактерий группы кишечной палочки имеет следующий состав, г/л водопроводной воды: пептон ферментативный сухой 3,0-5,0, желчь крупного рогатого скота стерильная 50,0-55,0, лактоза 4,0-5,0, генцианвиолет 0,036-0,04, рН 7,5
Изобретение относится к санитарной микробиологии и может быть использовано при санитарно-микробиологических исследованиях пищевых продуктов и смывов с объектов внешней среды для обнаружения бактерий группы кишечной палочки.
Библ. 15 США Univ. Maryland et Baltim. 666.
04 Биология Сводный Том 1995г.
Аналогичные данные получены авторами (см. табл. 1, 2, 3).
Нецелесообразность использования увеличенного до 1% количества дорогостоящего пептона в известной среде усугубляется посевом в среду исследуемых пищевых продуктов в соотношении 1:10, которые сами по себе являются дополнительным питательным субстратом для бактерий.
Целью изобретения является снижение стоимости питательной среды в 2-3 раза при равноценных ростовых качествах предложенной и известной среды.
Пример 2. Среда с минимальными значениями ингредиентов.
Пример 4. Среда с максимальными значениями ингредиентов.
Пример 5. Определение ростовых качеств среды методом серийных разведений.
Культуру E. coli 221 засевают в пробирку с 5 мл мясопептонного бульона. Через 4 ч инкубирования культуры при 37 o С по одной микробиологической петле бульонной культуры засеяли в пробирки с 10 мл среды Кесслер с лактозой, приготовленной из сухой коммерческой среды (ТОО «Квадра» ТУ 10.02.875-90) и предлагаемой средой с различными концентрациями пептона 1%; 0,5%; 0,4%; 0,3%; 0,2%.
Из всех пробирок, включая оставшиеся прозрачными, производят высев на сектора чашек со средой Эндо.
На следующий день после инкубирования посевов при 37 o С производят учет наличия роста красных характерных колоний с металлическим блеском в соответствующих разведениях, определяя таким образом ростовые качества среды с определенным содержанием пептона.
Пример 6. Определение ростовых качеств среды методом дозированного посева.
Культуру Citrobacter freundii 227 засевают на скошенный мясопептонный агар, культивируют при 37 o С 18 ч. Используя стандарт мутности, готовят 1 млр. взвесь культуры в физиологическом растворе и производят ряд последовательных разведений в физиологическом растворе до концентрации 1000 микр. тел в 1 мл, 500 м.т.; 100 м.т.; 10 м.т. в 1 мл.
В пробирки с 10 мл предлагаемой среды с концентрацией пептона 1%; 0,5%; 0,4%; 0,3%; 0,2% и в 10 мл среды Кесслер с лактозой, приготовленной из сухой коммерческой среды, засевают по 1 мл каждого из приготовленных разведений бактериальной взвеси.
Посевы инкубируют при 37 o С в течение суток при 37 o С и учитывают рост в соответствующих секторах характерных темно-розовых колоний (см. табл. 3).
Для чего нужна среда кесслера
В настоящее время исследование качества пищевых продуктов путем выявления в них неспецифической микрофлоры является актуальным для современной биологии и медицины. Размножение некоторых микроорганизмов приводит к непригодности пищевых продуктов к употреблению. Многие из производимых в мире продуктов не доходят до потребителя в связи с их порчей (в большинстве случаев микробами) [1–3].
Содержание в пищевых продуктах белков, углеводов, витаминов и других питательных веществ благоприятствует не только сохранению, но и размножению различных микроорганизмов [4, 5]. В молочнокислых и полученных путем брожения пищевых продуктах находятся в большом количестве микробы, которые придают им вкусовые качества и определенную консистенцию (специфическая микрофлора). Кроме того, в продуктах могут содержаться микроорганизмы или их споры, попавшие из внешней среды (неспецифическая микрофлора) [6–8].
В отдельных случаях пищевые продукты могут быть обсеменены сальмонеллами, шигеллами, стафилококками, клостридиями ботулизма, E. coli, B. cereus, Cl. perfringens и другими бактериями, приводящими к возникновению у людей пищевых токсикоинфекций и других заболеваний [9–11]. Поэтому актуально выявление и исследование культуральных, биохимических свойств микрофлоры пищи.
Целью нашего исследования явилось изучение биохимических свойств выявленных неспецифических микроорганизмов пищевых продуктов.
Материалы и методы исследования
Исследование проводилось в бактериологической лаборатории Департамента профилактики заболеваний и госсанэпиднадзора Кыргызской Республики. Объекты исследования – выявленная патогенная и условно-патогенная микрофлора пищевых продуктов.
Во время исследования использовали биохимические методы микробиологии (бродильный метод, методы определения лецитоветиллазы, индикаторные бумажные тесты) [12]. Определение бактерий группы кишечных палочек (БГКП) в пищевых продуктах производили бродильным методом посевом на среды Кесслера, – 37 °С – 18–24 ч., высев на Эндо – 37 °С – 24 ч. (ГОСТ 30518-97, ГОСТ 10444.15-94). Определение семейства Enterobacteriacea производили с помощью системы индикаторные бумажные (СИБ) тесты – индолообразования (СТ 28560-90, ГОСТ 30726-2001). А идентификацию Staphylococcus aureus – определением лецитоветиллазы (лецитиназа), реакцией плазмокоагуляция (ГОСТ 9225-84).
Результаты исследования и их обсуждение
Из молочных продуктов, кондитерских изделий и готовых кулинарных изделий выделены бактерии группы кишечных палочек. Характерные биохимические свойства бактерии группы кишечных палочек мы описываем ниже.
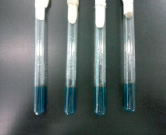
Для определения биохимических свойств БГКП 0,1 г продукта (разведение 1:10) высевали на 9 мл среды Кесслера с поплавками при температуре 37 °С и инкубировали на 16–24 ч. После инубации наблюдали выделение газа и изменение цвета среды. Цвет среды Кесслера изменился с красного на желтый. Это доказывает, что БГКП ферментировал среды Кесслера с образованием газа (рис. 1).
Рис. 1. Биохимические свойства семейства Enterobacteriaceae: а) отрицательный, б) положительный (ферментировали среды Кесслера с образованием газа)
Рис. 2. Биохимические свойства семейства Enterobacteriaceae: а) среда лактоза до посева, б) среда лактоза после посева
Затем, чтобы дальше исследовать биохимические свойства БГКП, производили посев на лактозную среду. После инкубации при температуре 37 °С на 24 ч на лактозной среде наблюдали выделение пузырьков и изменение цвета среды. Как видно на рис. 2, изменился цвет среды с темно-зеленого на желтый, выделение пузырьков доказывает, что эти микроорганизмы, ферментируя лактозную среду, образуют кислоту и газы.
Чтобы определить биохимические свойства E. coli, 0,1 г продукта (разведение 1:10) высевали на 9 мл среды Кесслера с поплавками при температуре 44 °С, инкубировали на 16–24 ч. После инкубации наблюдали выделение газа и изменение цвета среды. Цвет среды Кесслера изменился с красного на желтый. Это доказывает, что E. coli ферментировал среды Кесслера с образованием газа (рис. 1). Для дальнейщего исследования биохимических свойств E. coli производили посев на лактозную среду. После инкубации при температуре 37 °С на 24 ч на среде лактоза наблюдали выделение пузырьков и изменение цвета лактозной среды. Цвет лактозной среды изменялся с темно-зеленого на желтый и выделялись газы. Эти свойства характерны для семейства Enterobacteriaceae (рис. 2).
Для межродовой и видовой биохимической дифференциации энтеробактерий определяли с помощью системы индикаторные бумажные тесты (СИБ-тесты).
Биохимические свойства группы Proteus определяются с помощью СИБ-тестов. После инкубации наблюдали следующие изменения. Результат анализа регистрировался визуально. При определении оксидазной активности группы Proteus СИБ тест меняет свой цвет на синий. Это доказывает, что эти выросшие культуры на поверхности агара группы Proteus.
Из колонии группы Proteus vulgaris брали бактериологической петлей и посевали штрихом по косяку и уколом в столбик комбинированной среды для первичной биохимической идентификации микробов на среду Клиглера (1) и Симонса (2) (Проба № 2118-2121, рис. 3). На рис. 4 видно, что идет почернение среды Клиглера, образование сероводорода, ферментация глюкозы с изменениями окраски столбика среды, кислотообразования. А среда Симонса не изменилась. Почернение среды Клиглера, появляющееся в средней или нижней части столбика, происходит при образовании выделенным микробом сероводорода, что свойственно представителям рода Рroteus vulgaris, Р. mirabilis.
Рис. 3. Биохимические свойства Proteus vulgaris. Среда Клиглера (1) и Симонса (2) до пересева
Рис. 4. Биохимические свойства Proteus vulgaris. Среда Клиглера (1) и Симонса (2) после пересева
При проведении дополнительного биохимического анализа Proteus vulgaris определяли индолообразование. Для выявления индола в пробирки разливали 6 мл среды и засевали суспензией бактерий. Инкубировали при температуре 37 °С в течение 18–24 ч. Затем для определения индола складывали по намеченной на ней линии вдвое и пинцетом опускали на дно пробирки. Контроль произвели СИБ-диской, помещенной в пробирку со стерильным натрия хлорида раствором 0,9 %. Обе пробирки инкубировали при температуре (37 ± 1) °С. На пробе индолообразования подтверждено, что конец индола окрашивался в розово-малиновый цвет.
Staphylococcus aureus в анаэробных условиях ферментирует маннит. Биохимические свойства Staphylococcus aureus определяли с помощью лецитоветиллазы и плазмокоагуляции. При определении лецитоветиллазы (лецитиназа) посевали на среду желточно-солевой агар – хлористый натрий является элективным фактором, он подавляет рост большинства представителей другой микрофлоры, главным образом грамотрицательной. Одним из компонентов яичного желтка является лецитовителлин. Лецитовителлин является субстратом для фермента лецитовителлазы (лецитиназы), относящегося к группе липаз и продуцируемого некоторыми стафилококками. На желточно-солевом агаре (рис. 5) колонии Staphylococcus aureus – S-формы, выпуклые, круглые и блестящие. Наличие пигмента легко определяется на глаз. Вокруг колонии S. аureus образовался радужный венчик. Это доказывает, что S. aureus обладает лецитовителлазной активностью.
Рис. 5. Биохимическая идентификация Staphylococcus aureus
Для окончательной идентификации Staphylococcus aureus определяли фермент плазмокоагулазы. В пробирку, содержащую цитратную плазму крови, вносили с петлей суточной агаровой культуры исследуемого штамма и штатив с пробирками инкубировали на 4 часа в термостат при 37 °С. После инкубации учитывали результат, в пробирке (рис. 6) появился студнеобразный сгусток. Под действием фермента плазмокоагулазы активируется естественная система свертывания крови (плазминоген протромбин). Появление студнеобразного сгустка любого размера считается положительным результатом реакции. Положительным результатом следует считать наличие плазмокоагуляции в первые 4 часа инкубации. Отсутствие свертывания плазмы в течение 18 ч расценивается как отрицательный результат. В качестве контроля рекомендуется ставить реакцию с заведомо коагулирующим и некоагулирующим штаммами, а также оставлять одну пробирку с плазмой незасеянной (рис. 6).
Рис. 6. Биохимические свойства Staphylococcus aureus. Реакция плазмокоагуляции
Выводы
1. Показано, что семейства Enterobacteriaceae ферментируют углеводы с кислотообразованием и выделяют сероводород.
2. Установлено, что Staphylococcus aureus ферментирует лецитовителлин и активирует естественную систему свертывания крови и вызывает плазмокоагуляцию.
3. Показано, что Proteus vulgaris обладает сахаролитической и протеолитической активностью.
Среда Кесслера
Цена за упаковку 250 г.
Описание
Инструкция по применению Питательной среды для санитарно-бактериологических исследований воды, пищевых продуктов сухой (среда Кесслера)
Питательная среда для санитарно-бактериологических исследований воды, пищевых продуктов сухая (среда Кесслера) представляет собой мелкодисперсный порошок желтого цвета, гигроскопичный, светочувствительный.
Пептон сухой ферментативный для бактериологических целей 5,0
Питательный бульон сухой 3,5
Желчь крупного рогатого скота очищенная сухая 4,5
Кристаллический фиолетовый 0,015
Натрий углекислый 0,3±0,15
НАЗНАЧЕНИЕ
«Питательная среда для санитарно-бактериологических исследований воды, пищевых продуктов сухая ( среда Кесслера)» предназначена для обнаружения бесспоровых грамотрицательных аэробных и факультативно-анаэробных бактерий (БГКП), в основном относящихся к родам эшерихия, цитробактер, энтеробактер и клебсиелла по признаку ферментации лактозы при санитарно-бактериологическом обследовании пищевых продуктов и объектов внешней среды ( вода, сточные воды и др.).
СПОСОБ ПРИМЕНЕНИЯ
1.Оборудование и материалы, необходимые для анализа.
III-IV групп патогенности (опасности) и возбудителями паразитарных заболеваний».
Сухую питательную среду в количестве 23,3 г тщательно размешивают в 1 л дистиллированной воды, кипятят в течение 2-3 мин, фильтруют через ватно-марлевый фильтр, разливают в стерильные пробирки с поплавками или стерильными ватными рыхлыми тампончиками по 5 мл. Среду наливают по стенке пробирки, чтобы вата не всплывала. Питательную среду не стерилизовать!
Готовая к использованию среда должна быть прозрачной или с небольшой опалесценцией, фиолетового цвета.
Готовую среду можно использовать в течение 15 сут., при условии хранения ее при температуре 2-8ºС в защищенном от света месте.
Если иное не указано в нормативных документах по анализу конкретного пищевого продукта, по 1 мл соответствующего разведения пищевого продукта засевают в пробирки с питательной средой. Пробирки помещают в термостат. Посевы инкубируют при (37±1)ºС и (или) (43±1)ºС в течение 20-48 часов.
УЧЕТ РЕЗУЛЬТАТОВ
Регистрацию и учет результатов производят визуально.
Рост бактерий группы кишечной палочки, ферментирующих лактозу, сопровождается газообразованием, о степени которого судят по подъему ватного тампончика.
Рост бактерий, не ферментирующих лактозу, вызывает слабое помутнение среды без газообразования.
Среда ингибирует рост стафилококка и протея.
ФОРМА ВЫПУСКА
Питательная среда для санитарно-бактериологических исследований воды, пищевых продуктов сухая (Среда Кесслера) выпускается в полиэтиленовых банках по 100, 200, 250 г.
УСЛОВИЯ ХРАНЕНИЯ И ТРАНСПОРТИРОВАНИЯ
Хранение — в соответствии с СП 3.3.2.1248-03 в герметично закрытой упаковке в сухом, защищенном от света места при температуре от 2 до 25ºС.
Транспортирование – в соответствии с СП 3.3.2.1248-03 при температуре от 2 до 25ºС.
Срок годности – 2 года. Питательная среда с истекшим сроком годности использованию не подлежит.
Рекламации на качество питательной среды в течение срока годности следует направлять в адрес производителя: ФГУП «НПО «Микроген» Минздравсоцразвития России, Россия, 115088, г. Москва, ул.1-ая Дубровская, 15, тел.(495)710-37-87.
Адрес производства: Россия, 367025, Республика Дагестан, г. Махачкала, 367010