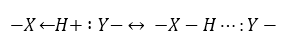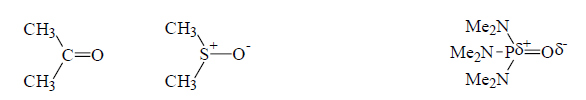Для чего нужна водородная связь
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
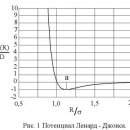
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
Характеристика водородной связи
Водородная связь характеризуется
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Водородная связь
Вы будете перенаправлены на Автор24
Понятие водородная связь
Появление водородной связи предопределено исключительностью атома водорода. Атом водорода гораздо меньше, чем другие атомы. Электронное облако, образованное им и электроотрицательным атомом сильно смещено в сторону последнего. В результате ядро водорода остается слабоэкранированным.
Атомы кислорода гидроксильных групп двух молекул карбоновых кислот, спиртов или фенолов могут близко сходиться из-за образования водородных связей.
Положительный заряд ядра атома водорода и отрицательный заряд другого электроотрицательного атома притягиваются. Энергия их взаимодействия сопоставима с энергией прежней связи, поэтому протон оказывается связанным сразу с двумя атомами. Связь со вторым электроотрицательным атомом может быть более сильной, чем первоначальная связь.
Протон может передвигаться от одного электроотрицательного атома к другому. Энергетический барьер у такого перехода незначительный.
Водородные связи относятся к числу химических связей средней силы, но, если таких связей много, то они способствуют образованию прочных димерных или полимерных структур.
Готовые работы на аналогичную тему
Положительный конец диполя в гидроксильной группе находится у атома водорода, поэтому через водород может формироваться связь с анионами или электроотрицательными атомами, содержащими неподеленные электронные пары.
Рисунок 2. Ацетон, диметилсульфоксид (ДМСО), гексаметилфосфортриамид (ГМФТА)
Так как стерические препятствия отсутствуют, водородная связь образуется легко. Ее сила, в основном определяется тем, что она преимущественно имеет ковалентный характер.
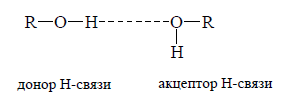
Обычно наличие водородной связи обозначают пунктирной линией между донором и акцептором, например, у спиртов
Как правило, расстояние между двумя атомами кислорода и водородной связи меньше суммы ван-дер-ваальсовых радиусов атомов кислорода. Должно присутствовать взаимное отталкивание электронных оболочек атомов кислорода. Однако силы отталкивания преодолеваются силой водородной связи.
Природа водородной связи
Значение межмолекулярной водородной связи
Водородные связи оказывают следующее влияние на соединения:
они обуславливают ассоциацию соединений (карбоновых кислот, спиртов), что приводит к появлению высоких температур кипения этих соединений;
Например: уксусная кислота даже в газовой фазе существует в виде димера.
сольватация соединений посредством образования водородных связей с растворителем существенно повышает их растворимость;
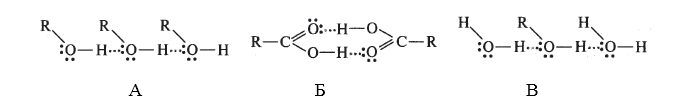
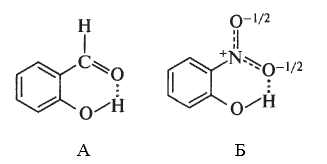
способствуют стабилизации ионизированных частиц в растворе, например межмолекулярные водородные связи в соединениях А,Б,В:
важны при формировании пространственной структуры нуклеиновых кислот, белков, полисахаридов и др. соединений;
участвуют в осуществлении ряда биохимических процессов (синтез мРНК, репликация ДНК);
обеспечивают связывание лекарственных препаратов с рецепторами и т.д.
Внутримолекулярные водородные связи
В случаях, когда возможно замыкание шестичленного или пятичленного цикла, образуются внутримолекулярные водородные связи.
Наличие внутримолекулярных водородных связей в салициловом альдегиде и о-нитрофеноле является причиной отличия их физических свойств от соответствующих мета- и пара-изомеров.
$o$-Нитрофенол является единственным из трех изомерных представителей нитрофенолов, который способен перегоняться с водяным паром. На этом свойстве основано его выделение из смеси изомеров нитрофенола, которая образуется в результате нитрования фенолов.
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Водородная связь
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными. [1]
Содержание
Природа
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR’. Результатом таких взаимодействий являются комплексы RA-H•••BR’ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR’.
История
Свойства
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от
6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB) ± ; так, для комплекса (H2O•H•OH2) + образованного H2O и H3O + — 132 кДж/моль в газовой фазе.
В воде
Механизм Гротгуса
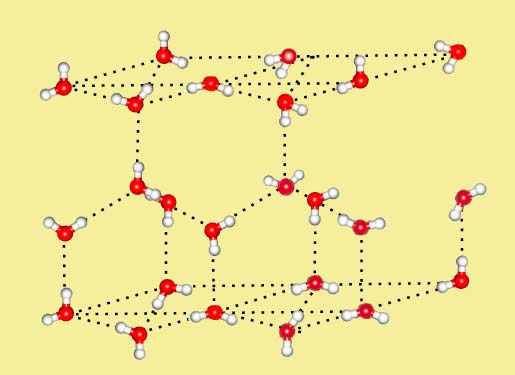
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных Н-связей до 5-6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
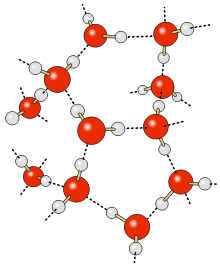
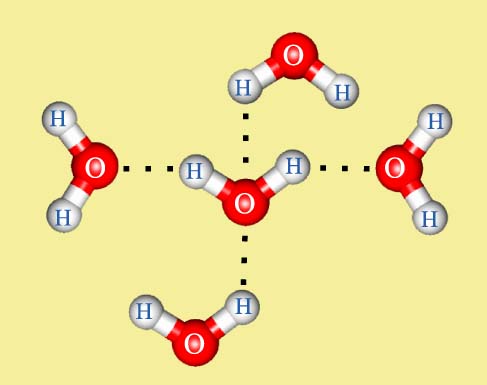
Водные кластеры
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
В нуклеиновых кислотах и белках
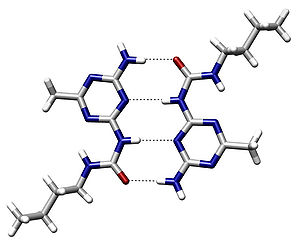
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах, водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК, определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
В полимерах
Много полимеров усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
См. также
Примечания
Литература
Полезное
Смотреть что такое «Водородная связь» в других словарях:
ВОДОРОДНАЯ СВЯЗЬ — ВОДОРОДНАЯ СВЯЗЬ, ХИМИЧЕСКАЯ связь, образующаяся между некоторыми молекулами, содержащими водород. Атом водорода должен быть связан с электроотрицательным (отталкивающим электроны) атомом; связь возникает между положительным зарядом атома… … Научно-технический энциклопедический словарь
ВОДОРОДНАЯ СВЯЗЬ — тип связи, промежуточный между ковалентной химической связью и невалентным межат. вз ствием и осуществляющийся с участием атома водорода, расположенного либо между молекулами, либо между атомами внутри молекулы. Примером межмолекулярной В. с. явл … Физическая энциклопедия
ВОДОРОДНАЯ СВЯЗЬ — вид химической связи типа А Н. А ; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.), и неподеленной парой электронов другого атома А (обычно O, N). Атомы А и А… … Большой Энциклопедический словарь
водородная связь — – особый вид трехцентровой химической связи X H. Y, в которой центральный атом водорода, соединенный ковалентной связью с электроотрицательным атомом X (C, N, O, S) образует дополнительную связь с атомом Y (N, O, S), имеющим направленную вдоль… … Химические термины
водородная связь — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN hydrogen bond … Справочник технического переводчика
водородная связь — Термин водородная связь Термин на английском hydrogen bond Синонимы Аббревиатуры H bond Связанные термины клатрат, когезия, протеомика, супрамолекулярная химия, нанодиапазон, межмолекулярное взаимодействие Определение притяжение между ковалентно… … Энциклопедический словарь нанотехнологий
водородная связь — вид химической связи типа А Н. А ; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом A (N, O, S и др.), и неподелённой парой электронов другого атома А (обычно О, N). Атомы А и А… … Энциклопедический словарь
Водородная связь — вид химического взаимодействия атомов в молекулах, отличающийся тем, что существенное участие в нём принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом (А). Группа А Н выступает донором протона (акцептором… … Большая советская энциклопедия
ВОДОРОДНАЯ СВЯЗЬ — невалентное взаимод. между группой АН одной молекулы (RAH) и атомом В другой (BR ). В результате этого взаимод. образуется устойчивый комплекс RAH. BR с межмолекулярной B.C., в к ром атом водорода играет роль мостика, соединяющего фрагменты RA и … Химическая энциклопедия
водородная связь — hydrogen bond водородная связь. Cлабое электростатическое взаимодействие между атомами водорода, связанными с атомами кислорода либо азота; В.с. слабее ковалентной связи; В.с. играет важную роль в образовании структур высшего порядка у… … Молекулярная биология и генетика. Толковый словарь.
ВОДОРОДНАЯ СВЯЗЬ
ВОДОРОДНАЯ СВЯЗЬ (Н-связь) – особый тип взаимодействия между реакционно-способными группами, при этом одна из групп содержит атом водорода, склонный к такому взаимодействию. Водородная связь – глобальное явление, охватывающее всю химию. В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а возникает в подходящих условиях сама и проявляется в виде межмолекулярных или внутримолекулярных взаимодействий.
Особенности водородной связи.
Отличительная черта водородной связи – сравнительно низкая прочность, ее энергия в 5–10 раз ниже, чем энергия химической связи. По энергии она занимает промежуточное положение между химическими связями и Ван-дер-ваальсовыми взаимодействиями, теми, что удерживают молекулы в твердой или жидкой фазе.
Возникший частичный положительный заряд на атоме водорода позволяет ему притягивать другую молекулу, также содержащую электроотрицательный элемент, таким образом, основную долю в образование Н-связи вносят электростатические взаимодействия.
В формировании Н-связи участвуют три атома, два электроотрицательных (А и Б) и находящийся между ними атом водорода Н, структура такой связи может быть представлена следующим образом: Б···Н d+ –А d- (водородную связь обычно обозначают точечной линией). Атом А, химически связанный с Н, называют донором протона (лат. donare – дарить, жертвовать), а Б – его акцептором (лат. acceptor – приемщик). Чаще всего истинного «донорства» нет, и Н остается химически связанным с А.
Атомов – доноров А, поставляющих Н для образования Н-связей, не много, практически всего три: N, O и F, в то же время набор атомов-акцепторов Б весьма широк.
Само понятие и термин «водородная связь» ввели В.Латимер и Р.Родебуш в 1920, для того, чтобы объяснить высокие температуры кипения воды, спиртов, жидкого HF и некоторых других соединений. Сопоставляя температуры кипения родственных соединений Н2O, Н2S, Н2Se, и Н2Te, они обратили внимание на то, что первый член этого ряда – вода – кипит намного выше, чем это следовало из той закономерности, которую образовали остальные члены ряда. Из этой закономерности следовало, что вода должна кипеть на 200° С ниже, чем наблюдаемое истинное значение.
Точно такое же отклонение наблюдается для аммиака в ряду родственных соединений: NН3, Н3P, Н3As, Н3Sb. Его истинная температура кипения (–33° С) на 80° С выше ожидаемого значения.
При кипении жидкости разрушаются только Ван-дер-Ваальсовы взаимодействия, те, что удерживают молекулы в жидкой фазе. Если температуры кипения неожиданно высокие, то, следовательно, молекулы связаны дополнительно еще какими-то силами. В данном случае это и есть водородные связи.
В настоящее время надежный способ обнаружить Н-связи дают спектральные методы (чаще всего инфракрасная спектроскопия). Спектральные характеристики групп АН, связанных водородными связями, заметно отличаются от тех случаев, когда такая связь отсутствует. Кроме того, если структурные исследования показывают, что расстояние между атомами Б – Н меньше суммы Ван-дер-Ваальсовых радиусов, то считают, что присутствие Н-связи установлено.
Помимо повышенной температуры кипения водородные связи проявляются себя также при формировании кристаллической структуры вещества, повышая его температуру плавления. В кристаллической структуре льда Н-связи образуют объемную сетку, при этом молекулы воды располагаются таким образом, чтобы атомы водорода одной молекулы были направлены к атомам кислорода соседних молекул:
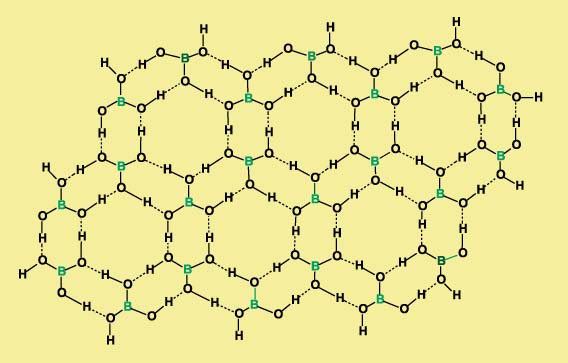
Борная кислота В(ОН)3 имеет слоистую кристаллическую структуру, каждая молекула связана водородными связями с тремя другими молекулами. Упаковка молекул в слое образует паркетный узор, собранный из шестиугольников:
Большинство органических веществ не растворимо в воде, когда такое правило нарушается, то, чаще всего, это результат вмешательства водородных связей.
Существует эмпирическое правило: если органическое вещество содержит не более трех атомов углерода на один атом кислорода, то оно легко растворяется в воде:
Бензол весьма незначительно растворим в воде, но если заменить одну группу СН на N, то получим пиридин С5Н5N, который смешивается с водой в любых соотношениях.
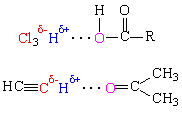
Водородные связи могут проявить себя и в неводных растворах, когда на водороде возникает частичный положительный заряд, а рядом находится молекула, содержащая «хороший» акцептор, как правило кислород. Например, хлороформ HCCl3 растворяет жирные кислоты, а ацетилен HCєCH растворим в ацетоне:
Этот факт нашел важное техническое применение, ацетилен, находящийся под давлением, очень чувствителен к легким сотрясениям и легко взрывается, а его раствор в ацетоне под давлением безопасен в обращении.
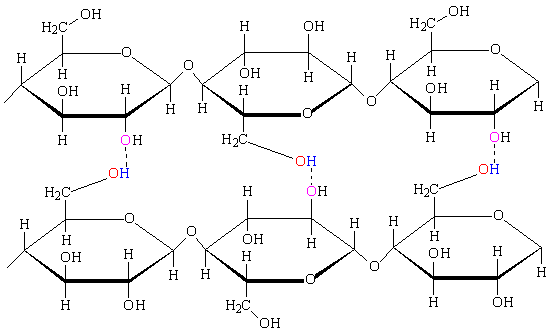
Важную роль играют водородные связи в полимерах и биополимерах. В целлюлозе – основном компоненте древесины – гидроксильные группы, расположены в виде боковых групп полимерной цепи, собранной из циклических фрагментов. Несмотря на сравнительно слабую энергию каждой отдельной Н-связи, их взаимодействие на всем протяжении полимерной молекулы приводит к столь мощному межмолекулярному взаимодействию, что растворение целлюлозы становится возможным лишь при использовании экзотического высокополярного растворителя – реактива Швейцера (аммиачный комплекс гидроксида меди).
В показанном комплексе клиновидными линиями со сплошной заливкой или поперечной штриховкой обозначены химические связи, направленные к вершинам октаэдра.