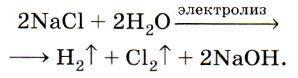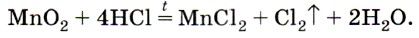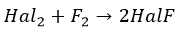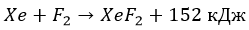Для чего нужны галогены
Для чего нужны галогены
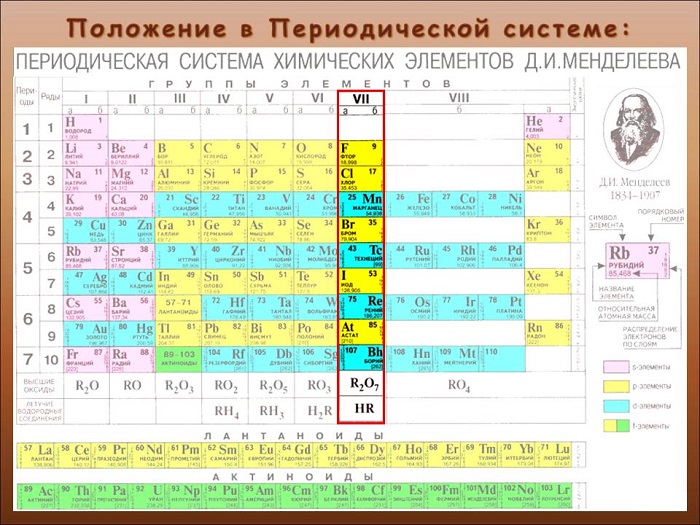
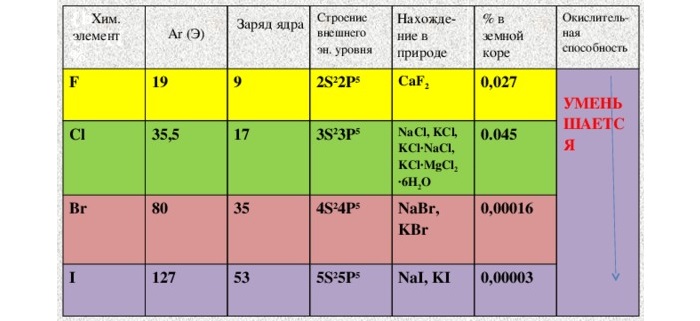
К галогенам относятся пять основных неметаллических элементов, которые расположены в VII группе таблицы Менделеева. В эту группу входят такие химические элементы, как фтор F, хлор Cl, бром Br, иод I, астат At.
Свое название галогены получили от греческого слова, которое в переводе обозначает образующий соль или «солеобразующий», так как в принципе большая часть соединений, которые содержат галогены и носят названия солей.
Галогены вступают в реакцию практически со всеми простыми веществами, за исключением только нескольких металлов. Они являются довольно таки энергичными окислителями, имеют очень сильный и резкий запах, прекрасно взаимодействуют с водой, а также имеют большую летучесть и высокую электроотрицательность. А вот в природе их можно встретить лишь в качестве соединений.
Физические свойства галогенов
1. Такие простые химические вещества, как галогены, состоят из двух атомов;
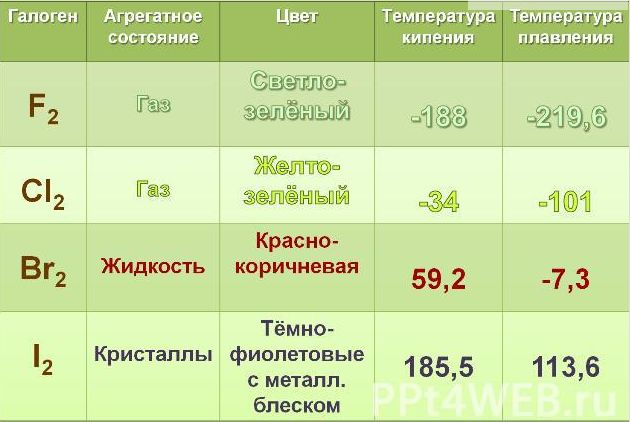
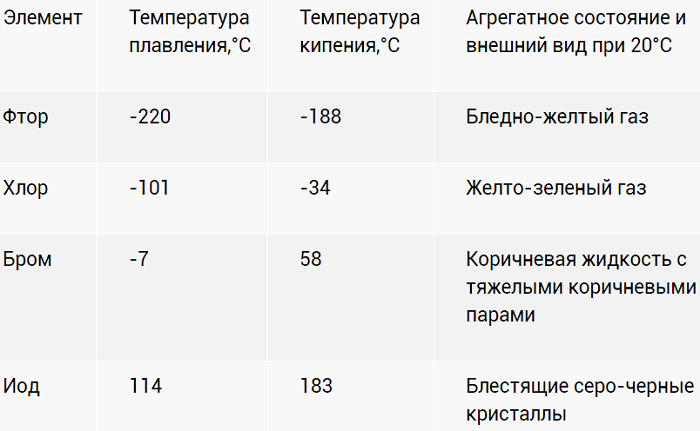
2. Если рассматривать галогены в обычных условиях, то следует знать, что фтор и хлор, находятся в газообразном состоянии, тогда как бром является жидким веществом, а йод и астат относятся к твердым веществам.
3. У галогенов температура плавления, кипения и плотность повышаются с увеличением атомной массы. Также при этом и меняется их окраска, она становиться более темной.
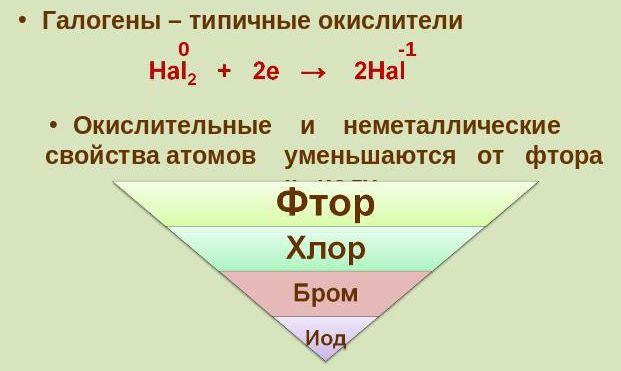
4. При каждом увеличении порядкового номера, уменьшается химическая активность, электроотрицательность и более слабыми становятся неметаллические свойства.
5. Галогены обладают способностью образовывать соединения между собой, как например BrCl.
6. Галогены при комнатной температуре могут находиться во всех трех состояниях материи.
7. Так же важно запомнить то, что галогены относятся к довольно таки токсичным химическим веществам.
Химические свойства галогенов
При химической реакции с металлами, галогены действуют, как окислители. Если, к примеру, взять фтор, то даже в обычных условиях он дает реакцию с большинством металлов. А вот алюминий и цинк воспламеняется даже в атмосфере: +2-1:ZnF2.
Получение галогенов
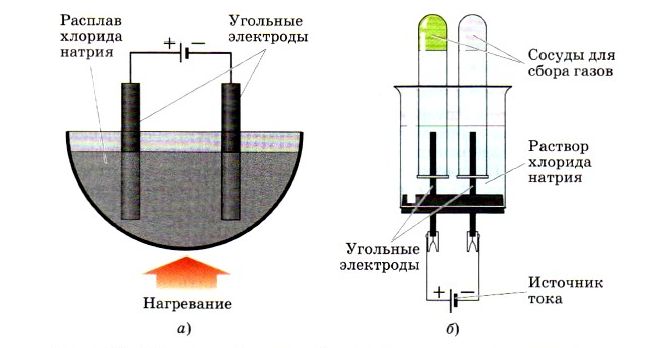
При получении фтора и хлора в масштабах промышленности используют электролиз или растворы солей.
Если вы внимательно рассмотрите рисунок, изображенный внизу, то увидите, как в лабораторных условиях с помощью установки для электролиза можно получить хлор:
На первом рисунке изображена установка для расплава хлорида натрия, а на втором уже для получения раствора хлорида натрия.
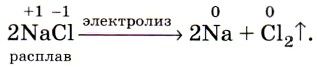
Такой процесс электролиза расплава хлорида натрия можно представить в виде даного уравнения:
При помощи такого электролиза, кроме получения хлора еще образуются также водород и гидроксид натрия:
Конечно же, водород получают более простым и дешевым способом, чего не скажешь об гидроксиде натрия. Его, так же, как и хлор получают практически всегда только с помощью электролиза раствора поваренной соли.
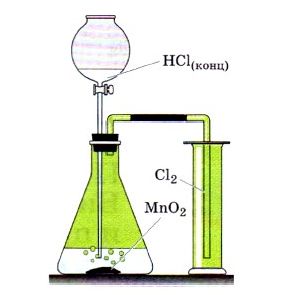
Если вы рассмотрите рисунок, изображенный вверху, то увидите, как лабораторным способом можно получить хлор. А получают его с помощью взаимодействия соляной кислоты с оксидом марганца:
В промышленности бром и йод получают с помощью реакции вытеснения этих веществ хлором из бромидов и йодидов.
Применение галогенов
Фтор или правильнее будет назвать фторид меди (CuF2) имеет довольно таки широкое применение. Его используют при изготовлении керамики, эмалей и различных глазурей. Имеющая в каждом доме тефлоновая сковородка и хладагент в холодильниках и кондиционере, также появились благодаря фтору.
Кроме бытовых нужд тефлон также используют в медицинских целях, так как его применяют при производстве имплантатов. Фтор необходим при изготовлении лизн в оптике и в зубных пастах.
Хлор также в нашей жизни встречается буквально на каждом шагу. Самым массовым и распространенным применением хлора, является, конечно же, поваренная соль NaCl. Она так же выступает в роли дезинтоксикационного средства и используется в борьбе с гололедом.
Кроме этого, хлор незаменим в производстве пластика, синтетического каучука и поливинилхлорида, благодаря которым мы получаем одежду, обувь и другие, нужные в нашей повседневной жизни вещи. Его используют при производстве отбеливателей, порошков, красителей, а также другой бытовой химии.
Бром, как правило, необходим, как светочувствительное вещество при печатании фотографий. В медицине он применяется, как успокаивающее средство. Также бром используют при производстве инсектицидов и пестицидов и т.д.
Ну, а всем известный йод, который имеется в аптечке у каждого человека, в первую очередь используется, как антисептик. Кроме своих антисептических свойств, йод присутствует в источниках света, а также является помощником для обнаружения отпечатков пальцев на бумажной поверхности.
Роль галогенов и их соединений для организма человека
Выбирая в магазине зубную пасту, наверное, каждый из вас обращал внимание на то, что на ее этикетке указывается содержание соединений фтора. И это неспроста, так как этот компонент участвует в построении зубной эмали и костей, повышает устойчивость зубов к кариесу. Также он играет важную роль в процессах обмена веществ, участвует в построении скелета костей и предупреждает появление такого опасного заболевания, как остеопороз.
Важная роль в организме человека отведена и хлору, так как он принимает активное участие в сохранении водно-солевого баланса и поддерживание осмотического давления. Хлор участвует в обмене веществ человеческого организма, построении тканей, ну и что тоже немаловажно – в избавление от лишнего веса. Соляная кислота, находящаяся в составе желудочного сока большое значение имеет для пищеварения, так как без нее невозможен процесс переваривания пищи.
Хлор необходим нашему организму и должен ежедневно в необходимых дозах поступать в него. Но если, же его норму поступления в организм превысить или резко снизить, то мы сразу же это ощутим в виде отеков, головных болей и других неприятных симптомов, которые способны не только нарушить обмен веществ, но и вызвать заболевания кишечника.
У человека в мозге, почках, крови и печени присутствует небольшое количество брома. В медицинских целях бром применяют, как успокоительное средство. Но при его передозировке могут быть неблагоприятные последствия, которые могут привести к угнетенному состоянию нервной системы, а в некоторых случаях и к психическим расстройствам. А недостаток брома в организме ведет к дисбалансу между процессами возбуждения и торможения.
Без йода наша щитовидная железа не может обходиться, так как он способен убивать микробы, поступающие в наше тело. При дефиците йода в организме человека может начаться заболевание щитовидной железы, под названием зоб. При этом заболевании появляются довольно неприятные симптомы. Человек, у которого появился зоб, чувствует слабость, сонливость, повышение температуры, раздражительность и упадок сил.
Из всего этого можно сделать вывод, что без галогенов человек мог бы не только лишиться многих необходимых в повседневной жизни вещей, но без них и не смог бы нормально функционировать наш организм.
Галогены — особая группа химически активных веществ
Галогены — класс простых неорганических веществ с похожими 
Все галогены химически активны, поэтому в естественном виде встречаются только (кроме йода) в минералах, а также в морской воде и подземных рассолах.
Физические свойства различны. Фтор и хлор — газообразны. Бром — жидкий, легко испаряется. Йод — твердый кристаллический, переходит в газообразное состояние, минуя жидкое. Астат — твердый. Все галогены плохо растворяются в воде, но способны образовывать «хлорную», «йодную» и «бромную» воду, частично вступая в реакцию с водой. Растворяются в неполярных органических растворителях. Все галогены ядовиты, пахнут неприятно.
Польза и опасность
Все галогены крайне токсичны. Например, пары йода, попав в легкие в больших количествах, вызывают отек легких, поражение почек, отрицательно влияют на сердечно-сосудистую систему. Если вовремя не принять меры, то человек может умереть. Еще более опасны хлор и фтор. Хлор, в свое время, стал первым боевым отравляющим газом. А воздействие фтора на кожу всего в течение двух секунд приведет к сильнейшему ожогу из-за крайней химической агрессивности реактива. Поэтому все работы с галогенами следует проводить с использованием средств защиты, включая противогазы.
Несмотря на то, что галогены токсичны, они являются биогенными элементами, важными для функционирования организма человека.
Фтор необходим для формирования эмали зубов и костной ткани.
Хлор играет важнейшую роль в регулировании водно-солевого баланса, нужен для работы нервной и мышечной системы, ЖКТ, эритроцитов.
Недостаток брома в организме приводит к бессоннице, замедлению роста детей, прерыванию беременности, снижению уровня гемоглобина.
Йод жизненно важен для работы щитовидной железы, влияет на развитие организма и на его обмен веществ. Недостаток йода отрицательно сказывается на памяти и интеллекте, работе сердечно-сосудистой системы, уровне гемоглобина.
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Остальные элементы ряда не взаимодействуют с:
Галогены
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
 |  |  |
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Содержание
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F − ) = +2,87 В и Eo(Cl2/Cl − ) = +1,36 В показывают, что окислить ионы F − и Cl − можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде: 
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na + переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl − в Cl2) и накапливаются у катода (образование OH − ). Перемещение OH − в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH − реагировал бы с Cl2 и сводил на нет весь результат.
Физические свойства галогенов
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309 [2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж, 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
При нагревании фтор окисляет все другие галогены по схеме
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж, 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж, Si + 2Cl2 = SiCl4(Ж) + 662 кДж, Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl, Cl + Н2 → HCl + Н, Н + Cl2 → HCl + Cl, Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов ( hν ), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде), 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж, Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
Галогены
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Природные соединения
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.