Для чего нужны катионы и анионы
Катионы и анионы в химии, таблица растворимости
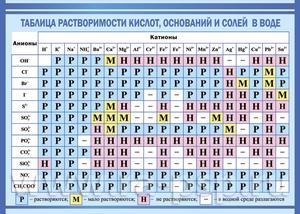
Показатели растворимости в воде
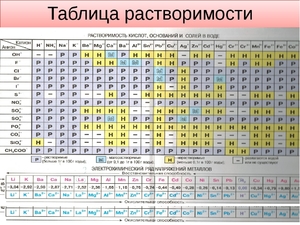
Она помогает при решении химических уравнений, где участвуют ионные реакции. Если результатом будет получение нерастворимого вещества, то реакция возможна. Существует несколько вариантов:
Это интересно: металлы и неметаллы в периодической таблице Менделеева.
Электролиты
Это растворы или сплавы, проводящие электрический ток. Электропроводность их объясняется мобильностью ионов. Электролиты можно поделить на 2 группы:
Теория электролитической растворимости
Одновременно с диссоциацией проходит противоположный процесс – соединение ионов в молекулы. Кислоты – это такие электролиты, при распаде которых образуется катион – ион водорода. Основания – анионы – это гидроксид ионы. Щелочи – это основания, которые растворяются в воде. Электролиты, которые способны образовывать и катионы и анионы, называются амфотерными.
Это такая частица, в которой больше протонов или электронов, он будет называться анион или катион, в зависимости от того, чего больше: протонов или электронов. В качестве самостоятельных частиц они встречаются во многих агрегатных состояниях: газах, жидкостях, кристаллах и в плазме. Понятие и название ввёл в обиход Майкл Фарадей в 1834 году. Он изучал воздействие электричества на растворы кислот, щелочей и солей.
Простые ионы несут на себе ядро и электроны. Ядро составляет почти всю атомную массу и состоит из протонов и нейтронов. Количество протонов совпадает с порядковым номером атома в периодической системе и зарядом ядра. Ион не имеет определённых границ из-за волнового движения электронов, поэтому невозможно измерить их размеры.
Отрыв электрона от атома требует, в свою очередь, затрат энергии. Она называется энергия ионизации. Когда присоединяется электрон, происходит выделение энергии.
Катионы
Это частицы, носящие положительный заряд. Могут иметь разную величину заряда, например: Са2+ — двузарядный катион, Na+ — однозарядный катион. Мигрируют к отрицательному катоду в электрическом поле.
Анионы
Это элементы, имеющие отрицательный заряд. А также обладает различным количеством величины зарядов, например, CL- — однозарядный ион, SO42- — двухзарядный ион. Такие элементы входят в состав веществ, обладающих ионной кристаллической решёткой, в поваренной соли и многих органических соединениях.
Химия – наука, где возможно творить практически любые чудеса. Катион вы можете узнать по ссылке.
Катион: образование, различия с анионом и примеры
Содержание:
А катион это химическое вещество, имеющее положительный заряд. Вместе с анионом он образует два типа существующих ионов. Его заряд является результатом нехватки электронов в атоме, что заставляет протоны в ядре проявлять большее притяжение. На каждый электрон, который теряет нейтральный атом, положительный заряд увеличивается на одну единицу.
Если атом теряет электрон, и поэтому число протонов больше единицы, то его положительный заряд будет +1; если вы потеряете два электрона, заряд будет +2 и так далее.Когда катион имеет заряд +1, он называется одновалентным; с другой стороны, если указанный заряд больше +1, катион считается поливалентным.
Как образуется катион?
Было упомянуто, что когда атом теряет электрон, большее количество протонов в нем по сравнению с электронами создает силу притяжения, которая преобразуется в положительный заряд. Но как может произойти потеря электрона? Ответ зависит от превращения, происходящего в химических реакциях.
Следует отметить, что наличие положительно заряженного атома не обязательно означает образование катиона. Чтобы его можно было рассматривать как таковое, не должно быть атома с отрицательным формальным зарядом, который нейтрализует его. В противном случае внутри одного и того же соединения было бы притяжение и отталкивание, и оно было бы нейтральным.
Официальные загрузки и другие ссылки
Электроотрицательные атомы притягивают к себе электроны из своих ковалентных связей. Даже если электроны разделены поровну, наступит момент, когда у них будет частично меньше электронов, чем в их базовой конфигурации; это его свободные атомы, не связанные с другими элементами.
Тогда эти электроотрицательные атомы начнут испытывать недостаток электронов, и вместе с этим протоны их ядер будут проявлять большую силу притяжения; рождается положительный формальный заряд. Если есть только один положительный формальный заряд, соединение будет проявлять общий положительный ионный заряд; таким образом рождается катион.
Атом кислорода катиона H3ИЛИ + Это верный пример вышесказанного. Имея три связи O-H, на одну больше, чем в молекуле воды (H-O-H), он испытывает потерю электрона из своего базового состояния. Формальные расчеты расходов позволяют определить, когда это произойдет.
Окисление
Металлы в первую очередь являются катионообразователями. Однако не все из них могут образовывать ковалентные связи (или, по крайней мере, чисто ковалентные). Вместо этого они теряют электроны, чтобы установить ионные связи: положительный заряд притягивает отрицательный, удерживаемый физическими силами.
Отличия от аниона
Различия между катионом и анионом перечислены ниже:
-Катион в целом меньше, чем анион. На изображении выше показано, как атомный радиус Mg уменьшается за счет потери двух электронов и превращения Mg в катион. 2+ ; с анионами происходит обратное: они становятся более объемными.
-У него больше протонов, чем электронов, а у аниона больше электронов, чем протонов.
— Чем меньше размер, тем выше плотность заряда и, следовательно, большая поляризующая сила; то есть деформирует электронные облака соседних атомов.
-Катион движется в том же направлении, что и приложенное электрическое поле, а анион движется в противоположном направлении.
Примеры наиболее распространенных катионов
Одноатомный
Одноатомные катионы происходят в основном из металлов (за некоторыми исключениями, такими как H + ). В остальном крайне редко можно рассматривать катион, полученный из неметаллического элемента.
Будет видно, что многие из них двух- или поливалентны, и что величина их зарядов согласуется с числом их групп в периодической таблице.
Эти двухвалентные катионы являются производными соответствующих металлов, принадлежащих к группе 2: щелочноземельных металлов.
Трехвалентные катионы группы бора.
До сих пор эти примеры характеризовались как имеющие одну валентность или заряд. Другие катионы проявляют более одной валентной или положительной степени окисления:
А другие металлы, такие как марганец, могут иметь еще больше валентностей:
Чем выше заряд, тем меньше и сильнее поляризуется катион.
Многоатомный
Не вдаваясь в органическую химию, есть неорганические и многоатомные катионы, которые очень часто встречаются в повседневной жизни; такие как:
-ЧАС3ИЛИ + (гидроксоний, уже упоминалось).
-НЕТ2 + (Нитроний, присутствующий в процессах нитрования).
Ссылки
Индуктивность: формула и единицы, самоиндуктивность
Что такое анионы и в чем их польза для здоровья человека?
Всё большее количество людей в современном мире причисляют себя к приверженцам здорового образа жизни. Они стремятся изыскать новые, немедикаментозные средства, которые позволят им эффективно противостоять жизненным вызовам: постоянным стрессам, переутомлению, бессоннице, преждевременному старению. Одним из способов достижения этих целей является применение анионов для общего оздоровления организма и профилактики ряда заболеваний. В наше время использовать его необязательно в специализированных лечебных учреждения. На рынке представлены кислородные концентраторы для дома, купить которые может каждый желающий. В качестве дополнительной функции они добавляют в генерируемый кислородный поток процент анионов, полезных для здоровья человека.
Химическая природа анионов
Механизм воздействия анионов на организм человека
Анионы могут воздействовать на организм человека двумя путями: через легочные ткани при вдыхании и через кожу и слизистые оболочки. Последний способ является более эффективным, поскольку обеспечивает быстрое и более полное усвоение отрицательно заряженных частиц организмом. Электрически активный кислород не менее важен для нормальной жизнедеятельности человека, чем молекулярный.
Человек не может физически чувствовать воздействие анионов, однако они оказывают положительный эффект на различные системы организма, поскольку непосредственно влияют на базовые физико-химические процессы, которые в нём происходят. Прежде всего, они оказывают воздействие на высшие отделы центральной нервной системы человека, нормализуют артериальное давление. Особое позитивное влияние они имеют на химические свойства крови. Так, анионы способствуют гармонизации соотношения белковых фракций и красных и белых телец, улучшают свёртываемость и реакцию оседания эритроцитов. Важным аспектом является повышения качества pH крови и электрокинетического потенциала эритроцитов. Зафиксировано также положительное воздействие анионов на обмен веществ в организме человека и качество тканевого дыхания.
Немаловажным эффектом от воздействие анионов является оздоровление кожных покровов, что позволяет применять их в качестве дополнения к основному лечению ряда кожных заболеваний. Благодаря им стимулируется рост волос и ускоряется регенерация тканей организма. Помимо этого, положительный эффект оказывается на протекание окислительных и восстановительных процессов в кишечнике человека. Анионы могут существенно замедлить развитие колоний вредоносных микроорганизмов, к примеру, брюшнотифозной палочки, стафилококка золотистого и холерного вибриона. По некоторым данным, их распространение уменьшается до 50%.
Поступление в организм анионов имеет и ещё один позитивный эффект. Они выступают катализатором, который способствует ускоренному образованию и активизации энзимов, гормонов, ряда витаминов и ферментов, жизненно важных для человека.
Перечисленные положительные воздействия, обусловленные поступлением анионов в организм, в комплексе способны существенно замедлить его старение. Недостаток отрицательных частиц ведёт к ухудшению метаболизма и снижает электрические потенциалы кровяных частиц, тканей и внутренних органов.Таким образом, анионы воздействуют на организм по ряду направлений, оказывая в целом тонизирующий, профилактический и во многих случаях оздоравливающий эффект. Одновременно с этим человек ощущает повышение тонуса и работоспособности.
Источники анионов
Традиционно человеку были доступны только естественные источники анионов. Наибольшая их концентрация фиксируется высокогорных областях, морских побережьях и вблизи водопадов. Регулярно посещать их целесообразно современному человеку, живущему в городских условиях. Это позволит временно восполнить дефицит отрицательно заряженных частиц в организме. Вместе с тем, современные технологии предоставляют возможность получения их в искусственных условиях. В свободной продаже уже существуют различные модели кислородных концентраторов, обогащающих анионами воздушную смесь, и ионизаторов. Помимо этого, разработаны специальные технологии, позволяющие получать отрицательно заряженные ионы посредством постоянно проходящей каталитической реакции. Благодаря этому на рынке предлагаются товары, которые, как заявляют производители, обеспечивают необходимый постоянный доступ организма к анионам: браслеты, пояса, наколенники, постельное бельё и другие.
Для чего нужны катионы и анионы
Катионы и анионы в отдельности
Катионы и анионы выполняют в организме важные функ» ции, например:
— ответственны за осмоляльность жидкости тела,
— образуют биоэлектрический мембранный потенциал,
— катализируют процесс обмена веществ,
— определяют действительную реакцию (рН) жидкости тела,
— стабилизируют определенные ткани (костную ткань),
— служат в качестве энергетического депо (фосфаты),
— участвуют в свертывающей системе крови.
В организме человека массой 70 кг содержится приблизительно 100 г натрия (60 мэкв/кг), 67% его активно обменивается (Geigy). Половина натрия организма находится во внеклеточном пространстве. Треть располагается в костях и хрящах. Содержание натрия в клетках мало (см. также рис. 6).
Концентрация в плазме: 142(137—147) мэкв/л
— Основная ответственность за осмоляльность внеклеточного пространства. 92% всех катионов и 46% всех внеклеточных осмотически активных частиц составляют ионы натрия.
Концентрация натрия может определять осмоляльность плазмы, за исключением таких патологических процессов, как сахарный диабет, уремия (см. 1.1.2).
Величина внеклеточного пространства зависит от содержания натрия.
При бессолевых диетах или применении салуретиков внеклеточное пространство уменьшается; оно увеличивается при усиленном введении натрия.
— Влияние на внутриклеточное пространство через содержание натрия в плазме. При повышении внеклеточной осмоляльности, например при введении гипертонического раствора поваренной соли, вода выводится из клеток, при снижении осмоляльности плазмы, например при потере соли, клетки обводняются.
— Участие в создании биоэлектрического мембранного потенциала.
В организме человека массой 70 кг содержится приблизительно 150 г калия (54 мэкв/кг), 90% его активно участвует в обмене (Geigy); 98% калия организма находится в клетках и 2% — внеклеточно (Fleischer, Frohlich). В мускулатуре определяется 70% общего содержания калия (Black)., Концентрация калия не во всех клетках одинакова. Мышечные клетки содержат 160 мэкв калия/кг воды (Geigy), эритроциты располагают только 87 мэкв/кг эритроцитной массы (Burck, 1970).
Концентрация калия в плазме: 4,5 (3,8—4,7) мэкв 1 л.
Калий
— участвует в утилизации углеводов;
— необходим для синтеза белков; три расщеплении белков калий освобождается; при синтезе связывается (соотношение: 1 г азота приблизительно на 3 мэкв калия);
— оказывает важное влияние на нервно-мышечное возбуждение.
Каждая клетка мышц и нервное волокно в состоянии покоя представляют собой калиевую батарею, заряд которой в значительной степени определяется соотношением концентраций калия внутри и вне клеток. Процесс возбуждения связан с активным включением внеклеточных ионов натрия во внутренние волокна и медленным выходам внутриклеточного калия из волокон.
Препараты обусловливают вывод внутриклеточного калия. Состояния, связанные с низким содержанием калия, сопровождаются выраженным действием препаратов дигиталиса. При хроническом недостатке калия нарушается тубулярная реабсорбция (Nizet).
Калий участвует в деятельности мышц, сердца, нервной системы, почек, каждой клетки.
Большой практический интерес представляет собой взаимосвязь между концентрацией калия в плазме и содержанием калия внутри клетки. Существует принцип, что при уравновешенном обмене веществ содержание калия в плазме определяет его общее содержание во всем организме. На это соотношение влияют:
— значение рН внеклеточной жидкости,
— энергия обмена веществ в клетке,
— содержание натрия,
— функция почек.
Влияние значения рН на концентрацию калия в плазме
При нормальном содержании калия в организме снижение рН увеличивает количество калия в плазме, (повышение рН — уменьшает. Пример:
рН 7,3, ацидемия — концентрация калия в плазме 4,8 мэкв/л рН 7,4, норма — концентрация калия в плазме 4,5 мэкв/л рН 7,5, алкалиемия—концентрация калия в плазме 4,2 мэкв/л (Значения рассчитаны по данным Siggaard-Andersen, 1965.) Ацидемии соответствует небольшое по сравнению с нормой повышение концентрации калия в плазме. Иначе говоря, значение 4,5 мэкв/л плазмы указывает при ацидемии на внутриклеточный дефицит калия. Наоборот, при алкалие-мии в случае нормального содержания калия нужно ожидать пониженного содержания его в плазме. Зная кислотно-щелочное состояние, можно лучше оценить количество калия в плазме:
Ацидемия →[К]плазма — повышение
Алкалиемия→ [К]плазма — снижение
Эти зависимости, выявленные в эксперименте, не всегда клинически доказуемы, так как одновременно развиваются: дальнейшие процессы, влияющие на количество калия в плазме, вследствие чего нивелируется воздействие одного процесса (Heine, Quoss, Guttler).
Влияние энергии обмена веществ клетки на концентрацию калия в плазме
Усиленный отток клеточного калия во внеклеточное пространство происходит, например, при:
— недостаточном снабжении тканей кислородом (шок),
— усиленном разрушении белков (катаболическое состояние).
— сниженной утилизации углеводов (диабет),
— клеточной дегидратации.
Интенсивный приток калия в клетки наблюдается, например, при:
— улучшенной утилизации глюкозы под действием инсулина,
— усиленном синтезе белков (рост, введение анаболических стероидов, репарационная фаза после операции, травма),
— клеточной регидратации.
Разрушающие процессы →[К]илазмы — повышение
Восстанавливающие процессы →[К]плаэмы — снижение
Влияние содержания натрия на концентрацию калия в плазме
Ионы натрия, введенные в большом количестве, повышают обмен клеточного калия и способствуют повышенному выведению калия через почки (особенно если ионы натрия связаны не с ионами хлора, а с легко метаболизируемыми анионами, например цитратом). Концентрация калия в плазме вследствие излишка натрия снижается в результате увеличения внеклеточного пространства. Снижение натрия ведет к уменьшению внеклеточного пространства и повышению концентрации калия в плазме:
Излишек натрия→[К] плазма — снижение
Недостаток натрия→ [К] плазма — повышение
Влияние почек на концентрацию калия в плазме
Почки меньше влияют на сохранение содержания калия, чем натрия. При недостатке калия почки удерживают его вначале с трудом, поэтому потери могут превышать введение. Наоборот, при передозировке калий довольно легко удаляется током мочи. При олигурии и анурии повышается количество калия в плазме.
Олигурия, анурия→[К]плазма — повышение
Таким образом, внеклеточная (плазменная) концентрацш калия является результатом динамического равновесия между:
— введением;
— способностью клеток к удержанию в зависимости от значения рН и состоянием обмена веществ (анаболизм — катаболизм);
— ренальным выведением калия в зависимости от:
содержания натрия,
кислотно-щелочного состояния,
тока мочи,
альдостерона;
— внепочечной потерей калия, например, в желудочно-кишечном тракте.
У взрослого человека массой 70 кг содержится приблизительно 1000—1500 г кальция —от 50000 до 75000 мэкв (1,4—2% массы тела), 99% кальция находится в костях и зубах (Rapoport).
Концентрация в плазме: 5(4,5—5,5) мэкв/л с небольшими индивидуальными отклонениями (Rapoport).
Кальций в плазме распределен в трех фракциях, а именно 50—60% ионизировано и способно к диффузии, 35—50% связано с белками (не ионизировано и не способно к диффузии), 5—10% связано комплексной связью с органическими кислотами (лимонная кислота) — не ионизировано, но способно к диффузии (Geigy). Между отдельными фракциями кальция существует подвижное равновесие, которое зависит от рН. При ацидозах, например, степень диссоциации, а следовательно, и количество диссоциированного кальция возрастают (замедляет явления тетании при ацидозе).
Биологически активны только ионы кальция. Точные данные, позволяющие определить состояние обмена кальция, получают только путем измерения количества ионизированного кальция (Pfoedte, Ponsold).
— Составная часть костей. Кальций в костях находится в виде нерастворимого структурного минерала, главным образом фосфата кальция (гидроксилапатит).
— Влияние на возбудимость нервов и мышц. Ионы кальция посредничают в биоэлектрическом феномене между поверхностью волокон и контрактильными реакциями внутри волокон.
— Влияние на проницаемость мембран.
— Вклад в свертывающую систему крови.
На абсорбцию кальция в кишечнике влияет состав пищи. Так, абсорбции кальция способствуют лимонная кислота и витамин D, а препятствуют органические кислоты, например оксалиновая кислота (шпинат, ревень), фитиновая кислота (хлеб, хлебные злаки), жирные кислоты (болезни желчного пузыря). Оптимальное соотношение кальция и фосфата (1.2.1) способствует абсорбции. В регуляции содержания кальция играют ведущую роль паратгормон, витамин D и кальцитонин.
В организме человека массой 70 кг находится 20—28 г магния (Hanze)—от 1600 до 2300 мэкв. Он определяется преимущественно в скелете (половина общего количества), меньше в почках, печени, щитовидной железе, мышцах и нервной системе (Simon). Магний наряду с калием является важнейшим катионом клеток животных и растений.
Концентрация в плазме: 1,6—2,3 мэкв/л (Hanze).
Приблизительно 55—60% магния плазмы ионизировано, 30% связано с белками и 15% — с комплексными соединениями (Geigy).
Значение для многочисленных процессов, управляемых ферментами (регенерация клеток, утилизация кислорода и выделение энергии; Simon). Магний важен для гликолиза, различных ступеней цитратного цикла, окислительного фосфорилирования, активации фосфатов, нуклеаз, различных пептидаз (Hanze).
— Тормозит перенос нервного возбуждения в конечную точку (подобно кураре; антагонист — ионы кальция), следствием чего является понижение нервно-мышечного возбуждения.
— Депрессивное влияние на центральную нервную систему.
— Уменьшение сократительной способности гладкой мускулатуры и миокарда.
— Подавление возбуждения в синусовом узле и нарушение атриовентрикулярной проводимости (при очень высоких дозах остановка сердца в диастоле).
— Расширение сосудов.
— Содействие фибринолизу (Hackethal, Bierstedt).
Наряду с абсорбцией и выделением через почки в регуляции содержания магния в организме участвует еще не до конца изученный гормон поджелудочной железы. Дефицит магния приводит к выведению ионов магния и кальция из костей. Абсорбцию понижает пища, богатая белками и кальцием, а также алкоголь (Simon).
В организме человека массой 70 кг содержится приблизительно 100 г хлора — 2800 мэкв (Rapoport). Концентрация в плазме: 103 (97—108) мэкв/л
Основная роль
— Хлор — важнейшая часть анионов плазмы.
— Ионы хлора участвуют в образовании мембранного потенциала.
Гидрокарбонат относится к изменяемой части ионов. Изменения в содержании анионов уравновешиваются благодаря гидрокарбонату. Система гидрокарбонат — угольная кислота является важнейшей внеклеточной буферной системой. Значение рН внеклеточного пространства можно рассчитать по отношению гидрокарбоната к угольной кислоте (дальнейшее рассуждение см. 1.3).
В теле взрослого человека содержится 500—800 г фосфата (1% массы тела). 88% находятся в скелете (Grossmann), остальная часть располагается внутриклеточно и лишь небольшая его часть — во внеклеточном пространстве (Rapoport).
Фосфат может быть как органическим (в качестве составной части фосфопротеинов, нуклеиновых кислот, фосфатидов, коферментов — Rapoport), так и неорганическим. Приблизительно 12% фосфатов плазмы связано с белками [Walser, 1960, 1961].
Концентрация в плазме (неорганический фосфор): 1,4— 2,6 мэкв/л.
— Вместе с кальцием образует нерастворимый гидроксилапатит (опорная функция костей).
— Участие в метаболизме углеводов, а также в хранении и переносе энергии (АТФ, креатинфосфат).
—Буферное действие.
Фосфор находится во всех продуктах питания. Абсорбция стимулируется витамином D и цитратом, задерживается некоторыми металлами (например, алюминием), цианидами, а также повышенным введением кальция. Фосфаты, выделяемые мочой, действуют в качестве буфера.
Концентрация в плазме (неорганического сульфата) :0,65 мэкв/л
Сульфат образуется из серосодержащих аминокислот (например, цистеин, метионин) и выводится через почки.
При почечной недостаточности концентрация сульфатов в плазме повышается в 15—20 раз.
Органические кислотные радикалы
— Лактат (молочная кислота).
— Пируват (пировиноградная кислота).
—бета-гидроксибутират (бета-гидроксимасляная кислота).
— Ацетоацетат (ацетоуксусная кислота).
— Сукцинат (янтарная кислота).
— Цитрат (лимонная кислота).
Концентрация в плазме: 6 мэкв/л (Geigy)
Молочная кислота является промежуточным продуктом в процессе обмена углеводов. При снижении уровня кислорода (шок, сердечная недостаточность) концентрация молочной кислоты повышается.
Ацетоуксусная кислота и бета-гидроксимасляная кислота (кетоновые тела) появляются при снижении количества углеводов (голод, пост), а также при нарушении утилизации углеводов (диабет) (см. 3.10.3).
Молекулы белков при рН крови 7,4 существуют главным образом в виде анионов (16 мэкв/л плазмы).
Общее содержание белков составляет 17% массы тела. Эти белки организма находятся в состоянии обмена с аминокислотами. Они составляют так называемый аминокислотный фонд (приблизительно 45 г аминокислот, при этом 40 г — в мускулатуре, 1 г — в плазме, 2—4 г — в печени; Lang, Fekl).
Жизнь связана с белками, отсюда без белков нет жизни
Белки
— являются основной составной частью клеточных и межтканевых структур;
— ускоряют в качестве ферментов процессы обмена веществ;
— образуют межклеточное вещество кожи, костей и хрящей;
— обеспечивают деятельность мускулатуры благодаря контрактильным свойствам определенных белков;
— определяют коллоидно-осмотическое давление и тем самым водозадерживающую способность плазмы (1 г альбумина связывает 16 г воды);
— являются защитными веществами (антитела) и гормонами (например, инсулин);
— транспортируют вещества (кислород, жирные кислоты, гормоны, лекарственные вещества и др.);
— действуют в качестве буфера;
— участвуют в свертывании крови.
Это перечисление уже показывает основополагающее значение белков. Особую нагрузку испытывает белковый баланс в состоянии стресса (см. также 3.8.2.1).
Указания для клинициста
Определяя состояние белков, обычно привлекают следующие параметры:
— клиническую оценку состояния пациента (похудание и пр.);
— концентрацию общего белка и альбумина в плазме;
— концентрацию трансферрина;
— состояние иммунитета (например, кожный тест, исследование с помощью БЦЖ и др., определение числа лимфоцитов и др.).
Чувствительный показатель состояния белкового питания, каковым является концентрация альбумина в плазме, представляет величину зкстраваскулярного запаса альбумина, измеряемого с помощью меченого альбумина. Экстраваскулярный, межтканевый альбумин можно рассматривать как белковый резерв. Он повышается при отличном питании и снижается при дефиците белков без изменения концентрации альбумина в плазме (Kudlicka и соавт.).
Внутрисосудистый запас альбумина составляет 120 г,. межтканевый — от 60 до 400 г, у взрослых в среднем 200 г. При падении концентрации альбумина в плазме ниже предельной границы нормы значительно истощаются в первую очередь межтканевые запасы альбумина (Kudlicka, Kudlickova), что видно из табл. 2 и 3. У 46 больных, оперированных по поводу хронических гастродуоденальных язв, Studley установил корреляцию послеоперационной летальности с предоперационным похуданием (см. табл. 3).
Летальность в зависимости от концентрации сывороточного альбумина на клиническом материале терапевтических больных (Wuhmann, Marki)