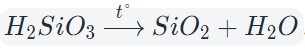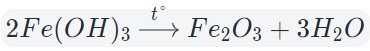Для чего нужны оксиды
Как оксиды воздействуют на природу и жизнь человека?
Оксидом является соединение, образованное двумя химическими элементами, один из которых кислород. Практически все элементы Периодической системы Менделеева Д. И. способны образовывать оксиды. Но оксиды Гелия, Неона, Аргона не получены. Наиболее известным и широко распространённым оксидом является вода. Она повсюду. Даже радуга – это результат преломления солнечных лучей в каплях воды.
Формулы оксидов
Элемент с постоянной валентностью образует один оксид. Например, у двухвалентного кальция оксид: CaO. Если у элемента переменная валентность, то он способен образовывать несколько оксидов. Примером являются окиды хрома: СrO, Сr2O3, СrO3.
Формула определяется в зависимости от валентностей составляющих элементов. Приведём пример для оксида серы.
1.Кислород двухвалентен. Сера черырёхвалентна. Пишем валентности над символами
IV II
химических элементов: SO.
2. Определяем наименьшее число, которое делится на 2 и 4. Таким числом является 4.
3. Определяем индекс возле серы: делим полученное число на значение валентности 4/4=1. Значит, индекс возле серы не пишем.
4. Этим же методом находим индекс возле кислорода: 4/2=2.
5. Получили формулу: SO2.
Интересное об оксидах
Причиной эффекта собачьей пещеры в Италии является оксид углерода СО2. Он тяжелее воздуха, поэтому получается так, что газ в пещере как раз покрывает собачью голову. Невысокие животные гибнут от удушья за несколько минут. А за счёт своего роста человек может легко пройти по ней.
В 1890 году парусное судно «Малборо» направлялось в Англию из Новой Зеландии. На борту было 23 члена экипажа и несколько пассажиров. В Англию судно не прибыло. Лишь через 23 года корабль появился вновь возле Огненной Земли. Шёл на всех парусах и оказался абсолютно не повреждённым. Оказывается, что причиной гибели людей стало извержение вулкана на острове Мартиника. Вулканические газы содержали 1,6% СО.
Появление кислот в атмосфере
Кислотные дожди появляются, когда с атмосферным кислородом и водяным паром соединяются оксиды серы и азота. Эти оксиды выбрасываются в окружающую среду металлургическими предприятиями, электростанциями, автомобильным транспортом. Полученные таким образом кислоты имеют вид дождя и разносятся ветром.
Оксид серы выбросов реагирует с водой, в результате образуется сернистая кислота:
SO2+H2O=H2SO3.
И взаимодействуя с кислородом воздуха, она частично превращается в серную кислоту:
2Н2SO3+О2=2Н2SO4.
Оксиды азота появляются в атмосфере в результате реакций азота и кислорода. Взаимодействие осуществляется при высоких температурах сгорания топлива
N2+O2=2NO
Но образуемое соединение быстро взаимодействует с кислородом:
2NO+O2=2NO2,
А полученный оксид азота реагирует с влагой из окружающей среды
2NO2+Н2О=НNO2+НNO3.
Сфера влияния кислотных дождей
Таким образом в воздухе появляются примеси кислот: серной, сернистой, азотной и азотистой. И эти примеси с осадками попадают на землю. Кислотные дожди негативно сказываются на росте растений, здоровье животных и людей.
В 1952 году непрозрачный туман охватил улицы Лондона, в результате чего погибло 4000 жителей. Частички смога раздражали дыхательные пути, а в лёгких появлялась слизь. Многие люди получили сердечные приступы с предшествующим тяжёлым кашлем. По оценкам учёных тот туман был более кислым, чем лимонный сок. Затем правительством было запрещено сжигать в городе топливо, образующее большое количество дыма. Это было сделано во избежание образования серной и азотной кислот.
Урожайность многих культур уменьшается на 3-8%, потому что листья повреждаются кислотами.
Изменяется состав воды в озёрах и ставках. В результате погибает рыба и многие виды насекомых. Исчезают птицы и животные, которые ими питаются. У улиток истончается карбонатная раковина, которая защищает их. В результате они гибнут. Также разрушаются ракушки обитателей водоёмов. Это негативно сказывается на экосистемах.
Кроме того кислотные дожди увеличивают коррозию металлов, разрушают мрамор и известняк.
После того, как был определён вред подобных дождей, в развитых странах стали устанавливать улавливатели, не пропускающие кислотные оксиды в воздух.
Основные, кислотные, амфотерные оксиды и их свойства, получение
Получение оксидов происходит с помощью различных способов. Из наиболее простых
2H2 + O2 = 2H2O
Существуют основные и кислотные оксиды. Они различаются тем, что при взаимодействии оксида с водой образуется либо кислота, либо основание. Эти реакции относят к реакциям соединения:
1. Основные оксиды и кислотные оксиды способны взаимодействовать между собой:
СаО+SO3=CaSO4
2. Основные оксиды взаимодействуют с кислотами. Образуются соответствующая соль и вода:
CaO+H2SO4=CaSO4+H2O
3. Образуются соответствующая соль и вода и при взаимодействии кислотных оксидов со щелочами:
СО2+2NaOH=Na2CO3+H2O.
В химии существуют вещества, проявляющие двойственность свойств. Это подобные двуликому Янусу амфотерные оксиды. Выступают как в качестве кислотных, так и в качестве основных оксидов. Поэтому со щелочами они проявляют особенности, характерные для кислотных оксидов, а с кислотами – основных.
Применение оксидов
Известно около 300 оксидов. Из железных руд, содержащих оксиды железа, получают железо.
Песок, состоящий преимущественно состоит из SiO2, используют при производстве стекла.
Некоторые оксиды являются основой для красок: ZnO – белой, Fe2O3 – коричневой, Cr2O3 – зелёной. А природные и искусственные кристаллы оксидов алюминия, окрашенные примесями, используют для изготовления ювелирных украшений.
Эти соединения могут как дарить жизнь, так и разрушать её. То есть значение оксидов в жизни человека и природе является довольно существенным.
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
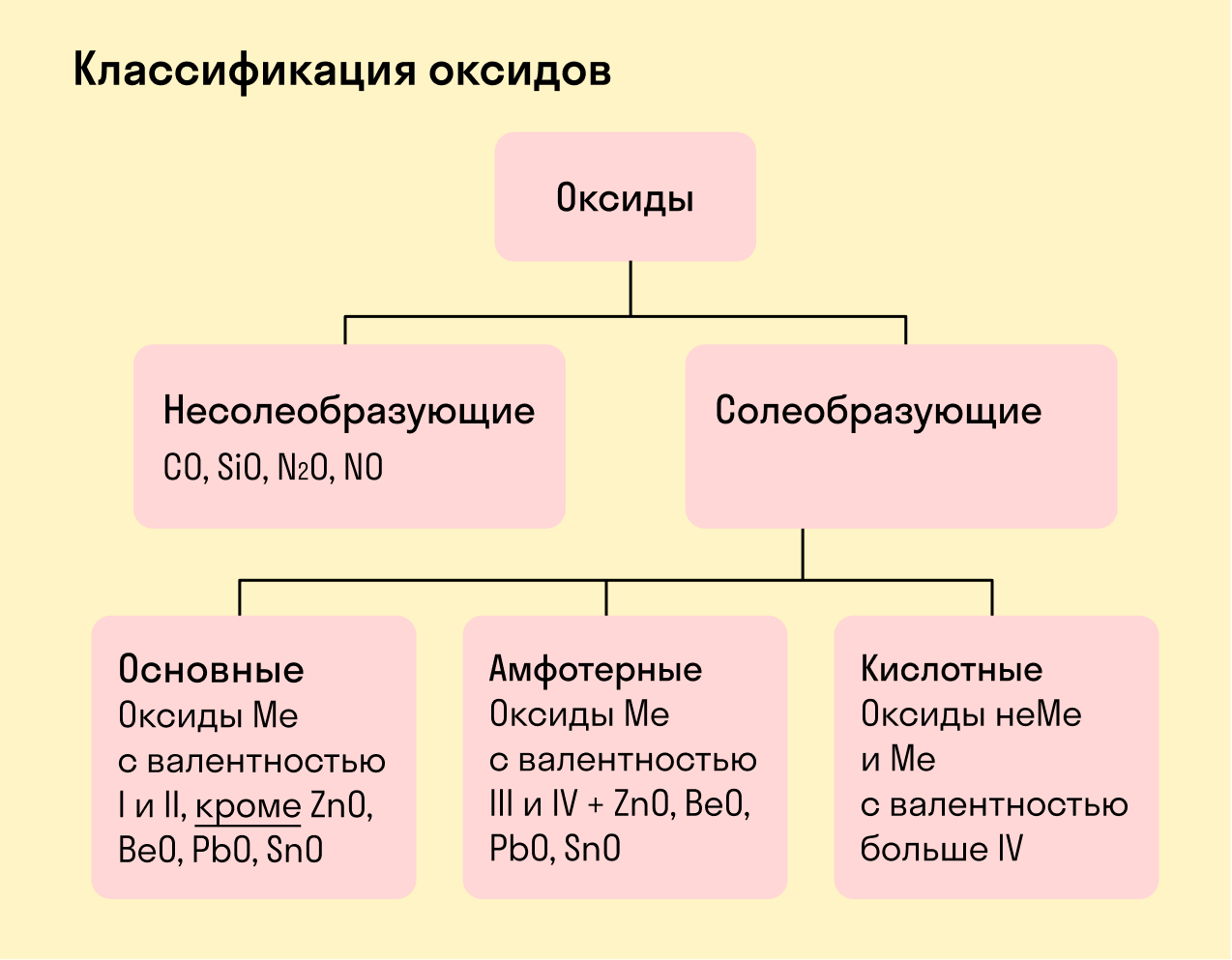
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
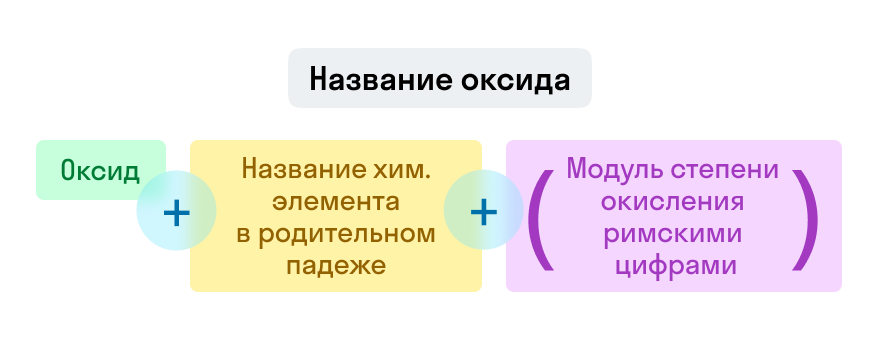
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Оксиды. Классификация, свойства, получение, применение.

Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:

CO2 – оксид углерода (IV)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):


Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:


Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: 
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: 


Применение оксидов

Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Оксиды для окрашивания волос
Известно, что краска сама по себе волосы не окрасит – это всего лишь бесцветный или слабоокрашенный крем. Стойкая краска «работает» только в дуэте с оксидом. Только во время окисления краска приобретает цвет и способность окрашивать.
Оксиды, оксигенты, окислители проявители и активаторы – все это составы для окрашивания волос на основе перекиси водорода с добавлением консервантов, стабилизаторов, отдушек и загустителей. Сейчас все чаще производители обогащают состав оксида полезными компонентами: липидами, витаминами, растительными экстрактами и другими добавками.
Принцип работы оксида
Оксигент – щелочной продукт с pH от 9,2 до 10,4. В зависимости от выбранной вами концентрации перекиси водорода оксид (вместе с красителем) вступает в химическую реакцию с волосами и «передает» им свою щелочную среду. Таким образом рН волос изменяется: вместо нейтрального (pH 5,5) показатель pH становится щелочным (около pH 7,0-8,5 и более). Как следствие – кутикула волос ослабевает и приоткрывается. Далее оксид попадает внутрь и вступает в реакцию с родным пигментом волос, частично его разрушая. Освободившееся место заполняется искусственным пигментом.
По сути, чем выше процент окислителя, тем больше он раскрывает кутикулу, больше вытесняет натуральный пигмент, а значит, больше места освобождается под новый пигмент.
Назначение оксидов с разной процентностью
9% (30 volume) окислитель эффективно закрашивает седину на жестких волосах, стойко окрашивает темные волосы, производит быстрое осветление для получения чистого цвета на 2-3 уровня.
12% (40 volume) применяется для максимального осветления и кардинальной смены имиджа. При применении краски осветляющего ряда достигается осветление до 3-4 уровней, с другими цветами (если разрешено применение) максимально можно достичь 3 уровней осветления. Оксид 12% агрессивно воздействует на волосы, поэтому после процедуры окрашивания необходим тщательный уход.
Можно ли использовать оксид и краску разных брендов
Окислитель одного бренда полностью адаптирован производителем к красителю той же марки. В процессе реакции с красителем оксид окисляет именно такое количество натурального пигмента, которое «запрограммировано» для внедрения и закрепления красящего вещества. Последствия смешивания краски и окислителя разных фирм – некорректный результат по цвету, степени осветления и стойкости окрашивания. Не нарушайте технологию! Как говорится: «Не жарьте лук на машинном масле!».
Решили рискнуть? Тогда хотя бы соблюдайте пропорцию окислителя по отношению к красителю смеси. Не соблюдение пропорции смешивания (1:1 или 1:1,5) ведет к тому, что нарушается взаимодействие пигментов красителя и кислорода, обеспечивающего его проявление. Объясню. Если производитель рекомендует смешать 1:1 – это говорит о том, что такие красители имеют в составе меньшее количество пигментов. Красители, смешиваемые 1:1,5 содержат большее количества пигмента и требуют большее количество кислорода для «закрепления» красителя в волосах.
Можно ли смешивать оксиды с разной процентностью
В случае если у вас под рукой не оказалось нужного оксида, можно экстренно смешать оксиды разной концентрации перекиси в рамках одного бренда. Для этого возьмите оксид с % выше искомого и оксид с более низким %, чем требуется. Вот несколько схем смешивания.
Схемы смешивания оксидов
Логично, что никаким смешиванием невозможно получить самый низкий 1,2% и самый высокий 12% оксид. А также отмечу, что ни вода, ни всевозможные шампуни, бальзамы и прочие средства, добавленные в смесь, процент оксида не понизят. Не рискуйте, пытаясь разбавить оксид водой: очень велик шанс «убить» свои волосы или, как минимум, получить нестойкое, а порой неравномерное окрашивание.