Для чего нужны цитокины
Иммунная система Часть 5 Цитокины
Иммунная система Часть 5 Цитокины
Цитокины
Очень значительная группа крупных молекул, секретируемых клетками после их взаимодействия с антигенами и другими цитокинами. Они служат связующим звеном между врожденным и приобретенным иммунитетом, влияют на выраженность воспалительного и иммунного ответа, передают сигналы клеткам через рецепторы на их поверхности. Цитокины и их антагонисты используются в лечении онкологических, воспалительных, инфекционных, аутоиммунных заболеваний и при трансплантации органов и тканей.
Провоспалительные цитокины (ИЛ-1, ИЛ-6, ИЛ-12, ФНО-альфа, интерфероны, хемокины, ИЛ-8, и др.) стимулируют воспалительный ответ, разрушают пораженные клетки и вирусы. Высокий уровень этих цитокинов в крови отражает активность и тяжесть воспалительного процесса.
Противовоспалительные цитокины (ИЛ-4, ИЛ-10, ТФР-бета и др.) ограничивают развитие воспаления и завершают иммунный ответ.
Часть цитокинов несут дополнительные функции в активации клеточного или гуморального направления иммунного ответа.
Основные группы цитокинов:
Хемокины
Хемокины стимулируют хемотаксис – направленное движение и перемещение лейкоцитов. Производят хемокины лейкоциты, тромбоциты, эпителиальные и эндотелиальные клетки. Эти клетки расположены в местах наиболее частого проникновения возбудителей (кожа, слизистые оболочки, сосуды) и через хемокины зовут лейкоциты на помощь для быстрого обезвреживания чужеродных антигенов. Из минусов – к хемокиновым рецепторам на поверхности Т-лимфоцитов приспособился вирус иммунодефицита человека, используя их для проникновения в клетку.
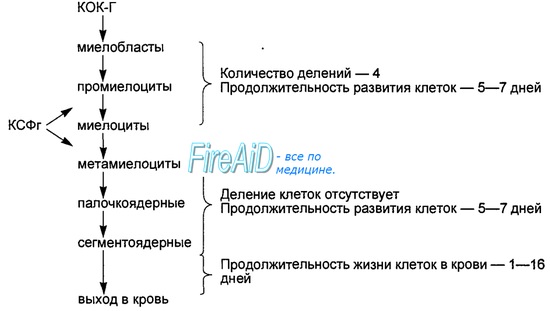
Колониестимулирующие факторы
Вырабатываются эндотелиальными клетками, фибробластами, макрофагами, тучными клетками и T-хелперами. Предназначены для стимуляции гемопоэза – роста клеток крови. Выделяют:
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) стимулирует рост предшественников нейтрофилов.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) стимулирует рост моноцитов, нейтрофилов, эозинофилов и базофилов, активирует макрофаги.
Макрофагальный колониестимулирующий фактор (М-КСФ) стимулирует рост предшественников моноцитов.
Трансформирующие факторы роста
Трансформирующий фактор роста альфа
Макрофаги, моноциты, эпителиальные клетки, клетки костного мозга
Стимулирует рост и развитие иммунных клеток. Стимулирует выработку слизи.
Трансформирующий фактор роста бета
В-лимфоциты, макрофаги, тучные клетки
Подавляет рост лимфоцитов, отменяет эффекты многих цитокинов, переключает на синтез IgA. Способствует заживлению тканей и росту соединительной ткани в месте воспаления.
Факторы некроза опухоли
Фактор некроза опухоли – альфа
Макрофаги, лимфоциты, нейтрофилы, дендритные клетки, тучные клетки
Вызывает апоптоз, активирует макрофаги, синтез ИЛ-1, ИФН-гамма, ГМ-КСФ. Стимулирует воспаление, повреждает опухолевые клетки, повышает температуру тела.
Фактор некроза опухоли-бета
Лимфоциты, преимущественно Т-клетки
Усиливает фагоцитоз, развитие лимфоидных органов. Повреждает опухолевые клетки.
Выберите город
Годовой абонемент
Годовой абонемент входит в состав первого заказа и дает возможность год Вам и членам Вашей семьи сдавать анализы в два раза дешевле. Результаты всех анализов бессрочно будут храниться в личном кабинете. Подробнее
Для чего нужны цитокины?
Защитные механизмы организмов
Иммунная система организма – это потрясающе сложная система, состоящая из многих ступеней, которые формировались на протяжении всей эволюции. Защитные механизмы для борьбы с вирусами есть у клеток, отдельных организмов и целой популяции. О том, как от вирусов защищаются бактерии, растения и животные, ПостНауке рассказал вирусолог Леонид Марголис.
Как вирус проникает в организм?
Вирусы очень маленькие. Так, например, размер частицы коронавируса или ВИЧ составляет всего порядка 150 нанометров. Благодаря размеру вирусу очень легко проникнуть в организм: мы можем его вдохнуть или проглотить, можем прикоснуться к поверхности, на которой он находится. При этом вирусу не обязательно попадать в кровь, чтобы спровоцировать инфекцию. Разные вирусы избирают разные пути заражения человека. Например, энтеровирусы попадают в желудок и вызывают расстройство и желудка, и ваших планов.
Далеко не каждый вирус сможет проникнуть внутрь клетки и заразить нас чем-нибудь неприятным. Это предусмотрено эволюционно: среди вирусных частиц очень много дефектных, с нарушенной последовательностью РНК или ДНК. Такие вирусы могут проникнуть сквозь клеточную мембрану, но размножаться внутри клетки у них не выйдет.
Невозможно сказать, сколько вирусных частиц необходимо, чтобы наверняка заразить человека. Это вероятностный процесс, на который в каждый момент времени влияет множество факторов. Разумеется, чем больше частиц вас окружает, тем выше вероятность, что какой-то из них удастся проникнуть внутрь и запустить инфекцию. Но точно просчитать шансы заболеть невозможно.
Работа иммунной системы
Защита организма от вирусной угрозы – это война с постоянной гонкой вооружений. Наша иммунная система адаптируется к новым условиям, но основные принципы остаются неизменными. В процессе эволюции человеческий организм выработал несколько ступеней защиты. Они предусматривают иммунный ответ на уровне клетки, организма или даже всей популяции.
Врожденный иммунитет, который мы получили в процессе эволюции, позволяет нашему организму обезвредить потенциально опасный или чужеродный патоген еще до заражения клеток. Такая система реагирует на появление патогена очень быстро, но недостаточно точно, так как реакция провоцируется не конкретными антигенами (вирусами), а определенными классами антигенов. Приобретенный иммунитет, называемый также адаптивным, специфическим, работает по принципу создания в клетках иммунологической памяти – запоминания реакции на первый контакт с патогеном и усиления реакции на каждый последующий. Благодаря этому механизму, к примеру, людям достаточно переболеть ветрянкой только один раз, чтобы получить иммунитет к этому заболеванию.
Некоторые механизмы защиты люди унаследовали от растений и бактерий. Растения, например, продуцируют новую РНК, которая не дает вирусу размножаться дальше. Такой механизм называется подавлением экспрессии генов (silencing). Она связывается с вирусным геномом таким образом, что запрещает репликацию, то есть воспроизведение новой копии этого генома.
Бактерии умеют считывать маленький кусочек ДНК бактериофага, попавшего в клетку, и переводит этот кусочек в РНК с механизмом вырезания генов. А вырезает она те гены, которые принадлежат вирусу, оставляя здоровую ДНК клетки.
Молекулярная память, называемая CRISPR, – бактериальный эквивалент приобретенной иммунной системы, способной отличить полезные вирусы от вредных. Эта система вносит изменения в геном бактерии и добавляет в него вирусные гены, называемые спейсерами. Спейсеры формируют память о прошлых вирусах-интервентах. Специальные ферменты затем распознают и разрушают вирусы, как только они предпринимают попытку повторного инфицирования бактерии.
Защитная система организмов более высокого уровня устроена намного сложнее. Например, клетки могут узнать вирус по чужеродной РНК и индуцировать внутриклеточный ответ, а именно выработку интерферона – белка, отвечающего за блокирование репликации вируса. Он подавляет размножение вируса внутри клетки и «оповещает» (выходит из зараженной клетки) соседние клетки организма о том, что поблизости враг – вирус. Таким образом происходит межуровневый переход от внутриклеточной защиты к уровню защиты всего организма.
Когда вирусу удается заразить клетку и запустить механизм репликации своих копий, она может ликвидировать сама себя еще до того момента, когда вирусных частиц станет слишком много и они смогут заставить клетку лизировать – раствориться, чтобы выпустить новые вирусные частицы вовне. Этот процесс самоликвидации клетки называется апоптозом.
Еще один противовирусный барьер – специальные клетки, предназначенные для того, чтобы и узнавать вирус, попадающий в организм, и идентифицировать зараженные клетки. Такие клетки реагируют на белки вируса, которые отличаются от белков здоровой клетки своим химическим составом, и производят специальные агенты – антитела, предназначенные для уничтожения патогенов.
Эта система имеет свои недостатки: ее калибровка требует много времени, так как антитела специфичны и настроены на распознавание только одного определенного типа вирусного белка. Поэтому, когда система активизируется, ей требуется несколько дней, чтобы размножиться и настроить производство антител. Когда вирус проникает внутрь, клетка атакует его белки, «разрубает» их на кусочки и экспонирует на своей поверхности. Затем антитела могут идентифицировать зараженные клетки, потому что на поверхности клеточной мембраны остаются вирусные белки в сочетании с комплексом гистосовместимости МНС 1 – специального семейства генов для распознавания «свой – чужой».
Однако эту систему вирусы тоже научились обходить. Есть, к примеру, вирусы, подавляющие механизм экспонирования чужеродных белков, и клетка не может подать сигнал о заражении. У нашей иммунной системы и на это есть ответ. Лимфоциты, которые называются natural killers, реагируют на отсутствие на поверхности клеток комплекса гистосовместимости МНС 1, который подавляет вирус. Для лимфоцитов отсутствие МНС 1 – уже достаточный повод, чтобы уничтожить такую клетку.
Еще один помощник в борьбе с вторжением вирусов – температура. На рост температуры через пироген и гипоталамус напрямую влияют интерферон и цитокины интерлейкины 1 и 6. Многие бактерии и вирусы температурно-зависимы: под влиянием высокой температуры они разрушаются или снижают свою активность. Поэтому сбивать неопасную для жизни температуру не нужно: так вы можете помешать естественной борьбе организма с болезнью.
Интерферон и цитокины
Взаимодействия между иммунными клетками, которые атакуют вирус, очень сложны. Для того чтобы нейтрализовать вирус, некоторые из них производят специальные молекулы – цитокины (от лат. cyto – «клетка», kines – «движение»). Цитокины регулируют иммунную систему клеток, их взаимодействие между собой, отвечают за апоптоз, стимуляцию и подавление их роста.
Одним из классов цитокинов является хорошо известный нам интерферон. На самом деле интерферонов много, и их задача – регулировать взаимодействие между иммунными клетками. Интерфероны запускают в клетках процессы, приводящие к подавлению синтеза вирусных белков, сборки и выхода вирусных частиц. Интерфероны также активируют гены, которые важны для защиты клетки от вирусов.
В настоящее время наука еще далека от понимания механизмов, при помощи которых цитокины связываются между собой. Но уже сейчас известно, к примеру, что один цитокин может заменить другой: если у вас нет какого-то из необходимых цитокинов, его функцию возьмет на себя другой.
Каждый цитокин крайне важен, однако механизм их действия может быть опасен и приводить к несоразмерно сильной реакции иммунной системы на угрозу – цитокиновому шторму. Когда организм не способен справиться с болезнью, иммунная система начинает неконтролируемо выпускать цитокины и вместо помощи вредить организму, разрушая здоровые клетки вместе с пораженными.
Подавление иммунитета и чрезмерная активация
Человеческий организм существует в очень тонком, особом балансе: ему необходимо чередовать стимулы и подавление стимулов. Постоянно активированная иммунная система скорее опасна для человека, чем полезна. С чрезмерно активированным иммунитетом связаны многие болезни человека – от диабета до старения (хоть старость и нельзя назвать болезнью в прямом смысле слова).
В качестве примера можно привести знакомый всем грипп: если вы заболели, ваша иммунная система выработала цитокины и активизировала Т-клетки, которые победили вирус. Но после этого нужно их остановить, выключить, иначе они могут замедлять работу здоровых клеток.
По этому принципу лечатся аутоиммунные заболевания – при помощи препаратов, подавляющих иммунитет. Несмотря на то, что механизм таких заболеваний достаточно хорошо изучен, причина их возникновения до сих пор остается предметом научных изысканий и споров. Аутоиммунные заболевания, такие как волчанка или астма, протекают по единому сценарию: антитела, выработанные клетками организма, почему-то начинают атаковать собственные ткани организма. Яркий пример – ВИЧ-инфекция. Вопреки тому, что это заболевание иммунной системы, болезнь поддерживается именно иммунной активацией, потому что вирус размножается только в активированных клетках.
Иммунитет новорожденных
Значительная часть нашей иммунной защиты формируется еще в утробе матери через плаценту. Однако если бы иммунитет беременной женщины работал по всем правилам иммунной системы, то эмбрион не имел бы ни малейшего шанса выжить: организм отторг бы его как чужеродную клетку. Ведь беременность – это трансплантация ткани, в которой есть чужие для матери частицы. Для того чтобы отторжения не происходило, существуют специальные регулирующие Т- клетки, которые подавляют иммунитет матки и позволяют закрепиться плодному яйцу.
Если вернуться к вопросу, передается ли иммунитет от матери через плаценту, то ответ однозначный: передается. Хоть плацента и фильтрует молекулы, однако пропускает антитела, которые развились у матери. Это позволяет защитить новорожденного в первые дни жизни в агрессивной, незнакомой ему окружающей среде. Довольно много антител передается ребенку и с молоком матери, но только в первые несколько недель. Дальше у ребенка в течение нескольких месяцев развивается собственный иммунитет. Этот период считается очень опасным в плане заражения вирусами, но благодаря прививкам иммунитет ребенка получает дополнительную поддержку.
Конечно, генетическая составляющая иммунитета все-таки присутствует – например, аутоиммунные заболевания, передающиеся по наследству, или резистентность к ВИЧ, которая наблюдается у некоторых людей.
Об авторе: Леонид Марголис – доктор биологических наук, заведующий отделом межклеточного взаимодействия Национальных институтов здоровья США, профессор факультета Биоинженерии и биоинформатики МГУ им. Ломоносова.
Для чего нужны цитокины
Цитокинами называют белковые и полипептидные молекулы, которые продуцируются клетками иммунной системы (лимфоцитами, мононукле-арными фагоцитами, дендритными клетками), а также стромальными клетками. Цитокины действуют на клетки, соединяясь со своими поверхностными рецепторами. Связывание цитокина с рецептором служит источником сигнала активации генов, который передается в ядро клетки. Чувствительность клеток-мишеней к действию цитокинов изменяется в зависимости от количества цитокиновых рецепторов на их поверхности. Время синтеза цитокина, как правило, краткосрочно: лимитирующим фактором служит нестабильность молекул мРНК. Отдельные цитокины (например, ростовые факторы) продуцируются спонтанно.
Большинство цитокинов оказывают наиболее выраженное влияние в ближайшем микроокружении клеток-продуцентов. Местное действие цитокинов может быть как аутокринное, так и паракринное, в зависимости от того, связывается ли цитокин с рецептором на самой клетке-продуценте, или — на соседней клетке. Системное (эндокринное) влияние цитокинов возможно только в случае интенсивного накопления их в циркулирующей крови (например, при эндотоксическом шоке). Обычно в крови присутствуют следовые количества цитокинов, недостаточные для проявления системных эффектов.
В костном мозге, в тимусе и лимфоидных органах постоянно происходит спонтанный синтез цитокинов, выполняющих функции ростовых факторов, которые связываются с рецепторами на клетках-предшественницах, стимулируя процессы их пролиферации и дифференцировки.
— Вернуться в оглавление раздела «Физиология человека.»
Цитокины
Из Википедии — свободной энциклопедии
Цитокины — небольшие пептидные информационные молекулы. Цитокины имеют молекулярную массу, не превышающую 30 кДа.
Цитокин выделяется на поверхность клетки А и взаимодействует с рецептором находящейся рядом клетки В. Таким образом от клетки А к клетке В передаётся сигнал, который запускает в клетке В дальнейшие реакции.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические воздействия.
Цитокины активны в очень малых концентрациях. Их биологический эффект на клетки реализуется через взаимодействие со специфическим рецептором, локализованным на клеточной цитоплазматической мембране. Образование и секреция цитокинов происходит кратковременно и строго регулируется.
Все цитокины, а их в настоящее время известно более 30, по структурным особенностям и биологическому действию делятся на несколько самостоятельных групп. Группировка цитокинов по механизму действия позволяет разделить цитокины на следующие группы:
Спектры биологических активностей цитокинов в значительной степени перекрываются: один и тот же процесс может стимулироваться в клетке более чем одним цитокином. Во многих случаях в действиях цитокинов наблюдается синергизм. Цитокины — антигеннеспецифические факторы, поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня цитокинов невозможна. Но определение их концентрации в крови даёт информацию о функциональной активности различных типов иммунокомпетентных клеток; о тяжести воспалительного процесса, его переходе на системный уровень и о прогнозе заболевания.
Цитокины регулируют активность гормональной оси гипоталамус-гипофиз-надпочечники: [2] например, интерлейкин 1, воздействуя на гипоталамус, усиливает синтез кортиколиберина, что, в свою очередь, повышает выработку АКТГ.
Цитокины (фактор некроза опухоли, интерлейкин-10, интерлейкин-6) (венозная кровь) в Тамбове
Комплексный лабораторный анализ трёх важных цитокинов — белков, участвующих во всех воспалительных процессах в организме, — в сыворотке крови. Результат исследования позволяет лечащему врачу оценить текущий иммунный, или цитокиновый, статус пациента.
Что входит в комплекс
Приём и исследование биоматериала
Когда нужно сдавать анализ Цитокины (фактор некроза опухоли, интерлейкин-10, интерлейкин-6)?
Комплексное выявление концентрации ключевых цитокинов у пациентов со следующими патологическими состояниями:
Подробное описание исследования
Воспаление — это защитная реакция организма, которая направлена на ограничение и нейтрализацию повреждения, действия чужеродного агента и др. В норме воспаление является физиологической реакцией. Тем не менее избыточный воспалительный процесс может приводить к вредным для организма метаболическим и гемодинамическим нарушениям, которые способствуют развитию тяжелых и затяжных заболеваний.
Данное комплексное исследование определяет количественные показатели одних из ключевых цитокинов — белков, участвующих в воспалении.
Интерлейкин 6 (ИЛ-6, IL-6) относится к провоспалительным цитокинам, т.е. к белкам, которые увеличивают активность воспаления. Источником ИЛ-6 в организме являются различные клетки: Т-лимфоциты, моноциты, клетки эндотелия и др.
Интерлейкин 6 стимулирует образование острофазных белков — гаптоглобин, С-реактивный белок, гаптоглобулин и др., — которые в свою очередь способствуют усилению воспалительного процесса. Также ИЛ-6 регулирует иммунный ответ и участвует в активации лимфоцитов, которые запускают образование требующихся на текущий момент иммуноглобулинов, или антител.
Интерлейкин 10 (ИЛ-10, IL-10) — это цитокин с выраженными противовоспалительными свойствами. ИЛ-10 играет большую роль в ограничении воспалительного процесса, тем самым предотвращая чрезмерное повреждение тканей. Действие ИЛ-10 способствует уменьшению синтеза других воспалительных цитокинов, включая ФНО-альфа. Нарушение регуляции интерлейкина 10 ассоциировано с развитием аутоиммунных и инфекционных заболеваний, а также воспалением эндотелия сосудов, которое может отягощать течение сахарного диабета, дислипидемии — атеросклероза — и сердечных патологий.
Фактор некроза опухоли-альфа (ФНО-альфа, TNF-α) — один из ключевых многофункциональных провоспалительных цитокинов, который преимущественно образуется в макрофагах. В физиологических условиях он регулирует множество процессов: обмен липидов; свертывание крови; деление, созревание и гибель клеток.
Уровень ФНО-альфа в сыворотке может повышаться при множестве аутоиммунных, ревматологических и инфекционных заболеваний. Также этот цитокин усугубляет течение хронического воспаления при наличии злокачественных опухолей.
Комплексное определение вышеуказанных цитокинов может быть актуально при дополнительной диагностике следующих патологий:
Последний синдром является наиболее актуальным показанием. «Цитокиновый шторм» — это обобщенный термин, означающий чрезмерную сверхактивную воспалительную реакцию организма, которая сопровождается выработкой избыточного количества цитокинов (включая ИЛ-6, ИЛ-10 и ФНО-альфа).
К причинам «цитокинового шторма» можно отнести:
Анализ на определение данных цитокинов в крови рекомендуется сдавать только при наличии показаний от лечащего врача.