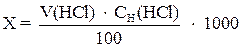Для чего определяют щелочность
Для чего определяют щелочность
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксо-анион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
Щелочность пробы воды измеряется в моль/л экв. или ммоль/л экв. и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль/л экв.), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН 8,0–8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений рН 4,2–4,5 в качестве индикатора используют метиловый оранжевый*. Определяемая таким образом величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу. Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Мы уделим этим компонентам достаточно внимания, рассмотрев подробно в разделе «Карбонаты и гидрокарбонаты». Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Аналогично щелочности иногда, главным образом при анализе сточных и технологических вод, определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксо-анионами. К таким соединениям относятся:
1) сильные кислоты: соляная (HCl), азотная (HNO3), серная (H2SO4);
2) слабые кислоты: уксусная (CH3COOH); сернистая (H2SO3); угольная (H2CO3); сероводородная (H2S) и т.п.;
3) катионы слабых оснований: аммоний (NH4 + ); катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль/л экв. или ммоль/л экв. и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора. Аналогично показателю щелочности, различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН 4,3–4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO3, H2SO4, H3PO4.
Общая кислотность определяется при титровании до значений рН 8,2–8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др.
* Титрование в присутствии метилового оранжевого обычно применяется в России. Национальным бюро стандартизации США для тех же целей рекомендуется использовать смесь индикаторов бромкрезолового зеленого и метилового красного.
Что такое щелочность воды и расчет pH
В таблицах СанПиН РФ («Питьевая вода») предельно допустимая концентрация по щелочным показателям не указывается, поэтому большинство источников при определении нормы щёлочности воды ссылаются на стандарты ВОЗ, директиву ЕС или санитарные правила стран со сходным нормативным порядком.
Определение и содержание понятия
Щёлочностью воды («Щ» в формулах) называют сумму содержащихся в ней веществ – гидроксильных ионов/анионов слабых кислот, – вступающих с сильными кислотами в реакцию с разделением на:
Единица измерения – миллиграмм-эквивалент кислоты, записывающийся как мг-экв/л. Общая щёлочность как сумма анионов слабых кислот – силикатов, боратов, карбонатов, гидрокарбонатов, сульфидов, гидросульфидов, сульфитов, гидросульфитов, фосфатов, анионов гуминовых кислот) – это способность связывать сильные кислоты (их эквивалентное количество). Концентрация некоторых ионов незначительна, поэтому, когда говорят об общей щёлочности, то имеют в виду, главным образом, карбонатный тип (определяющийся ионами угольной кислоты), где гидролизованные анионы образуют гидроксид-ионы:
Щелочной показатель для поверхностных вод связывают с присутствием в них в основном гидрокарбонатов щелочноземельных металлов (и щелочных – в меньшей степени), и для природных вод с pH 8,5 происходит возникновение гидратного типа.
Щелочной параметр необходим для:
Северные районы России с низкими щелочными показателями и pH для природной воды характеризуются повышенной коррозионной агрессивностью, от которой страдают трубопроводы и конструкции из черных металлов и бетона.
По мнению японских исследователей, в районах, где пьют более щелочную воду (выше показателя 6,5, но ниже 9) продолжительность жизни выше на 20-30%. В целом щелочные показатели должны быть достаточными для прохождения химической коагуляции, однако при этом они не должны быть слишком высокими, чтобы не провоцировать физиологические расстройства у водопотребителей. Минимальные щелочные значения составляют +/- 30 мг/л, а максимальные в пределах 450-500 мг/л.
Распространившееся среди обладателей различных модифицированных аэраторов мнение об их влиянии на щелочные свойства гидропотока не подтверждается. Эти аэраторы-экономители ( http://water-save.com/ ) позволяют сократить водорасход, но не влияют на химические характеристики водоресурса. Слоты 1хбет бонус при регистрации. Слоты 1хбет бонус: какие другие подарки можно получить. Беттинговые площадки, зарегистрированные в ЦУПИС, предоставляют услуги исключительно по ставкам на спорт. Но функции офшорных, при всех их минусах, гораздо шире. Помимо спортивных пари, там можно поиграть в виртуальном казино промокод на 1xbet где конкретно их надо искать: Витрина промокодов. Среди бесплатных ставок, в этом разделе на 1xbet можно в том числе найти фриспины. Бонусные игры. Здесь – увлекательные игры на удачу, по аналогии с мгновенными лотереями.
Методы определения концентрации карбонатов
В межгосударственном стандарте описаны 2 титриметрических метода расчёта щёлочности воды:
Конечная точка титрования определяется при изменении значения на рН-метре или окраски индикатора:
Равным нулю параметр принимается, если для анализируемой пробы рН
ОПРЕДЕЛЕНИЕ ЩЕЛОЧНОСТИ И КИСЛОТНОСТИ ВОДЫ
Объемный (количественный) анализ.Объемный метод количественного анализа основан на точном измерении реагирующих веществ, концентрация одного из которых известна. Растворы с точно установленной концентрацией называются титрованными, т.к. они используются для определения концентрации исследуемых растворов, то их называют рабочими или стандартными. Процесс прибавления стандартного титрованного раствора к раствору исследуемого вещества называется титрованием. Титрование ведется до достижения точки эквивалентности, т.е. до того момента, когда количество прибавленного стандартного раствора будет эквивалентно количеству определяемого вещества согласно уравнению реакции. Необходимое условие объемного анализа – точная фиксация точки эквивалентности, поэтому используют реакции, конец которых характеризуется определенным внешним признаком (изменение окраски, выпадение осадка). Часто для фиксации точки эквивалентности употребляют специальные вещества, изменяющие цвет или другие свойства с изменением концентрации исследуемого иона. Такие вещества называются индикаторами.
Требования к реакциям, применяемым в объемном анализе:
— возможность тем или иным способом фиксировать точку эквивалентности;
— количественное течение реакции до равновесия, характеризующегося соответствующей величиной константы равновесия реакции;
— можно применять только те реакции, которые протекают с достаточной скоростью;
— при титровании не должны протекать побочные реакции, делающие точное вычисление результатов анализа невозможным.
В зависимости от типа реакции, которая протекает при титровании, выделяют методы объемного анализа:
1 Нейтрализация. В основе метода лежит реакция нейтрализации:
Этим методом определяют кислотность, щелочность, карбонатную жесткость воды.
2 Окислительно-восстановительные методы, в основе которых применяют окислительно-восстановительные реакции, в ходе которых исследуемое вещество количественно переводят в окисленную или восстановленную форму.
3 Осаждение. Объемные определения метода основаны на осаждении определенного иона в виде труднорастворимого соединения.
Измерение объемов. Для точного измерения в объемном анализе используют бюретки, пипетки, мерные колбы.
1 Бюретки служат для титрования и представляют собой цилиндрические трубки с суженным концом, отсчет ведется сверху вниз.
2 Пипетки служат для точного отмеривания каких-либо определенных объемов исследуемого раствора.
3 Мерные колбы служат для разбавления исследуемого раствора до определенного объема.
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксоанион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
Щелочность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 ммоль-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации до значений рН = 8,0 – 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений
рН = 4,2 – 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая данным образом величина называется общей щелочностью. При рН = 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй – по метилоранжу.
Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Экспериментальная часть
Определение свободной щелочности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором HCl до обесцвечивания раствора. Расчет производят по формуле:
где х – свободная щелочность воды, мг-экв/л;
V (HCl) – объем HCl, мл;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
100 – объем взятой пробы.
Определение общей щелочности. В ту же колбу, где проводили титрование, добавляют 2 – 3 капли индикатора метилового оранжевого и продолжают титрование до тех пор, пока окраска индикатора из желтой не перейдет в оранжевую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 1. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 1 – Результаты титрования
| № | V (H2О), мл | V (HСl), мл | V (HCl) средн., мл |
| 100,0 |
Перед каждым титрованием заполняют бюретку раствором до нулевого деления шкалы.
Расчет производят по формуле:
где х – общая щелочность воды, мг-экв/л;
V (HCl) – объем HCl, мл;
СH(HCl) – молярная концентрация эквивалента раствора HCl, моль/л;
V (H2О) – взятый объем воды, мл.
Аналогично щелочности при анализе сточных и технологических вод определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксоанионами. К таким соединениям относятся:
1) сильные кислоты: соляная HCl, азотная HNO3, серная H2SO4;
2) слабые кислоты: уксусная CH3COOH; сернистая H2SO3; угольная H2CO3; сероводородная H2S и т.п.;
3) катионы слабых оснований: аммоний NH4 + ; катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в моль-экв/л или моль-экв/л и определяется количеством сильной щелочи (обычно используют растворы КОН или NaOH с концентрацией 0,05 или 0,1 моль/л), израсходованной на нейтрализацию раствора.
Различают свободную и общую кислотность. Свободная кислотность определяется при титровании до значений рН = 4,3 – 4,5 в присутствии в качестве индикатора метилового оранжевого. В этом диапазоне оттитровываются HCl, HNO3, H2SO4, H3PO4.
Общая кислотность определяется при титровании до значений рН = 8,2 – 8,4 в присутствии фенолфталеина в качестве индикатора. В этом диапазоне оттитровываются слабые кислоты – органические, угольная, сероводородная, катионы слабых оснований.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (например, гуминовых кислот). Загрязнения, придающие воде повышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточных вод промышленных предприятий и др.
Экспериментальная часть
Определение свободной кислотности. В коническую колбу наливают 100 мл исследуемой воды, прибавляют 2 – 3 капли индикатора метилового оранжевого и титруют раствором щелочи до перехода оранжевой окраски раствора в желтую.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 2. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 2 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствра щелочи, мл;
СH(NaOH) – молярная концентрация эквивалента раствора щелочи, моль/л;
100 – объем взятой пробы.
Определение общей кислотности. В коническую колбу наливают 100мл исследуемой воды, прибавляют 2 – 3 капли индикатора фенолфталеина и титруют раствором щелочи появления малиновой окраски индикатора.
Эксперимент повторяют три раза, результаты эксперимента записывают в таблицу 3. Из полученных результатов находят среднее арифметическое значение объема рабочего раствора.
Таблица 3 – Результаты титрования
| № | V (H2О), мл | V (NaOH), мл | V (NaOH) средн., мл |
| 100,0 |
Расчет проводят по формуле:
где х – свободная кислотность воды, мг-экв/л;
V (NaOH) – объем раствора щелочи, мл;
СH(NaOHl) – молярная концентрация эквивалента раствора щелочи, моль/л;
100 – объем взятой пробы.
Вопросы для самоконтроля
1 На титрование 100 мл исследуемой воды пошло 20 мл 0,1 н раствора соляной кислоты по метиловому оранжевому. Определите щелочность воды.
2 Вода содержит (мг/л): CaSO4 – 50, Ca(HCO3)2 – 100, Mg(HCO3)2 – 25. Какова величина щелочности.
4 При определении щелочности воды было израсходовано 0,1 н кислоты на титрование 100 мл пробы с индикатором фенолфталеином 3 мл и дополнительно с индикатором метиловым оранжевым 5 мл. Рассчитайте общую и отдельные виды щелочности воды.
5 Вода имеет жесткость равную 9 мг-экв/л. Постоянная жесткость составляет 60 % от общей жесткости (соли натрия отсутствуют). Какова величина щелочности воды.
6 В 1 л воды содержится 210 мг NaHCO3 и 5,3 мг Na2CO3. Определите общую щелочность воды.
Щелочность воды
Человек оценивает качество питьевой воды по двум основным показателям – цвету и запаху. Но есть не менее важные свойства, которые напрямую влияют на то, можно ли считать воду пригодной для питья. Особенно это касается щелочности, о которой осведомлены далеко не все. В данной статье мы постараемся разобраться в том, какая норма допустима, как ее определить и каким образом привести уровень щелочности к оптимальным показателям.
Что такое щелочность воды?
Во-первых, следует определиться с тем, что из себя представляет данное понятие. Если обращаться к учебникам, щелочность – это число гидроксильных ионов, которые содержатся в воде, и анионов слабых кислот. Следует отметить, что щелочной называется та среда, в которой водородный показатель превышает значение 7. Все, что ниже – это кислая среда. При этом щелочность и pH связаны напрямую – чем больше первый показатель, тем выше и второй. Щелочность измеряется в ммоль/дм³, pH – в единицах.
В соответствии с европейскими санитарными нормами допустимым значением pH для питьевой воды является диапазон 6,5-8,5 единиц, дистиллированной, то есть условно нейтральной – 7 единиц. Предельно допустимой концентрацией по щелочности согласно нормам СанПиН является значение 4,4 ммоль/дм³. Это касается нецентрализованных источников водоснабжения.
Каким образом показатели щелочности могут влиять на организм?
Нормам щелочности придается большое значение и тому есть важная причина – ее уровень напрямую влияет на состояние организма. Оптимальный показатель поможет стабилизировать различные функции организма, включая обменные процессы, а также активизировать мозговую деятельность.
Однако, в случае превышения установленной нормами концентрации возможно возникновение ряда проблем: зуда, высыпания, раздражения слизистой оболочки. Именно поэтому столь важно определять щелочность питьевой воды и контролировать эти показатели.
Сохранение кислотно-щелочного баланса возможно благодаря оптимизации рациона, однако сложность в том, что большая часть продуктов имеет в своем составе кислую среду, поэтому важно также пить и воду, что увеличит объем переносимого кровью кислорода. Но подойдет не всякая вода, а со значениями, близкими к нейтральным.
Определение щелочности и регулирование уровня pH
Уровень pH может колебаться и зависит от региона. В случае превышения допустимых значений необходимо уделить внимание их стабилизации. Для измерения уровня pH в домашних условиях используются специальные тестеры, но для определения щелочности не обойтись без услуг профессиональных лабораторий, оснащенных современным оборудованием и имеющих необходимый уровень аккредитации.
После проведения исследования специалисты предоставят рекомендации по поддержанию уровня щелочности. В случае его превышения – помогут выбрать решение для его снижения за счет использования специальных фильтров. В частности, с этой проблемой эффективно справляются системы обратного осмоса, которые не только стабилизируют показатели, но также нормализуют состав воды, уменьшая жесткость и минерализацию.
Щёлочность, гидрокарбонат-ион
Щёлочность
Описание: многоуровневый интегральный параметр, отражающий концентрацию анионов слабых органических и неорганических кислот в воде, в основном — угольной. Характеризует направленность гидро- и геохимических процессов, коррозионной агрессивности воды по отношению к бетону, стали, отопительным котлам, парогенераторам.
Методы определения: титриметрия с использованием индикаторов, потенциометрическое определение.
Типы щёлочности
| Тип | Обусловленность |
|---|---|
| Свободная щелочность | Наличие в воде карбонат-ионов CO 2− 3 и гидроксильных ионов OH − в водах с pH > 8,3 |
| Карбонатная щелочность | Наличие в воде продуктов диссоциации угольной кислоты — карбонатов CO 2− 3 и гидрокарбонатов HCO − 3, находящихся в равновесии |
| Общая щелочность | Наличие в воде анионов слабых неорганических и органических кислот, титруемых сильной кислотой |
Методики, используемые в Испытательном центре МГУ определения концентрации гидрокарбонатов в природных средах
| Нормативный документ на методику | Метод определения | Оборудование |
|---|---|---|
| Вода | ||
| ГОСТ 31957-2012 | титриметрия | вспомогательное оборудование |
| РД 52.24.493-2006 | титриметрия | вспомогательное оборудование |
| Почва | ||
| ГОСТ 26424-85 | титриметрия | весы |
Распространённость: гидрокарбонаты HCO − 3, карбонаты CO 2− 3, гидроксид-ион OH − и ионы слабых органических и неорганических кислот появляются в природной воде естественным образом в процессе растворения в воде углекислого газа, минералов и вмещающих пород при контакте воды с почвой. Поэтому практически все типы вод характеризуются щёлочностью отличной от нуля. Щёлочность тесно связана с показателем pH, поэтому разные щёлочности могут не присутствовать в воде одновременно.
Нормирование
С нормированием щёлочностей дела обстоят сложно. Сама по себе эта группа параметров в воде не нормируется. Однако нормируются гидрокарбонаты (только в бутилированной воде), частично обуславливающие значение щёлочностей. Содержание карбонатов напрямую не нормируются, но, если учесть, что в питьевой воде строго нормируется pH, свободная щёлочность в питьевой воде должна быть равна нулю.
Предельно допустимая концентрация (ПДК) гидрокарбонатов в различных типах вод
| Нормирование | ПДК, мг/л |
|---|---|
| Бутилированная вода первой категории СанПиН 2.1.4.1116-02 | 0–400 |
| Бутилированная вода высшей категории СанПиН 2.1.4.1116-02 | 30–400 |
| Вода систем централизованного водоснабжения СанПиН 2.1.4.1074-01 | — |
| Водные объекты рыбохозяйственного значения Приказ Минсельхоза РФ № 552 | — |
| Объекты рекреационного водопользования СанПиН 2.1.5.980-00 | — |
| Вода плавательных бассейнов СанПиН 2.1.2.1188-03 | — |
| Сточные воды в бытовых системах водоотведения Постановление Правительства РФ № 644 | — |
| Сточные воды в ливневых системах водоотведения Постановление Правительства РФ № 644 | — |
Польза и вред
Несмотря на то, что щёлочность не нормируется в большей части типов вод (кроме бутилированной), у щёлочности есть физиологическое воздействие: при употреблении воды с повышенной щёлочностью неизбежны негативные последствия для организма. Наиболее опасна свободная щёлочность. Общую и карбонатную щёлочности (при отсутствии свободной) лучше контролировать по содержанию гидрокарбонатов. Их содержание не должно превышать 400 мг/л.
При повышенной щёлочности наблюдается:
Методы очистки воды
Появление в питьевой воде свободной щёлочности говорит о наличии загрязнения источника.
При загрязнении источника такими загрязнителями очистка воды, как правило, не целесообразна — необходимо проводить очистку самого источника. В случае, если без очистки воды не обойтись, предпочтительнее использовать обратный осмос.
Щёлочность — важный интегральный параметр состояния воды. Повышенное содержание свободной щёлочности говорит о загрязнении источника. Общая и карбонатная щёлочности позволяют судить о происходящих в воде процессах и о балансе карбонатов и гидрокарбонатов, а также о связи этого баланса с показателем pH. Также параметры используются для оценки пригодности воды для использования в технологических процессах и устройствах, например парогенераторах, отопительных котлах, бойлерах и т.д.