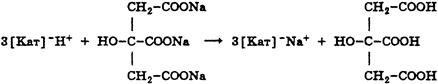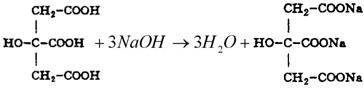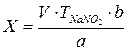Для чего проводят контрольный опыт при титровании
Расчеты при титровании



Концентрацию индивидуального лекарственного вещества рассчитывают в процентах. Концентрацию ингредиента в смеси или его содержание рассчитывают в тех единицах, в каких данный ингредиент выписан в прописи.
1. При прямом титровании концентрацию индивидуального лекарственного вещества или ингредиентов смеси в процентах (в жидких лекарственных формах, мазях, порошках) рассчитывают но формуле:
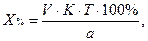
где 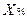
V – объем титрованного раствора, мл;
К – коэффициент поправки на титрованный раствор;
Т – титр по определяемому веществу (титриметрический фактор пересчета);
а – масса (г) или объем (мл) анализируемого лекарственного вещества или масса (объем) лекарственной смеси.
Содержание ингредиентов лекарственной смеси в граммах (в жидких лекарственных формах, порошках, мазях) рассчитывают по формулам:
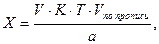
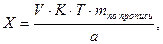
где X – масса определяемого лекарственного вещества, г;
V – объем титрованного раствора, мл;
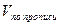
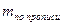
а – объем (мл) или масса (г) лекарственной формы, отобранные для анализа;
К – поправочный коэффициент.
Если при анализе порошка или жидкой лекарственной формы предварительно делали разведение и для титрования использовали часть полученного разведения (А), то концентрацию определяемого вещества в процентах рассчитывают по формуле;
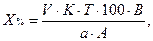
где В – объем мерной колбы, мл;
А – объем разведенного раствора, отобранный для титрования (аликвотная доля), мл. Остальные обозначения – см. формулу (3).
При необходимости выразить содержание анализируемого вещества в граммах в числитель вместо цифры 100 подставляют величину общей массы ( 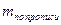
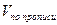
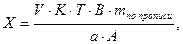
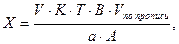
2. При обратном титровании (или титровании по избытку) концентрацию ингредиентов в процентах (в жидких лекарственных формах, мазях, порошках) рассчитывают по формуле;
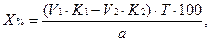
где 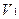
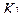
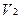
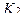
Содержание ингредиентов в граммах (в жидких лекарственных формах, порошках, мазях) рассчитывают по формулам:
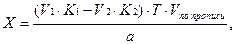
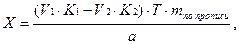
где 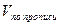
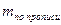
В экспресс-анализе иногда проводят контрольный (холостой) опыт при прямом и обратном способах титрования. Контрольный опыт в случае прямого титрования проводят при:
— алкалиметрическом титровании веществ в мазях (контрольный опыт проводится с мазевой основой, обладающей собственной кислотностью);
— алкалиметрическом титровании с использованием растворителей, обладающих кислотными свойствами (спирт, ацетон);
— комплексонометрическом титровании в малых количествах солей 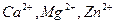
— нитритометрическом определении малых количеств лекарственных веществ 0,02 М раствором натрия нитрита с использованием внутренних индикаторов.
В приведенных примерах концентрацию определяемого вещества в процентах и в граммах вычисляют с учетом контрольного опыта по формулам:
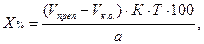
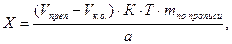
где 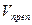
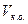
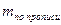
При прямом ацидиметрическом титровании некоторых лекарственных веществ контрольный опыт проводится с целью сравнения перехода окраски индикатора в точке эквивалентности в анализируемом и контрольном растворах. В этом случае количество титрованного раствора, израсходованное на титрование в контрольном опыте, при расчетах не учитывается.
В экспресс-анализе проводить контрольный опыт в случае обратного титрования необходимо при:
— йодометрическом определении некоторых лекарственных веществ;
— броматометрическом определении препаратов группы фенолов;
— при йодхлорметрическом определении метилурацила, этакридина лактата;
— перманганатометрическом определении натрия нитрита.
Концентрацию определяемого вещества в процентах и в граммах вычисляют с учетом контрольного опыта по формулам:
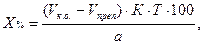
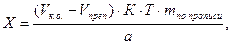
где 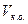
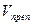
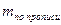
Кроме того, контрольный опыт ставят, если необходимо отфильтровать осадок и титровать избыток раствора в аликвотной части фильтрата. В этом случае расчет ведут по формулам:
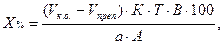
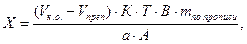
где В – объем мерной колбы, мл;
А – объем фильтрата, взятого на титрование, мл. Остальные обозначения – см. формулы (12) и (13).
3. При косвенном (заместительном) титровании расчет ведут, как при прямом титровании, но титриметрический фактор пересчета определяют не по титруемому заместителю, а по определяемому веществу. Например, при пропускании через катионитную колонку натрия цитрата образуется эквивалентное количество лимонной кислоты, которую титруют стандартным раствором натрия гидроксида. При расчете титр определяют по натрия цитрату, а не по лимонной кислоте.
f = 1/3, Mf (цитрата) = 86 г/моль.
В расчетную формулу титра по определяемому веществу подставляют молярную массу эквивалента натрия цитрата и концентрацию натрия гидроксида.
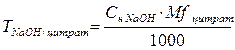
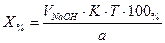
4. При определении по разности лекарственные вещества титруют суммарно общим для них методом, а затем один из компонентов анализируют другим методом, при котором второй компонент не мешает определению. Вычисление по разности включает несколько вариантов в зависимости от типа протекающих реакций.
Если при титровании разными методами М (1/z) анализируемых веществ не меняются, то объем титрованного раствора (V1), пошедший на титрование вещества, определяемого по разности, рассчитывают по алгебраической разности между объемом, затраченным на титрование суммы веществ (Vc), и объемам другого титрованного раствора (V2), израсходованного на титрование второго вещества:
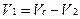
Такой расчет справедлив, если при титровании использовали одинаковые массы (объемы) лекарственной смеси и одинаковые концентрации титрованных растворов.
Соответственно содержание ингредиентов рассчитывают по формуле:
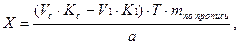
где 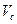
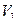
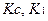
Т – титр по определяемому веществу;
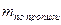
Например, в лекарственной смеси состава:
Кальция хлорида 0,5
Воды очищенной до 100,0
Кальция хлорид и калия йодид можно определить каждый раздельно. Для определения калия бромида титруют сумму галогенидов и содержание калия бромида рассчитывают по разности, пользуясь формулой:
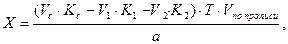
где 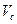
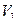
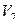
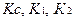
Т – титр по определяемому веществу;
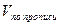
Если на определение одного ингредиента и на суммарное определение компонентов смеси взяты разные массы, то для расчета содержания второго ингредиента их необходимо привести к одной массе. Например, анализируется микстура состава:
Кальция хлорида 3,0
Воды очищенной до 100,0
На суммарное титрование галогенидов взят объем а1, определение же кальция хлорида проводили в объеме а. Количество калия бромида (Х) вычисляют по формуле:
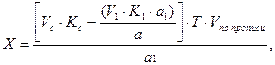
Для суммарного раздельного определения ингредиентов лекарственной смеси часто используют разные методы, при которых молярная масса эквивалентов препаратов различны. Например, анализируется микстура состава:
Натрия гидрокарбоната 2,0
Воды очищенной до 100,0
Гексаметилентетрамин определяют методом йодхлорометрии: Мf = M ∙ 1/4.
Сумму гексаметилентетрамина и натрия гидрокарбоната титруют 0,1 моль/л раствором хлористоводородной кислоты. При титровании кислотой молярная масса эквивалента гексаметилентетрамина равна молекулярной массе. В таких случаях при расчете содержания препарата, определяемого суммарно, необходимо приведение к одному эквиваленту. Так, расчет количества натрия гидрокарбоната в данной смеси проводят по формуле:
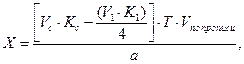
где 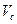
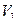
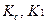
Т – титр по определяемому веществу;
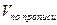
Если раздельное и суммарное титрование ингредиентов проводится в разных массах и одновременно при различии молярных масс эквивалентов, то при расчете компонента, определявшегося суммарно, необходимо приведение к одному эквиваленту и к одной массе. В приведенной выше прописи гексаметилентетрамин определяют методом йодхлорометрии в 1 мл микстуры, а суммарное титрование компонентов смеси проводят в 5 мл.
В этом случае содержание натрия гидрокарбоната (Х) рассчитывают по формуле:
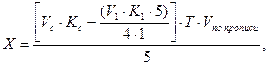
где 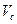
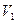
Т – титр по определяемому веществу;
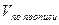
5. Реверсионное титрование.
Например, при экспресс-анализе нежелательно определять натрия нитрит фармакопейным методом. Прямое же титрование в кислой среде дает заниженные результаты, так как из натрия нитрита образуется легко разрушающаяся азотистая кислота. В данном случае лучше взять точный объем титрованного раствора калия перманганата (V), прибавить к нему серную кислоту и по каплям титровать анализируемой микстурой (а) до обесцвечивания раствора.
Вопросы для самоконтроля:
1. Какие растворы называются титрованными? Укажите их назначение.
2. Каковы способы выражения концентрации титрованных растворов?
3. Каковы наиболее употребительные концентрации титрованных растворов?
4. Приведите определение молярности, титра, титра по определяемому веществу.
5. Как рассчитывается титр по определяемому веществу? Где используется эта величина? Поясните смысл определения титра по определяемому веществу на конкретных примерах из ФС: натрия хлорида и др. Выведите расчетную формулу для определения массовой доли вещества в граммах, процентах.
6. Что такое контрольный опыт и почему при установке титра проводят контрольный опыт?
7. Назовите два способа определения концентрации титрованного раствора.
8. Выведите расчетную формулу для определения концентрации титрованного раствора по первому способу – по точной массе (навеске) химически чистого вещества, используя данные 5 вопроса.
9. Выведите расчетную формулу для определения концентрации титрованного раствора по второму способу – по титрованному раствору известной концентрации. Какой закон лежит в основе этой формулы?
10. Как вычисляют поправочный коэффициент к молярности (К) для приготовленных титрованных растворов? Каково его назначение?
11. Как поступают в случае отклонения поправочного коэффициента более чем 0,98 – 1,02?
12. Как поступают в случае укрепления титрованного раствора?
13. Как поступают в случае разбавления титрованного раствора?
14. Что такое фактор эквивалентности и молярная масса эквивалента вещества? Как рассчитываются эти величины в реакциях различного типа?
15. Каковы условия хранения титрованных растворов? Напишите уравнения реакции, объясняющие помутнение титрованного раствора натрия тиосульфата при хранении.
16. По какой формуле рассчитывают концентрацию вещества в процентах при прямом способе титрования?
17. По какой формуле рассчитывают концентрацию вещества в процентах при обратном способе титрования?
18. Что такое заместительное титрование, приведите примеры.
Определение воды (ОФС.1.2.3.0002.15). Методика определения
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Определение воды (ОФС.1.2.3.0002.15)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ст. ГФ XI
Метод К. Фишера (полумикрометод). Метод определения воды
Метод основан на химическом взаимодействии воды с компонентами реактива К. Фишера.
Реактив К. Фишера
Реактив К. Фишера представляет собой раствор серы диоксида, йода и пиридина (или другого основания, например, имидазола) в метаноле. Взаимодействие реактива с водой протекает в две стадии стехиометрически по уравнениям:
Используемые растворы и реактивы должны быть безводными. Их хранят и применяют в условиях, исключающих возможность воздействия на них атмосферной влаги.
Йодсернистый реактив представляет собой раствор, содержащий пиридин безводный, монометиловый эфир этиленгликоля, йод и серу диоксид. В йодсернистых реактивах часто пиридин заменяют на другие основания. Использование реактивов такого состава должно быть предварительно валидировано для подтверждения в каждом конкретном случае стехиометрии реакции и отсутствия несовместимости между испытуемым веществом и реактивом.
При определении воды в твердых веществах, нерастворимых в метаноле, тонко измельченную навеску вещества взбалтывают с метанолом, после чего титруют реактивом К. Фишера. Некоторые вещества или смеси можно растворять в безводной уксусной кислоте, хлороформе, пиридине и других растворителях.
Пропанол и другие алканолы имеют большую растворяющую способность для молекул с длинной цепью и могут использоваться как таковые или в смеси с метанолом при анализе высокомолекулярных соединений.
2-Метоксиэтанол (монометиловый эфир этиленгликоля) применяют в тех случаях, когда в присутствии метанола протекают побочные реакции (этерификация, образование кеталей и т. п.). Однако, титрование в этом растворителе протекает медленнее по сравнению с метанолом. Хлороформ является хорошим растворителем для жиров и может использоваться в смеси с метанолом, содержание которого обычно составляет 50 %, но не менее 25 %. Формамид улучшает растворимость полярных веществ и может добавляться в метанол для определения воды в протеинах. Не рекомендуется использование в качестве рабочей среды чистые апротонные растворители, которые нарушают стехиометрию реакции К. Фишера.
Масса навески, время взбалтывания навески с растворителем, а также наименование растворителя, должны быть указаны в фармакопейной статье.
С помощью реактива К. Фишера может быть определена как гигроскопическая, так и кристаллизационная вода. При этом воду можно определять в органических и неорганических соединениях, в различных растворителях и летучих веществах.
Прибор
Прибор для титрования по методу К. Фишера представляет собой закрытую систему, состоящую из бюретки, снабженной осушительной трубкой, заполненной, осушающим агентом, (например, молекулярными ситами), сосуда для подачи реактива и колбы для титрования, соединенных с бюреткой. Колба для титрования представляет собой сосуд вместимостью 60–100 мл с двумя платиновыми электродами, трубкой для подвода азота, осушительной трубкой, заполненной, осушающим агентом, (например, молекулярными ситами), и пробкой, в которую вставляется кончик бюретки. Испытуемое вещество вносят в сосуд через трубку, расположенную с противоположной стороны по отношению к трубке-осушителю, и закрываемую притертой пробкой. Перемешивание раствора в процессе титрования осуществляют при помощи магнитной мешалки или продуванием высушенного азота через раствор.
Конечную точку титрования определяют амперометрически. Электрическая схема состоит из потенциометра с сопротивлением 2000 Ом, подключенного к источнику постоянного тока с напряжением 1,5 В и обеспечивающего необходимую разность потенциалов. Разность потенциалов отрегулирована таким образом, чтобы через платиновые электроды, соединенные последовательно с микроамперметром, проходил небольшой начальный ток. При прибавлении реактива стрелка микроамперметра отклоняется, но сразу же возвращается в исходное положение. В конце реакции получаемое отклонение должно оставаться неизменным не менее 30 с.
Конечную точку титрования допускается определять визуально по изменению окраски титруемой жидкости от желтой до красновато-коричневой при условии обеспечения необходимой точности. При этом необходимо проводить контрольный опыт.
Допускается использование автоматических титраторов в соответствии с инструкцией производителя.
Если нет других указаний в фармакопейной статье, используют методику А.
Методика А
Точную навеску испытуемого вещества, содержащую приблизительно от 30 до 50 мг воды, помещают в сосуд для титрования, в который предварительно внесено 5,0 мл метанола безводного. Перемешивают
1 мин и титруют реактивом К. Фишера, прибавляя его при приближении к конечной точке по 0,1–0,05 мл.
Параллельно проводят контрольный опыт (титруют 5,0 мл метанола безводного).
Методика Б
Около 20 мл метанола безводного или растворителя, указанного в фармакопейной статье, помещают в сосуд для титрования и титруют реактивом К. Фишера, определяя конечную точку титрования амперометрически. Затем в сосуд для титрования вносят точную навеску испытуемого вещества, указанную в фармакопейной статье. Смесь перемешивают в течение 1 мин и снова титруют реактивом К. Фишера, определяя конечную точку титрования амперометрически.
Методика С
Около 10 мл метанола безводного или растворителя, указанного в фармакопейной статье, помещают в сосуд для титрования и титруют йодсернистым реактивом, определяя конечную точку титрования амперометрически.
Затем быстро вносят в сосуд для титрования указанное количество испытуемого вещества и точно отмеренный объем йодсернистого реактива, взятый с избытком приблизительно на 1 мл или объем, указанный в фармакопейной статье. Сосуд закрывают пробкой, выдерживают в защищенном от света месте в течение 1 мин или в течение времени, указанного в фармакопейной статье, периодически перемешивая содержимое сосуда. Избыток йодсернистого реактива титруют до первоначального значения силы тока, используя метанол безводный или растворитель, указанный в фармакопейной статье, к которому было прибавлено точно известное количество воды, эквивалентное около 2,5 мг/мл.
Микрометод определения воды (кулонометрический)
При кулонометрическом титровании необходимый для реакции К. Фишера йод образуется при анодном окислении йодид-иона:
Образующийся йод реагирует с присутствующей водой и диоксидом серы в присутствии основания. Йод потребляется до тех пор, пока в среде присутствует вода. Избыток йода указывает на достижение конечной точки титрования. Количество оттитрованной воды пропорционально количеству электричества, пропущенному через ячейку.
1 моль йода соответствует 1 молю воды, а количество электричества 10,71 Кл соответствует 1 мг воды.
Вследствие малого тока титрования кулонометрическое определение применяется для количественного определения микроколичеств воды: от
10 мкг до 10 мг.
Правильность и точность метода должны быть обеспечены устранением атмосферной влаги из системы.
Оборудование
Главным блоком прибора является кулонометрическая ячейка. Наиболее часто используемая ячейка состоит из анодного отделения, в котором протекает реакция К. Фишера, и меньшего по объему катодного отделения, в котором протекает катодная реакция восстановления. Каждое отделение содержит платиновый электрод. Анодное отделение заполняется анолитом, в качестве которого используется модифицированный реактив К. Фишера, содержащий йодид-анион вместо йода. Катодное отделение заполняется подходящим католитом, как правило, содержащим соли аммония в качестве активного компонента. Отделения разделены диафрагмой, предотвращающей смешение двух растворов. Поскольку диффузия активных компонентов не может быть полностью исключена диафрагмой, компоненты католита должны быть совместимы с анолитом. Могут использоваться и однокамерные ячейки без диафрагмы. В этом случае анодная и катодная реакции протекают в одном и том же объеме электролита, поэтому катодная реакция восстановления не должна давать продукты, способные окисляться на аноде, что может привести к завышенным результатам определения.
Реакционная ячейка должна поддерживаться в абсолютно сухом состоянии. Заливка реактива в анодное отделение производится через сухую воронку, после чего ячейка немедленно герметизируется. При этом может произойти обесцвечивание реактива. Влагу удаляют из системы предварительным электролизом.
Катодное отделение также должно быть безводным. Небольшой избыток элементарного йода в католите не оказывает влияния на титрование.
Анализируемая жидкая проба вводится в ячейку с анолитом шприцем через силиконовую прокладку. Следует избегать ввода твердых проб в ячейку. Тем не менее, если необходимо провести испытание на твердых образцах, они вводятся через герметично закрываемый ввод; при этом должны быть предприняты меры по предотвращению поступления в ячейку атмосферной влаги, например, работать в перчаточном боксе в атмосфере сухого инертного газа. Также твердые пробы могут вводиться в виде раствора после растворения в подходящем растворителе, или вода высвобождается из пробы в трубчатой печи при нагревании и переносится в анолит потоком сухого инертного газа. Газы вводятся в анолит через трубку для ввода газа (барботер).
Объем пробы не должен превышать 10 мл. Обычно в ячейку дозируется 0,5–5,0 мл жидкой пробы. Газовые пробы вводятся в объеме от 100 мл до 10 л.
Методика
Кулонометрическое титрование выполняют до установления конечной точки титрования.
Отделение реакционной ячейки заполняют электролитом для микроопределения воды согласно инструкциям изготовителя. Влагу удаляют из системы предварительным электролизом.
Точное количество испытуемого вещества, указанное в фармакопейной статье, вносят в реакционную ячейку и перемешивают в течение
30 с или в течение времени, указанного в фармакопейной статье. Титруют до установления конечной точки титрования.
При использовании испарителя точную навеску испытуемого вещества, указанную в фармакопейной статье, помещают в трубку и нагревают. После выпаривания воды из образца в ячейку проводят титрование.
Проводят контрольный опыт и вычисляют содержание воды в испытуемом веществе в процентах.
Проверка точности. Между двумя последовательными титрованиями вводят точно взвешенное количество воды – такое же, как в определяемом образце, и выполняют кулонометрическое титрование. Результат должен быть в пределах от 97,5 до 102,5 % для содержания 1000 мкг воды в образце и в пределах от 90,0 до 110,0 % для содержания 100 мкг воды в образце.
Определение воды методом дистилляции
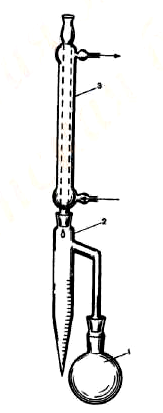
Прибор
Определение проводят в приборе (рис. 1), состоящем из стеклянной круглодонной колбы (1) вместимостью от 250 до 500 мл, приемника (2), представляющего собой градуированную пробирку или бюретку вместимостью 6–10 мл с ценой деления 0,1 мл, и холодильника (3).
Рис. 1. Прибор для определения воды методом дистилляции. 1 – колба, 2 – приемник, 3 – холодильник
Методика
В колбу (1) отвешивают с точностью до 1 % указанное в фармакопейной статье количество испытуемого вещества (от 10,0 до 20,0 г (точная навеска), содержащее от 2 до 3 мл воды), прибавляют 100 мл толуола или ксилола и несколько кусочков пористого материала (например, несколько кусочков пемзы). Колбу нагревают на электроплитке или песчаной бане до кипения. Кипячение ведут так, чтобы конденсирующийся растворитель не скапливался в холодильнике, а спокойно стекал навстречу поднимающимся парам жидкости со скоростью от 2 до 4 капель в секунду. Кипячение прекращают, когда объем воды в приемнике перестанет увеличиваться и верхний слой растворителя в приемнике станет прозрачным. Внутреннюю трубку холодильника промывают толуолом и продолжают нагревание еще 5 мин, после чего приемник охлаждают до комнатной температуры и стряхивают со стенок приемника все капли воды.
Вся отогнанная вода собирается в нижней части приемника. После полного разделения слоев отмечают объем отогнанной воды.