Для чего служат индикаторы химия
Химические индикаторы
Индика́тор (лат. indicator – указатель ) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения.
Содержание
Применение индикаторов
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Структура молекул и цвет индикаторов
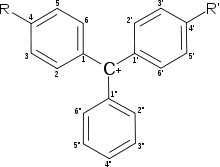
Трифенилметановые красители-индикаторы
Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
| Название \ Положение | 2″ | 2 | 3 | 4 | 5 | 2′ | 3′ | 4′ | 5′ |
|---|---|---|---|---|---|---|---|---|---|
| Бромтимоловый синий | SO3 − | Me | Br | OH | MeEt | Me | Br | OH | MeEt |
| Бромфеноловый синий | SO3 − | H | Br | OH | Br | H | Br | OH | Br |
| Бромкрезоловый зелёный | SO3 − | Me | Br | OH | Br | Me | Br | OH | Br |
| Крезоловый красный | SO3 − | H | Me | OH | H | H | Me | OH | H |
| Фенолфталеин | CO2 − | H | H | OH | H | H | H | OH | H |
| Тимолфталеин | CO2 − | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Малахитовый зелёный | H | H | H | NMe2 | H | H | H | NMe2 | H |
Производные азобензола
Виды индикаторов
Распространённые кислотно-основные индикаторы
Металлоиндикаторы
Редокс-индикаторы
Редокс- или окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона.
Адсорбционные индикаторы
Термоиндикаторы
Химические индикаторы влажности
См. также
Полезное
Смотреть что такое «Химические индикаторы» в других словарях:
Химические реактивы — (реагенты химические) химические препараты, предназначенные для химического анализа научно исследовательских, различных лабораторных работ. В большинстве случаев химические реактивы представляют собой индивидуальные вещества; однако к… … Википедия
ИНДИКАТОРЫ ХИМИЧЕСКИЕ — ИНДИКАТОРЫ ХИМИЧЕСКИЕ, вещества, используемые для определения водородного показателя pH или установления конечной точки титрования по изменению окраски химического индикатора. Наиболее известные индикаторы химические лакмус, фенолфталеин,… … Современная энциклопедия
ИНДИКАТОРЫ ХИМИЧЕСКИЕ — органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно основные (напр., фенолфталеин, лакмус), окислительно… … Большой Энциклопедический словарь
ИНДИКАТОРЫ — (1) технические средства отображения информации о количественном и (или) качественном значении параметров технологического процесса либо состояния контролируемой системы (объекта) наблюдения или управления в виде, наиболее удобном для восприятия… … Большая политехническая энциклопедия
Индикаторы химические — вещества, введение которых в анализируемый раствор позволяет установить конец химической реакции или концентрацию водородных ионов по легко заметному признаку. И. х. используют главным образом в титриметрическом анализе (См.… … Большая советская энциклопедия
индикаторы химические — органические и неорганические вещества, используемые для определения водородного показателя рН или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно основные (например, фенолфталеин, лакмус), окислительно… … Энциклопедический словарь
Индикаторы кислотно-основные — рН индикаторы, используемые для установления точки эквивалентности в нейтрализации методах (См. Нейтрализации методы); см. Индикаторы химические … Большая советская энциклопедия
Индикаторы металлохромные — металл индикаторы, используемые для установления точки эквивалентности при комплексонометрическом титровании; см. Индикаторы химические, Комплексонометрия … Большая советская энциклопедия
Индикаторы химические — Индикатор соединение, позволяющее визуализировать изменение концентрации какого либо компонента в растворе (часто при титровании) или быстро определить рН, еН и др. параметры. Виды индикаторов Кислотно основные индикаторы Редокс индикаторы, Ох… … Википедия
Индикаторы химические — этим именем называются такие вещества, которые, будучи введены в круг исследуемых химических превращений, образованием окрашенных соединений различных оттенков или выделением характерных осадков показывают на существование в данной среде или… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химические индикаторы: для чего они нужны, виды, примеры
Содержание:
А химический индикатор Это вещество, которое выполняет функцию сигнализации, обычно изменением цвета, о том, что в растворах, в которых оно присутствует, произошли изменения. Это связано с тем, что другое вещество в окружающей среде достигает критической концентрации.
Этот последний индикатор, индикатор пурпурной капусты, можно считать универсальным индикатором, так как его цвет варьируется от pH 0, 1 до 13.
Для чего нужны химические индикаторы?
Индикаторы имеют два основных применения:
-Оценка таких параметров, как pH, влажность, окислительно-восстановительный потенциал, растворимость и т. Д.
-Определение конечных точек степеней независимо от того, какого они типа.
Типы химических индикаторов
Кислотно-щелочной индикатор
Процесс ионизации кислотно-основного химического индикатора можно описать следующим образом.
HIn (цвет 1) ⇌ In – (цвет 2) + H3ИЛИ +
Однако есть индикаторы, которые имеют более двух цветов.
Природные кислотно-основные показатели
Они содержатся в листьях, цветках, плодах и стеблях многих видов растений. В пример можно привести гортензию, у которой цветки синие, если ее посадить в кислую почву, богатую алюминием. Но в щелочных почвах его цветки от розового до фиолетового цвета.
Индикаторы окислительно-восстановительных реакций (редокс)
1-10-фенантролин железа меняет цвет с красного на бледно-голубой, когда потенциал окисления находится в диапазоне от 1,04 до 1,08 вольт. Метиленовый синий в восстановленном состоянии имеет синий цвет; в окисленном состоянии он бесцветен. 2,2′-биперидин изменяется с синего на красный с электродным потенциалом 0,97 вольт.
Показатели адсорбции (осаждения)
Впоследствии к осадку хлорида серебра прилипает дополнительное количество серебра и флуоресцеина, изменяя его цвет с желто-зеленого на красный. Это указывает на завершение образования осадка хлорида серебра.
Металлохромные или комплексометрические индикаторы
Это химические индикаторы, которые меняют цвет в присутствии определенных ионов и могут вернуться к своему первоначальному цвету после удаления ионов. Эти индикаторы используются для определения того, когда все ионы металлов хелатированы или секвестрированы, обычно с помощью ЭДТА.
Для определенных ионов существует специфика металлохромных индикаторов. Например: кальцеин специфичен для кальция. Гематоксилин специфичен для меди. А дитизон специфичен для цинка и свинца.
Химические индикаторы с люминесцентной способностью
Индикаторы химической влажности
Чтобы влагопоглотитель мог выполнять свою функцию, он снабжен химическим индикатором влажности, например метиловым фиолетовым. Этот индикатор имеет оранжевый цвет в сухом состоянии и фиолетовый во влажном состоянии.
Химические показатели стерилизации
Эти показатели позволяют быть уверенными в том, что материал прошел весь процесс стерилизации.
Примеры химических индикаторов
Основная кислота
Несколько кислотных индикаторов будут перечислены ниже вместе с диапазонами pH, в которых они меняют цвет:
Природная кислотная основа
Пигмент антоцианов, который действует как кислотно-щелочной индикатор, содержится в лепестках различных красных цветов, включая герани, на стеблях, таких как ревень и т. Д.
Куркума, специя, используемая в восточной кухне, желтая в кислых условиях и коричневая в щелочных.
Лакмус
Лакмус красный при кислом pH и синий при щелочном pH со шкалой изменения цвета от 4,5 до 8,3.
Перманганат калия
ИНДИКАТОРЫ в химии
ИНДИКАТОРЫ в химии (лат. indicator указатель) — вещества, изменяющие свой цвет в присутствии тех или иных химических соединений в исследуемой среде (в растворе, в воздухе, в клетках, в тканях), а также при изменении pH или окислительно-восстановительного потенциала среды; широко применяются в биохимических, клинических и санитарно-гигиенических лабораториях.
И. применяют для определения конца реакции (точки эквивалентности) при титровании, для колориметрического определения величин pH или окислительно-восстановительных потенциалов, для обнаружения различного рода веществ в тех или иных исследуемых объектах. Для всех этих целей И. применяют в виде водных или спиртовых р-ров или в виде индикаторных бумажек, представляющих собой полоски фильтровальной бумаги, пропитанные И.
В зависимости от назначения и механизма действия И. подразделяют на ряд групп.
Кислотно-основные индикаторы представляют собой сложные органические соединения, изменяющие окраску (двухцветные И.) или ее интенсивность (одноцветные И.) в зависимости от pH среды. Двухцветным И. является, напр., лакмоид: в щелочной среде он имеет синюю окраску, а в кислой — красную. Примером одноцветных И. может служить фенолфталеин, бесцветный в кислой среде и малиновый в щелочной.
По теории Оствальда (W. Ostwald) кислотно-основные И. представляют собой слабые органические к-ты или основания, недиссоциированные молекулы которых имеют в р-ре иную окраску, чем образуемые ими анионы и катионы. Фенолфталеин, напр., является слабой к-той, не диссоциированные молекулы к-рой бесцветны, а анионы окрашивают р-ры в малиновый цвет. В р-рах И., представляющие собой слабые к-ты, диссоциируют по уравнению
Константа ионизации таких И. равна
(квадратными скобками обозначены молярные концентрации соответствующих частиц).
И., представляющие собой слабые основания, диссоциируют по уравнению
где ВОН — не диссоциированные молекулы И., В+ — катионы И., а OH- — гидроксильные ионы.
Константа диссоциации этих И. равна
Кислотно-основные И. широко применяют при титровании к-т и щелочей, а также для колориметрического измерения величины pH биол, жидкостей, клеток, тканей и др.
Титрование к-т и щелочей должно быть закончено в момент достижения точки эквивалентности, т. е. в момент, когда к титруемому р-ру к-ты (щелочи) добавлен такой объем титранта, в к-ром содержится эквивалентное количество к-ты (щелочи). Для этого необходимо применять такой И., точка перехода к-рого равна величине pH титруемого р-ра в точке эквивалентности (см. Нейтрализации метод). В табл. перечислены И., наиболее употребляемые при титровании к-т и оснований.
Качественное определение кислотности и щелочности производят с помощью так наз. нейтральных И., точка перехода которых находится практически при pH 7,0. К ним относятся, напр., лакмус, имеющий в кислой среде (pH меньше 7,0) красный, а в щелочной среде (pH больше 7,0) синий цвет; нейтральный красный, окрашивающийся в кислой среде в красный цвет, а в щелочной — в желтый цвет.
Приближенное измерение величины pH среды (с точностью до 0,5— 1,0 ед. pH) обычно производят с помощью универсального (комбинированного) И., представляющего собой смесь нескольких И., интервалы перехода которых близки друг к другу и охватывают широкую область значений pH.
К 0,5 мл испытуемой жидкости добавляют 1—2 капли р-ра универсального И. и появляющуюся при этом окраску сравнивают с прилагаемой цветовой шкалой, на к-рой указаны значения pH, отвечающие различным окраскам И. Применяют также полоски фильтровальной бумаги, пропитанные универсальным И.
Для более точного (0,1—0,5 ед. pH) колориметрического определения величины pH обычно пользуются одноцветными И. ряда динитро- и нитрофенолов, предложенными Михаэлисом (L. Michaelis) и представляющими собой слабые к-ты, изменяющие окраску от бесцветной (в кислой среде) до желтой (в щелочной). С этой же целью пользуются рядом двухцветных И., предложенных Кларком (W. М. Clark) и Лабсом (H. A. Lubs), представляющих собой сульфофталеины. Кислотная и щелочная формы этих И. резко различаются по цвету, в этом состоит их преимущество по сравнению с индикаторами Михаэлиса.
Окислительно-восстановительные, или редоксиндикаторы, представляют собой органические красители, цвет которых в окисленном и восстановленном состоянии различен. Такие И. применяют при оксидиметрическом титровании (см. Оксидиметрия), а также для колориметрического определения величин окислительно-восстановительных потенциалов жидкостей (см. Окислительно-восстановительный потенциал), отдельных клеток и тканей в цитохим, и цитол, лабораториях. Большинство редокс-индикаторов при восстановлении превращается в бесцветные соединения, а при окислении окрашивается. Окисленная и восстановленная формы И. находятся в р-рах в состоянии динамического равновесия:
окисленная форма + ne восстановленная форма, где n — число электронов.
Соотношение между равновесными концентрациями двух форм данного И., а следовательно, и цвет р-ра, в к-ром находится И., зависят от величины окислительно-восстановительного потенциала р-ра. Если величина потенциала р-ра больше нормального окислительно-восстановительного потенциала (Е0) данного редокс-индикатора, то большая часть И. в этом р-ре переходит в окисленную форму (обычно окрашенную), если же окислительно-восстановительный потенциал исследуемой среды меньше Е0, то И. превращается в восстановленную форму (обычно бесцветную). При равенстве значений окислительно-восстановительного потенциала среды и Е0 индикатора концентрации окисленной и восстановленной форм И. равны друг другу. Имея ряд И. с различными значениями Е0, можно по их окраске в данной среде судить о величине окислительно-восстановительного потенциала данной среды. Редокс-индикаторы, предложенные Михаэлисом, имеющие общее название «виологены» и представляющие собой производные гамма- и гамма’-дипиридилов, обладают малой токсичностью и широко применяются для измерения окислительно-восстановительных потенциалов в биол, системах; у этих И. окрашена восстановленная форма.
Нормальный окислительно-восстановительный потенциал виологенов не зависит от величины pH р-ра. Этим они отличаются от других редокс-индикаторов.
Комплексонометрические индикаторы (металлоиндикаторы) представляют собой хорошо растворимые в воде органические красители, способные образовывать с ионами металлов окрашенные комплексные соединения. Эти И. применяются для установления точки эквивалентности при комплексонометрическом титровании (см. Комплексонометрия).
Адсорбционные индикаторы — это органические красители, адсорбирующиеся на поверхности осадков, образующихся при титровании по методу осаждения, и изменяющие свой цвет при достижении точки эквивалентности. Напр., тропеолин 00 при титровании хлоридов р-ром азотнокислого серебра меняет окраску в точке эквивалентности с желтой на розовую.
Хемилюминесцентныe (флюоресцентные) индикаторы — органические соединения (например, люменол, люцегинин, силаксен и др.), обладающие способностью люминесцировать при естественном освещении или при облучении ультрафиолетовым светом. Интенсивность и цвет люминесценции зависят как от величины pH среды, так и от величины ее окислительно-восстановительного потенциала; эти И. применяются при титровании (при нейтрализации и оксидиметрии) сильно окрашенных или мутных жидкостей, когда изменение окраски обычных И. незаметно.
И. используются во многих биохим. методах, применяемых в клин.-биохим. лабораториях. Наиболее употребимыми из них являются бромтимоловый синий (при определении активности фруктозодифосфатальдолазы в сыворотке крови, активности ацетилхолинэстеразы и холинэстеразы в сыворотке крови по А. А. Покровскому, а также активности карбоксилэстеразы в крови по А. А. Покровскому и Л. Г. Пономаревой), бромфеноловый синий (при электрофоретическом разделении различных белков для окраски электрофореграмм наряду с амидочерным и кислотным сине-черным), универсальный И., феноловый красный (при определении активности аспартат- и аланин-аминотрансфераз в сыворотке крови, активности холинэстеразы в сыворотке крови и т. д.), фенолфталеин, нитросиний тетразолий, используемый для качественной и количественной оценки активности различных дегидрогеназ (см. Дегидрогеназы), и др.
Таблица. Краткая характеристика индикаторов, наиболее часто используемых при титровании кислот и оснований
Интервал перехода индикатора, в единицах pH
Индикаторы в химии
Слово «индикатор» происходит от латинского indicator — «указатель». Действительно, индикаторы — органические вещества сложной природы, с помощью которых можно отслеживать состав среды или протекание химической реакции. Среда любого водного раствора характеризуется содержанием ионов водорода Н+ или гидроксид-ионов. У водных растворов бывают нейтральная, щелочная и кислотная среды. В нейтральной среде число ионов водорода равно числу гидроксид-ионов. В кислотной среде число ионов водорода больше числа гидроксид-ионов. В щелочной среде число ионов водорода меньше числа гидроксид-ионов.
Пожалуй, самыми распространенными являются кислотно-основные индикаторы, изменяющие цвет согласно кислотности раствора. Кислотностью называется показатель активности ионов водорода в растворе. От кислотности зависит строение молекул индикатора. Например, фенолфталеин в слабой и средней кислой среде представляет собой недиссоциированные молекулы, и раствор остается бесцветным. Правда, в концентрированной серной кислоте он дает красную окраску, поскольку в ней присутствует катион фенолфталеина. В щелочной среде раствор приобретает малиновый цвет, потому что там присутствуют однозарядные анионы фенолфталеина. В сильнощелочной среде образуются трехзарядные анионы фенолфталеина, которые обесцвечивают раствор.
Существует множество кислотно-основных индикаторов/ их знают многие века. Это экстракты или отвары окрашенных плодов и цветов. Так, красными в кислой среде становятся отвары черники, малины, ежевики, черной смородины, свеклы, красной капусты, анютиных глазок, тюльпанов, ириса. В щелочной среде они будут синими. Кислый (например, уксус) и щелочной (пищевая или стиральная сода) растворы позволяют делать красные или синие узоры либо надписи на лепестках цветов. Чай тоже индикатор: он светлеет, если в него положить ломтик лимона, и темнеет, если добавить в него пищевую соду.
В химии давно, еще с 1300 г., известен такой кислотно-основной индикатор, как лакмус.
В чистом виде лакмус — темный порошок со слабым запахом аммиака. В нейтральной водной среде он дает фиолетовый цвет, в кислой — красный, в щелочной — синий.
В химической практике применяют несколько форм лакмуса — водный раствори ленты пропитанной лакмусом фильтровальной бумаги. Выражение «лакмусовая бумага» теперь является нарицательным и обозначает мгновенную определенную реакцию на что-либо.
Состоит природный лакмус из смеси 10— 15 разных веществ. Основные его компоненты — это азолитмин, эритролитмин, спанол, итмин, лейкоорцеин и лейказолитмин. Добывают его из растительного сырья в основном из лишайников.
Кроме кислотно-щелочных существуют и другие виды индикаторов, например адсорбционные. Они основаны на явлении адсорбции — увеличении концентрации растворенного вещества на границе раздела двух фаз. Эти вещества адсорбируются на поверхности осадка и меняют его окраску. Примеры таких индикаторов — ализариновый красный и эозин. Флуоресцентные индикаторы светятся разным цветом в соответствии с pH раствора. Так, флуоресценция акридина при pH = 4,5 зеленая, при pH = 5,5 синяя. При этом свечение индикатора никак не связано с собственной окраской раствора и его прозрачностью.
Кислотно-основные индикаторы широко используются в биохимии и аналитической химии, особенно при титровании. Однако их точность не очень высока, а определение цвета достаточно субъективно и зависит от особенностей человеческого зрения. Поэтому для точных исследований обычно используются специальные приборы — рН-метры.
Реферат по химии на тему «Индикаторы в аналитической химии»
Государственное бюджетное образовательное учреждение
средняя общеобразовательная школа №225 Адмиралтейского района Санкт-Петербурга
Школа БИОТОП Лаборатории непрерывного математического образования
Индикаторы в аналитической химии
Нематова Рената Батировна
Воронаев Иван Геннадьевич
Оглавление
Что такое химические индикаторы? Качественный анализ.
Их применяют для определения конца реакции (точки эквивалентности) при титровании, для колориметрического определения величин pH или окислительно-восстановительных потенциалов, для обнаружения различного рода веществ в тех или иных исследуемых объектах. Для всех этих целей Индикаторы применяют в виде водных или спиртовых растворов или в виде индикаторных бумажек, представляющих собой полоски фильтровальной бумаги, пропитанные Индикатором.
В зависимости от назначения и механизма действия Индикаторы подразделяют на ряд групп :
Кислотно-основные индикаторы представляют собой сложные органические соединения, изменяющие окраску (двухцветные индикаторы) или ее интенсивность (одноцветные индикаторы) в зависимости от pH среды. Двухцветным индикаторами является, например, лакмоид: в щелочной среде он имеет синюю окраску, а в кислой — красную. Примером одноцветных индикаторов может служить фенолфталеин, бесцветный в кислой среде и малиновый в щелочной.
Качественное определение кислотности и щелочности производят с помощью нейтральных И., точка перехода которых находится практически при pH 7,0. К ним относится лакмус, имеющий в кислой среде (pH меньше 7,0) красный, а в щелочной среде (pH больше 7,0) синий цвет; нейтральный красный, окрашивающийся в кислой среде в красный цвет, а в щелочной — в желтый цвет.
Комплексонометрические индикаторы (металлоиндикаторы) представляют собой хорошо растворимые в воде органические красители, способные образовывать с ионами металлов окрашенные комплексные соединения. Эти индикаторы применяются для установления точки эквивалентности при комплексонометрическом титровании.
Хемилюминесцентныe (флюоресцентные) индикаторы — органические соединения (например, люменол, люцегинин, силаксен и др.), обладающие способностью люминесцировать при естественном освещении или при облучении ультрафиолетовым светом. Интенсивность и цвет люминесценции зависят как от величины pH среды, так и от величины ее окислительно-восстановительного потенциала; эти И. применяются при титровании (при нейтрализации и оксидиметрии) сильно окрашенных или мутных жидкостей, когда изменение окраски обычных индикаторов незаметно.
Индикаторы используются во многих биохимических методах, применяемых в клинико-биохимических лабораториях. Наиболее употребимыми из них являются бромтимоловый синий (при определении активности фруктозодифосфатальдолазы в сыворотке крови, активности ацетилхолинэстеразы и холинэстеразы в сыворотке крови по А. А. Покровскому, а также активности карбоксилэстеразы в крови по А. А. Покровскому и Л. Г. Пономаревой), бромфеноловый синий (при электрофоретическом разделении различных белков для окраски электрофореграмм наряду с амидочерным и кислотным сине-черным), универсальный И., феноловый красный (при определении активности аспартат- и аланин-аминотрансфераз в сыворотке крови, активности холинэстеразы в сыворотке крови и т. д.), фенолфталеин, нитросиний тетразолий, используемый для качественной и количественной оценки активности различных дегидрогеназ, и др.