Для чего служат индикаторы
Химические индикаторы
Индика́тор (лат. indicator – указатель ) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH, еН и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения.
Содержание
Применение индикаторов
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Структура молекул и цвет индикаторов
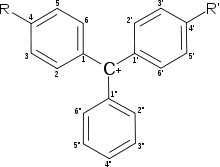
Трифенилметановые красители-индикаторы
Трифенилметановые красители широко используются в качестве индикаторов. В зависимости от типа заместителей изменения структуры молекулы приводят к широкой гамме цветных соединений, большинство из которых могут служить химическими индикаторами.
| Название \ Положение | 2″ | 2 | 3 | 4 | 5 | 2′ | 3′ | 4′ | 5′ |
|---|---|---|---|---|---|---|---|---|---|
| Бромтимоловый синий | SO3 − | Me | Br | OH | MeEt | Me | Br | OH | MeEt |
| Бромфеноловый синий | SO3 − | H | Br | OH | Br | H | Br | OH | Br |
| Бромкрезоловый зелёный | SO3 − | Me | Br | OH | Br | Me | Br | OH | Br |
| Крезоловый красный | SO3 − | H | Me | OH | H | H | Me | OH | H |
| Фенолфталеин | CO2 − | H | H | OH | H | H | H | OH | H |
| Тимолфталеин | CO2 − | Me | H | OH | MeEt | Me | H | OH | MeEt |
| Малахитовый зелёный | H | H | H | NMe2 | H | H | H | NMe2 | H |
Производные азобензола
Виды индикаторов
Распространённые кислотно-основные индикаторы
Металлоиндикаторы
Редокс-индикаторы
Редокс- или окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II)
Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона.
Адсорбционные индикаторы
Термоиндикаторы
Химические индикаторы влажности
См. также
Полезное
Смотреть что такое «Химические индикаторы» в других словарях:
Химические реактивы — (реагенты химические) химические препараты, предназначенные для химического анализа научно исследовательских, различных лабораторных работ. В большинстве случаев химические реактивы представляют собой индивидуальные вещества; однако к… … Википедия
ИНДИКАТОРЫ ХИМИЧЕСКИЕ — ИНДИКАТОРЫ ХИМИЧЕСКИЕ, вещества, используемые для определения водородного показателя pH или установления конечной точки титрования по изменению окраски химического индикатора. Наиболее известные индикаторы химические лакмус, фенолфталеин,… … Современная энциклопедия
ИНДИКАТОРЫ ХИМИЧЕСКИЕ — органические и неорганические вещества, используемые для определения водородного показателя pH или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно основные (напр., фенолфталеин, лакмус), окислительно… … Большой Энциклопедический словарь
ИНДИКАТОРЫ — (1) технические средства отображения информации о количественном и (или) качественном значении параметров технологического процесса либо состояния контролируемой системы (объекта) наблюдения или управления в виде, наиболее удобном для восприятия… … Большая политехническая энциклопедия
Индикаторы химические — вещества, введение которых в анализируемый раствор позволяет установить конец химической реакции или концентрацию водородных ионов по легко заметному признаку. И. х. используют главным образом в титриметрическом анализе (См.… … Большая советская энциклопедия
индикаторы химические — органические и неорганические вещества, используемые для определения водородного показателя рН или установления конечной точки титрования (обычно по изменению окраски). Различают кислотно основные (например, фенолфталеин, лакмус), окислительно… … Энциклопедический словарь
Индикаторы кислотно-основные — рН индикаторы, используемые для установления точки эквивалентности в нейтрализации методах (См. Нейтрализации методы); см. Индикаторы химические … Большая советская энциклопедия
Индикаторы металлохромные — металл индикаторы, используемые для установления точки эквивалентности при комплексонометрическом титровании; см. Индикаторы химические, Комплексонометрия … Большая советская энциклопедия
Индикаторы химические — Индикатор соединение, позволяющее визуализировать изменение концентрации какого либо компонента в растворе (часто при титровании) или быстро определить рН, еН и др. параметры. Виды индикаторов Кислотно основные индикаторы Редокс индикаторы, Ох… … Википедия
Индикаторы химические — этим именем называются такие вещества, которые, будучи введены в круг исследуемых химических превращений, образованием окрашенных соединений различных оттенков или выделением характерных осадков показывают на существование в данной среде или… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Химические индикаторы: для чего они нужны, виды, примеры
Содержание:
А химический индикатор Это вещество, которое выполняет функцию сигнализации, обычно изменением цвета, о том, что в растворах, в которых оно присутствует, произошли изменения. Это связано с тем, что другое вещество в окружающей среде достигает критической концентрации.
Этот последний индикатор, индикатор пурпурной капусты, можно считать универсальным индикатором, так как его цвет варьируется от pH 0, 1 до 13.
Для чего нужны химические индикаторы?
Индикаторы имеют два основных применения:
-Оценка таких параметров, как pH, влажность, окислительно-восстановительный потенциал, растворимость и т. Д.
-Определение конечных точек степеней независимо от того, какого они типа.
Типы химических индикаторов
Кислотно-щелочной индикатор
Процесс ионизации кислотно-основного химического индикатора можно описать следующим образом.
HIn (цвет 1) ⇌ In – (цвет 2) + H3ИЛИ +
Однако есть индикаторы, которые имеют более двух цветов.
Природные кислотно-основные показатели
Они содержатся в листьях, цветках, плодах и стеблях многих видов растений. В пример можно привести гортензию, у которой цветки синие, если ее посадить в кислую почву, богатую алюминием. Но в щелочных почвах его цветки от розового до фиолетового цвета.
Индикаторы окислительно-восстановительных реакций (редокс)
1-10-фенантролин железа меняет цвет с красного на бледно-голубой, когда потенциал окисления находится в диапазоне от 1,04 до 1,08 вольт. Метиленовый синий в восстановленном состоянии имеет синий цвет; в окисленном состоянии он бесцветен. 2,2′-биперидин изменяется с синего на красный с электродным потенциалом 0,97 вольт.
Показатели адсорбции (осаждения)
Впоследствии к осадку хлорида серебра прилипает дополнительное количество серебра и флуоресцеина, изменяя его цвет с желто-зеленого на красный. Это указывает на завершение образования осадка хлорида серебра.
Металлохромные или комплексометрические индикаторы
Это химические индикаторы, которые меняют цвет в присутствии определенных ионов и могут вернуться к своему первоначальному цвету после удаления ионов. Эти индикаторы используются для определения того, когда все ионы металлов хелатированы или секвестрированы, обычно с помощью ЭДТА.
Для определенных ионов существует специфика металлохромных индикаторов. Например: кальцеин специфичен для кальция. Гематоксилин специфичен для меди. А дитизон специфичен для цинка и свинца.
Химические индикаторы с люминесцентной способностью
Индикаторы химической влажности
Чтобы влагопоглотитель мог выполнять свою функцию, он снабжен химическим индикатором влажности, например метиловым фиолетовым. Этот индикатор имеет оранжевый цвет в сухом состоянии и фиолетовый во влажном состоянии.
Химические показатели стерилизации
Эти показатели позволяют быть уверенными в том, что материал прошел весь процесс стерилизации.
Примеры химических индикаторов
Основная кислота
Несколько кислотных индикаторов будут перечислены ниже вместе с диапазонами pH, в которых они меняют цвет:
Природная кислотная основа
Пигмент антоцианов, который действует как кислотно-щелочной индикатор, содержится в лепестках различных красных цветов, включая герани, на стеблях, таких как ревень и т. Д.
Куркума, специя, используемая в восточной кухне, желтая в кислых условиях и коричневая в щелочных.
Лакмус
Лакмус красный при кислом pH и синий при щелочном pH со шкалой изменения цвета от 4,5 до 8,3.
Перманганат калия
Индикаторы
Индикаторы – средства измерений (СИ) с ненормируемыми метрологическими характеристиками, используемые для наблюдения за изменением физических величин без оценки их значений в единицах измерения с нормированной точностью. Индикаторы не подлежат поверке или калибровке.
Справка. С 01.071985 по 01.12.2001 год в РФ действовал ГОСТ 8.513-84 «ГСИ. Поверка средств измерений. Организация и порядок проведения». Он установил, что СИ, используемые для наблюдения за изменением величин без оценки их значения не подлежали поверке. На них самих и на их эксплуатационной документации должна была наноситься литера «И». Порядок контроля исправности И устанавливало само предприятие (п.1.14).
После отмены ГОСТ 8.513-84 регулирование вопросов, связанных с И, по-прежнему находится в ведении предприятия (отрасли). Оно устанавливает требования к обозначению, клеймению И, порядок их регистрации, эксплуатации, технического обслуживания и ремонта, в том числе, в стандарте организации – СТО.
На данный момент не существует нормативных документов федерального уровня касательно индикаторов.
В некоторых отраслях для индикаторов сформулированы ведомственные нормативные требования (как, например, в военной промышленности). Если в отрасли нет обязательных требований, то предприятие имеет право внедрить их у себя на добровольной основе.
В общем случае СИ, которые по условиям применения можно отнести к индикаторам, определяются распоряжением (приказом) руководства предприятия. (Этот факт может также быть отражен в СТО). Правильность отнесения СИ к индикаторам может быть проверена в рамках государственного метрологического надзора.
О термине «индикатор» в законодательных документах РФ и НПА
В действующей редакции Федерального закона 102-ФЗ от 26.06.2008 «Об обеспечении единства измерений» нет понятия «индикатор», нет определений «ненормированные СИ», «СИ с ненормируемыми метрологическими характеристиками». Точно также действующие с 01.01.2015 на территории РФ Рекомендации РМГ 29-2013 «ГСИ. Метрология. Основные термины и определения» не включают определения термина «индикатор».
Справка. В РМГ 29-99 (вместо которого введены РМГ 29-2013) в ст. 6.26 в последних редакциях присутствовал термин «индикатор» (Detektor), и он определялся как вещество или техническое средство для установления наличия или превышение уровня порогового значения какой-либо физической величины.
РМГ 29-2013 (ст 6.14) содержит определение «детектора» как технического средства или вещества, которое указывает на наличие определенного свойства объекта измерения при превышении порогового значения соответствующей величиной. (Приведены примеры индикаторов – галогенный течеискатель, лакмусовая бумага. Примечание – в химии для этого понятия часто используют термин индикатор).
Некоторые специалисты объясняют факт отсутствия определений термина «индикаторы» в современных законодательных и нормативно-правовых актах (НПА) тем, что данные устройства не являются объектами государственного регулирования в сфере обеспечения единства измерений (ОЕИ), так как это ненормируемые СИ. Тем не менее вопросы, связанные с устройствами данного типа, периодически всплывают в метрологическом сообществе. Объектами обсуждений становятся ведомственные нормативные документы определяющие порядок отнесения и применения индикаторов.
Ведомственные НПА об индикаторах
Отдельные отраслевые нормативные документы, устанавливающие обязательные требования в сфере обеспечения единства измерений, (даже принятые совсем недавно) по-прежнему содержат определение данного термина и устанавливают для предприятий своего ведомства рекомендуемые или обязательные требования к индикаторам (в зависимости от статуса документа). Приведем несколько примеров таких НПА:
В учебниках по метрологии также присутствуют определения индикатора. Например, Мокров Ю.В. Метрология, стандартизация и сертификация (Учебное пособие – Дубна, 2007).
Что включать в СТО касательно индикаторов?
Термин «индикатор» может применяться по усмотрению вашей организации или предприятия, если он является для вас удобным. Но его использование допустимо лишь вне сферы государственного регулирования ОЕИ.
На примере ОАО «Газпром» (Р Газпром 5.1-2008) определим основные требования к стандартам организации, направленные на индикаторы.
Так ваш СТО может включать следующие разделы:
Порядок перевода СИ в разряд индикаторов и контроль их работоспособности
Перевод СИ в разряд индикаторов происходит на основе приказа руководителя предприятия. Такой приказ означает, что данные устройства и их показания исключаются из процесса принятия решений: ссылка на показания индикаторов, приведшие к травмам персонала, к поломке технического оборудования, к выпуску некачественной или опасной продукции не может быть использована в качестве доказательной базы, т.к. не имеет юридической силы. Поэтому при переводе СИ в индикаторы рекомендуется учитывать возможность влияния такой процедуры на технику безопасности и качество продукции. Этим же приказом может быть установлен график технического обслуживания СИ, переводимых в индикаторы.
Ведомственные руководства Минсвязи по отнесению средств измерений к индикаторным (РД 45.013-98) и Федеральной таможенной службы содержат (в качестве приложений) методику проведения анализа СИ для отнесения их к категории индикаторов.
Перевод средства измерений в индикаторы требует тщательного исследования СИ и их документации, необходимо изучить: назначение, выполняемые функции и устройство СИ; техническое описание СИ; тип показывающего или регистрирующего прибора или устройства; перечень и нормы на контролируемые параметры; вид шкалы, экрана или дисплея.
Средства измерений могут быть отнесены к категории индикаторов в случаях если:
Запрещается к категории индикаторов относить СИ, если хотя бы на одном пределе измерения или для измерения одного из параметров с их помощью выполняется измерение величины с нормируемой точностью.
Процедура перевода СИ в И также регулируется, например, действующими рекомендациями МИ 2233-2000 «ГСИ. Обеспечение эффективности измерений при управлении технологическими процессами. Основные положения» (разработаны ФГУП «ВНИИМС», который координирует работу по формированию правовой и нормативной основ в области ОЕИ). Данный документ содержит и положения касательно процедуры контроля функционирования индикаторов.
Контроль работоспособности индикаторов. МИ 2233-2000 содержат рекомендации, что СИ, применяемые для индикации наличия напряжения или давления в некоторых состояниях технологического процесса и оборудования могут быть переведены в разряд индикаторов. Контроль работоспособности индикаторов рекомендовано осуществлять одним из способов приведенных в п. 4.4.4. и п. 4.3.:
Проверку индикаторов может проводить осведомленный персонал (часто это работники эксплуатационной службы), уполномоченный приказом руководителя или должностной инструкцией. Главному метрологу рекомендуется курировать данный вопрос.
Если на предприятии не введены в действие СТО касательно индикаторов или в них не включены требования по контролю их работоспособности, то главному метрологу рекомендуется составить инструкции по проверке конкретного вида индикаторов (на основе существующих методик поверки).
Для чего служат индикаторы
Индикаторы в нашей жизни
Автор работы награжден дипломом победителя II степени
Введение.
Когда у меня появился набор «В поисках энергии», я впервые увидел, как выглядит известный всем школьникам индикатор, который называется лакмус. Мне стало интересно, что представляет собой лакмусовая бумажка. Оказалось, что лакмус является индикатором, и при взаимодействии с кислотной или щелочной средой меняет свой цвет. Поэтому индикаторы используются для определения реакции среды (кислая, щелочная или нейтральная).
Индикаторы широко используют в химии, в том числе и в школе. Мне захотелось выяснить, какими бывают индикаторы? Из чего делают индикаторы? Можно ли приготовить индикаторы в домашних условиях? С преподавателем по химии мы решили исследовать эту тему и провести нужные опыты.
Актуальность темы заключается в том, в основном для определения среды жидкости используются химические индикаторы, изготовленные на производстве. Нас заинтересовал вопрос, можно ли самостоятельно изготовить индикаторы, которые могут быть применены в домашних условиях.
Гипотеза: если растворы растительных индикаторов можно приготовить самостоятельно, то их можно применять в домашних условиях для определения среды некоторых жидкостей.
Цель работы: Изучить действие химических и природных индикаторов в различных средах.
Задачи:
— изучить литературные источники по теме;
— ознакомиться с классификацией индикаторов;
— научиться изготавливать индикаторы из растительного сырья;
— исследовать действие природных индикаторов в различных средах.
Основная часть
1. История открытия индикаторов.
В лаборатории горели свечи, в ретортах что-то кипело, когда некстати зашел садовник. Он принес корзину с фиалками. Бойль очень любил цветы, но предстояло начать опыт. Он взял несколько цветков, понюхал и положил их на стол. Опыт начался, открыли колбу, из нее повалил едкий пар. Когда же опыт кончился, Бойль случайно взглянул на цветы, они дымились. Чтобы спасти цветы, он опустил их в стакан с водой. И темно-фиолетовые лепестки фиалок стали красными. Учёный велел готовить помощнику растворы, которые потом переливали в стаканы и в каждый опустили по цветку. В некоторых стаканах цветы немедленно начали краснеть. И ученый понял, что цвет фиалок зависит от того, какие вещества содержатся в растворе. Затем Бойль заинтересовался, что покажут не фиалки, а другие растения.
Он приготовил для своих опытов водный настой лакмусового лишайника. Склянка, в которой он хранил настой, понадобилась для соляной кислоты. Вылив настой, Бойль наполнил склянку кислотой и с удивлением обнаружил, что кислота покраснела. Бойль на пробу добавил несколько капель настоя лакмуса к водному раствору гидроксида натрия и обнаружил, что в щелочной среде лакмус синеет.
Эксперименты следовали один за другим, проверялись васильки и другие растения, но всё же лучшие результаты дали опыты с лакмусовым лишайником. Так, в 1663 году, был открыт первый индикатор для обнаружения кислот и оснований, названный по имени лишайника лакмусом.
В 1667 году Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника – лакмуса, а также отварами фиалок и васильков. Высушенные и нарезанные бумажки Роберт Бойль назвал индикаторами, что в переводе с латинского означает «указатель», так как они указывают на среду раствора.
Лакмус стал самым древним кислотно-основным индикатором. Надо сказать, что само красящее вещество лакмус был известен ещё в Древнем Египте и Древнем Риме. Его добывали из некоторых видов лишайников, произраставших на скалах Шотландии, и использовали в качестве фиолетовой краски, но со временем, рецепт его приготовления был утерян.
В 1640 году ботаники описали гелиотроп 2 – душистое растение с темно-лиловыми цветками, из которого тоже было выделено красящее вещество. Этот краситель наряду с соком фиалок тоже стал широко применяться химиками в качестве индикатора, который в кислой среде был красным, а в щелочной – синим.
Позже, в середине XIX века химики научились искусственно синтезировать кислотно–основные индикаторы. Так в 1871 году немецкий химик-органик Адольф фон Байер, будущий лауреат Нобелевской премии, впервые осуществил синтез фенолфталеина.
В наши дни известны несколько сотен кислотно-основных индикаторов, искусственно синтезированных.
2. Классификация индикаторов.
Индикаторы бывают природного и химического происхождения. Химические индикаторы делят обычно на несколько групп. В школе используются самые распространенные кислотно – основные индикаторы. Примером может служить может служить общеизвестный индикатор фенолфталеин.
Помимо кислотно-основных известны и другие типы индикаторов: адсорбционные, комплексонметрические, флуоресцентные, изотопные, окислительно-восстановительные и прочие.
Кислотно-основные индикаторы – индикаторы, изменяющие цвет в зависимости от кислотности раствора.
Окислительно-восстановительные индикаторы – индикаторы, которые изменяют свой цвет в зависимости от того, что присутствует в растворе окислитель или восстановитель.
Комплексонометрические индикаторы – вещества, образующие с ионами металлов окрашенные комплексные соединения.
Флуоресцентные индикаторы – индикаторы, которые светятся (флуоресцируют) разным цветом в зависимости от рН раствора. Свечение индикатора не зависит от прозрачности и собственной окраски раствора.
Характер среды имеет большое значение в химических и биологических процессах. В зависимости от типа среды эти процессы могут протекать с различными скоростями и в разных направлениях. Среду исследуемого раствора можно приблизительно определить по окраске индикаторов.
Больше всего распространены индикаторы лакмус, фенолфталеин и метилоранж.
Самым первым появился лакмус 4 C12H7NO3. Фактически природный лакмус представляет собой сложную смесь. Это порошок черного цвета, растворим в воде, 95 % спирте, ацетоне, ледяной уксусной кислоте.
Окраска лакмуса в различных средах изменяется следующим образом:
В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зеленый 7 (его спиртовой раствор используется как дезинфицирующее средство – зеленка). В сильнокислой среде его окраска желтая, а в сильнощелочной среде раствор обесцвечивается.
Кислотно-основные индикаторы бывают не только химическими. Они находятся вокруг нас. Когда нет настоящих химических индикаторов, то для определения среды растворов можно успешно применять самодельные индикаторы из природного сырья.
Сырьем могут служить цветы герани, лепестки пиона или мальвы, ирис, темные тюльпаны или анютины глазки, а также ягоды малины, черники, черноплодной рябины, соки вишни, смородины, винограда, плоды крушины и черемухи.
Эти природные индикаторы содержат окрашенные вещества (пигменты), способные менять свой цвет в ответ на то или иное воздействие. И, попадая в кислую или щелочную среду, они наглядным образом сигнализируют об этом.
Антоцианами называют группу растительных пигментов (красителей), которые окрашивают лепестки цветов, листья, плоды в различные цвета – от красного до тёмно-синего и фиолетового. В большом количестве антоцианы содержатся в чернике, чёрной смородине, клюкве, вишне, черешне, малине, диком чёрном рисе, красном винограде, красной капусте, красных яблоках.
Почти все фрукты и ягоды, имеющие красную, оранжевую, коричневую, фиолетовую и синюю окраску, содержат антоцианы. Эта окраска может меняться при созревании плодов, отцветания цветков и увядании листьев.
Обычный чай – тоже индикатор. Если в стакан с крепким чаем капнуть лимонный сок или растворить несколько кристалликов лимонной кислоты, то чай сразу станет светлее. Если же растворить в чае питьевую соду, раствор потемнеет (пить такой чай, конечно, не следует). Чай же из цветков каркаде дает намного более яркие цвета.
Индикатором являются и обычные чернила, которые под влиянием кислоты изменяют окраску с фиолетовой на зеленую, и вновь приобретают фиолетовую окраску при нейтрализации кислоты
3. Роль природных индикаторов в нашей жизни.
Индикаторы позволяют быстро и достаточно точно контролировать состав жидких сред, следить за изменением их состава или за протеканием химической реакции.
В растениях много природных пигментов, природных индикаторов, большая часть которых относится к антоцианам. Так как антоцианы обладают хорошими индикаторными свойствами, то их можно применять как индикаторы для идентификации кислотной, щелочной или нейтральной среды, как в химии, так и в быту.
Природные индикаторы находят применение во многих областях человеческой деятельности: в медицине и экологии, в сельском и народном хозяйстве, в пищевой промышленности и в быту. Антоцианы применяются в косметике, в производстве пищевых продуктов. Красящие вещества растений обладают многообразными лечебными эффектами и благотворно влияют на организм человека. Антоцианы являются мощными антиоксидантами, которые сильнее в 50 раз витамина С. Они способствуют быстрому выведению радиоактивных элементов из организма, оказывают защитное действие на сосуды, помогают снизить уровень сахара в крови, улучшают память. Поэтому овощи и фрукты ярких цветов считаются полезными для организма.
В сельском хозяйстве антоцианы применяются для определения кислотности почвы, ведь от неё зависит урожайность.
Индикаторы помогают определять среду растворов различных средств бытовой химии и косметических средств, удалять пятна растительного происхождения. Даже дома на кухне мы применяем свойства растительных индикаторов – добавляем кислоту для цвета борща. А йодом можно проверить натуральность сметаны.
Практическая часть.
В качестве природных индикаторов были отобраны ягоды клюквы, чёрной смородины, малины, моркови, свеклы, клубники, раствор приправы карри, черный чай (приложение 1).
Определение наличия антоцианов в исследуемых объектах.
Исследуемый материал порезать или потереть, затем прокипятить, так как это приводит к разрушению мембран клеток, и антоцианы свободно выходят из клеток, окрашивая воду.
Растворы наливают в прозрачную посуду и добавляют в одну порцию раствор соды, а в другую наливают уксус. Если окраска изменится под их воздействием, значит, продукты содержат антоцианы и они особенно полезны.
Результаты определения занесены в таблицу (приложение 2).
Опыт 1. Методика изготовления индикаторов из природного сырья
Цель: приготовление вытяжки антоцианов.
Чтобы изучить свойства природных индикаторов мы выбрали несколько известных растений, которые содержат антоцианы. Для проведения опытов сделали отвары из клюквы, чёрной смородины, малины, моркови, свеклы, клубники, раствор приправы карри, заварили пакетик чая.
Ход опыта: Для приготовления отваров брали 200 грамм растительного сырья, морковь и свеклу нужно было натереть на тёрке, наливали в кастрюльку воды, закладывали растительное сырьё и кипятили в течении одной минуты.
Наблюдение: происходит окрашивание раствора.
Вывод: Цвет раствора убеждает в том, что антоцианы – водорастворимые пигменты.
Получив растворы индикаторов, мы проверили, какую окраску они имеют в разных средах.
Опыт 2 Исследование чувствительности растворов растительных индикаторов на изменение рН среды.
Цель: выяснить, какие природные индикаторы обладают высокой чувствительностью.
Оборудование: образцы природных индикаторов используемых в предыдущих опытах, щелочной раствор соды, уксусная кислота; пробирки.
Ход опыта: Во все образцы добавляем кислоту и раствор соды.
Наблюдение: Из растительных индикаторов наиболее контрастные изменения получены у клюквы, чёрной смородины, краснокочанной капусты.
Выводы: при анализе полученных результатов мы увидели, что все полученные отвары растений, кроме отвара моркови изменяли цвет, реагируют на ту или иную среду.
Лучшие результаты показали отвары чёрной смородины, малины, клюквы, чай и сок листка орхидеи.
Опыт 3. Определение рН среды пищевых продуктов.
Цель: с помощью полученных индикаторов исследовать кисло-молочные продукты.
Оборудование: образцы молока, сметаны, отвары чёрной смородины, малины, клюквы, чая, сок листка орхидеи, универсальная индикаторная бумагу, пробирки.
Ход опыта: В образцы молока и сметаны добавляем растительные индикаторы.
Наблюдение: Результаты наблюдений занесены в таблицу (приложение 3). Вывод: После проведения опыта было выявлено, что среда сметаны является кислотной, а среда молока – нейтральной.
Опыт 4. Вода и сок в одной бутылке (химические индикаторы).
Цель: использование индикаторов для проведения занимательных опытов
Оборудование: химические стаканы, фенолфталеин, растворы пищевой соды и уксусной кислоты.
Фенолфталеин краснеет в щелочах и солях с преобладающими щелочными свойствами. Сода (двууглекислый натрий) как раз и есть такая соль. Она образована очень слабой угольной кислотой и сильной щелочью – едким натром. Кислоты разрушают эту окраску, поэтому при переливании окрасившегося от соды раствора в стакан с уксусной кислотой он снова обесцветился.
Вывод: фенолфталеин применяется в химических лабораториях, служа для указания появления и исчезновения щелочной реакции растворов. Как и лакмус, он, следовательно, является химическим индикатором.
Выводы:
Изучив литературу по теме, мы самостоятельно изготовили индикаторы из растительного сырья в домашних условиях. Оказалось, что чаще всего используемые индикаторы относятся к кислотно-основной группе индикаторов. И они необходимы для определения среды растворов. Так как, попадая в кислую или щелочную среду, индикаторы меняют свой цвет.
В растениях существуют особые вещества – пигменты, которые отвечают за окраску растений. К ним относятся антоцианы. Растения с этими веществами могут проявлять свойства кислотно-основных индикаторов. Приготовив природные индикаторы, мы убедился в этих свойствах некоторых растений. В результате эксперимента мы узнали, что почти все вещества, из приготовленных нами в домашних условиях (клюква, чёрная смородина, малина, свекла, клубника, приправа карри, чай), можно использовать как индикаторы. Но отвар из моркови нежелательно использовать как индикатор, потому что его изменения незначительны.
Природные индикаторы также точны, как и химические. Самые лучшие результаты были получены при помощи чёрной смородины, малины, клюквы, чая и сок листка орхидеи.
Природные индикаторы имеют короткий срок хранения, но зато они безопасны и могут быть изготовлены в домашних условиях.
Индикаторы имеют большое значение. Ведь при помощи их можно определить кислотность продуктов, что я и сделал во втором опыте, определяя кислотность сметаны и молока, а значит можно проверить натуральность продукта, и тем самым обезопасить себя от подделок. Можно определить кислотность почвы для повышения её урожайности.
Заключение
Проведя исследовательскую работу, мы пришли к следующим выводам:
— многие природные растения обладают свойствами кислотно-основных индикаторов, способных изменять свою окраску в зависимости от среды, в которую они попадают;
— растворы растительных индикаторов можно использовать, например, в качестве кислотно-основных индикаторов для определения среды растворов пищевых продуктов в домашних условиях;
По результатам моего исследования были доказаны индикаторные свойства исследуемых объектов. Наблюдается следующая закономерность – все данные природные объекты в кислотной среде преимущественно окрашиваются в красный цвет, а в щелочной среде – в зелено-желтый. И это доказывает, что они действительно содержат антоцианы. Данное исследование нам показало, что в природе существуют такие растительные объекты, которые меняют свою окраску в зависимости от кислотности среды. Поэтому мы можем назвать их природными индикаторами. Изучая данную тему, я узнал много новой и полезной информации для себя. Мне было интересно и познавательно заниматься данным исследованием. Я буду продолжать изучать различные темы и проводить опыты, ведь химия – очень интересная наука!