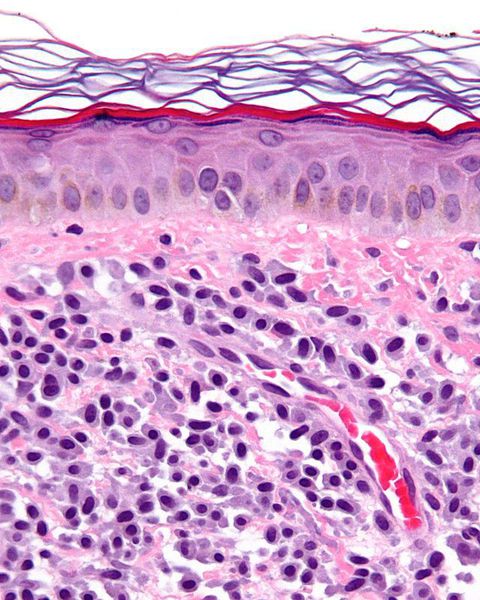
Для чего тучные клетки
Иммунная система Часть 3 Иммунные клетки
Иммунная система Часть 3 Иммунные клетки
В костном мозге основные иммунные клетки рождаются из кроветворной стволовой клетки. Процесс называется гемопоэз – рождение клеток крови. Часть иммунных клеток известна всем как белые клетки крови – лейкоциты. Это большая группа клеток, разделяющаяся во время гемопоэза. Иммунные клетки врожденного иммунитета образовываются непосредственно в тканях и в костном мозге как из стволовых клеток, так и из клеток крови, других клеток кожи и слизистых оболочек.
Гранулоциты
Имеют такое название, поскольку содержат гранулы. Процесс выхода содержимого гранул называется дегрануляция. Вещества гранул обладают токсическим действием, являются регуляторами острого воспаления, приводя к развитию клинических симптомов (отек, зуд, спазм сосудов и т.п.). Составляют основу лейкоцитарной формулы крови.
Нейтрофилы
Эозинофилы
Базофилы
Лейкоцитарная формула (циркуляция в крови)
Во время острого воспалительного процесса нейтрофилы выходят в ткани. Их цель – фагоцитировать и разрушать антигены.
Атакуют крупные микроорганизмы, которые не могут быть поглощены. Источник регуляторов острого воспаления
Работают как тучные клетки тканей, обуславливая аллергическую воспалительную реакцию. Источник регуляторов острого воспаления
Повышаются в крови
При острых бактериальных и грибковых инфекциях; при системных воспалительных заболеваниях; при онкологии костного мозга
При аллергических заболеваниях; при паразитарных заболеваниях; при системных воспалительных заболеваниях.
При аллергических заболеваниях; при онкологических заболеваниях костного мозга
При тяжелой инфекции с развитием сепсиса; при многих вирусных инфекциях; при иммунодефиците и повреждении костного мозга.
При острых бактериальных инфекциях; при болезнях надпочечников.
При острых бактериальных инфекциях.
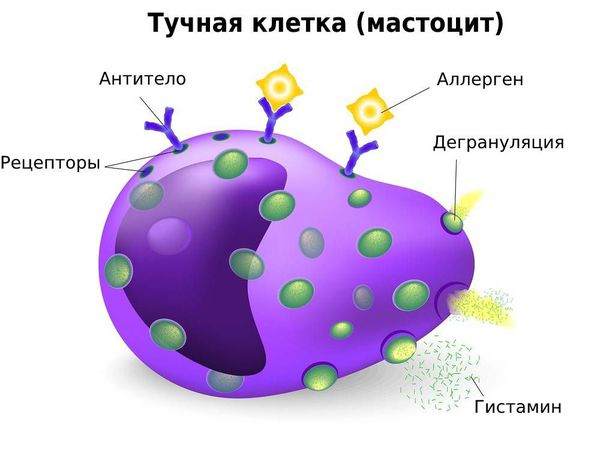
Тучные клетки
Ранее предполагалось, что образуются из базофилов крови, но выявлены их различия. Тучные клетки постоянно живут в тканях, как и базофилы играют ведущую роль в остром аллергическом воспалении.
Естественные клетки-киллеры
Моноциты крови как часть лейкоцитарной формулы (до 8%) коротко циркулируют в крови и в основном преобразуются в тканевые макрофаги (фагоцитирующие клетки), но от 5 до 15% моноцитов лейкоцитарной формулы на самом деле – естественные клетки-киллеры (ЕК-клетки). Они созревают в костном мозге и имеют колоссальное значение в уничтожении зараженных, отработанных и опухолевых клеток, умея распознавать их и участвуя в процессе апоптоза. Это важный компонент безопасной гибели клеток, ограничивающий выход ее содержимого. Также они являются источником некоторых молекулярных компонентов (ИФН-гамма, ИЛ-1, ФНО-альфа).
Антиген-презентирующие клетки
Не являются какой-то одной группой клеток. Скорее это способность многих клеток, обладающих фагоцитозом – процессом поглощения и переваривания антигенов. К ним относят тканевые макрофаги (образующиеся из моноцитов крови), клетки Лангерганса в коже, дендритные клетки, интердигитальные клетки, являющиеся клетками врожденного иммунитета. Для реализации приобретенного иммунитета требуется специальная обработка антигенов и представление их на поверхности клетки в связке с особыми рецепторами – презентация антигена.
Клетки, способные это делать, называют антиген-презентирующие. После поглощения антигена они устремляются в лимфатические узлы для встречи с Т-лимфоцитами. Именно для них нужна презентация антигена, чтобы информацию о нем передать В-лимфоцитам для синтеза антител. Кроме того, антиген-презентирующие клетки выделяют особые молекулы, необходимые для формирования популяций Т-лимфоцитов, определяющих направление иммунного ответа – клеточный или гуморальный.
Для чего тучные клетки
Одним из основных симптомов розацеа является покраснение лица, сопровождающее не только эритематозно-телеангиэктатическую, но и другие формы заболевания. Покраснение может спровоцировать перепад температуры, ультрафиолет, волнение, прием пищи и другие факторы.
Согласно недавнему исследованию, проведенному Национальным обществом розацеа, йогурт, сыр, сметана, соя, дрожжевой экстракт и шоколад являются одними из наиболее распространенных пищевых триггеров, о которых сообщали пациенты с розацеа. Объединяет их всех то, что это — ферментированные продукты с относительно повышенным уровнем гистамина. Гистамин обусловливает повышение проницаемости сосудистой стенки, приток воспалительных элементов, а также явления зуда, сопровождающего розацеа.
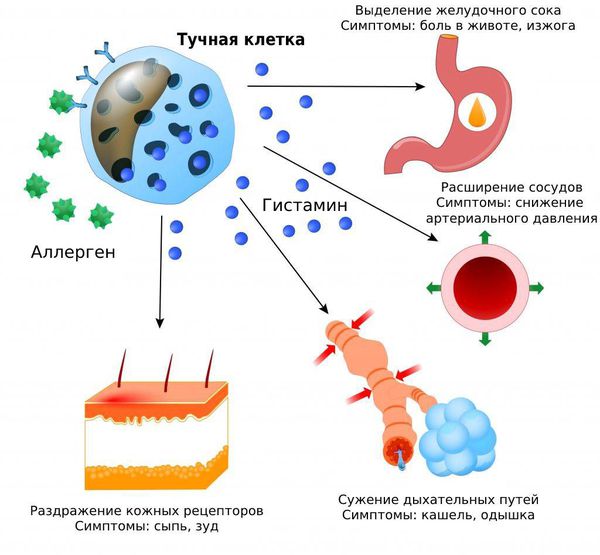
В организме человека основным источником гистамина и других медиаторов, вызывающих вазодилатацию и воспалительную реакцию, являются тучные клетки. Тучные клетки — это одни из клеток иммунной системы, которые располагаются непосредственно в тканях организма, и особенно большое их количество наблюдается в слизистых оболочках и коже — их количество там достигает 10% от всех иммуннокомпетентных клеток. По сути, тучные клетки являются одними из первых клеток иммунной системы, которые взаимодействуют с антигенами и аллергенами окружающей среды, а также с инвазивными патогенами. После активации тучные клетки могут способствовать высвобождению различных медиаторов и оказывать значительное влияние на патофизиологию воспалительных заболеваний.
Недавние исследования показали, что в пораженной коже пациентов с папуло-пустулезной и эритематозно-телангиэктатической формами розацеа количество тучных клеток значительно выше, чем в незатронутой патологией коже. При этом отмечалась положительная корреляция между количеством тучных клеток и продолжительностью розацеа. Хотя нет сообщений о взаимодействии между тучными клетками и другими иммунными клетками, включая макрофаги, нейтрофилы и Т-клетки при розацеа, многие исследования доказали, что тучные клетки могут активироваться другими иммунными клетками или могут активировать соседние клетки посредством высвобождения провоспалительных посредников. Кроме того, бримонидин и ботулинический токсин, которые используются для терапии розацеа, уменьшают приток тучных клеток и ингибируют их дегрануляцию, что, среди прочего, может быть причиной облегчения состояния пациентов. Также в поддержку роли тучных клеток говорят и доклинические исследования доктора Ричарда Галло и его коллег из Калифорнийского университета в Сан-Диего. В их работе использование стабилизатора тучных клеток эффективно уменьшало развитие розацеа-подобного воспаления.
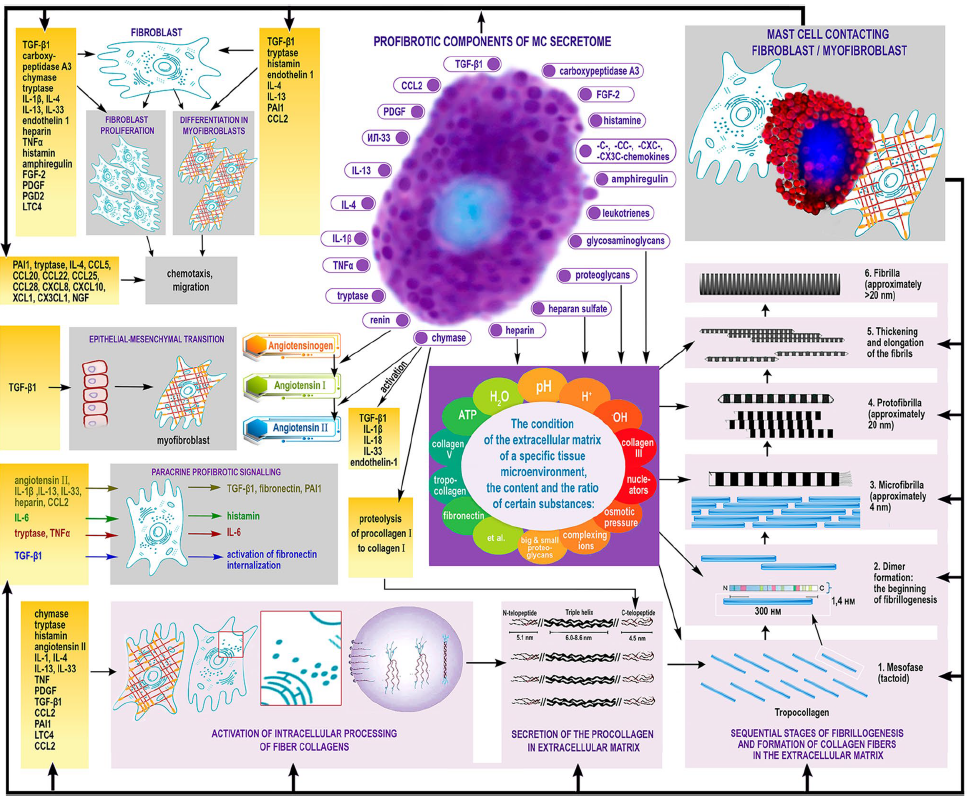
Как говорилось выше, тучные клетки выбрасывают не только гистамин, но и большое количество других активных веществ, среди которых интерлейкин-1, 4, 13, трансформирующий фактор роста (TGF) бета, фактор некроза опухолей (TNF) альфа, фактор роста эндотелия сосудов, протеазы и др. Кроме воспалительных реакций, они также вовлечены в процессы клеточной пролиферации, ангиогенеза и регуляции гомеостаза внеклеточного матрикса. Согласно недавним данным, зафиксировано участие тучных клеток в развитии фиброза в разных органах. Новое исследование немецких подтвердило, что тучные клетки действительно активно вовлечены в синтез коллагена, влияя на процессы образования и организации коллагеновых фибрилл. Это происходит как за счет влияния тучных клеток непосредственно на фибробласты, так и на микросреду, что способствует «сборке» цепей коллагена. Последнее происходит в том числе за счет выделения тучными клетками протеогликанов в непосредственной близости к фибробластам. Морфология образующихся коллагеновых фибрилл сильно зависит от pH среды: увеличение pH от приблизительно нейтрального (6,9-7,4) до слабощелочного (7,6-8,1) приводит к увеличению диаметра фибрилл практически на порядок. В итоге в близком соседстве с тучными клетками формируются длинные и толстые коллагеновые волокна. Кроме того, выделяемые тучными клетками протеазы способны изменять соотношение матриксных металлопротеиназ (ММР) и их тканевых ингибиторов (ТIMP).
Исходя из всего вышесказанного можно заключить, что тучные клетки играют роль не только в развитии эритематозно-воспалительных симптомов розацеа, но и способствуют разрастанию тканей, т.е. прогрессированию в фиброзные формы.
Таким образом использование соединений, регулирующих активность тучных клеток (и особенно с учетом того, что с течением заболевания их концентрация в пораженной коже увеличивается), может быть действительно перспективным направлением терапии данного состояния.
Источники:
Wang L., Wang Y.J., Hao D. et al. The Theranostics Role of Mast Cells in the Pathophysiology of Rosacea. Front Med (Lausanne) 2020; 6: 324.
Gallo R.L. et al. Mast cells are key mediators of cathelicidin-initiated skin inflammation in rosacea. J Invest Dermatol 2014; 134(11): 2728–2736.
Atiakshin D., Buchwalow I., Tiemann M. Mast cells and collagen fibrillogenesis. Histochem Cell Biol 2020;154(1):21–40.
Brown M., O’Reilly S. The immunopathogenesis of fbrosis in systemic sclerosis. Clin Exp Immunol 2019; 195:310–321.
ТУЧНЫЕ КЛЕТКИ
Тучные клетки (син.: гепариноциты, лаброциты, мастоциты, тканевые базофилы) — одна из основных клеточных форм соединительной ткани; характеризуются наличием в цитоплазме обильной метахроматической зернистости и способностью вырабатывать, хранить и выделять биологически активные вещества (гепарин, гистамин и др.).
Тучные клетки и их гранулы впервые описаны в 1877 г. П. Эрлихом; в 1902 — 1906 гг. А. А. Максимов подробно исследовал Тучные клетки у различных животных. В наст. время Тучные клетки выявлены у многих позвоночных животных, в т. ч. у всех млекопитающих. Тучные клетки описаны в большинстве органов, однако наиболее часто они локализуются в рыхлой волокнистой соединительной ткани около мелких сосудов, под эпителием и вблизи желез кожи, слизистых и серозных оболочек, в капсуле и трабекулах паренхиматозных органов, в лимфоидных органах, перитонеальной жидкости.
Количество, распределение и структура Тучных клеток имеют видовые, индивидуальные и возрастные особенности. Размеры Т. к. у человека варьируют от 3,5 до 14 мкм, они бывают веретенообразной или округлой формы (рис. 1). Цитоплазматическая мембрана (плазмолемма) образует складки и микроворсинки. Ядро обычно округлое или овальное. В цитоплазме (см.) расположены мембранные и немембранные органеллы. К мембранным органе л лам относятся эндоплазматическая сеть (см. Эндоплазматический ретикулум), комплекс Гольджи (см. Гольджи комплекс), митохондрии и лизосомы; к немембранным — рибосомы, центриоли, макротрубочки и микрофиламенты. Большая часть цитоплазмы занята гранулами, количество, размеры, структура, хим. состав и тинкториальные свойства к-рых имеют видовые особенности и зависят от степени их зрелости и функционального состояния клетки. Диаметр гранул варьирует от 0,3 до 2 мкм. Основу их составляет комплекс гепарина (см.) и основных белков, к к-рому присоединен гистамин (см.), а у ряда животных серотонин (см.) и дофамин (см. Катехоламины). В Т. к. при участии ферментов арилсульфатазы, сульфат-аденилил-трансферазы синтезируется гепарин — сульфатированный гликозаминогликан. Слабо сульфатированный гепарин локализуется в молодых клетках и обусловливает ортохроматическую окраску гранул; сильно сульфатированный гепарин находят в зрелых клетках, он обусловливает их мета хроматическую окраску (см. Метахромазия). В гранулах могут содержаться и другие гликозаминогликаны — хондроитинсульфаты (см. Хондроитинсерные кислоты), гиалуроновые кислоты (см.), а также гликопротеиды (см.). Кроме основных белков, в Т. к. представлены протеолитические ферменты (химаза и триптаза), а также оксид азы (см.), декарбоксилазы (см.), фосфатазы (см.) и другие. Т. к. могут синтезировать гистамин при участии фермента гистидиндекарбоксилазы, а также поглощают его извне. Гранулы могут иметь фибриллярную, пластинчатую, сетчато-зернистую и кристаллоидную структуру. В формировании гранул Т. к., в частности синтезе белков, участвует эндоплазматическая сеть, а также комплекс Гольджи (см. Гольджи комплекс), где образуются гликозаминогликаны и их комплексы с белками. Вначале в области комплекса Гольджи появляются небольшие (около 70 нм), окруженные мембраной плотные програнулы, к-рые объединяются в вакуоли с общей мембраной. Затем расположенные внутри мембраны програнулы сливаются, образуя рыхлую структуру. В процессе созревания гранулы происходит уплотнение ее содержимого, что определяет полиморфизм структуры гранул в зависимости от степени их зрелости. Зрелые гранулы отличаются от незрелых большей электронной плотностью и гомогенностью (рис. 2).
Одним из способов секреции (выделения) биологически активных веществ Т. к. является дегрануляция (рис. 3), к-рая происходит путем экзоцитоза, являющегося переходной формой к апокриновому типу секреции (см. Железы). Секреция может быть также мерокриновой, т. е. вещества могут выделяться без дегрануляции, и реже голокриновой, сопровождающейся разрушением Т. к. Усиленная дегрануляция является показателем повышенной функциональной активности Т. к. и наблюдается при действии многих физических, химических и биологических факторов. Обычно дегрануляция сопровождается процессом восстановления гранул.
Происхождение Тучных клеток окончательно не установлено. Предполагают, что они развиваются из лимфоцитоподобного костномозгового предшественника. Популяция Т. к. обновляется медленно. Т. к. имеют низкую пролиферативную активность. В полностью гранулированных Т. к. митозы (см. Митоз) встречаются редко, чаще — в менее гранулированных клетках. Способность Т. к. к пролиферации связана с их секреторной активностью. Существует обратная зависимость между количеством Т. к. и базофилов в крови: так, у крыс, мышей при высоком содержании Т. к. базофилы в крови отсутствуют, у морских свинок, кроликов, птиц при малом содержании Т. к. в крови отмечается большое количество базофилов. Т. к. отличаются от базофилов крови происхождением, строением и функцией. Количество, структура и функциональная активность Т. к. зависят от возраста и нейрогормонального статуса организма. Отмечено влияние на Т. к. гормонов гипофиза (соматотропного, тиреотропного и адренокортикотропного), щитовидной железы (тироксина), поджелудочной железы (инсулина), половых гормонов (эстрогенов, прогестерона, тестостерона).
Функции Т. к. многообразны. Они участвуют в развитии воспаления, регуляции свертывания крови, жировом обмене, обеспечивают постоянство состава соединительной ткани, влияя на микроциркуляторное русло (см. Микроциркуляция), образование и проницаемость основного вещества, на размножение, миграцию и функцию фибробластов (см. Соединительная ткань), макрофагов (см.), эндотелиоцитов (см. Эндотелий), лейкоцитов (см.), а также на иммунные реакции.
Роль тучных клеток в аллергии
Тучные клетки, так же как и базофилы, являются основными клетками-мишенями аллергической реакции. Они вовлекаются в аллергическую реакцию посредством соединения фиксированных на клеточной мембране аллергических антител (реагинов), преимущественно принадлежащих к IgE (см. Иммуноглобулины), с аллергеном. Это приводит, по мнению И. С. Гущина, Б. Увнеса, Джонсона (A. R. Johnson) и Морана (N. С. Moran), к активации Т. к. и высвобождению из них разнообразных биологически активных веществ, к-рые, действуя на другие клетки и ткани, вызывают внешние проявления реакции гиперчувствительности немедленного типа, или химергической аллергической реакции (см. Медиаторы аллергических реакций). Таким образом, реакция Т. к. является обязательным и важнейшим звеном аллергических реакций, лежащих в основе анафилаксии (см.), неинфекционно-аллергической бронхиальной астмы (см.), аллергических ринитов (см. Ринит), конъюнктивитов (см.), отека Квинке (см. Квинке отек), крапивницы (см.) и других проявлений атопии (см.).
Имеются сведения, что Т. к. могут принимать участие и в реакциях гиперчувствительности замедленного типа, благодаря способности антигенспецифических Т-лимфоцитов при взаимодействии с антигеном выделять лимфокины (см. Медиаторы клеточного иммунитета), вызывающие в свою очередь активацию Т. к. и высвобождение из них медиаторов и других биологически активных веществ.
Избирательная фиксация IgE-антител на Тучных клетках объясняется присутствием в их цитоплазматической мембране специфических для IgE рецепторов (ок. 300 000 рецепторов на одну Т. к.). За связывание IgE с рецепторами ответственны участки в области С84-домена молекулы IgE. Рецептором для IgE является гликопротеид с мол. весом (массой) порядка 50 000. Для активации Т. к. необходимо соединение между собой соседних, расположенных на мембране Т. к., молекул IgE-антител молекулой антигена, к-рая должна иметь для этого не менее двух валентностей. Моновалентные антигены не активируют Т. к., но тормозят активацию, вызванную мульти-валентными антигенами. Связывание антигенными мостиками IgE-антител приводит к сближению последних на клеточной мембране и, соответственно, к сближению мембранных рецепторов IgE-антител, что является толчком к активации Т. к. Не исключено, что активация Т. к. осуществляется путем взаимодействия участков С83-домена, открывающихся в структурно измененной молекуле IgE-антитела, с участками клеточной мембраны, отличными от рецепторов для IgE.
По данным, полученным с помощью фазово-контрастной микроскопии, реакция сенсибилизированных Т. к. на антиген морфологически проявляется в увеличении их размера, «вскипании» клетки, к-рое сопровождается утратой цитоплазматических гранул в результате дегрануляции или гранулолизиса, потерей четкости очертаний клетки, что может быть принято за ее разрушение. Об отсутствии разрушения Т. к. при аллергической реакции свидетельствует то, что при дегрануляции из них не высвобождаются АТФ, лактат-дегидрогеназа и предварительно введенные в клетки радиоактивные калий (42K) или хром (51Cr), как это происходит при заведомо цитотоксических воздействиях.
За счет образования видимых сообщений и зон повышенной проницаемости цитоплазматической мембраны содержащиеся во внеклеточной среде ионы Na + усиленно поступают в вакуоли и вытесняют биогенные амины (см. Медиаторы аллергических реакций), соединенные ионной связью с белками гранулярного матрикса.
Наряду с высвобождением из Т. к. гистамина, серотонина, эозинофильного хемотаксического фактора — ECF-A (англ. eosinophilic chemotactic factor of anaphylaxis), нейтрофильного хемотаксического фактора — NCF (англ. neutrophil chemotactic factor), содержащихся в гранулах Т. к. в предсуществующей (предобразованной) форме, происходит активация ферментов и образуются такие медиаторы, как медленно реагирующая субстанция анафилаксии SRS-A (англ. slow-reacting substance of anaphylaxis), фактор, активирующий тромбоциты — PAP (англ. platelet activating’ factor), и липидные хемотаксичоские факторы.
Из фосфолипидов клеточной мембраны активированных Тучных клеток высвобождается арахидоновая кислота (см.). В результате окислительного превращения арахидоновой к-ты, катализируемого циклооксигеназой (циклооксигеназный путь), образуются простагландины и тромбоксаны (см. Простагландины). Окислительное превращение арахидоновой к-ты, катализируемое липокспгеназой (липоксигеназныи путь), приводит к образованию гидроксиэйкозатетраеновых к-т, обладающих гуморальной и клеточной активностью: они оказывают хемотаксическое действие на эозииофилы, усиливают сродство клеточных мембранных рецепторов к СЗЬ компоненту комплемента (см.), стимулируют активность аденилат- и гуанилатциклаз. Кроме того, в результате окислительного превращения арахидоновой к-ты по липоксигеназному пути образуются лейкотриены. Полагают, что лейкотриены С4 (ЛТС4), Дд (ЛТДл) и Е4 (JITEj) представляют собой SRS-A, поэтому ингибиторы лииоксигеиазы тормозят высвобождение SRS-A из тучных клеток и оказывают тем самым противоаллергическое действие.
Дегрануляция Т. к. и высвобождение из них медиаторов находятся под частичными контролем системы циклических нуклеотидов: циклического 3′,5′-АМФ (цАМФ) и циклического 3′,5′-гуанозинмоно-фосфата (цГМФ). Увеличение внутриклеточного содержания цАМФ ослабляет, а увеличение содержания цГМФ усиливает секрецию медиаторов. Однако в регуляции аллергической реакции Т. к. система аденилатциклаза — цАМФ имеет относительное значение. Аденилатциклаза Т. к. может быть стимулирована простагландинами Е (ПГЕ), гистамином и в значительно меньшей степени, чем в других клетках, стимуляторами Р-адренергических рецепторов. Противоаллергическое действие ингибиторов фосфодиэстеразы можно частично объяснить торможением выброса медиаторов из Т. к. за счет повышения содержания в клетках цАМФ.
Доказательство нецитотоксической природы дегрануляции Т. к. обосновало новый принцип подхода к контролю за аллергическими реакциями, состоящий в стабилизации этих клеток и торможении их функции. Противоаллергический препарат интал обладает стабилизирующим действием на Т. к. и тормозит высвобождение из них медиаторов в ответ на аллерген.
Библиогр.: Адо А. Д. Общая аллергология, М., 1978;
Гущин И. С. Немедленная аллергия клетки, М., 1976; Елисеев В. Г. Соединительная ткань, с. 115, М., 1961; Серов В. В. и Шехтер А. Б. Соединительная ткань, с. 62, М., 1981; Хрущов Н. Г. Функциональная цитохимия рыхлой соединительной ткани, М., 1969; Юрина Н. А. и Радостина А. И. Тучные клетки и их роль в организме, М., 1977; Asboe-Hansen О. The mast cell, Int. Rev. Cytol., v. 3, p. 399, 1954; Boot J. R. a. o. The anti-allergic activity of Benoxaprofen [2-(4-Chloropheny])-a-Methyl-5-Benzoxazole acetic acidj-a lipoxygenase inhibitor, Int. Arch. Allergy, v. 67, p. 340, 1982; Fernex M. The mast-cell system, its relationship to atherosclerosis, fibrosis and eosinophils, Baltimore, 1968; Goetzl E. J. Mediators of immediate hypersensitivity derived from arachidonic acid, New Engl. J. Med., v. 303, p. 822, 1980; Ishizaka T. Membrane events in triggering mast cells for IgE-mediated histamine release, в кн.: Advanc. allerg. clin. immunol., ed. by A. Oehling a. о., p. 157, Oxford a. o., 1979; Laglinoff D. a. Chi E. Y. Cell biology of mast cells and basophils, в кн.: Cell biology of inflammation, ed. by G. Weiss manii, p. 217, Amsterdam — N. Y., 1980; Maximоw A. A. Bindegewebe und blutbildende Gewebe, Handb. d. mikr. Anat. d. Menschen, hrsg. v. W. Mollendorff, Bd 2, T. 1, S. 232, B., 1927; Rileу J. F. The mast cells, Edinburgh — L., 1959; Schauer A. Die Mastzelle, Stuttgart, 1964; Sedwick J. D., Holt P. G. a. Turner K. J. Production of a histamine-releasing lymphokine by antigen-or mitogen-stirnulated human peripheral T cells, Clin. exp. Immunol., v. 45, p. 409, 1981; Selye H. The mast cells, Washington, 1965; Velican C. a- Velican D. Histogenesis of mast cells, Folia histochem. cytochem., v. 1, p. 433, 1963; WassermanS. I. The lung mast cell, its physiology and potential relevance to defense of the lung, Environ. Hltii Perspect., v. 35, p. 153, 1980.
H. А. Юрина; И. С. Гущин (алл.).
Что такое мастоцитоз у взрослых? Причины возникновения, диагностику и методы лечения разберем в статье доктора Потапенко В. Г., гематолога со стажем в 15 лет.
Определение болезни. Причины заболевания
Тучные клетки — разновидность белых клеток крови, которые возникают в костном мозге. В норме они не выходят в кровоток, а находятся в соединительной ткани.
Распространённость
Симптомы мастоцитоза у взрослых
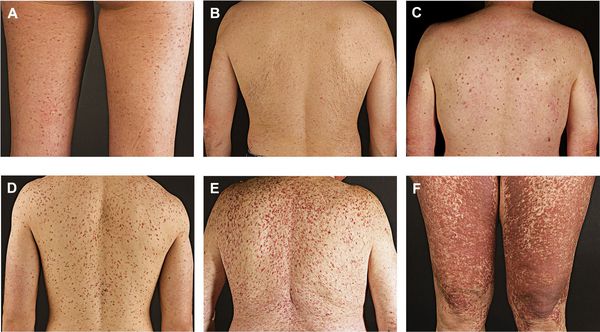
Мастоцитоз может быть агрессивным и вялотекущим. Люди гораздо чаще болеют медленными, вялотекущими формами мастоцитоза. Симптомы бывают кожными и системными.
Кожные симптомы
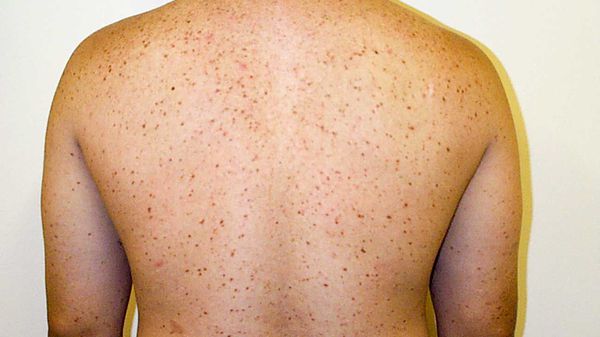
Основное проявление болезни — типичная сыпь и аллергоподобные проявления, например зуд, отёк и покрасненияе. Пятен бывает немного, но иногда они покрывают всё тело.
Системные симптомы
При мастоцитозе возможны следующие системные проявления:
Патогенез мастоцитоза у взрослых
Тучные клетки относятся к долгоживущим клеткам, их мало и делятся они очень медленно. Регулируется деление с помощью специального вещества — фактора роста стволовых клеток. Этот фактор передаёт сигнал к делению в тучную клетку с помощью специального вещества-передатчика — фермента тирозинкиназы KIT, который находится в клеточной стенке.
Как работают тучные клетки при мастоцитозе
Медиаторы привлекают другие клетки иммунной системы для защиты организма. Например, гистамин расширяет сосуды и повышает их проницаемость, за счёт этого иммунные клетки могут попасть в очаг воспаления.
При мастоцитозе наблюдается постоянная дегрануляция, при которой в кровь выбрасывается небольшое количество гистамина. Процесс резко усиливается, когда в организм попадают патогены, аллергены или действуют другие провоцирующие факторы: физическая нагрузка, укусы насекомых, пищевые продукты, волнение, страх, приём алкоголя или некоторых лекарств и др.
Из-за избытка тучных клеток происходит массивный выброс гистамина и других медиаторов. Именно воздействие медиаторов воспаления является причиной многих симптомов мастоцитоза.
Как влияет выброс гистамина:
При агрессивном течении мастоцитоза тучные клетки начинают вытеснять из костного мозга здоровые клетки, вырабатывающие эритроциты. Когда эритроцитов становится мало, падает уровень гемоглобина — основного переносчика кислорода от лёгких к тканям. Поэтому его недостаток сопровождается симптомами анемии.
Классификация и стадии развития мастоцитоза у взрослых
Мастоцитоз может быть кожным и системным:
Классификация по агрессивности заболевания. Определение агрессивности мастоцитоза проводится по типичным лабораторным В и С-находками:
1. В-находки означают доброкачественное течение. То есть состояние не опасно для жизни, но в дальнейшем может потребоваться цитостатическое лечение. Буква «В» от английского «be careful, borderline, benign» — будьте внимательны, пограничное доброкачественное состояние. К В-находкам относятся:
2. С-находки — признак агрессивного течения. Они означают, что пора проводить противоопухолевое лечение. Буква «С» от английского «consider, chemotherapy, cytoreduction» — необходимо рассматривать химиотерапию и циторедукцию. С-находки:
Формы мастоцитоза:
Неагрессивные формы, которые протекают более доброкачественно:
Отдельно выделяют мастоцитоз, ассоциированный с другими заболеваниями крови, который бывает как доброкачественным, так и агрессивным.
Осложнения мастоцитоза у взрослых
К тяжёлым осложнениям мастоцитоза относятся нарушения работы вовлечённых органов и тканей.
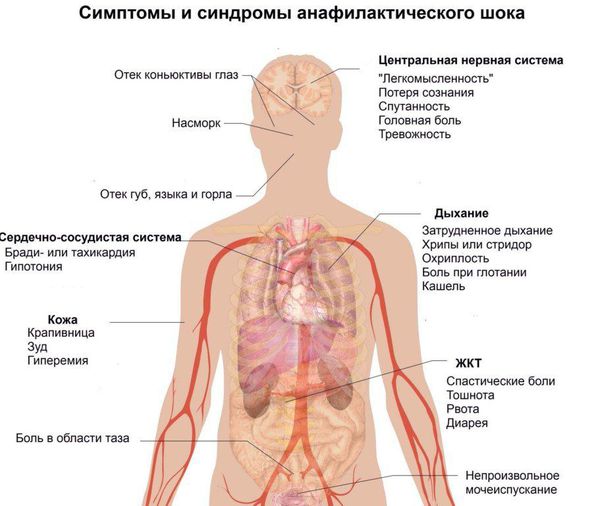
При шоке сразу падает артериальное давление, больной стремительно слабеет, может потерять равновесие, упасть и получить тяжёлую травму. Кроме того, резкое падение артериального давления иногда запускает целый каскад фатальных, неизбежных реакций в организме со стороны всех органов и систем, который может привести к гибели.
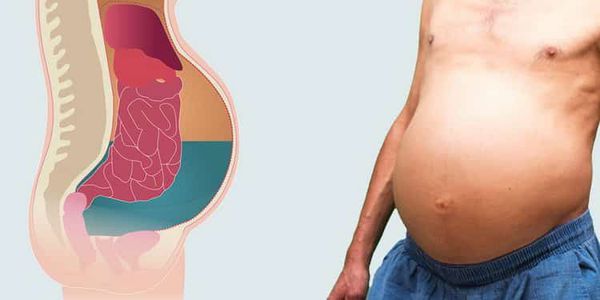
Разрыв селезёнки. Без лечения селезёнка может чрезмерно увеличиться и разорваться. Ушить такой разрыв невозможно — необходимо экстренно удалять селезёнку, иначе больной погибнет от кровопотери.
Желудочно-кишечные кровотечения. Поражение печени проявляется по-разному. Оно может быть лёгким, и это видно только по изменению активности печёночных ферментов в анализе крови, или значительным, когда кровь плохо проходит через печень. Нарушение кровотока приводит к появлению жидкости (асцита) в брюшной полости и к расширению вен, обеспечивающих ток крови в обход поражённой печени. Такое расширение вен называют портальной гипертензией. Расширяются вены пищевода, прямой кишки и передней брюшной стенки, что может осложниться кровотечением из них.
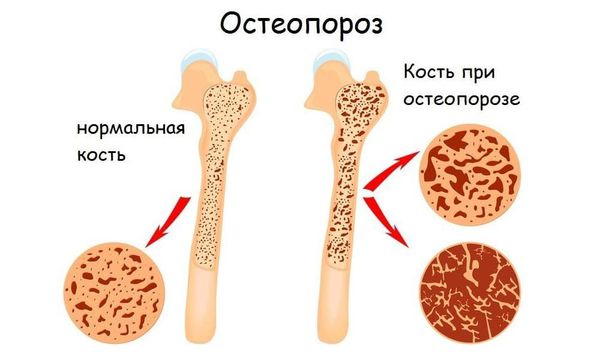
Переломы. Поражение костей при мастоцитозе может привести к сложным переломам, в том числе позвонков, что вызовет хроническую боль. Таким пациентам будет необходима помощь травматолога-ортопеда.
Замещение ткани костного мозга опухолевой тканью. Это приводит к снижению количества клеток крови:
Диагностика мастоцитоза у взрослых
Количество диагностических мероприятий напрямую зависит от агрессивности мастоцитоза и жалоб пациента. При изолированном кожном поражении обычно выполняют только биопсию кожи, а при агрессивных формах проводят весь спектр исследований, вплоть до молекулярно-генетических анализов.
Осмотр. Сыпь считают основным признаком мастоцитоза. Высыпания обычно представляют собой пигментные пятна диаметром 3-5 мм, иногда больше. Обращают внимание на кожный симптом Дарье — Унны.
Иммуногистохимическое исследование. Тучные клетки могут быть в избытке и при некоторых других состояниях. Отличить здоровые клетки от опухолевых помогает иммуногистохимическое исследование. Это анализ выполняют по фрагменту (биоптату) органа или ткани, в котором подозревают мастоцитоз.
Определение мутации гена KIT. При агрессивном течении мастоцитоза проводят противоопухолевое лечение. Выбор терапии зависит от мутации гена KIT, поэтому всем пациентам с агрессивным течением необходимо определить мутацию гена.
Биохимические анализы. При мастоцитозе определяют уровень триптазы в крови. Это фермент, содержащийся в гранулах тучных клеток, и его концентрация может повышаться при мастоцитозе, достигая больших значений. По колебаниям концентрации триптазы можно оценивать и эффективность проводимого лечения.
Дополнительные исследования. Все остальные диагностические мероприятия так или иначе аналогичны диагностике при других заболеваниях крови. Обычно всем пациентам делают УЗИ брюшной полости, клинический и биохимический анализ крови.
Мастоцитоз часто связан с другими заболеваниями крови, поэтому при выявлении анемии, выраженного увеличения лимфатических узлов, изменений картины крови необходимо выполнить биопсию лимфоузла и/или костного мозга. В редких случаях диагноз могут поставить лишь после удаления селезёнки.
Лечение мастоцитоза у взрослых
Симптоматическая терапия
Симптоматическое лечение направлено на профилактику приступов и уменьшение симптомов мастоцитоза. Как правило, пациенты сами знают, какие факторы вызывают приступы болезни, и избегают их.
Чтобы снизить негативное влияние медиаторов на организм и уменьшить частоту и тяжесть приступов, необходим постоянный приём антигистаминных препаратов и стабилизаторов мембран тучных клеток:
Пациенты обычно хорошо переносят лечение антигистаминными средствами и стабилизаторами мембран тучных клеток, поэтому они подходят для длительного, в том числе многолетнего, приёма.
Чтобы справиться с изжогой, применяют антигистаминные препараты, действующие в желудочно-кишечном тракте: фамотидин, ранитидин.
Правильно подобранное симптоматическое лечение позволяет пациенту чувствовать себя лучше и жить полной жизнью.
Цитостатическое лечение
Трансплантация аллогенных гемопоэтических стволовых клеток — единственный метод, который может излечить мастоцитоз. Однако процедура сопряжена с рисками, поэтому её можно применять только в ситуации, когда все остальные способы терапии уже испробованы.
Прогноз. Профилактика
Предупредить развитие болезни невозможно, хотя для большинства пациентов с мастоцитозом прогноз благоприятный. Длительность жизни больных с неагрессивным течением такая же, как у людей без мастоцитоза. В этом случае лечение направлено на сокращение (купирование) симптомов и профилактику осложнений.
Если мастоцитоз агрессивен, то проводят и симптоматическое, и противоопухолевое лечение. Эффективная терапия позволяет уменьшить риск осложнений, улучшить качество жизни пациентов и продлить их полноценную жизнь на многие годы.