Для чего в жизни нужны изотопы
Как применяют радиоактивные изотопы
Содержание статьи
Применение в медицине
Данные вещества на сегодня нашли большое применение в различных прикладных областях, в частности, в медицине. Они используются как для лечения, так и для диагностики заболеваний.
Например, в качестве терапии Базедовой болезни щитовидной железы используется радиоактивный йод-131. В данном случае рекомендуется вводить большие дозы этого элементы, так как они способствуют разрушению аномальных тканей, вследствие чего структура органа восстанавливается, а с ним и функция. Йод широко применяется и для диагностики состояния щитовидной железы. При введении его в организм на экране монитора оценивается скорость отложения в клетках, на основании чего ставится диагноз.
Для диагностики нарушений кровообращения большую роль играют изотопы натрия.
Наиболее часто в повседневной жизни для лечения опухолевых заболеваний применяются изотопы кобальта, в частности кобальт-60. Он нашел применение в радиохирургии при создании“кобальтовых пушек, в дезинфектологии для стерилизации медицинского инструментария, материалов.
В целом все методы исследования внутренних органов с помощью подобных элементов принято называть радиоизотопными. Изотопы могут применяться и для получения полезных микроорганизмов. А те являются основой синтезирования антибактериальных средств.
Использование в промышленности и сельском хозяйстве
Большое значение имеют радиоактивные изотопы и в других сферах деятельности человека. В машиностроительной отрасли с их помощью определяют степень износа различных деталей в двигателях.
По ним можно определять скорость диффузии металлов в доменных печах.
Важное направление – это дефектоскопия. При помощи подобных химических элементов можно исследовать структуру деталей, в том числе металлических.
При помощи радиоактивных изотопов создают новые сорта сельскохозяйственных растений. Кроме того, научно доказано, что гамма-облучение способствует повышению урожайности культур, повышает их устойчивость к неблагоприятным факторам. Широкое применение эти вещества нашли в селекции. При удобрении растений используют способ, при котором их помечают радиоактивным фосфором и оценивают эффективность удобрений. В силу всего можно сделать вывод о том, что радиоактивные изотопы применяются вот многих сферах деятельности. Они обладают свойствами, которых нет у тех же элементов с нормальной атомной массой.
Применения изотопов
Изотопы, особенно радиоактивные, имеют многочисленные применения. В табл. 1.13 указаны отдельные примеры некоторых промышленных применений изотопов. Каждая методика, упоминаемая в этой таблице, используется также и в других отраслях промышленности. Например, методика определения утечки вещества с помощью радиоизотопов используется: в производстве напитков-для определения утечки из накопительных баков и трубопроводов; в строительстве инженерных сооружений-для
Таблица 1.13. Некоторые применения радиоизотопов
Стерилизованный слабым источником радиоактивного излучения самец мухи цеце маркируется для последующего обнаружения (Буркина-Фасо). Эта процедура является частью эксперимента, проводимого для изучения мухи цеце и установления эффективных мер контроля, препятствующих широкому распространению трипаносомоза (сонной болезни). Муха цеце является переносчиком этого заболевания и заражает им людей, домашних животных и дикий скот. Сонная болезнь чрезвычайно распространена в некоторых частях Африки.
определения утечки из подземных водоводов; в энергетической промышленности-для определения утечки из теплообменников на электростанциях; в нефтяной промышленности-для определения утечки из подземных нефтепроводов; в службе контроля сточных и канализационных вод-для определения утечки из магистральных коллекторов.
Изотопы также широко используются в научных исследованиях. В частности, они используются для определения механизмов химических реакций. В качестве примера укажем использование воды, меченной устойчивым изотопом кислорода 18O, для изучения гидролиза сложных эфиров, подобных этилацетату (см. также разд. 19.3). С использованием масс-спектрометрии для обнаружения изотопа 18O было установлено, что при гидролизе атом кислорода из молекулы воды переходит в уксусную кислоту, а не в этанол
Радиоизотопы широко используются в роли меченых атомов в биологических исследованиях. Для того чтобы прослеживать метаболические пути * в живых системах, используют радиоизотопы углерод-14, тритий, фосфор-32 и сера-35. Например, усвоение фосфора растениями из обработанной удобрениями почвы можно проследить, пользуясь удобрениями, которые содержат примесь фосфора-32.
Радиационная терапия. Ионизирующее излучение способно разрушать живые ткани. Ткани злокачественных опухолей более чувствительны к облучению, чем здоровые ткани. Это позволяет лечить раковые заболевания при помощи у-лучей, испускаемых из источника, в качестве которого используется радиоактивный изотоп кобальт-60. Излучение направляют на пораженный опухолью участок тела больного; сеанс лечения длится несколько минут и повторяется ежедневно в течение 2-6 недель. Во время сеанса все остальные части тела больного должны быть тщательно закрыты непроницаемым для излучения материалом, чтобы предотвратить разрушение здоровых тканей.
Определение возраста образцов при помощи радиоуглерода. Небольшая часть того диоксида углерода, который находится в атмосфере, содержит радиоактивный изотоп ‘бС. Растения поглощают этот изотоп в процессе фотосинтеза. Поэтому ткани всех
Радиоизотопы используются для наблюдения за механизмами осаждения наносов в устьях рек, портах и доках.
Использование радиоизотопов для получения фотографического изображения камеры сгорания реактивного двигателя в Центре неповреждающих испытаний лондонского аэропорта Хитроу. (На плакатах надписи: Радиация. Не подходить.) Радиоизотопы широко используются в промышленности для проведения неповреждающих испытаний.
Метод радиоуглеродной датировки позволил установить, что образцы древесного угля из Стоунхенджа имеют возраст около 4000 лет.
Радиоуглеродный метод геохронологии разработал в 1946 г. У.Ф. Либби, получивший за него Нобелевскую премию по химии в 1960 г. Этот метод широко используется в настоящее время археологами, антропологами и геологами для датировки образцов, имеющих возраст вплоть до 35000 лет. Точность этого метода-приблизительно 300 лет. Наилучшие результаты получаются при определении возраста шерсти, семян, ракушек и костей. Для определения возраста образца измеряют активность р-излучения (число распадов в минуту) в расчете на 1 г содержащегося в нем углерода. Это позволяет установить возраст образца при помощи кривой радиоактивного распада для изотопа 14С.
Какой возраст имеют Земля и Луна?
Метод датировки по калию и аргону. Такие минералы, как слюда и некоторые разновидности полевого шпата, содержат небольшое количество радиоизотопа калий-40. Он распадается, претерпевая электронный захват и превращаясь в аргон-40:
Возраст образца определяется на основе вычислений, в которых используются данные об относительном содержании в образце калия-40 по сравнению с арго-ном-40.
Метол датировки по рубидию и стронцию. Некоторые из наиболее древних горных пород на Земле, например граниты с западного побережья Гренландии, содержат рубидий. Приблизительно третья часть всех атомов рубидия приходится на долю радиоактивного рубидия-87. Этот радиоизотоп распадается, превращаясь в устойчивый изотоп стронций-87. Вычисления, основанные на использовании данных об относительном содержании в образцах изотопов рубидия и стронция, позволяют устанавливать возраст таких горных пород.
Метод датировки по урану и свинцу. Изотопы урана распадаются, превращаясь в изотопы свинца. Возраст таких минералов, как апатиты, которые содержат примеси урана, можно определять, сравнивая содержание в их образцах определенных изотопов урана и свинца.
Все три описанных метода использовались для датировки земных горных пород. Полученные в результате данные указывают, что возраст Земли равен 4,6-109 лет. Указанные методы использовались также для определения возраста лунных горных пород, доставленных на Землю из космических экспедиций. Возраст этих пород составляет от 3,2 до 4,2 *10 9 лет.
Мы уже упоминали, что экспериментальные значения изотопных масс оказываются меньше значений, вычисленных как сумма масс всех входящих в ядро элементарных частиц. Разность между вычисленным и экспериментальным значением атомной массы называется дефект массы. Дефект массы соответствует энергии, необходимой для преодоления сил отталкивания между частицами с одинаковым зарядом в атомном ядре и связывания их в единое ядро; по этой причине она называется энергия связи. Энергию связи можно вычислить через дефект массы при помощи уравнения Эйнштейна
где E-энергия, m-масса и с—скорость света.
Энергию связи принято выражать в мегаэлектронвольтах (1 МэВ = 106 эВ) на одну субъядерную частицу (нуклон). Электронвольт-это энергия, которую приобретает или теряет частица с единичным элементарным зарядом (равным по абсолютной величине заряду электрона), перемещаемая между точками с разностью электрического потенциала в 1 В (1 МэВ = 9,6* 10 10 Дж/моль).
Например, энергия связи, приходящаяся на один нуклон, в ядре гелия приблизительно равна 7 МэВ, а в ядре хлора-35 она составляет 8,5 МэВ.
Чем больше энергия связи на один нуклон, тем больше устойчивость ядра. На рис. 1.33 показана зависимость энергии связи от массового числа элементов. Следует обратить внимание на то, что наибольшей устойчивостью обладают элементы с массовым числом, близким к 60. К таким элементам относятся 56Fe, 59Co, 59Ni и 64Cu. Элементы с более низкими массовыми числами могут, по крайней мере с теоретической точки зрения, повышать свою устойчивость в результате увеличения их массового числа. На практике, однако, представляется возможным увеличивать массовые числа только наиболее легких элементов, таких, как водород. (Гелий обладает аномально высокой устойчивостью; энергия связи нуклонов в ядре гелия не укладывается на кривую, изображенную на рис. 1.33.) Массовое число таких элементов увеличивается в процессе, называемом ядерным синтезом (см. ниже).
Рис. 1.33. Зависимость энергии связи от массового числа элемента.
Элементы с большими массовыми числами становятся более устойчивыми в результате уменьшения их массового числа, когда они превращаются в более легкие элементы. Это происходит в процессе расщепления ядер, который называется ядерным делением (см. ниже).
ИЗОТОПЫ
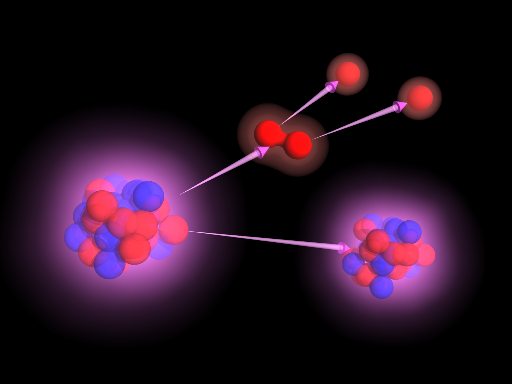
ИЗОТОПЫ – разновидности одного и того же химического элемента, близкие по своим физико-химическим свойствам, но имеющие разную атомную массу. Название «изотопы» было предложено в 1912 английским радиохимиком Фредериком Содди, который образовал его из двух греческих слов: isos – одинаковый и topos – место. Изотопы занимают одно и то же место в клетке периодической системы элементов Менделеева.
Атом любого химического элемента состоит из положительно заряженного ядра и окружающего его облака отрицательно заряженных электронов. Положение химического элемента в периодической системе Менделеева (его порядковый номер) определяется зарядом ядра его атомов. Изотопами называются поэтому разновидности одного и того же химического элемента, атомы которых имеют одинаковый заряд ядра (и, следовательно, практически одинаковые электронные оболочки), но отличаются значениями массы ядра. По образному выражению Ф.Содди, атомы изотопов одинаковы «снаружи», но различны «внутри».
В 1932 был открыт нейтрон – частица, не имеющая заряда, с массой, близкой к массе ядра атома водорода – протона, и создана протонно-нейтронная модель ядра. В результате в науке установилось окончательное современное определение понятия изотопов: изотопы – это вещества, ядра атомов которых состоят из одинакового числа протонов и отличаются лишь числом нейтронов в ядре. Каждый изотоп принято обозначать набором символов 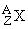
Из всех известных нам изотопов только изотопы водорода имеют собственные названия. Так, изотопы 2 H и 3 H носят названия дейтерия и трития и получили обозначения соответственно D и T (изотоп 1 H называют иногда протием).
В природе встречаются как стабильные изотопы, так и нестабильные – радиоактивные, ядра атомов которых подвержены самопроизвольному превращению в другие ядра с испусканием различных частиц (или процессам так называемого радиоактивного распада). Сейчас известно около 270 стабильных изотопов, причем стабильные изотопы встречаются только у элементов с атомным номером Z Ј 83. Число нестабильных изотопов превышает 2000, подавляющее большинство их получено искусственным путем в результате осуществления различных ядерных реакций. Число радиоактивных изотопов у многих элементов очень велико и может превышать два десятка. Число стабильных изотопов существенно меньше, Некоторые химические элементы состоят лишь из одного стабильного изотопа (бериллий, фтор, натрий, алюминий, фосфор, марганец, золото и ряд других элементов). Наибольшее число стабильных изотопов – 10 обнаружено у олова, у железа, например, их – 4, у ртути – 7.
Открытие изотопов, историческая справка.
В 1808 английский ученый натуралист Джон Дальтон впервые ввел определение химического элемента как вещества, состоящего из атомов одного вида. В 1869 химиком Д.И.Менделеевым была открыт периодический закон химических элементов. Одна из трудностей в обосновании понятия элемента как вещества, занимающего определенное место в клетке периодической системы, заключалась в наблюдаемой на опыте нецелочисленности атомных весов элементов. В 1866 английский физик и химик – сэр Вильям Крукс выдвинул гипотезу, что каждый природный химический элемент представляет собой некоторую смесь веществ, одинаковых по своим свойствам, но имеющих разные атомные масс, однако в то время такое предположение не имело еще экспериментального подтверждения и поэтому прошло мало замеченным.
Важным шагом на пути к открытию изотопов стало обнаружение явления радиоактивности и сформулированная Эрнстом Резерфордом и Фредериком Содди гипотеза радиоактивного распада: радиоактивность есть не что иное, как распад атома на заряженную частицу и атом другого элемента, по своим химическим свойствам отличающийся от исходного. В результате возникло представление о радиоактивных рядах или радиоактивных семействах, в начале которых есть первый материнский элемент, являющийся радиоактивным, и в конце – последний стабильный элемент. Анализ цепочек превращений показал, что в их ходе в одной клеточке периодической системы могут оказываться одни и те же радиоактивные элементы, отличающиеся лишь атомными массами. Фактически это и означало введение понятия изотопов.
Независимое подтверждение существования стабильных изотопов химических элементов было затем получено в экспериментах Дж. Дж. Томсона и Астона в 1912–1920 с пучками положительно заряженных частиц (или так называемых каналовых лучей), выходящих из разрядной трубки.
В 1919 Астон сконструировал прибор, названный масс-спектрографом (или масс-спектрометром). В качестве источника ионов по-прежнему использовалась разрядная трубка, однако Астон нашел способ, при котором последовательное отклонение пучка частиц в электрическом и магнитном полях приводило к фокусировке частиц с одинаковым значением отношения заряда к массе (независимо от их скорости) в одной и той же точке на экране. Наряду с Астоном масс-спектрометр несколько другой конструкции в те же годы был создан американцем Демпстером. В результате последующего использования и усовершенствования масс-спектрометров усилиями многих исследователей к 1935 году была составлена почти полная таблица изотопных составов всех известных к тому времени химических элементов.
Методы разделения изотопов.
Для изучения свойств изотопов и особенно для их применения в научных и прикладных целях требуется их получение в более или менее заметных количествах. В обычных масс-спектрометрах достигается практически полное разделение изотопов, однако количество их ничтожно мало. Поэтому усилия ученых и инженеров были направлены на поиски других возможных методов разделения изотопов. В первую очередь были освоены физико-химические методы разделения, основанные на различиях в таких свойствах изотопов одного итого же элемента, как скорости испарения, константы равновесия, скорости химических реакций и т.п. Наиболее эффективными среди них оказались методы ректификации и изотопного обмена, которые нашли широкое применение в промышленном производстве изотопов легких элементов: водорода, лития, бора, углерода, кислорода и азота.
Другую группу методов образуют так называемые молекулярно-кинетические методы: газовая диффузия, термодиффузия, масс-диффузия (диффузия в потоке пара), центрифугирование. Методы газовой диффузии, основанные на различной скорости диффузии изотопных компонентов в высокодисперсных пористых средах, были использованы в годы второй мировой войны при организации промышленного производства разделения изотопов урана в США в рамках так называемого Манхэттенского проекта по созданию атомной бомбы. Для получения необходимых количеств урана, обогащенного до 90% легким изотопом 235 U – главной «горючей» составляющей атомной бомбы, были построены заводы, занимавшие площади около четырех тысяч гектар. На создание атомного центра с заводами для получения обогащенного урана было ассигновано более 2-х млрд. долл. После войны в СССР были разработать и построены заводы по производству обогащенного урана для военных целей, также основанные на диффузионном методе разделения. В последние годы этот метод уступил место более эффективному и менее затратному методу центрифугирования. В этом методе эффект разделения изотопной смеси достигается за счет различного действия центробежных сил на компоненты изотопной смеси, заполняющей ротор центрифуги, который представляет собой тонкостенный и ограниченный сверху и снизу цилиндр, вращающийся с очень высокой скоростью в вакуумной камере. Сотни тысяч соединенных в каскады центрифуг, ротор каждой из которых совершает более тысячи оборотов в секунду, используются в настоящее время на современных разделительных производствах как в России, так и в других развитых странах мира. Центрифуги используются не только для получения обогащенного урана, необходимого для обеспечения работы ядерных реакторов атомных электростанций, но и для производства изотопов примерно тридцати химических элементов средней части периодической системы. Для разделения различных изотопов используются также установки электромагнитного разделения с мощными источниками ионов, в последние годы получили распространение также лазерные методы разделения.
Применение изотопов.
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем, для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны. Так, в связи с использованием тяжелой воды D2O в ядерных реакторах ее общемировое производство к началу 1990-х прошлого века составляло около 5000 т в год. Входящий в состав тяжелой воды изотоп водорода дейтерий, концентрация которого в природной смеси водорода составляет всего 0,015%, наряду с тритием станет в будущем, по мнению ученых, основным компонентом топлива энергетических термоядерных реакторов, работающих на основе реакций ядерного синтеза. В этом случае потребность в производстве изотопов водорода окажется огромной.
В научных исследованиях стабильные и радиоактивные изотопы широко применяются в качестве изотопных индикаторов (меток) при изучении самых различных процессов, происходящих в природе.
В сельском хозяйстве изотопы («меченые» атомы) применяются, например, для изучения процессов фотосинтеза, усвояемости удобрений и для определения эффективности использования растениями азота, фосфора, калия, микроэлементов и др. веществ.
Стабильные изотопы – на службе здоровья
Спецпроекты ЛГ / На переднем крае науки и техники
Что такое изотопы
При изучении свойств радиоактивных элементов было обнаружено, что у одного и того же химического элемента можно встретить атомы с различной массой ядра. Заряд ядра при этом они имеют одинаковый, то есть это не примеси сторонних веществ, а то же самое вещество. В Периодической системе Менделеева и данный элемент, и атомы вещества с отличающейся массой ядра занимают одну клетку. Таким разновидностям одного и того же вещества было дано название «изотопы» (от греческого isos – одинаковый и topos – место). Итак, изотопы – это разновидности одного и того же химического элемента, различающиеся по массе атомных ядер.
Как известно, ядра атомов состоят из протонов и нейтронов. Ядра некоторых атомов вещества содержат различное количество нейтронов, но одинаковое количество протонов. В самом деле, заряд ядра изотопов одного элемента одинаков, следовательно, количество протонов в ядре одинаково. Ядра различаются по массе, соответственно они содержат разное количество нейтронов.
Изотопы бывают стабильными и нестабильными. На сегодняшний день известно около 270 стабильных изотопов и более 2000 нестабильных. Стабильные изотопы – это разновидности химических элементов, которые могут самостоятельно существовать продолжительное время.
Большая часть нестабильных изотопов была получена искусственным путём. Нестабильные изотопы радиоактивны, их ядра подвержены процессу радиоактивного распада, то есть самопроизвольному превращению в другие ядра, сопровождающемуся испусканием частиц и/или излучений. Практически все радиоактивные искусственные изотопы имеют очень маленькие периоды полураспада, измеряемые секундами и даже долями секунд. Ядро не может содержать произвольное количество нейтронов. Соответственно количество изотопов ограничено. У чётных по количеству протонов элементов количество стабильных изотопов может достигать десяти. Например, олово имеет 10 изотопов, ксенон – 9, ртуть – 7 и так далее.
Те элементы, количество протонов которых нечётно, могут иметь лишь по два стабильных изотопа. У ряда элементов имеется только один стабильный изотоп. Это такие вещества, как золото, алюминий, фосфор, натрий, марганец и другие. Такие вариации по числу стабильных изотопов у разных элементов связаны со сложной зависимостью числа протонов и нейтронов от энергии связи ядра.
Практически все вещества в природе существуют в виде смеси изотопов. Количество изотопов в составе вещества зависит от вида вещества, атомной массы и количества стабильных изотопов данного химического элемента.
Где применяют изотопы
Разнообразные изотопы химических элементов находят широкое применение в научных исследованиях, в различных областях промышленности и сельского хозяйства, в ядерной энергетике, современной биологии и медицине, в исследованиях окружающей среды и других областях. Стабильные изотопы нашли наибольшее применение в химии (для изучения механизма химических реакций, процессов горения, катализа, синтеза химических соединений, в спектрометрии), в биологии, физиологии, биохимии и агрохимии (для изучения процессов обмена веществ в живых организмах, превращения белков, жирных и аминокислот, процессов фотосинтеза в растениях, движения воды от корня по стеблю к листьям и плодам). Они также используются в ядерно-физической аппаратуре для изготовления счётчиков нейтронов, что позволяет увеличить эффективность счёта более чем в 5 раз, в ядерной энергетике как замедлители и поглотители нейтронов. Перечисленное, однако, далеко не исчерпывает все существующие и возможные области использования изотопов. Более того, сфера их использования как эффективных помощников в решении целого ряда научных и прикладных проблем расширяется с каждым годом.
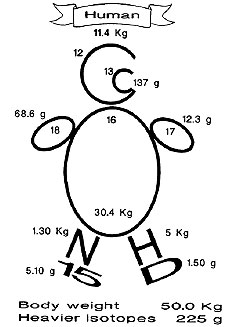
В научных исследованиях (например, в химическом анализе) требуются, как правило, небольшие количества редких изотопов различных элементов, исчисляемые граммами и даже миллиграммами в год. Вместе с тем для ряда изотопов, широко используемых в ядерной энергетике, медицине и других отраслях, потребность в их производстве может составлять многие килограммы и даже тонны.
В биологии изотопы применяют для решения как фундаментальных, так и прикладных биологических проблем, изучение которых другими методами затруднено или невозможно. Существенное для биологии преимущество метода меченых атомов состоит в том, что использование изотопов не нарушает целостности организма и его основных жизненных отправлений. С применением изотопов связаны многие крупные достижения современной биологии, определившие расцвет биологических наук во второй половине XX века. С помощью стабильных и радиоактивных изотопов водорода, углерода, азота, кислорода, фосфора, серы, железа, йода были выяснены и детально изучены сложные и взаимосвязанные процессы биосинтеза и распада белков, нуклеиновых кислот, углеводов, жиров и прочих биологически активных соединений, а также химические механизмы их превращений в живой клетке. Использование изотопов привело к пересмотру прежних представлений о природе фотосинтеза. С помощью изотопов выполнено огромное число исследований в самых разнообразных направлениях биологии и биохимии. Одно из направлений включает работы по изучению динамики и путей перемещения популяций в биосфере и отдельных особей внутри данной популяции, миграции микробов, а также отдельных соединений внутри организма. Вводя в организмы с пищей или путём инъекций метку, удалось изучить скорость и пути миграции многих насекомых (москитов, мух, саранчи), птиц, грызунов и других мелких животных и получить данные о численности их популяций. В области физиологии и биохимии растений с помощью изотопов решён ряд теоретических и прикладных проблем: выяснены пути поступления минеральных веществ, жидкостей и газов в растениях, а также роль различных химических элементов, в том числе микроэлементов, в жизни растений. Показано, в частности, что углерод поступает в растения не только через листья, но и через корневую систему, установлены пути и скорости передвижения ряда веществ из корневой системы в стебель и листья и из этих органов к корням. В области физиологии и биохимии животных и человека изучены скорости поступления различных веществ в их ткани (в том числе скорость включения железа в гемоглобин, фосфора в нервные и мышечные ткани, кальция в кости). Важная группа работ охватывает исследования механизмов химических реакций в организме. Так, во многих случаях удалось установить связь между исходными и вновь образующимися молекулами, проследить за «судьбой» отдельных атомов и химических групп в процессах обмена веществ, а также выяснить последовательность и скорость этих превращений. Полученные данные сыграли решающую роль при построении современных схем биосинтеза и метаболизма (метаболических карт), путей превращения пищи, лекарственных препаратов и ядов в живых организмах.
В медицине с помощью изотопов были раскрыты механизмы развития (патогенез) ряда заболеваний; их применяют также для изучения обмена веществ и диагностики многих заболеваний. Изотопы вводят в организм в крайне малых количествах, не способных вызвать какие-либо патологические сдвиги. Различные элементы неравномерно распределяются в организме. Аналогично им распределяются и изотопы. Излучение, возникающее при распаде изотопа, регистрируют специальными приборами. Так, можно определить состояние большого и малого круга кровообращения, сердечного кровообращения, скорости кроветока, получить изображение полостей сердца.
Для чего нужен дыхательный тест
Выдыхаемый человеком воздух содержит столько информации, что, научившись анализировать её, можно составить полнейшее представление о состоянии организма. Можно поставить диагноз в зависимости от состава выдыхаемого воздуха. На этом основан новый метод исследования пищеварительной системы человека, при котором применяются так называемые дыхательные тесты. Его самый очевидный плюс – нет опасности заразиться гепатитом или СПИДом. А традиционные трубки для осмотра желудка, взятия желудочного сока при плохой дезинфекции могут стать причиной этих и других вирусных инфекций. Метод этот весьма точен – примерно 90% достоверности.
«Не навреди» – основной принцип медицины с древних пор. Дыхательные диагностические тесты заболеваний полностью ему удовлетворяют в отличие от зондирования и биопсии. А использование тест-препаратов со стабильным изотопом углерода 13С (так обозначают изотоп с атомным весом, то есть общим числом нейтронов и протонов в ядре равным 13) исключает и возможность радиоактивного облучения (не только пациентов, но и персонала). Выпил раствор 13С-препарата и по содержанию 13СО2(углекислого газа) в выдыхаемом воздухе определил состояние того или иного органа – просто, точно и безопасно. Но ещё более широкие возможности открывают новейшие 13С-магниторезонансные методы, которые позволяют получать высококачественные снимки опухолей, сосудов. и даже контролировать метаболические процессы, а значит, и наше здоровье без использования рентгеновских, радиоизотопных и прочих дорогих, сложных и небезопасных методов диагностики.
Стабильно-изотопная диагностика – это не больно!

А что за препарат в соке растворяли? Да самую обычную мочевину. Но вместо распространённого углерода 12С её молекула содержит изотоп 13С, которого в природе немного – чуть больше 1%, но он есть везде, и в теле человека его около двухсот граммов. Это так называемый стабильный изотоп углерода, который не распадается, ничего не излучает и отличается от «обычного» атома 12С только тем, что он чуть тяжелее – на один нейтрон.
Ценность изотопа 13С в том, что он нисколько не меняет химические свойства веществ, благодаря чему мы можем принимать 13С-препараты без вреда для здоровья. Этот изотоп легко увидеть с помощью современных приборов, на чём и основана стабильно-изотопная диагностика: если зловредная H. pylori всё же попала в ваш организм, её фермент (уреаза) быстро разлагает мочевину, образующийся углекислый газ кровью переносится в лёгкие и удаляется с выдыхаемым воздухом. Выпив раствор 13С-мочевины, вы выдохните 13СО2, что и увидит доктор на экране прибора.
И не надо глотать жуткие скользкие металлические шланги-зонды. Помимо всего прочего эти методы обладают высочайшей точностью (до 100%) и специфичностью (поставленный диагноз будет однозначен). Именно благодаря этим достоинствам можно получить массу информации, например: как работает желудок (перистальтика), поджелудочная железа (хорошо ли усваиваются жиры), здорова ли печень (циррозы, гепатиты) и так далее.
Для того чтобы применять активные изотопы в медицине, нужно налаженное производство веществ, их содержащих, то есть меченых. Такого производства в России нет.
В то же время перечень заболеваний, выявляемых с помощью тест-препаратов на основе стабильных изотопов, быстро растёт и включает болезни органов пищеварения, печени, поджелудочной железы. Метод применяют для выявления ряда онкологических заболеваний, заболеваний крови, центральной нервной системы (ЦНС), а также в эндокринологии (диабет). В целом, медицинская диагностика с помощью стабильных изотопов быстро развивается и имеет большие перспективы.
Наиболее востребованны органические соединения, меченные лёгкими стабильными изотопами 13С.
В России существуют объективные условия быстрого развития данного направления. Госкорпорация «Росатом» выпускает изотопное сырьё высшего качества – двуокись углерода (113CO2), пригодное для производства медицинских тест-препаратов, освоено производство окиси углерода (13CO).
В 2007 году по инициативе авторов проекта на базе научно-технической программы правительства Москвы (Департамент науки) «Разработка и практическое освоение в здравоохранении новых методов и средств профилактики, диагностики и лечения онкологических, инфекционных и других опасных заболеваний» начато выполнение этой программы НИОКР. В работе участвовали ведущие медицинские научные центры: ГНЦ РФ – ИМБП РАН, НИИ скорой помощи им. Н.В. Склифосовского, РОНЦ им. Н.Н. Блохина РАМН и ряд других научных организаций.
В настоящее время впервые в нашей стране разработаны способы получения 14 различных 13С‑препаратов медицинского назначения. В соответствии с приказом Минздравсоцразвития РФ от 25.08.2005 г. № 539 начата подготовка производства первого в России препарата СИД «Геликотест» на основе высокообогащённого (99%) 13С‑карбамида для диагностики Helicobacterpylori методом дыхательного теста. Разработан оригинальный и недорогой отечественный прибор для массовой 13С‑диагностики методом дыхательных тестов (изготовлены действующие образцы прибора для медицинской регистрации). Проведена успешная медицинская апробация дыхательных тестов с использованием ряда 13С‑препаратов.
В ходе выполнения работ участниками проекта получены патенты РФ. Растёт интерес к данной проблеме в отечественной медицине.
Однако российские медицинские организации в отсутствие отечественных препаратов СИД вынуждены закупать их по импорту. Вместе с тем началось проникновение на внутренний рынок зарубежных компаний, поставляющих дорогие импортные 13С-препараты.
Рыночные цены меченых соединений составляют от 100 до 1000 долларов США (и более) за 1 грамм вещества; потребность составляет более 1000 килограммов в год и постоянно растёт. Только Москве для однократной диспансеризации населения требуются сотни килограммов 13С-карбамида, а номенклатура необходимых препаратов СИД превышает 20 наименований. С учётом значительного роста потребности медицины и других областей в стабильно-изотопных тест-препаратах производство этой продукции должно возрастать ускоренными темпами.
Итоговые перспективы проекта СИД
Проектом предусмотрено решение трёх основных задач:
1) разработка новых способов получения 13С-продуктов и значительное расширение их номенклатуры с целью широкого внедрения методов стабильно-изотопной диагностики в практику российского здравоохранения;
2) создание новой наукоёмкой отечественной продукции – высокообогащённых (99%) 13С‑препаратов – для реализации на внешнем рынке;
3) освоение и развитие новых областей использования стабильно-изотопных продуктов – в криминалистике, судебно-медицинской экспертизе, космической медицине, антидопинговом контроле, экологии, геологии, геофизике, изучении биосинтеза и других научных исследованиях, производстве стандартных образцов.
Первая задача предполагает разработку методов синтеза и создание научных основ производства стабильно-изотопных препаратов медицинского назначения, содействие в разработке и производстве диагностических приборов и оборудования, широком освоении методов СИД в различных областях отечественной медицины.
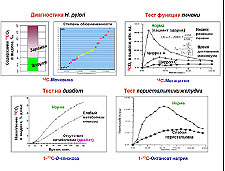
Решение третьей задачи обеспечит выпуск и использование тест-препаратов специального назначения независимо от рыночной конъюнктуры (то есть от импорта), а также ускоренное развитие ряда областей экономики.
В ходе работы планируется разработка новых способов синтеза 13С-продуктов для производства диагностических препаратов для дыхательных тестов.
В итоге работы ожидаются следующие результаты:
– расширение номенклатуры отечественных 13С-продуктов, принадлежащих к разным классам соединений, до 40–50 наименований, включая моно- и поликарбоновые органические (в том числе ароматические) кислоты и их производные, аминокислоты, углеводы, мочевины, циклические карбонаты и другие;
– научные основы технологий эффективного производства 13С-продуктов;
– установки синтеза 13С-продуктов в количествах, необходимых для проведения медицинских и иных испытаний с целью создания отечественной стабильно-изотопной диагностики (включая разработку и медицинскую регистрацию 13С-препаратов и приборов для дыхательных тестов);
– образцы 13С-продуктов медицинского и иного назначения.
Полученные результаты позволят приступить к организации серийного производства 13С-препаратов для дыхательных тестов, а также 13С-продуктов иного назначения, в том числе для их поставок на экспорт, провести клиническую апробацию и внедрение методов 13С‑диагностики заболеваний с помощью 13С-компьютерной томографии, расширять исследования в смежных (немедицинских) областях использования 13С-тест-препаратов и продуктов.
Развитие данного направления значительно расширит возможности российского здравоохранения, уменьшит его зависимость от импорта, повысит экспортопригодность отечественной наукоёмкой продукции, будет способствовать увеличению её доли на мировом рынке.
Учёные РН-ЦИР ведут успешные исследования в этом направлении и ожидают хороших результатов.