Для элемента азот справедливо что
Урок по теме «Азот: безжизненный или рождающий (селитры). Проблема связывания азота»
Разделы: Химия
Цели и задачи урока:
Ход урока:
Сегодня на уроке мы поговорим об азоте. Об азоте – элементе и об азоте – веществе, газе.
1.Вспомним основные характеристики элемента азота:
2.А теперь вспомним, что вы знаете о газе азоте:
3.Поиграем в игру крестики-нолики. Выигрышный путь линия, соответствующая соединениям азота с высшей степенью окисления.
Таблица заранее заготовлена на ватмане.
Изучение нового материала:
Теперь рассмотрим другое название элемента – Nitrogenium – рождающий селитры.
Начнем с главного факта:
И теперь мы подошли к тому, почему же азот «рождающий селитры».
Дать определение: Селитры – соли азотной кислоты и щелочных и щелочноземельных металлов и аммиака. Привести примеры, составить вместе с учениками формулы натриевой, калийной, кальциевой селитр.
Мы с вами говорили о том, что азот инертен при обычных условиях. Но его можно заставить вступать в реакции с различными веществами, только для этого надо создать определённые условия. Какие? Да нужна высокая температура или электрический разряд. Где в природе можно наблюдать электрические разряды? Когда? Запишем протекающую реакцию:
Какова степень окисления азота в этом соединении? Назовите соединение. Тут же происходит окисление оксида азота (II). Запишем реакцию:
Определить степень окисления азота и назвать соединение. NO2 – ядовитый газ, бурого цвета, который вступает в реакцию с водой и кислородом воздуха и образует азотную кислоту HNO3:
Где взять азот для реакции? (из воздуха).
А водород получают в результате химических производственных реакций. Синтез аммиака – энергоёмкий процесс, и не один год понадобился учёным для его осуществления. Первым получил патент на его изобретение Ле Шателье в 1901 году. А в 1914 году немецкие учёные Габер и Бош создали промышленную установку по производству аммиака и разработали оптимальные условия производства. За это они получили Нобелевскую премию. И по сей день 95% аммиака производят по методу Габера-Боша. И это тема нашего следующего урока. Из аммиака путём химических превращений получают оксиды азота, азотную кислоту, а потом и соли нитраты.
Но мы с вами отвлеклись от темы. Вернёмся к названию Nitrogenium. Только что мы рассмотрели, как происходит рождение селитр и других нитратов. И, конечно, этот факт в пользу названия Nitrogenium.
Так как же вы думаете, какое же название элемента отражает истинную сущность азота? Да, конечно, Nitrogenium.
А почему же мы называем седьмой элемент азотом? Ваши предположения? В 19 веке был сделан перевод слова, и получилось – селитротвор. Название не прижилось в силу неблагозвучности и название «азот» закрепилось исторически. Оно является удобным, коротким, привычным. (Дети и сами могут сделать этот вывод).
Заключение. Сегодня на уроке мы составили логическую цепочку умозаключений, используя наши знания, всё наше воображение, и доказали, что элемент с порядковым номером 7 хоть и переводится как «безжизненный», на самом деле является одним из элементов, создающих, творящих жизнь на Земле!
Вопросы для повторения и закрепления:
Задача:
Какой объём азота и водорода потребуется для получения 300 литров аммиака?
Азот: что это такое, молярная масса, строение атома, характеристика
Азот — что это за элемент в химии
Азот — является элементом, расположенным в главной подгруппе V группы (или в 15 группе в современной форме периодической системы химических элементов Д.И. Менделеева) и во втором периоде.
Азот относят к пниктогенам, он представляет собой один из самых распространенных элементов на нашей планете.
В основном состоянии азот обладает следующей электронной конфигурацией:
Азот в природном мире можно обнаружить в виде простого вещества газа N2. Молекула N2 неполярная. По этой причине в воде азот практически не растворяется. В молекуле азота атомы соединены тройной связью, в связи с тем, что каждый атом в молекуле обладает тремя неспаренными электронами. Одна из трех связей является σ-связью (сигма-связью), и две — π-связями.
Схема образования молекулы азота:
Структурно-графическая формула молекулы азота имеет вид: N≡N
Схема перекрывания электронных облаков при образовании молекулы азота:
Простое вещество N2 — двухатомный газ, без цвета, вкуса и запаха. Вещество обладает химической инертностью, вступает в химические реакции с комплексными соединениями переходных металлов.
Азот N2 является ключевым компонентом воздуха: составляет 78% от общего объема атмосферного воздуха. В промышленности азот получают путем разделения (фракционирования) воздуха, свыше ¾ от массы производимого в промышленности азота используют для получения аммиака. Простое вещество N2 применяют в качестве инертной среды для реализации разнообразных технологических процессов. Жидкий азот играет роль хладагента.
Азот представляет собой один из ключевых биогенных элементов, который входит в компонентный состав белков и нуклеиновых кислот. В земной коре азот встречатеся преимущественно в виде нитратов — солей азотной кислоты.
Первооткрыватели
У азота нет конкретного ученого, который считался бы первооткрывателем этого элемента. Точнее есть, но несколько. Выяснить, кому именно принадлежат лавры открытия, сейчас уже невозможно.
1772 год — важный год для химического элемента. Сразу четверо ученых вплотную приблизились к открытию азота. Это и британский химик Генри Кавендиш, и первооткрыватель кислорода Джозеф Пристли, и шведский химик-фармацевт Карл Шееле, и шотландский химик Даниэль Резерфорд. Все они в одно и то же время проводили различные исследования и эксперименты с газами. Эти люди близко подошли к открытию нового химического элемента. Но выделить кого-то из них в качестве однозначного первооткрывателя нельзя.
Степень окисления азота
Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Химические свойства азота
Химический элемент азот образует только одно простое вещество. Данное вещество является газообразным и образовано двухатомными молекулами, т.е. имеет формулу N2. Не смотря то, что химический элемент азот имеет высокую электроотрицательность, молекулярный азот N2 является крайне инертным веществом. Обусловлен данный факт тем, что в молекуле азота имеет место крайне прочная тройная связь (N≡N). По этой причине практически все реакции с азотом протекают только при повышенных температурах.
Взаимодействие азота с металлами
Единственное вещество, которое реагирует с азотом в обычных условиях – литий:
Интересным является тот факт, что с остальными активными металлами, т.е. щелочными и щелочноземельными, азот реагирует только при нагревании:
Взаимодействие азота с металлами средней и низкой активности (кроме Pt и Au) также возможно, однако требует несравнимо более высоких температур.
Нитриды активных металлов легко гидролизуются водой:
Взаимодействие азота с неметаллами
Азот реагирует с водородом при нагревании в присутствии катализаторов. Реакция является обратимой, поэтому для повышения выхода аммиака в промышленности процесс ведут при высоком давлении:
Как восстановитель азот реагирует со фтором и кислородом. Со фтором реакция идет при действии электрического разряда:
С кислородом реакция идет под действием электрического разряда или при температуре более 2000 оС и является обратимой:
Из неметаллов азот не реагирует с галогенами и серой.
Взаимодействие азота со сложными веществами
В рамках школьного курса ЕГЭ можно считать, что азот не реагирует ни с какими сложными веществами кроме гидридов активных металлов:
Физические свойства азота

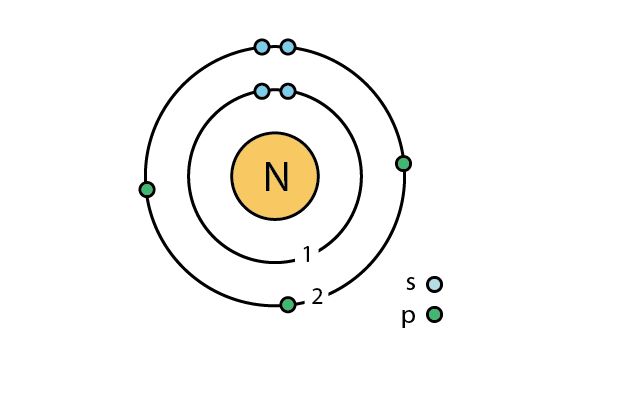
Рис. 1. Атом азота.
Атмосферный азот состоит из двух изотопов: 14N (99.64%) и 15N (0.36%). Известны также радиоактивные изотопы азота 13N и 16N.
Перевод названия элемента «азот» – безжизненный. Это название справедливо для азота, как для простого вещества, но в связанном состоянии он является одним из главных элементов жизни, а также входит в состав белков, нуклеиновых кислот, витаминов и т. д.
Способы получения азота и его применение
Существуют разные способы получения азота. К примеру, в лабораторных условиях вещество синтезируют в процессе химической реакции между растворами хлорида аммония и нитрита натрия. Продуктом реакции обмена является нитрит аммония, который достаточно просто разлагается, что приводит к образованию азота и воды. Колбу заполняют раствором хлорида аммония, а капельную воронку — раствором нитрита натрия. В процессе добавления нитрита натрия в колбу начинает выделяться азот, который собирают с помощью цилиндра. Затем можно посмотреть, сколько газа получено. Горящая лучинка в атмосфере азота гаснет, так проверяют наличие азота в сосуде.
Следующим лабораторным способом получения азота является восстановление оксида меди (II) аммиаком при температуре около 700 °C:
В промышленной сфере азот получают из воздуха. Эффективность промышленного производства зависит от наличия дешевого и доступного сырья определенного класса. Воздух в данном случае представлен в неограниченном количестве и является бесплатным. Азот из воздуха выделяют по нескольким технологиям:
Адсорбционный метод синтеза азота заключается в разделении воздуха на компоненты с помощью связывания твердым веществом, называемым адсорбентом, отдельных компонентов газовой смеси. Принцип работы мембранных систем заключается в создании разницы скоростей проникновения компонентов газа через вещество мембраны. В качестве движущей силы разделения газов выступает разница парциальных давлений на различных сторонах мембраны. Криогенные установки функционируют по методу разделения газовых смесей за счет разности температур кипения компонентов воздуха и различии составов, которые находятся в равновесии жидких и паровых смесей.
Азот используют для выпуска минеральных удобрений, синтеза аммиака, получения инертной атмосферы в лампах, применяют в медицине. Жидкий азот обеспечивает глубокое охлаждение и вымораживание. Полученный с помощью азота аммиак применяют в производстве азотной кислоты, азотсодержащих солей, мочевины и соды, им заправляют холодильное оборудование. Жидкий аммиак и его растворы используют в качестве жидких удобрений, а также в сфере медицины.
С помощью оксида одновалентного азота N2O создают аэрозоли и анестезирующие средства при наркозах. Жидкий диоксид азота NО2играет роль неводного растворителя и окислителя в двигателях космических кораблей. Нитрит натрия нашел широкое применение в органическом синтезе. Данное вещество используют в качестве добавки к колбасным изделиям, которая придает им цвет натурального мяса. Азотная кислота необходима для производства минеральных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон. Концентрированную азотную кислоту используют в ракетной технике, как окислитель топлива для сгорания в двигателях.
Сферы применения азота:
Азот в природе
Азот находится в атмосфере в виде молекул, состоящих из двух атомов. Помимо атмосферы, азот есть в мантии Земли и в гумусном слое почвы. Основной источник азота для промышленного производства – это полезные ископаемые.
Однако в последние десятилетия, когда запасы минералов стали истощаться, возникла острая необходимость выделения азота из воздуха в промышленных масштабах. В настоящее время эта проблема решена, и огромные объемы азота для нужд промышленности добываются из атмосферы.
Роль азота в биологии
Это вещество является одним из основных биогенных элементов и входит в состав важнейших элементов живых клеток — нуклеиновых кислот и белков. Однако количество азота в живых организмах невелико (примерно 1–3 % на сухую массу). Имеющийся в атмосфере молекулярный материал усваивают лишь сине-зеленые водоросли и некоторые микроорганизмы.
Довольно большие запасы этого вещества сосредоточены в почве в виде различных минеральных (нитраты, аммонийные соли) и органических соединений (в составе нуклеиновых кислот, белков и продуктов их распада, включая еще не полностью разложившиеся остатки флоры и фауны).
Растения отлично усваивают азот из грунта в виде органических и неорганических соединений. В природных условиях большое значение имеют особые почвенные микроорганизмы (аммонификаторы), которые способны минерализировать органический N почвы до солей аммония.
Нитратный азот грунта образуется в процессе жизнедеятельности нитрифицирующих бактерий, открытых С. Виноградским в 1890 году. Они окисляют аммонийные соли и аммиак до нитратов. Часть усвояемого флорой и фауной вещества теряется из-за воздействия денитрифицирующих бактерий.
Микроорганизмы и растения отлично усваивают как нитратный, так и аммонийный N. Они активно превращают неорганический материал в различные органические соединения — аминокислоты и амиды (глутамин и аспарагин). Последние входят в состав многих белков микроорганизмов, растений и животных. Синтез аспарагина и глутамина путем амидирования (ферментативного) аспарагиновой и глутаминовой кислот осуществляется многими представителями флоры и фауны.
Производство аминокислот происходит при помощи восстановительного аминирования ряда кетокислот и альдегидокислот, возникающих путем ферментативного переаминирования, а также в результате окисления различных углеводов. Конечными продуктами усвоения аммиака (NH₃) растениями и микроорганизмами являются белки, которые входят в состав ядра клеток, протоплазмы, а также откладываются в виде так называемых запасных белков.
Человек и большинство животных могут синтезировать аминокислоты лишь в довольно ограниченной мере. Они не способны производить восемь незаменимых соединений (лизин, валин, фенилаланин, триптофан, изолейцин, лейцин, метионин, треонин), и потому для них главным источником азота являются потребляемые с пищей белки, то есть, в конечном счете, — собственные белки микроорганизмов и растений.
Свойства азота

Всего получено оценок: 521.
Всего получено оценок: 521.
Азот – химический элемент V группы периодической системы Менделеева, имеющий атомный номер 7 и атомную массу 14,00674. Какими же свойствами обладает этот элемент?
Физические свойства азота
Атмосферный азот состоит из двух изотопов: 14N (99.64%) и 15N (0.36%). Известны также радиоактивные изотопы азота 13N и 16N.
Перевод названия элемента «азот» – безжизненный. Это название справедливо для азота, как для простого вещества, но в связанном состоянии он является одним из главных элементов жизни, а также входит в состав белков, нуклеиновых кислот, витаминов и т. д.
Химические свойства азота
В молекуле азота химическая связь осуществляется за счет трех общих пар p-электронов, орбитали которых направлены по осям x,y,z.
Ковалентная связь, которая образуется при перекрывании орбиталей вдоль линии, связывающей центры соединяющихся атомов, называются q-связью.
Ковалентная связь, возникающая при перекрывании орбиталей по обе стороны линии, связывающей центры соединяющихся атомов, называются п-связью. В молекуле азота имеется одна q-связь и две п-связи.
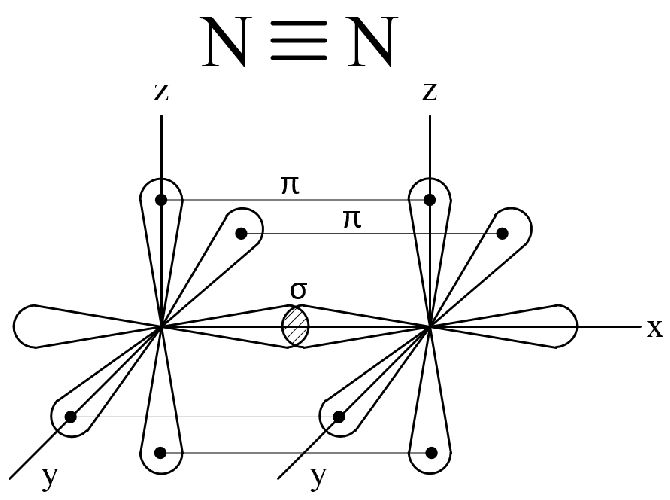
Молекулярный азот – химически малоактивное вещество, это объясняется тройной связью между атомами азота и ее малой длиной
При нормальных условиях азот может реагировать только с литием:
При высоких температурах связи между атомами ослабляются и азот становится более реакционноспособным. При нагревании он может взаимодействовать с другими металлами, например с магнием, кальцием, алюминием с образованием нитридов:
Пропуская азот через раскаленный кокс, получают соединение азота с углеродом – дициан.
С оксидом алюминия и углеродом азот при высокой температуре также образует нитрид алюминия:
а с содой и углем – цианид натрия:
При соприкосновении с водой многие нитриды полностью гидролизуются с образованием аммиака и гидроксида металла:
При температуре электрической дуги (3000-4000 градусов) азот реагирует с кислородом:
При высокой температуре карбид кальция CaC2 поглощает азот с образования цианамида кальция:
Эту реакцию использовали в одном из первых методов промышленного связывания азота воздуха.
В присутствии катализатора при высокой температуре и давлении азот способен реагировать с водородом:
Что мы узнали?
Азот – химический элемент, способный проявлять валентность III и IV. Так же в статье рассмотрены физические и химические свойства азота, и дается характеристика этого элемента и реакции, в которые этот элемент способен вступать при нормальных условиях и под действием катализаторов.
Проверочная работа по химии Периодический закон 9 класс
Проверочная работа по химии Периодический закон 9 класс с ответами. Работа представлена в 3 вариантах в виде теста. В каждом варианте по 15 заданий.
1 вариант
1. Увеличение порядкового номера элемента в периоде сопровождается:
1) возрастанием радиуса атома и увеличением электроотрицательности атома
2) уменьшением радиуса атома и увеличением электроотрицательности атома
3) возрастанием радиуса атома и уменьшением электроотрицательности атома
4) уменьшением радиуса атома и уменьшением электроотрицательности атома
2. В атомах элементов 24 Mg и 40 Са одинаковое число:
1) всех электронов
2) протонов в ядре
3) электронов на внешнем энергетическом уровне
4) нейтронов
3. Число энергетических уровней, занятых электронами, одинаково в атомах элементов, расположенных в ряду:
1) В — Al — Ga
2) О — S — Cl
3) Li — Mg — Ве
4) Si — Р — S
4. Элементы главной подгруппы периодической системы расположены в ряду:
1) О — S — Se
2) Cr — Мо — W
3) Fe — Со — Ni
4) Сu — Ag — Аu
5. В побочные подгруппы периодической системы не входят:
6. Из приведенных примеров металлические свойства сильнее всего выражены у:
1) бария
2) кальция
3) магния
4) стронция
9. Амфотерные оксид и гидроксид характерны для обоих элементов ряда:
1) S, Mg
2) Li, Cl
3) С, Р
4) Ве, Al
10. В ряду оксидов MgO — Al2O3 — SiO2 химические свойства меняются:
1) от амфотерных к основным и кислотным
2) от основных к амфотерным и кислотным
3) от кислотных к основным и амфотерным
4) от амфотерных к кислотным и основным
11. Кислотные свойства усиливаются в ряду:
12. Для ряда элементов Li — Nа — К верно, что:
1) формула их высшего оксида R2O
2) кислотные свойства их гидроксидов. усиливаются
3) их гидроксиды амфотерны
4) неметаллическая активность простых веществ усиливается
5) металлическая активность простых веществ усиливается
13. В атоме элемента № 6:
1) 6 протонов в ядре
2) 6 энергетических уровней
3) 6 электронов в электронной оболочке
4) 6 электронов на внешнем энергетическом уровне
5) 6 энергетических подуровней
14. Установите соответствие между положением элемента в периодической системе и свойством его простого вещества:
А) 2 период, IA группа
Б) 3 период, VIA группа
В) 3 период, IIIA группа
Г) 2 период, IVА группа
Свойство простого вещества
1) металл
2) неметалл
15. Для элемента сера справедливо, что:
1) ее простое вещество — металл
2) формула высшего оксида — SO3
3) ее простое вещество — неметалл
4) формула водородного соединения — Н3S
5) высший оксид проявляет основные свойства
2 вариант
1. Увеличение порядкового номера элемента в главной подгруппе сопровождается:
1) возрастанием радиуса атома и увеличением относительной электроотрицательности атома
2) уменьшением радиуса атома и увеличением относительной электроотрицательности атома
3) возрастанием радиуса атома и уменьшением относительной электроотрицательности атома
4) уменьшением радиуса атома и уменьшением относительной электроотрицательности атома
2. В ряду элементов Na — Si — Cl:
1) радиус атома увеличивается
2) увеличивается число валентных электронов
3) радиус атома не меняется
4) уменьшается число валентных электронов
3. Число энергетических уровней, занятых электронами, различно в атомах элементов, расположенных в ряду:
1) N — Р — As
2) N — О — F
3) Fe — Со — Ni
4) Li — Ве — В
4. Элементы главной подгруппы периодической системы расположены в ряду:
1) Mn — Те — Re
2) Fe — Со — Ni
3) Cu — Ag — Au
4) В — Al — Ga
5. В главные подгруппы периодической системы входят:
1) только s-элементы
2) только p-элементы
3) только d-элементы
4) s— и р-элементы
6. Из приведенных примеров неметаллические свойства сильнее всего выражены у:
1) селена
2) кислорода
3) серы
4) теллура
7. Металлические свойства простых веществ усиливаются в ряду:
1) Ge — Sn — РЬ
2) С — N — О
3) Ge — Si — С
4) Ва — Са — Ве
8. Для бария и калия верно, что:
1) они образуют амфотерные оксиды
2) они образуют кислотные оксиды
3) их простые вещества — неметаллы
4) их гидроксиды проявляют основные свойства
9. Кислотные оксид и гидроксид характерны для обоих элементов ряда:
1) S, Mg
2) Li, Cl
3) С, Р
4) Ве, Al
10. В ряду оксидов N2O5 — B2O3 — Li2O химические свойства меняются:
1) от амфотерных к кислотным
2) от основных к кислотным
3) от кислотных к основным
4) от амфотерных к основным
11. Основные свойства усиливаются в ряду:
12. Для ряда элементов Р — S — Cl верно, что:
13. В атоме элемента № 9:
1) 9 нейтронов в ядре
2) 9 протонов в ядре
3) 9 электронов в электронной оболочке
4) 9 энергетических уровней
5) 9 электронов на внешнем энергетическом уровне
14. Установите соответствие между положением элемента в периодической системе и свойством его простого вещества:
А) 2 период, VIA группа
Б) 3 период, VIIA группа
В) 4 период, IА группа
Г) 2 период, IVА группа
Свойство простого вещества
1) металл
2) неметалл
15. Для элемента азот справедливо, что:
1) его простое вещество — металл
2) формула высшего оксида — N2O5
3) его простое вещество — неметалл
4) формула водородного соединения — NH
5) высший оксид проявляет основные свойства
3 вариант
1. Увеличение порядкового номера элемента в малых периодах сопровождается:
1) увеличением числа электронов на внешнем энергетическом уровне и увеличением радиуса атома
2) уменьшением числа электронов на внешнем энергетическом уровне и увеличением радиуса атома
3) уменьшением числа электронов на внешнем энергетическом уровне и уменьшением радиуса атома
4) увеличением числа электронов на внешнем энергетическом уровне и уменьшением радиуса атома
2. В ряду элементов F — Cl — Br:
1) уменьшается относительная электроотрицательность атома
2) уменьшается радиус атома
3) увеличивается радиус атома
4) увеличивается относительная электроотрицательность
3. Число энергетических уровней, занятых электронами, одинаково в атомах элементов, расположенных в ряду:
1) Mg — Al — Si
2) С — Si — Ge
3) Р — О — Не
4) Ne — Ar — Kr
4. Элементы главной подгруппы периодической системы расположены в ряду:
1) Zn — Cd — Hg
2) Ве — Mg — Са
3) Fe — Со — Ni
4) Cu — Ag — Au
5. В главные подгруппы периодической системы не входят:
6. Из приведенных примеров металлические свойства слабее всего выражены у:
1) цезия
2) калия
3) лития
4) натрия
7. Неметаллические свойства простых веществ усиливаются в ряду:
1) I — Br — CI
2) F — О — N
3) К — Rb — Cs
4) S — Se — Те
8. Для кремния и азота верно, что:
1) они образуют основные оксиды
2) они не образуют водородных соединений
3) их простые вещества — металлы
4) их гидроксиды проявляют кислотные свойства
9. Основные оксид и гидроксид характерны для обоих элементов ряда:
1) S, Mg
2) Li, Са
3) С, Р
4) Zn, Al
10. В ряду оксидов P2O5 — Al2O3 — MgO химические свойства меняются:
1) от амфотерных к основным и кислотным
2) от основных к амфотерным и кислотным
3) от кислотных к амфотерным и основным
4) от амфотерных к кислотным и основным
11. Основные свойства ослабевают в ряду:
12. Для ряда элементов I — Br — CI верно, что:
1) формула их высшего оксида R2O7
2) кислотные свойства их высших гидроксидов усиливаются
3) неметаллическая активность простых веществ ослабевает
4) неметаллическая активность простых веществ усиливается
5) они не образуют водородных соединений
13. В атоме элемента № 19:
1) 19 нейтронов в ядре
2) 19 энергетических уровней
3) 19 электронов в электронной ·оболочке
4) 19 протонов в ядре
5) 19 электронов на внешнем энергетическом уровне
14. Установите соответствие между положением элемента в периодической системе и свойствами его простого вещества:
А) 2 период, ПА группа
Б) 3 период, IIIA группа
В) 4 период, VIIA группа
Г) 2 период, VA группа
Свойство простого вещества
1) металл
2) неметалл
15. Для элемента натрий справедливо, что:
1) его простое вещество — металл
2) формула оксида — Nа2O5
3) его простое вещество — неметалл
4) водородного соединения не имеет
5) высший оксид проявляет основные свойства
Ответы на проверочную работу по химии Периодический закон 9 класс
1 вариант
1-2
2-3
3-4
4-1
5-4
6-1
7-2
8-1
9-4
10-2
11-3
12-15
13-13
14. А1 Б2 В1 Г2
15. 23
2 вариант
1-3
2-2
3-1
4-4
5-4
6-2
7-1
8-4
9-3
10-3
11-1
12-24
13-23
14. А2 Б2 В1 Г2
15. 23
3 вариант
1-4
2-1
3-1
4-2
5-3
6-3
7-1
8-4
9-2
10-3
11-4
12-14
13-34
14. А1 Б1 В2 Г2
15. 15


:max_bytes(150000):strip_icc()/nitrogen-chemical-element-186451118-5810efe03df78c2c7313e500.jpg)

