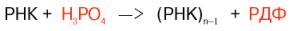До чего распадаются нуклеиновые кислоты
Распад нуклеиновых кислот
Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. Различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот с образованием олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или олигонуклеотидов. Имеются также ферменты, катализирующие распад нуклеиновых кислот, например, посредством трансферазной реакции.
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов.
Рестриктазы – ферменты ДНК-азного типа действия – катализируют распад чужеродной (в основном фаговой) ДНК в строго определенных участках молекулы. Рестриктазы оказывают строго специфическое действие, поэтому они используются для расшифровки последовательности нуклеотидных остатков в ДНК фагов и вирусов и находят широкое применение в генетической инженерии при создании рекомбинантных геномов.
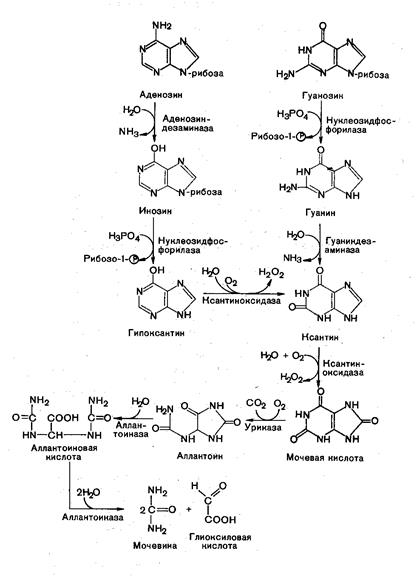
Распад пуриновых нуклеозидов.Образовавшиеся при гидролизе пуриновые нуклеозиды – аденозин и гуанозин – подвергаются ферментативному распаду в организме животных. Распад активно протекает в печени, почках, слизистой кишечника. Конечным продуктом пуринового обмена у человека, приматов, большинства животных является мочевая кислота.
У части рептилий и некоторых млекопитающих мочевая кислота расщепляется до аллонтаина и у рыб – до аллантоиновой кислоты и мочевины.
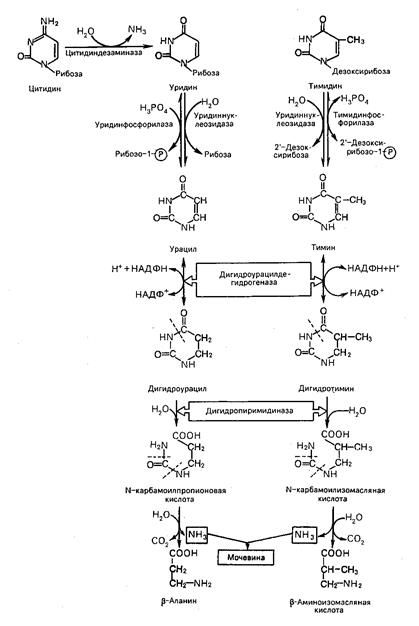
Распад пиримидиновых нуклеозидов. Распад пиримидиновых нуклеотидов начинается с превращения нуклеотидов в нуклеозиды, а затем в свободные азотистые основания – урацил и тимин. Распад тимина и урацила приводят к образованию b-аланина и b-аминоизомасляной кислоты. Конечными продуктами реакции распада являются также СО2, NH3, мочевина.
Вопросы и задачи
1. Какие ферменты участвуют в гидролизе нуклеиновых кислот?
2. С какого соединения начинается пуриновый цикл?
3. Напишите реакции синтеза пуриновых нуклеотидов.
4. Какое соединение образуется на первой стадии синтеза пиримидиновых нуклеотидов?
5. Что необходимо для превращения GDP в GTP?
6. Репликация ДНК происходит полуконсервативным способом. Что это означает?
7. Какие ферменты участвуют в синтезе ДНК?
Рекомендуемая литература
1. Березов Т.Т., Коровкин Б.Ф. Биологическая химия: Учебник. – М.: Медицина, 1998. – 704 с.
2. Жимулев И.Ф. Общая и молекулярная генетика: Учеб. пособие. – Новосибирск: Изд-во Новосиб. ун-та: Сиб. унив. изд-во, 2002. – 459 с.
3. Коничев А.С. Молекулярная биология: Учеб. для студ. пед. вузов / А.С. Коничев, Г.А. Севастьянова. – М.: Изд. центр «Академия», 2003. – 400 с.
4. Комов В.П. Биохимия. – М.: Дрофа, 2004. – 640 с.
5. Сингер М., Берг П. Гены и геномы: В 2 т. – Т.1. – Пер. с англ. – М.: Мир, 1998. – 373 с.
6. Филлипович Ю.Б. Основы биохимии: Учебник для хим. и биол. спец. ун-тов и ин-тов. – М.: Изд-во «Агар», 1999. – 512 с.
7. Чиркин А.А. Практикум по биохимии: Учеб. пособие. – Мн.: Новое издание, 2002. – 512 с.
8. Эллиот В. Биохимия и молекулярная биология / В. Эллиот, Д. Эллиот; Под ред. А.И.Арчакова, М.П. Кирпичникова, А.Е. Медведева, В.П. Скулачева. – Пер. с англ. О.В. Добрыниной, И.С. Севериной, Е.Д. Скоцеляс и др. – М.: МАИК «Наука / Интерпериодика», 2002. – 446 с.
Дата добавления: 2015-07-06 ; просмотров: 4542 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
До чего распадаются нуклеиновые кислоты
Помимо гидролитических нуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, в частности посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5-го углеродного атома рибозы одного мононуклеотида ко 2-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2-м и 3-м углеродным атомами рибозы одного и того же мононуклеотида. К настоящему времени открыты следующие группы нуклеаз, катализирующие распад ДНК и РНК.
Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфирных связей в одной из двух цепей молекулы ДНК между 3′-м углеродным остатком дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов:
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая молекулярную массу 38 000 дальтон и состоящая из 343 аминокислот. В составе этой ДНК-азы открыт глюкозамин. Фермент также активируется ионами металлов, ингибируется анионами; его оптимум pH колеблется между 4,5 и 5,5.
Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5′-дезоксирибонуклеотидов; в частности, из Е. coli выделено 4 таких фермента, обозначаемых экзодезоксирибонуклеазами I, II, III и IV.
Из ферментов, катализирующих гидролитический распад РНК, наиболее изученными являются рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. К настоящему времени выделена РНК-аза из поджелудочной железы многих животных. Она состоит из 124 аминокислот во всех РНК-азах, хотя последние несколько различаются по последовательности аминокислотных остатков; выяснена также третичная структура ряда РНК-аз.
Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотидфосфорилазу и группу ДНК-гликозидаз. Первая открыта в лаборатории С. Очоа еще в 1955 г. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотидфосфорилазы в лаборатории С. С. Дебова; в той же лаборатории фермент открыт в животных тканях. Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат:
Группа ДНК-гликозидаз участвует в акциях отщепления модифицированных пуриновых и пиримидиновых оснований (например, урацила, образовавшегося при дезаминировании остатка цитозина в одной из цепей ДНК). В серии последующих реакций при участии ДНК-полимеразы и ДНК-лигазы брешь восполняется включением соответствующего и отсутствующего мононуклеотида. Таким образом, ДНК-гликозидазы выполняют важную функцию в процессах репарации (восстановления структуры) молекулы ДНК.
В результате последовательного действия разнообразных клеточных экзо- и эндонуклеаз нуклеиновые кислоты подвергаются распаду до стадии рибо- и дезоксирибонуклеозид-3′- и 5′-фосфатов.
Дальнейший распад образовавшихся продуктов связан с ферментативными превращениями мононуклеотидов и нуклеозидов, далее свободных азотистых оснований. Известно, что адениловая кислота, кроме того, подвергается в животных тканях обратимому дезаминированию в инозиновую кислоту. На первом этапе гидролиза действуют 3′- или 5′-нуклеотидазы, катализирующие гидролитический распад мононуклеотидов по уравнению:
На втором этапе распада имеет место перенос остатка рибозы от нуклеозида на свободную фосфорную кислоту с образованием рибозо-1-фосфата и свободного азотистого основания. По этому пути окисляются преимущественно пиримидиновые нуклеотиды (см. ниже).
Распад пиримидиновых нуклеозидов
Последовательность ферментативных реакций гидролиза пиримидиновых нуклеозидов можно видеть из представленной схемы:
Как видно из приведенной схемы, начальные этапы реакции распада пиримидиновых нуклеотидов катализируются специфическими ферментами; конечными продуктами реакции являются СO2, NH3, мочевина, β-аланин и β-аминоизомасляная кислота. Следует указать, что гидролитический путь распада пиримидинов является, очевидно, главным путем образования β-аланина, который может служить источником для синтеза ансерина и карнозина (см. Биохимия мышц), а также для образования коэнзима А. Известно, кроме того, что β-аланин в животных тканях подвергается дальнейшему распаду. В частности, в тканях животных открыта специфическая трансаминаза, катализирующая трансаминирование между β-аланином и пировиноградной кислотой. В процессе этой обратимой реакции синтезируются β-аланин и формилацетат (полуальдегид малоновой кислоты):
Образовавшийся формилацетат далее подвергается окислительному декарбоксилированию с образованием углекислоты и ацетил-КоА:
Распад пуриновых нуклеозидов
Последовательность ферментативных реакций гидролиза пуриновых нуклеозидов можно видеть из представленной схемы:
Параграф 71. катаболизм нуклеиновых кислот
Автор текста – Анисимова Елена Сергеевна.
Авторские права защищены. Продавать текст нельзя.
Курсив не зубрить.
Замечания можно присылать по почте: exam_bch@mail.ru
https://vk.com/bch_5
ПАРАГРАФ 71.
«Катаболизм нуклеиновых кислот».
71. 1. Гидролиз нуклеиновых кислот.
Нуклеиновые кислоты расщепляются до мономеров (нуклеотидов, НМФ)
путем расщепления (фосфодиэфирных) связей между нуклеотидами
путем гидролиза под действием ферментов класса гидролазы подкласса нуклеазы.
РНК расщепляются РНК-азами. ДНК расщепляются ДНК-азами.
Нуклеотиды расщепляются на фосфат и нуклеозид
путем гидролиза под действием нуклеотидаз.
При расщеплении нуклеозида на основание и рибозу
к рибозе присоединяется фосфат
(расщепление называется фосфоролизом, катализируется фосфорилазой),
в результате чего при отщеплении рибозы образуется рибозо-5-фосфат.
71. 2. Катаболизм пиримидиновых оснований.
При катаболизме пиримидинов их кольцо разрушается.
Из урацила
образуются NH3, СО2 и ;-аланин
(NH3 – из 3-го N, СО2 – из 2-го N,
а из остальных атомов образуется ;-аланин).
Цитозин
сначала превращается в урацил
(как ясно при виде формул, путем замены NH2 группы на ОН –
при этом отщепляется NH3 и присоединяется НОН,
процесс называется дезаминированием цитозина),
а затем урацил распадается так, как сказано выше.
Распад тимина
похож на распад урацила, но в формуле тимина есть СН3 группа,
которой нет в формуле урацила,
поэтому при распаде тимина образуется не ;-аланин,
а ;-аланин с СН3 группой, который называется ;-амино/изо/масляной кислотой
(АИМК: масляной, потому что 4С, кислотой – потому что есть СООН, изо – потому что разветвленная).
;-аланин используется в мышцах
для синтеза КАРНОЗИНА –
вещества, которое способно связывать протоны
(образующиеся в повышенных количествах при диссоциации молочной кислоты, оразующейся при работе мышц – п.32)
и тем самым – увеличивать выносливость мышц.
АИМК кислота образуется из тимина,
который, в свою очередь, образуется из ДНК при распаде ДНК,
поэтому увеличение [АИМК] является показателем увеличения распада клеток.
(Урацил образуется при распаде РНК, цитозин – при распаде и ДНК, и РНК).
71. 3. Катаболизм пуринов (аденина и гуанина)
после их образования из ДНК или РНК.
Пуриновое кольцо пуринов в организме человека не разрушается
(нет ферментов для этого).
Катаболизм пуринов заключается в том, что
пурины превращаются в пурин с 3-мя ОН группами,
который называется мочевой кислотой
(не путайте с мочевиной – формулы совсем разные, сходство веществ только в том, что оба есть в моче).
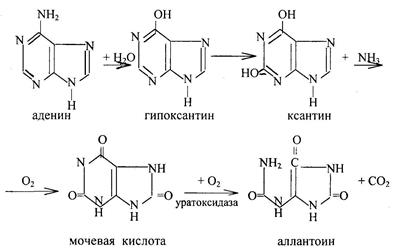
71. 3. 1. Превращение гуанина в мочевую кислоту.
Первая реакция – превращение гуанина в ксантин – пурин с двумя ОН группами.
При этом (легко догадаться при сравнении формул) происходит
замена NH2 группы на ОН,
при этом отщепляется NH3 и присоединяется НОН,
процесс называется дез/аминированием гуанина.
Вторая реакция – превращение ксантина в мочевую кислоту;
при этом происходит образование еще одной (3-й) ОН группы
(окисление ксантина), реакцию катализирует ксантин/оксидаза.
71. 3. 2. Превращение аденина в мочевую кислоту
сначала аденин превращается в гипоксантин – пурин с одной ОН группой.
При этом (аналогично превращению гуанина в ксантин) происходит
замена NH2 на ОН;
процесс называется дез/аминированием и катализируется аденозин/дезаминазой
(фермент действует не на аденин, а на аденозин – соединение аденина с рибозой).
Гипоксантин превращается в ксантин при образовании второй ОН группы под действием ксантин/оксидазы.
Далее ксантин превращается в мочевую кислоту, как и при обмене гуанина.
Т.о., превращение гуанина в мочевую кислоту происходит через ксантин,
а аденина в мочевую кислоту – через гипоксантин и ксантин.
71. 3. 3. Отсутствие аденозин/дезаминазы
(из-за мутации её гена) приводит к накоплению аденозина
и снижению синтеза ДНК –
это приводит к дефициту Т и В-лимфоцитов и снижению иммунитета –
патология называется синдромом комбинированного врожденного иммунодефицита (СВИД).
Продлить жизнь (спасти от смерти в детстве) может только внедрение нормального гена аденозин/дезаминазы (ГЕНОТЕРАПИЯ).
Генотерапия была применена при лечении именно этого заболевания в 90-х годах ХХ века – впервые в истории.
71. 4. Мочевая кислота: причины и последствия гиперуратемии.
Мочевая кислота образует соли, которые называются УРАТАМИ.
Ураты плохо растворимы в воде и при повышении концентрации образуют осадок и кристаллы.
Ураты откладываются:
1) В СУСТАВАХ, приводя к развитию АРТРИТОВ (особенно артрита больших пальцев ног),
2) в коже (скопления уратов в коже называются тофусами),
3) в мочевыводящей системе, создавая риск развития почечной недостаточности
(это самое опасное последствие избытка уратов).
Совокупность этих проявлений называется ПОДАГРОЙ.
Появлению подагры способствуют:
1) повышенная концентрация уратов в тканях и крови – гипер/урат/емия (много уратов, мало воды),
2) кислая среда.
Повышение содержание уратов (гиперуратемия) – это результат
1) повышенного образования уратов (при избытке пуринов или при избыточной активности ферментов образования),
2) сниженного удаления уратов из тканей при снижении кровотока,
3) сниженного выведения.
Повышенное образование уратов – это результат
повышенного распада избыточного количества пуринов клеток
(особенно при разрушении клеток и при избытке пищи, содержащей много пуринов: мясо, икра, кофе, шоколад и т.д.).
Основная причина повышенного образования уратов в организме –
это особенность обмена веществ, при котором
очень активны ферменты, синтезирующие и разрушающие пурины.
Кислая среда в тканях – это результат
накопления лактата (п.32) при анаэробном гликолизе,
который стимулируется при гипоксии
(в основном из-за нарушения кровообращения в тканях при гиподинамии).
Отсюда меры по профилактике и лечению подагры:
1) ограничить употребление пищи, богатой пуринами,
2) позаботиться о нормальном кровообращении (гимнастика, массаж, мази и т.д.).
Снизить образование уратов и риск их накопления можно
применением ингибитора фермента, образующего мочевую кислоту (ксантин/оксидазы);
этот ингибитор называется аллопуринолом.
Снизить [уратов] в крови можно, применяя препарат, улучшающий их выведение почками (пробенецид).
Здесь нужно вставить таблицу
«Повышенная [уратов] в крови –
гипер/урат/емия или гипер/урик/емия (ГУЕ): причины и последствия.»
Но пока она в отдельном файле.
Причиной избытка уратов бывает
снижение превращения пуриновых оснований или нуклеозидов в нуклеотиды
(см. № 72) из-за снижения активности фермента.
Причина дефекта фермента – дефект его гена (мутация),
поэтому это заболевание относится к наследственным
и называется синдромом Леша-Нихана.
Кроме подагры из-за уратов,
при этом заболевании есть олигофрения, агрессивность и самокалечение
(ребенок способность отгрызть себе палец).
Из-за патологии почек дети с этим заболеванием не доживают до взрослого возраста.
Гиперуратемия при синдроме Л-Н. является первичной.
(Но не путайте с обычной подагрой).
Польза уратов.
В нормальных концентрациях ураты не только не опасны, но и полезны.
Они являются антиоксидантами.
Считается, что ураты продлевают жизнь, увеличивают энергичность и интеллект.
Потому что
1) многие выдающиеся люди болели подагрой,
2) [уратов] у человека больше, чем у обезьян
(факт: чем выше интеллект у вида приматов, чем больше у него уратов).
Здесь нужно вставить таблицу.
Но пока она в отдельном файле.
Распад нуклеиновых кислот
Полимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. Различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот с образованием олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или олигонуклеотидов. Помимо гидролитических нуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, например, посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5′-го углеродного атома рибозы одного мононуклеотида ко 2′-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2′-м и 3′-м углеродными атомами рибозы одного и того же мононуклеотида. К настоящему времени открыты группы нуклеаз, катализирующие распад ДНК и РНК.
Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфир-ных связей в одной из двух цепей молекулы ДНК между 3′-м углеродным атомом дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов:
ДНК + (n–1) Н2O –> n-Олигодезоксирибонуклеотиды.
Среди продуктов реакции открыты также моно- и динуклеотиды. Типичными представителями этих ферментов являются ДНКазы поджелудочной железы. Одна из них (ДНКаза I) была получена в чистом виде, расшифрована последовательность всех ее 257 аминокислотных остатков. Фермент наиболее активен при рН 6,8–8,0, активируется двухвалентными ионами Mg 2+ и Мn 2+ и ингибируется конечными продуктами ферментативной реакции – олигонуклеотидами.
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая мол. массу 38000 и состоящая из 343 аминокислотных остатков. В составе этой ДНКазы открыт глюкозамин. Фермент также активируется ионами металлов, ингибируется анионами; его оптимум рН между 5,5 и 5,8.
Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5′-дезоксирибонуклеотидов. Например, из E. coli выделено четыре таких фермента, обозначаемых экзодезоксирибонуклеазами I, II, III и IV.
Рестриктазы – ферменты ДНКазного типа действия – катализируют распад чужеродной (в основном фаговой) ДНК в строго определенных участках молекулы, имеющих структуру палиндромов. Из E. coli выделены и охарактеризованы две такие рестриктазы, обозначаемые EcoRI и EcoRII соответственно. Рестриктазы оказывают строго специфическое действие, поэтому они используются для расшифровки последовательности нуклео-тидных остатков в ДНК фагов и вирусов. Кроме того, это уникальное свойство рестриктаз находит все большее практическое применение в генетической инженерии при «вырезании» определенных фрагментов ДНК и «встраивании» их в геном бактериальной ДНК (получение рекомби-нантных ДНК). В результате клетке передается ряд не свойственных ей прежде наследственных признаков. Теоретическое и главным образом практическое значение подобных исследований трудно переоценить. Свидетельством огромного интереса к проблемам генетической инженерии является создание и успешное выполнение в институтах Российской АН и лабораторий ряда стран совместной комплексной программы – проекта «Рестриктазы».
Многие сотни рестриктаз выделены в очищенном состоянии и уже являются коммерческими препаратами.
Из ферментов, катализирующих гидролитический распад РНК, наиболее изучены рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. Выделенная из поджелудочной железы многих животных РНКаза состоит из 124 аминокислотных остатков во всех случаях, хотя ферменты несколько различаются последовательностью аминокислотных остатков; выяснена также третичная структура ряда РНКаз (см. главу 4). Получен в гомогенном состоянии из плесневого гриба рода Aspergillus фермент гуанилрибонуклеаза, катализирующая эндонуклеолитическое расщепление РНК.
Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотид-фосфорилазу и группу ДНК-гликозидаз. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотид-фосфорилазы в лаборатории С.С. Дебова; в той же лаборатории фермент открыт в животных тканях.
Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат, при этом образуется рибо-нуклеотиддифосфат (РДФ):
Предполагают, что in vivo фермент катализирует распад клеточных РНК, преимущественно мРНК, до нуклеозиддифосфатов, участвуя тем самым в регуляции концентрации клеточного неорганического фосфата. Следует указать еще на одну не менее важную уникальную функцию полинуклеотид-фосфорилазы – способность фермента катализировать в опытах in vitro синтез из свободных нуклеозиддифосфатов (НДФ) поли-рибонуклеотидов с заданной последовательностью. Этот фермент сыграл выдающуюся роль в расшифровке кода белкового синтеза в лабораториях лауреатов Нобелевской премии С. Очоа и М. Ниренберга (см. главу 15).
Открыта группа ДНК-гликозидаз, участвующих в реакциях отщепления модифицированных пуриновых и пиримидиновых оснований (например, урацила, образующегося при дезаминировании остатка цитозина в одной из цепей ДНК).
Таким образом, ДНК-гликозидазы выполняют важную функцию в процессах репарации (восстановление структуры) молекулы ДНК.
Распад нуклеиновых кислот в тканях



В клетках тканей нуклеиновые кислоты распадаются под влиянием нуклеаз. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы гидролизуют фосфодиэфирные связи одновременно во многих участках молекулы нуклеиновых кислот. По специфичности действия различают ДНКазы и РНКазы. В результате их действия образуются олигонуклеотиды и лишь небольшое количества мононуклеотидов. Экзонуклеазы отщепляют нуклеотиды с 3 ′ или 5′ конца, в результате образуются свободные рибонуклеозид или дезоксирибонуклеозид – 3`или 5′ фосфаты, например:
Рибо- и дезоксирибонуклеозидфосфаты расщепляются до нуклеозидов и фосфорной кислоты (под действием фосфатаз).
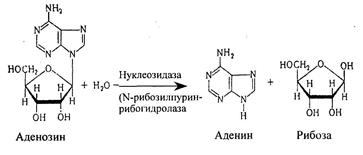
Нуклеозиды могут расщепляться и гидролитическим путем с участием фермента нуклеозидазы:
Аденозин + Н2О → Аденин + рибоза
Другие мононуклеотиды подвергаются расщеплению таким же образом.
Пентозы окисляются до CO2 и H2O; фосфорная кислота используется для фосфорилирования органических соединений или выводится из организма. Азотистые основания превращаются в конечные продукты обмена и выделяются с мочой.
Гуанин под действием фермента гуаназы превращается в ксантин. Мочевая кислота плохо растворяется в воде (1:15000) и при нарушении обмена нуклеиновых кислот, особенно при избыточном поступлении в организм пуринов, мочевая кислота и ее соли откладываются в виде кристаллов в суставах пальцев, хрящах, в коже и мышцах, образуя узелки. Вокруг узелков развивается очень болезненный воспалительный очаг. Это заболевание известно под названием подагра. У многих животных, кроме млекопитающих, аллантоин может подвергаться дальнейшему расщеплению (у некоторых рыб, амфибий, морских беспозвоночных) с образованиекм аллантоиновой кислоты, а из нее – мочевины и глиоксалевой кислоты.