Докажите что частицы взаимодействуют друг с другом
Основные положения молекулярно-кинетической теории (МКТ)
Какая-то абстрактная тема. Непонятно. В названии нет никаких уравнений, никаких законов. Что это вообще такое? Давайте попробуем разобрать название темы по словам. Мы думаем, что тогда что-то станет яснее.
« Основные положения… » – это, по-видимому, основные утверждения, которые надо понять, чтобы разобраться в «молекулярно-кинетической теории».
« Молекулярно-… » – это значит, что речь идёт про молекулы – некоторые мельчайшие частицы вещества. Мы думаем, что вы знаете про молекулы. Например, из химии. По крайней мере, знаете, что они в принципе существуют, а возможно, даже помните химические формулы некоторых молекул.
« …-кинетической… » – кинетика – знакомое слово. Например, оно встречалось в названии кинетической энергии – энергии движения. Значит, что-то движется. В названии темы есть слово «молекулы». Похоже, что они и движутся.
« …теории » – это слово, думаем, объяснять не нужно.
Если собрать вместе наше понимание отдельных частей, то получается, что это теория про то, что вещество состоит из молекул и они всё время двигаются. Так оно и есть.
По сути, перед тем как изучать вещество, физики решили договориться – а что такое вещество? Ответ на этот вопрос содержится в трёх пунктах – трёх постулатах молекулярно-кинетической теории:
1. Вещество состоит из мелких частиц: молекул или атомов; да, именно так – некоторые вещества состоят из молекул, а некоторые – напрямую, сразу – из атомов.
2. Эти частицы всё время хаотически (случайно) двигаются.
3. Частицы (молекулы) взаимодействуют друг с другом – отталкиваются и притягиваются.
Попробуем разобрать каждый из пунктов немного подробнее – и дополним картинками.
1. Вещество состоит из мельчайших частиц: молекул или атомов. Многие наверняка видели, как крошится сахар. Маленький кристаллик сахара можно дробить и дробить – так, что в итоге он превращается в пыль. Можно предположить, что есть некоторый предел этому дроблению, когда мы получим самые маленькие кусочки сахара – молекулы. Если бы нам удалось раздробить каждую из молекул сахара, то получившиеся фрагменты были бы уже не сахаром, а отдельными атомами, как вы, может быть, помните из курса химии.
На самом деле, молекулы сахара ну ооооочень маленькие. И тот сахарный порошок, который можно получить из сахара в домашних условиях, – это, конечно же, ещё не молекулы. Молекулы ещё меньше.


Что из перечисленного является примером хаотического теплового движения молекул?
Движение молекул воды в водопроводных трубах в квартире.
Движение молекул воздуха, взмывающих вверх над костром.
Движение молекул красителя в стакане с водой – постепенное распространение окраски воды на весь стакан.
Перемещение молекул воздуха в воздушном шарике, когда ребёнок бежит с ним по дороге.
3. Молекулы взаимодействуют друг с другом: отталкиваются и притягиваются. Ну, кажется, это вполне логично. Если одна молекула летит на другую, вряд ли одна молекула пройдёт насквозь через другую молекулу. Скорее всего, они оттолкнутся. Отталкивание, если рассматривать в деталях, – это электромагнитные силы. Но пока мы не будем сильно углубляться в этот вопрос.


Если толчёный мел размешать в воде, то частицы мела будут долго «висеть» в толще воды, не оседая на дно.
(Источник: ЕГЭ-2014. Физика. Досрочный экзамен. Вариант 1)
Это явление объясняется тем, что
вода выталкивает их вверх согласно закону Архимеда.
частицы мела совершают броуновское движение в воде.
Земля не притягивает столь мелкие частицы.
температура частиц мела выше температуры воды.
Идеальный газ
Возможно, вы знаете, что тела бывают:

Она фактически рождается из основных положений МКТ. Только есть небольшие изменения и дополнения. Вот они.
Модель идеального газа :
– размеры молекул газа несравнимо меньше расстояний между молекулами газа; молекулы идеального газа – это крошечные шарики, которые «летают» в пространстве»;
– эти «шарики» никак не взаимодействуют друг с другом на расстоянии – не притягиваются и не отталкиваются (кстати, это не противоречие МКТ, а её упрощение: в реальном мире молекулы взаимодействуют друг с другом – притягиваются и отталкиваются; нам же нужно что-то попроще, чем реальный мир, – поэтому мы говорим, что молекулы друг с другом не взаимодействуют);
– они взаимодействуют только при непосредственном ударе друг о друга;
Модель идеального газа – это упрощение ситуации с реальным газом. Но упрощение, которое очень близко к реальности – к тому, что происходит в газе по-настоящему.
Неплохим аналогом идеального газа может быть движение бильярдных шаров на столе. Правда, в этом случае движение плоское. В случае газа – оно объёмное.
Учитель записал на доске три утверждения, относящиеся к молекулам.
(Источник: ЕГЭ-2014. Физика. Тренировочная работа от 06.05.2014)
Какие из этих утверждений можно соотнести с моделью идеального газа?
Все три утверждения.
Только первое утверждение.
Первое и второе утверждения.
Первое и третье утверждения.
Задачи для самостоятельного решения: #основные положения мкт
Взаимодействие частиц веществ
В двух предыдущих параграфах мы обсудили опыты, иллюстрирующие первое и второе положения МКТ. Рассмотрим теперь эксперименты, иллюстрирующие третье основное положение МКТ и его следствия.
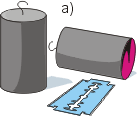
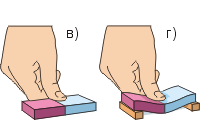
Для опыта возьмём два свинцовых цилиндрика с крючками. Чтобы убрать частицы пыли, ножом или лезвием зачистим до блеска торцы обоих цилиндриков (рис. а). Плотно прижав торцы друг к другу, мы обнаружим, что цилиндрики прочно «сцепились». Сила их сцепления настолько велика, что при удачном проведении опыта цилиндрики выдерживают тяжесть гири массой до 5 кг (рис. б). Из этого опыта следует вывод: частицы веществ притягиваются друг к другу. Однако это притяжение заметно лишь тогда, когда поверхности тел очень гладкие и, кроме того, плотно прилегают друг к другу.
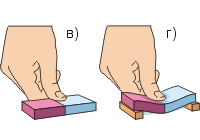
Проделаем второй опыт (рис. в, г). Чтобы сдавить резиновый ластик пальцем, требуется очень большая сила; ластик проще изогнуть, чем сдавить. Другие тела (кроме газообразных) также очень сложно сдавить. Это говорит о том, что частицы веществ отталкиваются друг от друга.
Притяжение и отталкивание частиц веществ возникают лишь в случае, если частицы находятся в непосредственной близости друг от друга. Как правило, на расстояниях, больших размеров самих частиц, они притягиваются; на расстояниях, меньших размеров частиц, они отталкиваются. Если частицы удалены на расстояние, во много раз большее, чем их размеры, взаимодействие почти не проявляется.
Рассмотрим теперь энергетический аспект взаимодействия частиц.
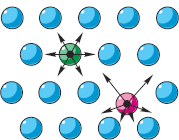
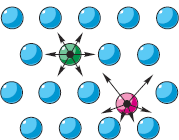
Если какие-либо тела взаимодействуют, они обладают потенциальной энергией, зависящей от взаимного положения этих тел (см. § 5-д). На рисунке справа стрелками на частицах показаны силы отталкивания «соседок». Так же можно было бы изобразить и силы притяжения. Если бы все частицы находились на равных расстояниях друг от друга, то все силы взаимно уравновешивались бы («зелёная» частица). Однако, согласно второму положению МКТ, частицы движутся. Поэтому расстояния от каждой частицы до её соседок всё время меняются («красная» частица). Следовательно, силы их взаимодействия постоянно меняются и не уравновешиваются. При этих изменениях расстояний и сил меняется потенциальная энергия каждой частицы, принимая минимальное значение в положении её равновесия.
Потенциальную энергию частицы считают нулевой, когда она находится на большом удалении от других частиц, как, например, в газах, где взаимодействия между частицами практически нет (см. рис. § 7-б). В твёрдых и жидких веществах взаимодействие частиц есть, значит, есть и потенциальная энергия частиц (в скобках заметим: она отрицательна, но сейчас нам важно её значение по модулю). И, чтобы преодолеть взаимодействие частиц и развести их на расстояние, нужно совершить работу. И, чем больше работа по преодолению взаимодействия частиц для разведения их на расстояние, тем больше (по модулю) потенциальная энергия взаимодействия частиц изучаемого вещества.
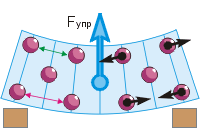
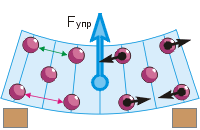
Возникновение силы упругости. Сжимая или растягивая, изгибая или скручивая тело, мы сближаем или удаляем его частицы (см. рисунок). Поэтому меняются силы притяжения и отталкивания частиц, совместное действие которых проявляется как сила упругости.
Вернёмся к изгибу ластика (рис. г). Частицы резины мы условно изобразили шариками. При надавливании пальцем верхние частицы сближаются друг с другом («зелёное» расстояние меньше «красного»). Это приводит к возникновению между ними сил отталкивания (чёрные стрелки направлены от частиц). Нижние частицы удаляются друг от друга, что приводит к возникновению между ними сил притяжения (чёрные стрелки направлены к частицам). В результате ластик стремится выпрямиться, а значит, в нём существует сила упругости, направленная вверх – противоположно силе давления пальца.
взаимодействие частиц вещества
Мы знаем, что тела и вещества состоят из отдельных частиц, между которыми есть промежутки. Почему же тогда тела не рассыпаются на отдельные частицы, подобно гороху в разорвавшемся пакете?
Проделаем опыт. Возьмем два свинцовых цилиндрика. Ножом или лезвием зачистим их торцы до блеска и плотно прижмем друг к другу. Мы обнаружим, что цилиндрики «сцепятся». Сила их сцепления настолько велика, что при удачном проведении опыта цилиндрики выдерживают тяжесть гири в 5 кг.
Из опыта следует вывод: частицы веществ способны притягиваться друг к другу. Однако это притяжение возникает лишь тогда, когда поверхности тел очень гладкие (для этого и понадобилась зачистка лезвием) и, кроме того, плотно прижаты друг к другу.
Частицы веществ способны отталкиваться друг от друга. Это подтверждается тем, что жидкие, а особенно твердые тела очень трудно сжать. Например, чтобы сдавить резиновый ластик, требуется значительная сила! Ластик гораздо легче изогнуть, чем сдавить.
Притяжение или отталкивание частиц веществ возникает лишь в том случае, если они находятся в непосредственной близости. На расстояниях, чуть больших размеров самих частиц, они притягиваются. На расстояниях, меньших размеров частиц, они отталкиваются. Если же поверхности тел удалены на расстояние, заметно большее, чем размер частиц, то взаимодействие между ними не проявляется никак. Например, нельзя заметить никакого притяжения между свинцовыми цилиндриками, если их сначала не сжать, то есть не сблизить их частицы.
Энергия взаимодействия частиц. Поскольку частицы вещества взаимодействуют, они обладают потенциальной энергией. Докажем это на примере частиц жидкости.
Возникновение силы упругости. Сжимая или растягивая, изгибая или скручивая тело, мы сближаем или удаляем его частицы. Поэтому между ними возникают силы притяжения-отталкивания, которые мы и объединяем термином «сила упругости».
Броуновское движение
7 класс, без форм заявки
Молекулярно-кинетическая теория
Мы состоим из клеток, клетки состоят из молекул, молекулы из атомов, атомы из… Ладно, пока достаточно атомов. И молекулы, и атомы подчиняются законам, которые описаны в молекулярно-кинетической теории.
В основе молекулярно-кинетической теории лежат три основных положения:
Броуновское движение
Во второй половине ХIХ века в научных кругах разгорелась нешуточная дискуссия о природе атомов. На одной стороне дискуссии утверждали, что атомы — просто математические функции, удачно описывающие физические явления и не имеющие под собой реальной физической основы.С другой стороны настаивали, что атомы — это реально существующие физические объекты.
Самое смешное в этих спорах то, что за десять лет до их начала ботаник Роберт Броун уже провел эксперимент, который доказал физическое существование атомов. Вот, как это было:
Как Броун проводил эксперимент
Броун изучал поведение цветочной пыльцы под микроскопом и обнаружил, что отдельные споры совершают абсолютно хаотичные движения.
Представьте себе, что мы издалека наблюдаем, как плотная толпа людей толкает над собой большой мяч. Причём каждый толкает мяч, куда хочет. Мы не видим отдельных игроков, потому что поле далеко от нас, но мяч мы видим — и замечаем, что перемещается он очень беспорядочно.
Мяч постоянно меняет направление своего движения, и пойти в какую-нибудь определенную сторону не желает. Предсказать его местоположение через заданное время — нельзя.
Вот что-то похожее на это Броун увидел при изучении пыльцы.
В первую очередь он начал грешить на движение потоков воды или ее испарение, но проверив эту гипотезу, отмел ее. Проведя множество экспериментов, Броун установил, что такое хаотичное движение свойственно любым микроскопическим частицам — будь то пыльца растений, взвеси минералов или вообще любая измельченная субстанция. Но причины этого явления он выяснить не смог (не в обиду ботаникам, но все же, это не его специализация).
А теперь угадайте, кто смог применить этот эксперимент в доказательстве атомной теории строения вещества. Альберт Эйнштейн, кто же еще. Он объяснил его примерно так: взвешенная в воде спора подвергается постоянной «бомбардировке» со стороны хаотично движущихся молекул воды.
В среднем, молекулы воздействуют на нее со всех сторон с равной интенсивностью и через равные промежутки времени. Однако, как бы ни мала была частица, в силу чисто случайных отклонений сначала она получает импульс со стороны молекулы, ударившей ее с одной стороны, а затем — со стороны молекулы, ударившей ее с другой. И так далее.
Чуть позже, через 3 года после открытия Эйнштейна, в 1908 году французский физик Жан Батист Перрен провел серию опытов, которые подтвердили правильность эйнштейновского объяснения броуновского движения. Стало окончательно ясно, что наблюдаемое «хаотичное» движение броуновских частиц происходит вследствие межмолекулярных соударений. Поскольку вывод о том, что несуществующие в природе математические функции не могут привести к физическому взаимодействию, напрашивается сам собой, стало окончательно ясно, что спор о реальности атомов окончен: они существуют в природе.
Также, если еще раз посмотреть на второе положение молекулярно-кинетической теории, можно заметить, что броуновское движение очень хорошо его доказывает: Атомы и молекулы находятся в непрерывном хаотическом движении.
Диффузия
Явление, которое доказывает первое и второе положения молекулярно-кинетической теории называется диффузия.
Диффузия в газах
Если в комнате открыть флакон с духами или зажечь ароматизированную свечу, то запах вскоре будет чувствоваться во всей комнате. Распространение запахов происходит из-за того, что молекулы духов проникают между молекулами воздуха. На самом деле, в этом процессе очень большую роль играет такой вид теплопередачи, как конвекция, но и без диффузии не обошлось.
На самом деле, молекулы вокруг нас движутся очень быстро — со скоростью в сотни метров в секунду — это напрямую зависит от температуры.
Давайте проверим это сами несложным экспериментом:
Замерьте температуру воздуха в помещении. Распылите освежитель воздуха в одном углу, встаньте в другой и включите секундомер. А лучше проведите эксперимент вдвоем, чтобы один человек распылял, а другой включал секундомер — так не будет погрешности, но будет веселье 😉
Как только почувствуете аромат освежителя в противоположном от места распыления, выключите секундомер. Запишите результат измерения. А потом проветрите помещение и проделайте все то же самое. Время, через которое до вас дойдет запах, будет другим. Во втором случае аромат будет распространяться медленнее.
То есть, чем выше температура, тем больше скорость диффузии.
Диффузия в жидкостях
Если диффузия в газах происходит быстро — чаще всего за считанные секунды — то диффузия в жидкостях занимает минуты или в некоторых случаях часы. Зачастую это зависит от температуры (как и в эксперименте выше) и плотности вещества.
С диффузией в жидкостях вы встречаетесь, когда, например, размешиваете краску. Или когда смешиваете любые две жидкости, например, газировку с сиропом. Также из-за диффузии происходит загрязнение рек (да и в целом окружающей среды).
Ну или вот пример диффузии в жидкостях, с которым вы точно не встречались — акулы ищут свою жертву по запаху крови, который распространяется в океане за счет диффузии.
Диффузия в твёрдых телах
Диффузия в твёрдых телах происходит очень медленно. Например, при комнатной температуре (около 20 °С) за 4-5 лет золото и свинец взаимно проникают друг в друга на расстояние около 1 мм.
Кстати, если вы проведете такой эксперимент, то увидите, что в свинец проникло малое количество золота, а свинец проник в золото на глубину не более одного миллиметра. Такое различие обусловлено тем, что плотность свинца намного выше плотности золота.
Этот процесс можно ускорить за счет нагревания, как в жидкостях и газах. Если на тонкий свинцовый цилиндр нанести очень тонкий слой золота, и поместить эту конструкцию в печь на неделю при температуре воздуха в печи 200 градусов Цельсия, то после разрезания цилиндра на тонкие диски, очень хорошо видно, что свинец проник в золото и наоборот.
Частицы взаимодействуют между собой доказательство. Взаимодействия частиц
с. 1
§ 6. Каковы свойства мельчайших частиц вещества?
Исследование разных веществ показали, что между атомами и молекулами в веществе есть промежутки, В этом вы убеждаетесь, когда пьете чай с сахаром. Если аккуратно насыпать сахарный песок в полный стакан с горячим чаем, то чай из стакана не будет выливаться. Это возможно лишь потому, что молекулы сахарозы заняли промежутки между молекулами воды, подобно тому, как не пересыпаясь через край, займут промежутки между картофелем горошинки, если мы захотим добавить в ведро картофеля пару стаканов гороха. Промежутки между молекулами сравнимы с размерами самих молекул, т.е. очень малы. Проведенные вами следующие опыты помогут вам убедиться в существовании этих межмолекулярных промежутков.
Сожмите шарик, заполненный воздухом. Вы легко это сделаете, так как межмолекулярные промежутки уменьшаются. Молекулы воздуха не изменяются, а только сближаются.
Теперь возьмем колбу, в которой есть воздух, закроем ее пробкой с вставленной в нее трубочкой, в которой находится капля подкрашенной жидкости. При нагревании колбы капелька жидкости будет подниматься по трубке. Это происходит потому, что при нагревании воздуха расстояния между молекулами увеличиваются, а значит увеличивается объем газа, и он перемещает каплю вверх.
Это явление учитывают при строительстве железных дорог, когда оставляют зазоры на рельсах. Летом рельсы нагреваются и расширяются. Поэтому, если бы не было зазоров, то рельсы могли бы лопнуть или изогнуться то привело бы к аварии поездов. (Вы нередко наблюдали, как убегает из кастрюли молоко или горячая вода из чайника, до краев наполненного. Это тоже примеры, доказывающие, что между молекулами и атомами в веществе есть промежутки.
Частицы вещества (атомы и молекулы) непрерывно, беспорядочно движутся.
В этом нас убеждает повседневный опыт. Не выходя из комнаты, мы знаем, что нам готовит мама на обед. Запах пирожков или кофе легко распространяется по всей квартире. Если же мы откроем флакон с духами, то очень скоро их запах распространится по комнате. Зацвела сирень, и ее чудный аромат ощущается во всем саду.
Как объяснить распространение запаха?
Оказывается, молекулы веществ движутся. При этом они сталкиваются с молекулами воздуха, беспорядочно перемещаясь, они распространяются в определенному пространстве и перемешиваются с молекулами газов, воздуха. Наблюдаемое явление называют диффузией .
Диффузия является одним из основных доказательств непрерывного, беспорядочного движения частиц вещества (атомов и молекул).
При диффузии частицы одного вещества стремятся равномерно распределиться между частицами другого вещества.
Диффузия происходит в любых телах, но с разной скоростью. Наблюдая за этим явлением, ученые установили, что скорость движения молекул зависит от температуры. Чем выше температура, тем быстрее происходит диффузия, а значит быстрее движутся молекулы. И все-таки запах мы ощущаем не сразу, а через несколько минут, так как молекулы газа испытывают соударения с другими молекулами и движутся по очень сложной линии.
В жидкостях скорость движения молекул меньше, чем в газах. Если мы не будем размешивать чай, то сладким он станет дня через два. Для того чтобы диффузия произошла в твердых телах потребуются годы. Например, было замечено, что в старых зданиях часто невозможно отделить болты, скрепляющие детали между собой, так как они «срастаются» друг с другом.
Интересный факт. Молекулы вещества очень малы, поэтому увидеть их движение даже используя микроскоп невозможно. Зато можно разглядеть, как молекулы жидкости «подталкивают» более крупные частички, если рассматривать каплю загрязненной воды. Впервые это явление наблюдал в 1827 г. английский ботаник Роберт Броун. Он рассматривал в микроскоп размешенную в воде цветочную пыльцу.
В поле зрения прибора взад и вперед сновали темные частички. Крупные двигались не спеша, мелкие прыгали быстро и беспорядочно.
Броун был настоящим ученым и, столкнувшись с непонятным явлением, добросовестно исследовал его. Он убедился, что путь этих частичек случаен, и обнаружил, что в горячей воде они движутся быстрее, чем в холодной.
Но Броун был ботаником, и объяснить увиденное физическое явление он не смог. Это удалось лишь А. Эйнштейну в 1905 г. Беспорядочное, хаотическое движение частиц вещества получило название броуновское движение частиц.
Какова роль диффузии в живой природе?
Диффузия имеет большое значение в жизни человека, животных и растений. Благодаря диффузии осуществляется обмен газов в легких и тканях живых организмов, то есть процесс дыхания. При выдохе удаляется углекислый газ, а при вдохе с воздухом поступает кислород, который из легких попадает в кровь путем диффузии. Без диффузии не обходится процесс питания во всех организмах. Частицы питательных веществ всасываются микроворсинками кишечника и через капилляры (мельчайшие сосуды) попадают в кровь. В жизни некоторых живых организмов большое значение имеет дыхание через кожу, которое осуществляется опять-таки за счет диффузии.
За счет диффузии из воздуха в воду природных водоемов и аквариумов поступает кислород, который жизненно необходим их обитателям.
Между атомами и молекулами в веществе есть промежутки. Частицы вещества находятся в непрерывном, беспорядочном движении, что является доказательством диффузии.
Диффузия происходит в любых телах (газообразных, жидких и твердых), но с разной скоростью, которая увеличивается с повышением температуры и уменьшается с ее понижением.
Диффузия имеет большое значение в жизни любого живого организма.
Проверьте свои знания
1. Какими свойствами обладают мельчайшие частицы вещества?
2. Докажите существование промежутков между мельчайшими частицами вещества.
3. Чем опасен разлив нефти по поверхности водоема?
4. Что называют диффузией?
5. В каких телах происходит диффузия и от чего зависит ее скорость?
6. Расскажите о значении диффузии в природе и жизни организмов.
§ 7. Как взаимодействуют частицы вещества?
Попытайтесь растянуть деревянный брусок или камень. Вряд ли у вас это получится. Почему? Потому что частицы вещества взаимодействуют друг с другом. В данном случае они сильно притягиваются. Разрывая лист бумаги, раскалывая полено, мы прикладываем некоторое усилие, потому что мы разъединяем множество притягивающихся друг к другу частиц вещества. Благодаря взаимному притяжению частиц твердые тела не рассыпаются на отдельные молекулы.
Но молекулы не только притягиваются, они еще и отталкиваются. Эти силы, например, мешают сжатию тел. Попробуйте сжать резиновый ластик. Что у вас получилось? Как вы думаете, почему? Сжать ластик было довольно трудно, так как этому препятствует отталкивание молекул. Силы межмолекулярного взаимодействия (притяжение и отталкивание) мы наблюдаем постоянно. Например, как сливаются вместе дождевые капли. Если прижать две тщательно отполированные металлические пластинки, то отделить их друг от друга будет сложно. Но разорванный лист бумаги снова соединить по линии разрыва невозможно, так как край бумаги очень тонкий и неровный. Однако большие пачки бумаги, если они длительное время хранятся, то листы такой бумаги будет трудно отделить один от другого. Значит, притяжение проявляется на очень незначительных расстояниях между частицами. На расстояниях в одну миллионную часть миллиметра притяжение между молекулами практически исчезает. На еще меньших расстояниях проявляется отталкивание. Без применения каких-либо усилий к телам притяжение и отталкивание между молекулами их веществ уравновешены.
Итак, частицы вещества взаимодействуют друг с другом, они притягиваются и отталкиваются.
Интересный факт. Взаимодействуют друг с другом не только молекулы одного и того же вещества. Благодаря такому взаимодействию мы можем склеивать, сваривать, красить. Камень, опущенный в воду, становится мокрым потому, что притяжение между молекулами воды и камня сильнее, чем между молекулами камня друг с другом. А вот воск не смачивается водой. Восковой налет на листьях не дает залить воде устьица, и дыхание растений не нарушается.
Агрегатные состояния вещества.
Как вы думаете, чем будут различаться разные состояния вещества, если химический состав их остается неизменным? Конечно же, расположением, взаимодействием и движением молекул. Твердые тела, как правило, кристаллические. Например: кварц, алмаз, поваренная соль, металлы, снежинки, представляющие собой кристаллики льда. Все они имеют правильную форму.
Молекулы в таких телах расположены близко друг к другу в строгом порядке, прочно удерживаются на своих местах, совершая «бег на месте», лишь изредка перескакивая и меняя свое положение. Этим и объясняется то, что твердые тела сохраняют форму и объем. В обычных условиях их трудно сжать или растянуть, согнуть или разорвать.
Как вам известно, при повышении температуры движение молекул становится быстрее, «прыжки» на другое место становятся чаще, да и расстояние между молекулами увеличивается. Взаимодействие между молекулами ослабевает, вещество становится текучим. Этим и объясняются основные свойства жидкостей: они плохо сжимаемы, текучи, сохраняют объем, но легко меняют форму.
Молекулы в веществе взаимодействуют: притягиваются или отталкиваются. Силы межмолекулярного взаимодействия проявляются на очень незначительных расстояниях между частицами вещества. Взаимное расположение, взаимодействие и характер движения молекул определяют агрегатное состояние вещества.
Агрегатное состояние вещества * Силы межмолекулярного взаимодействия: притяжение и отталкивание.
Проверьте свои знания
1. Назовите силы межмолекулярного взаимодействия. Приведите примеры этих сил.
2. Поместим под колоколом воздушного насоса слабо надутый шарик. Если откачивать воздух из-под колокола, шарик раздуется. Почему?
3. На каких расстояниях проявляются силы межмолекулярного взаимодействия?
4. Объясните, почему твердые тела хорошо сохраняют форму и объем?
5.В каких состояниях может находиться вещество? Приведите примеры.
6. Какие состояния вещества называют агрегатными?
7. Объясните, почему жидкости обладают малой сжимаемостью, не сохраняют свою форму?
8. Объясните, почему газы не сохраняют форму и объем, легко сжимаются?
с. 1
Раздел 2. Основы молекулярно-кинетической теории.
2.1 Основные положения молекулярно-кинетической теории. Броуновское движение. Силы и энергия межмолекулярного взаимодействия. Размеры и масса молекул. Постоянная Авогадро. Идеальный газ. Давление газа. Межзвездный газ*.
Основные положения молекулярно-кинетической теории и их опытные обоснования.
Существенный вклад в развитие молекулярно-кинетических представлений сделал в середине XVIII в. великий русский ученый Михаил Васильевич Ломоносов (1711-1765). Он объяснил основные свойства газа, предположив, что все молекулы газа движутся беспорядочно, хаотично и при столкновениях отталкиваются друг от друга. Беспорядочным движением молекул М. В. Ломоносов впервые объяснил природу теплоты. Так как скорости теплового движения молекул могут быть сколько угодно велики, температура вещества по его представлениям не имеет ограничения сверху. При уменьшении скорости молекул до нуля должно быть достигнуто минимальное возможное значение температуры вещества.
Основные положения молекулярно-кинетической теории. Макроскопическими телами называются большие тела, состоящие из огромного числа молекул. (Газ в баллоне, вода в стакане, песчинка, земной шар).
Тепловыми явлениями называют явления связанные с нагреванием и охлаждением тел, с изменением их температуры.
Тепловое движение – это беспорядочное движение молекул.
Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул как наименьших частиц химического вещества.
Основные положения молекулярно-кинетической теории строения вещества:
*эти частицы хаотически движутся;
частицы взаимодействуют друг с другом.
Броуновское движение – это тепловое движение взвешенных в жидкости (или газе) частиц и оно не может прекратиться, т.к. связано с температурой тела. Впервые это явление наблюдал английский ботаник Роберт Броун в 1927 г., рассматривая в микроскоп взвешенные в воде споры плауна. Броуновское движение никогда не прекращается, т.к. оно является тепловым движением. С увеличением температуры интенсивность его растет.
Пример броуновского движения в газах – движение взвешенных в воздухе частиц пыли и дыма. Причина броуновского движения частицы заключается в том, что удары молекул жидкости о частицу некомпенсируют друг друга. (рис 4.1)
Диффузия – это перемешивание молекул газов, жидкостей и твердых тел при непосредственном контакте, т.е. проникновение молекул одного вещества в межмолекулярное пространство другого. Скорость протекания диффузии зависит от температуры и состояния вещества. Это явление объясняется беспорядочным движением молекул.
Размеры и масса молекул.
Число молекул. При очень малых размерах молекул число их в любом макроскопическом теле огромно. При каждом вдохе мы вы захватываете столько молекул, что если бы все они после выдоха равномерно распределились в атмосфере Земли, то каждый житель планеты при вдохе получил бы две- три молекулы, побывавшие в ваших легких.
Относительной молекулярной(или атомной) массой вещества М r называют отношение массы молекулы (или атома) m 0 данного вещества к массы атома углерода m 0 c:
Один моль – это количество вещества, в котором содержится столько же молекул или атомов, сколько атомов содержится в углероде массой 0,012 кг.
Постоянная Авогадро равна числу молекул в 1 моле вещества. ;
Молярной массой вещества(М) называют массу вещества, взятого в количестве одного моля.


Идеальный газ. Идеальный газ – это газ, взаимодействие, между молекулами которого пренебрежимо мало. Молекулы этого газа – крошечные шарики, которые обладают пренебрежимо малым объемом по сравнению с объемом сосуда. Идеальный газ – это физическая модель реального газа. Разряженные газы ведут себя подобно идеальному газу.
Давление газа. Пусть газ находится в закрытом сосуде. Молекул газа очень много, и удары их о стенку следуют один за другим с очень большой частотой. Среднее значение геометрической суммы сил, действующих со стороны отдельных молекул при их столкновениях со стенкой сосуда, и является силой давления газа. Давление будет тем больше, чем больше молекул ударяется о стенку за некоторый промежуток времени и чем больше скорости соударяющихся со стенкой молекул.
Силы взаимодействия молекул
Но картина меняется, если уменьшать расстояние между частицами. Нейтральные молекулы начинают ориентироваться в пространстве так, что их обращённые друг к другу поверхности начинают иметь противоположные по знаку заряды и между ними начинают действовать силы притяжения. Это происходит, когда расстояние между центрами молекул больше суммы их радиусов.
Если продолжать уменьшать расстояние между молекулами, то они начинают отталкиваться в результате взаимодействия одноимённо заряженных электронных оболочек. Это происходит, когда сумма радиусов взаимодействующих молекул больше расстояния между центрами частиц.
Таким образом, прочность связей взаимодействия между частицами отличает три состояния вещества: твёрдое тело, газ и жидкость, и объясняет их свойства.
Возьмём воду в качестве примера. Размер, форма и химический состав частиц воды остаётся тем же самым, является ли она твёрдой (льдом) или газообразной (паром). Но то, как эти частицы движутся и расположены, различно для каждого состояния.
Твёрдые вещества

Они удерживаются вместе в равновесии и могут только вибрировать вокруг фиксированного положения. В связи с этим твёрдые вещества имеют высокую плотность и фиксированную форму и объем. Если оставить стол в течение нескольких дней в покое, он не расширится, и тонким слоем древесины по всему полу не заполнит комнату!
Жидкости

Молекулы жидкости обладают гораздо большей кинетической энергией (энергией движения), чем твёрдое тело, но гораздо меньше, чем газ.

§ 07-г. Взаимодействие частиц веществ
В двух предыдущих параграфах мы обсудили опыты, иллюстрирующие первое и второе положения МКТ. Рассмотрим теперь эксперименты, иллюстрирующие третье основное положение МКТ и его следствия.
Для опыта возьмём два свинцовых цилиндрика с крючками. Чтобы убрать частицы пыли, ножом или лезвием зачистим до блеска торцы обоих цилиндриков (рис. а). Плотно прижав торцы друг к другу, мы обнаружим, что цилиндрики прочно «сцепились». Сила их сцепления настолько велика, что при удачном проведении опыта цилиндрики выдерживают тяжесть гири массой до 5 кг (рис. б). Из этого опыта следует вывод: частицы веществ притягиваются друг к другу. Однако это притяжение заметно лишь тогда, когда поверхности тел очень гладкие и, кроме того, плотно прилегают друг к другу.
Проделаем второй опыт (рис. в, г). Чтобы сдавить резиновый ластик пальцем, требуется очень большая сила; ластик проще изогнуть, чем сдавить. Другие тела (кроме газообразных) также очень сложно сдавить. Это говорит о том, что частицы веществ отталкиваются друг от друга.
Притяжение и отталкивание частиц веществ возникают лишь в случае, если частицы находятся в непосредственной близости друг от друга. Как правило, на расстояниях, больших размеров самих частиц, они притягиваются; на расстояниях, меньших размеров частиц, они отталкиваются. Если частицы удалены на расстояние, во много раз большее, чем их размеры, взаимодействие почти не проявляется.
Рассмотрим теперь энергетический аспект взаимодействия частиц.
Потенциальную энергию частицы считают нулевой, когда она находится на большом удалении от других частиц, как, например, в газах, где взаимодействия между частицами практически нет (см. рис. § 7-б). В твёрдых и жидких веществах взаимодействие частиц есть, значит, есть и потенциальная энергия частиц (в скобках заметим: она отрицательна, но сейчас нам важно её значение по модулю). И, чтобы преодолеть взаимодействие частиц и развести их на расстояние, нужно совершить работу. И, чем больше работа по преодолению взаимодействия частиц для разведения их на расстояние, тем больше (по модулю) потенциальная энергия взаимодействия частиц изучаемого вещества.
Возникновение силы упругости. Сжимая или растягивая, изгибая или скручивая тело, мы сближаем или удаляем его частицы (см. рисунок). Поэтому меняются силы притяжения и отталкивания частиц, совместное действие которых проявляется как сила упругости.
Вернёмся к изгибу ластика (рис. г). Частицы резины мы условно изобразили шариками. При надавливании пальцем верхние частицы сближаются друг с другом («зелёное» расстояние меньше «красного»). Это приводит к возникновению между ними сил отталкивания (чёрные стрелки направлены от частиц). Нижние частицы удаляются друг от друга, что приводит к возникновению между ними сил притяжения (чёрные стрелки направлены к частицам). В результате ластик стремится выпрямиться, а значит, в нём существует сила упругости, направленная вверх – противоположно силе давления пальца.
В вашем браузере отключен Javascript.
Чтобы произвести расчеты, необходимо разрешить элементы ActiveX!
Взаимодействие частиц вещества
Современная теория строения вещества опирается на пять основных положений.
1. Все вещества состоят из частиц.
Атом – мельчайшая частица химического элемента, сохраняющая его свойства. Все известные химические элементы перечислены в таблице Менделеева. Молекула – мельчайшая частица вещества, сохраняющая его свойства. Молекула может состоять из одного или нескольких атомов.
2. Между частицами вещества есть промежутки.
3. Частицы вещества двигаются непрерывно и хаотично.
4. Движение частиц вещества становится интенсивнее с ростом температуры. Движение частиц вещества называют тепловым.
5. Частицы вещества взаимодействуют между собой: притягиваются и отталкиваются. Притяжение и отталкивание действуют одновременно и постоянно. Силы взаимодействия определяют свойства агрегатных состояний вещества. Так как в состав атомов и молекул входят частицы, обладающие электрическими зарядами, межмолекулярные взаимодействия имеют электромагнитную природу. Силы притяжения и отталкивания по-разному зависят от расстояния между частицами. На расстоянии, примерно равном размеру частицы, притяжение и отталкивание равны. Этому расстоянию соответствует наиболее устойчивое расположение частиц, с уменьшение расстояния преобладает отталкивание частиц. С увеличением – притяжение. На расстояниях, превышающих размер частицы в десять и более раз, силы взаимодействия ничтожно малы.
Каждое из пяти положений теории строения вещества имеет экспериментальные доказательства.
1. Фотографии веществ с большим увеличением. Такие явления, как стачивание, растворение, растекание жидкостей до образования тонких плёнок.
2. Фотографии вещества. Тепловое расширение веществ. Уменьшение суммарного объёма при смешивании различных жидкостей.
3. Диффузия и броуновское движение.
4. Возрастание скорости диффузии и интенсивности броуновского движения при увеличении температуры вещества.
5. Слипание веществ при их тесном контакте, упругие деформации, смачивание жидкостями твёрдых поверхностей.