Докажите на примерах что ферменты высокоспецифичны
Ферменты
Жизнь любого организма возможна благодаря протекающим в нем процессам обмена веществ. Этими реакциями управляют природные катализаторы, или ферменты. Другое название этих веществ – энзимы. Термин «ферменты» происходит от латинского fermentum, что означает «закваска». Понятие появилось исторически при изучении процессов брожения.

Рис. 1 — Брожение с использованием дрожжей – типичный пример ферментативной реакции
Человечество давно пользуется полезными свойствами этих ферментов. Например, уже много веков из молока с помощью сычужного фермента делают сыр.
Ферменты отличаются от катализаторов тем, что действуют в живом организме, тогда как катализаторы – в неживой природе. Отрасль биохимии, которая изучает эти важнейшие для жизни вещества, называется энзимологией.
Общие свойства ферментов
Ферменты представляют собой молекулы белковой природы, которые взаимодействуют с различными веществами, ускоряя их химическое превращение по определенному пути. При этом они не расходуются. В каждом ферменте есть активный центр, присоединяющийся к субстрату, и каталитический участок, запускающий ту или иную химическую реакцию. Эти вещества ускоряют протекающие в организме биохимические реакции без повышения температуры.
Основные свойства ферментов:
Роль ферментов в организме человека невозможно переоценить. В то время, когда еще только открыли структуру ДНК, говорили, что один ген отвечает за синтез одного белка, который уже определяет какой-то определенный признак. Сейчас это утверждение звучит так: «Один ген – один фермент – один признак». То есть без активности ферментов в клетке жизнь не может существовать.
Классификация
В зависимости от роли в химических реакциях, различаются такие классы ферментов:
Классы
Особенности
Катализируют окисление своих субстратов, перенося электроны или атомы водорода
Участвуют в переносе химических групп из одного вещества в другое
Расщепляют крупные молекулы на более мелкие, добавляя к ним молекулы воды
Катализируют расщепление молекулярных связей без процесса гидролиза
Активируют перестановку атомов в молекуле
Образуют связи с атомами углерода, используя энергию АТФ.
В живом организме все ферменты делятся на внутри- и внеклеточные. К внутриклеточным относятся, например, ферменты печени, участвующие в реакциях обезвреживания различных веществ, поступающих с кровью. Они обнаруживаются в крови при повреждении органа, что помогает в диагностике его заболеваний.
Внутриклеточные ферменты, которые являются маркерами повреждения внутренних органов:
Внеклеточные ферменты выделяются железами во внешнюю среду. Основные из них секретируются клетками слюнных желез, желудочной стенки, поджелудочной железы, кишечника и активно участвуют в пищеварении.
Пищеварительные ферменты
Пищеварительные ферменты – это белки, которые ускоряют расщепление крупных молекул, входящих в состав пищи. Они разделяют такие молекулы на более мелкие фрагменты, которые легче усваиваются клетками. Основные типы пищеварительных ферментов – протеазы, липазы, амилазы.
Основная пищеварительная железа – поджелудочная. Она вырабатывает большинство этих ферментов, а также нуклеаз, расщепляющих ДНК и РНК, и пептидаз, участвующих в образовании свободных аминокислот. Причем незначительное количество образующихся ферментов способно «обработать» большой объем пищи.
При ферментативном расщеплении питательных веществ выделяется энергия, которая расходуется для процессов обмена веществ и жизнедеятельности. Без участия ферментов, подобные процессы происходили бы слишком медленно, не обеспечивая организм достаточным энергетическим запасом.
Кроме того, участие ферментов в процессе пищеварения обеспечивает распад питательных веществ до молекул, способных проходить через клетки кишечной стенки и поступать в кровь.
Амилаза
Амилаза вырабатывается слюнными железами. Она действует на крахмал пищи, состоящий из длинной цепи молекул глюкозы. В результате действия этого фермента образуются участки, состоящие из двух соединенных молекул глюкозы, то есть фруктоза, и другие короткоцепочечные углеводы. В дальнейшем они метаболизируются до глюкозы в кишечнике и оттуда всасываются в кровь.
Слюнные железы расщепляют только часть крахмала. Амилаза слюны активна в течение короткого времени, пока пища прожевывается. После попадания в желудок фермент инактивируется его кислым содержимым. Большая часть крахмала расщепляется уже в 12-перстной кишке под действием панкреатической амилазы, вырабатываемой поджелудочной железой.
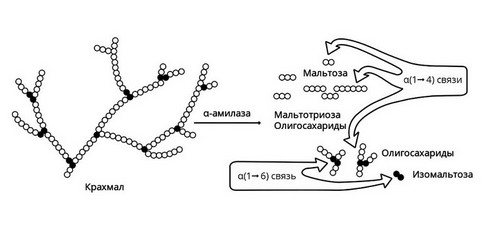
Рис. 2 — Амилаза начинает расщепление крахмала
Короткие углеводы, образовавшиеся под действием панкреатической амилазы, попадают в тонкий кишечник. Здесь с помощью мальтазы, лактазы, сахаразы, декстриназы они расщепляются до молекул глюкозы. Нерасщепляющаяся ферментами клетчатка выводится из кишечника с каловыми массами.
Протеазы
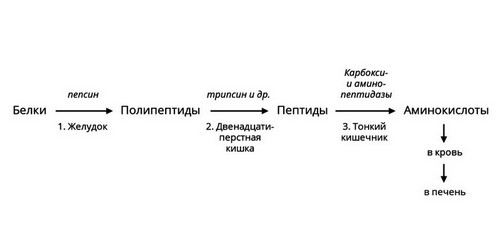
Рис. 3 — Ферментативное расщепление белков
Протеазы расщепляют пищевые белки на более мелкие фрагменты – полипептиды. Ферменты – пептидазы разрушают их до аминокислот, которые усваиваются в кишечнике.
Липазы
Пищевые жиры разрушаются ферментами-липазами, которые также вырабатываются поджелудочной железой. Они расщепляют молекулы жира на жирные кислоты и глицерин. Такая реакция требует наличия в просвете 12-перстной кишки желчи, образующейся в печени.
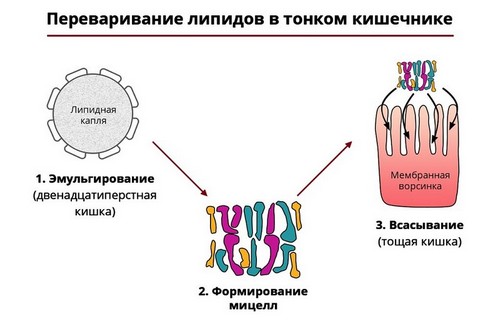
Рис. 4 — Ферментативный гидролиз жиров
Роль заместительной терапии препаратом «Микразим»
Для многих людей с нарушением пищеварения, прежде всего с заболеваниями поджелудочной железы, назначение ферментов обеспечивает функциональную поддержку органа и ускоряет процессы выздоровления. После купирования приступа панкреатита или другой острой ситуации прием ферментов можно прекратить, так как организм самостоятельно восстанавливает их секрецию.
Длительный прием ферментативных препаратов необходим лишь при тяжелой внешнесекреторной недостаточности поджелудочной железы.
Одним из наиболее физиологичных по своему составу является препарат «Микразим». В его состав входят амилаза, протеазы и липаза, содержащиеся в панкреатическом соке. Поэтому нет необходимости отдельно подбирать, какой фермент нужно использовать при разнообразных болезнях этого органа.
Показания для использования этого лекарства:
Прием пищеварительных ферментов с заместительной целью помогает избежать вздутия живота, жидкого стула, болей в животе. Кроме того, при тяжелых хронических заболеваниях поджелудочной железы Микразим полностью принимает на себя функцию по расщеплению питательных веществ. Поэтому они могут беспрепятственно усваиваться в кишечнике. Это особенно важно для детей, страдающих муковисцидозом.
Важно: перед применением ознакомьтесь с инструкцией или проконсультируйтесь с лечащим врачом.
Когда желудку и кишечнику не хватает ферментов
Основным инструментом пищеварения являются ферменты, именно они выполняют всю основную работу. Логично, что при их недостатке процесс пищеварения нарушается, и организм начинает нам сообщать о проблемах, сигнализируя различными симптомами. Такие привычные всем симптомы как изжога, тяжесть в животе, боль, метеоризм, диарея или запор – являются прямым указанием на проблемы с пищеварением.
Ферменты поджелудочной железы – виды и функции
Пора узнать, что представляют собой ферменты, и как они влияют на пищеварение. Ферменты поджелудочной железы – это белковые комплексы или катализаторы, основной задачей которых является расщепление питательных веществ на простые, легкоусвояемые соединения. Таким образом, организм легко усваивает все необходимые элементы и витамины.
Какие ферменты вырабатывает поджелудочная железа и какие у них функции?
Особо интересно то, что организм может регулировать выработку тех или иных ферментов в зависимости от характера потребляемой пищи. То есть, если вы потребляете много хлебобулочных изделий, то упор в выработке будет сделан на амилазе, если потребляется жирная пища, то поджелудочная железа отправит в кишечник больше липазы.
Кажется, что работа полностью налажена, и сбоев быть не может. Но сбои случаются и достаточно часто: слишком тонкий механизм работы, который легко нарушить. Даже большой приём пищи с преобладанием жиров может сломать систему, и поджелудочная железа не сможет обеспечить нужное количество ферментов.
Появление проблем с пищеварением
Мы выяснили, что проблемы с пищеварением могут возникать из-за недостатка ферментов. Существует два основных механизма, при которых организму не хватает ферментов поджелудочной железы. В первом варианте проблема с выработкой ферментов кроется в самой поджелудочной железе, т.е. сам орган функционирует неправильно.
Во втором варианте нарушаются условия, при которых ферменты могут правильно работать. Подобное возможно в результате изменения кислотности среды кишечника, например, при воспалении или при изменении стандартной температуры окружения (36-37° С). Воспалительный процесс в кишечнике может возникать при различных состояниях: кишечные инфекции, аллергические реакции (пищевая аллергия, атопический дерматит).
Основные признаки нехватки ферментов поджелудочной железы
Выявить недостаток ферментов достаточно просто. Ключевыми симптомами являются тяжесть после еды, чувство распирания в животе и дискомфорт в животе. Нередко эти симптомы сопровождаются вздутием, урчанием, метеоризмом, диареей. Чаще всего такие симптомы могут возникать в рядовых ситуациях: при употреблении тяжелой, жирной пищи или при переедании, когда удержаться от множества вкусных блюд попросту не удалось. В этом случае не стоит бояться неполадок с поджелудочной железой или других заболеваний ЖКТ. Поджелудочная железа просто не справляется с большим объемом работы, и ей может потребоваться помощь.
Если нехватка ферментов и проблемы с пищеварением сохраняются длительное время, то это не остается незаметным для организма. Симптомы могут усугубляться и носить уже не эпизодический, а регулярный характер. Постоянная диарея дает старт авитаминозу, могут развиваться: белково-энергетическая недостаточность и обезвоживание во всем организме. Может наблюдаться значительное снижение массы тела. Помимо этого при тяжелых стадиях могут наблюдаться следующие симптомы недостатка ферментов поджелудочной железы 8 :
Поддержание пищеварения и лечение ферментной недостаточности
При проблемах с пищеварением могут помочь ферментные препараты (чаще они называются препаратами для улучшения пищеварения), основная задача которых компенсировать нехватку собственных ферментов в организме. Не зря такая терапия называется «ферментозаместительная». Критически важно, чтобы ферментный препарат максимально точно «имитировал» физиологический процесс.
На сегодняшний момент существуют различные препараты для улучшения пищеварения. Как же ориентироваться в многообразии средств и сделать правильный выбор?
Эффективный ферментный препарат должен соответствовать следующим критериям 5,6 :
Высокоспецифичные ферменты, применяемые
В аналитических системах
| Фермент | Субстрат |
| АМФ-деаминаза | Аденозин монофосфат |
| Аспартаза | L-аспартат |
| Глутаматдекарбоксилаза | L-глутамат |
| Глутаматдегидрогеназа | L-глутамат |
| Глюкозооксидаза | D-глюкоза |
| Инвертаза | Сахароза |
| Каталаза | Перекись водорода |
| Лактатдегидрогеназа | L-лактат, пируват |
| Лизиндекарбоксилаза | L-лизин |
| Люцифераза светляков | АТФ |
| Люцифераза бактерий | Флавинмононуклетид восст. |
| Малатдегидрогеназа | Оксалоацетат |
| Мутаротаза | D-глюкоза |
| Нитратредуктаза | Нитрат ион |
| Нитритредуктаза | Нитрит ион |
| Уреаза | Мочевина |
| Урикиназа | Мочевая кислота |
| Тирозиндекарбоксилаза | L-тирозин |
| Фенилаланиндекарбоксилаза | a-фенилаланин |
| Холестериноксидаза | Холестерин |
Декарбоксилазы катализируют превращение только отдельных аминокислот. Наиболее высокой специфичностью обладает лизиндекарбоксилаза. Характерно, что ферменты класса трансфераз, изомераз и лигаз, осуществляющие тонкие биохимические превращения в клетке, как правило, обладают высокой специфичностью.
Ферменты, обладающие групповой специфичностью
| Фермент | Субстрат |
| Алкогольдегидрогеназа | Спирты |
| Арилсульфатаза | Эфиры серной кислоты |
| b-глюкозидаза | b-глюкозиды |
| Диаминооксидаза | Биогенные амины |
| Оксидазы D-аминокислот | D-аминокислоты |
| Оксидазы L-аминокислот | L-аминокислоты |
| Пенициллиназа | Производные 6-аминопенициллиновой к-ты |
| Пенициллинамидаза | Пенициллины и другие соединения |
| Пероксидаза | Ароматические соединения |
| Протеазы (химотрипсин, трипсин) | Эфиры аминокислот |
| Полифенолоксидаза | Замещенные фенолы |
| Холинэстераза | Эфиры холина и тиохолина |
| Щелочная фосфатаза | Эфиры фосфорной к-ты |
Во втором случае – это ферменты, обладающие групповой специфичностью. К ним относятся гидролазы и оксидоредуктазы. Синтезируя эти ферменты, клетки утилизируют источники питания и метаболиты таким образом, чтобы нейтрализовать действие соединений, вредных для жизнедеятельности организма. Они катализируют окисление аминокислот и ароматических соединений, гидролиз эфиров сахаров, фосфорной и серной кислот, разрушение лактамного кольца в производных 6-аминопенициллиновой кислоты и др. Кроме того, велика их роль в выявлении молекулярных механизмов катализа специфических химических реакций.
Факторы, влияющие на процесс ферментативного катализа. Каталитическая активность ферментов зависит от ряда факторов. Упомянем лишь те, которые могут оказывать существенное влияние на работоспособность биосенсорного устройства: температура, ионный состав среды, наличие в среде тяжелых металлов и других ферментных ингибиторов.
По мере возрастания температуры обычно скорость химической реакции возрастает. Это же правило характерно и для реакций, катализируемых ферментами, но для ограниченного диапазона температур. Зависимость скорости процесса, катализируемого ферментами, характеризуется наличием оптимума (рис. 5), т. е. скорость реакции растет лишь до определенного значения температуры. Дальнейшее по-вышение температуры резко снижает активность фермента. Следует отметить, что значение величины оптимальной температуры для различных ферментов или одного и того же фермента, выделяемого из разных биологических объектов, сильно различается. Поэтому именно подбором организма, из которого выделяется фермент, и подбором фермента, для которого определяемое вещество является субстратом, в большинстве случаев удается найти подходящий тест-объект биосенсора, который будет работоспособным в оговоренном диапазоне температур. Однако и в данном случае возможности подбора далеко не безграничны, большинство ферментов необратимо денатурируются при нагреве их свыше 45–50 o С.
Зависимость каталитической активности ферментов от рН среды в некоторой степени напоминает выше рассмотренную для температуры (рис. 6). И в этом случае существует оптимальное значение кислотности среды, при которой активность фермента максимальна. Отклонение рН в кислую или щелочную область от оптимального значения резко снижает активность фермента. Значение оптимальной величины рН для каждого фермента индивидуально и колеблется в очень широких пределах. При этом ферменты, относящиеся к одному и тому же классу и катализирующие одни и те же реакции, но извлеченные из разных организмов (или разных органов одного организма), могут чрезвычайно различаться по величине оптимального значения рН. Например, протеолитические ферменты пепсин и папаин характеризуются оптимумами рН около 1,0 и 7,0 соответственно, т. е. и в этом
 |
 |
 |
3 4 5 6 7 8
Рис. 6. Зависимость максимальной скорости ферментативной
Реакции от рН
случае среди значительного разнообразия ферментов принципиально возможно выбрать подходящий вариант.
Ионы тяжелых металлов являются эффективными ингибиторами ферментов. Действие их на белковые глобулы проявляется по-разному. Возможна химическая модификация аминокислотных остатков, главным образом цистеина, с образованием сульфидов солей. Если остаток цистеина входит в активный центр фермента или в фрагмент молекулы, ответственный за поддержание нативной структуры глобулы белка, модификации тиольных остатков инактивирует катализатор. Наиболее универсальное ингибирующее действие ионов металлов связано с их способностью образовывать координационные связи. Как известно, входящие в активные центры ферментов нуклеофильные остатки гистидина, лизина и т. д. весьма склонны к образованию координационных связей с ионами тяжелых металлов. Наконец, ионы тяжелых металлов переменной валентности (меди, железа) катализируют окисление аминокислотных остатков. Взаимодействие ионов металлов с белковыми молекулами, как правило, протекает необратимо, поэтому самый лучший способ защиты фермента от действия этих ингибиторов заключается в удалении свободных ионов путем очистки, комплексообразования при помощи добавляемых реагентов (ЭДТА) или путем связывания в нерастворимые соли.
Механизм действия перекиси водорода до конца не выяснен; по-видимому, основная причина инактивации заключается в окислении функционально важных групп фермента.
С другой стороны, сильная зависимость величины ферментативной активности от присутствия низкомолекулярных ингибиторов в значительной мере расширяет возможности применения ферментов в аналитических целях. Во всяком случае, тест-объекты на основе ферментов могут быть использованы не только при анализе биогенных субстратов, но и для определения содержания токсических неорганических соединений, например тяжелых металлов и перекисей.
Высокая каталитическая способность и специфичность ферментов определяет их применение в качестве аналитических реагентов. Простой расчет показывает,что в условиях реакции первого порядка для превращения 99 % исходного субстрата в течение 1 мин требуется всего 0,14 мкМ фермента, обладающего «средними» каталитическими параметрами. Количество фермента может быть значительно уменьшено при использовании кинетического метода определения скорости превращения субстрата.
Использование высокоспецифичных ферментов позволяет селективно определять субстраты в присутствии других соединений. Вместе с тем ферменты с групповой специфичностью используются для обнаружения таких классов соединений, как антибиотики (пенициллиназа), токсичные гидросилированные производные бензола (полифенолоксидаза) и т. д.
В обычных методиках анализа процесс контролируется с применением одного из физико-химических способов оценки потребления, исходных реагентов или образования продуктов реакции, при этом ферменты расходуются так же, как и другие реагенты. Благодаря иммобилизации ферментов создалась возможность многократного применения биокатализаторов. На основе этих гетерогенных ферментов были созданы принципиально новые аналитические системы – биосенсоры, которые нашли широкое применение в научной практике и на производстве.
В конце данного раздела укажем основные достоинства и недостатки ферментов как тест-объектов биосенсорных устройств. К достоинствам относятся:
Высокая селективность.
2. Высокая чувствительность (обусловлена каталитической активностью ферментов).
3. Возможность подбора фермента с соответствующими техническому заданию свойствами (ферменты достаточно давно исследуются, проведена их классификация, установлены содержание и локализация многих ферментов в отдельных организмах).
Относительно низкая стоимость (хотя в целом процедуры выделения и очистки указанных препаратов достаточно трудоемки, однако налажено промышленное производство значительного числа ферментов, используемых в биотехнологическом производстве. Именно увеличение масштабов производства и дает возможность снизить их себестоимость).
Докажите на примерах что ферменты высокоспецифичны
Ферменты
Ферменты синтезируются только живыми клетками, мертвые клетки их не образуют. Ферменты высокоспецифичны. Каждый фермент ускоряет только одну или группу сходных между собой химических реакций.
Очень небольшое количество ферментов вызывает превращения огромного количества вещества, но сами ферменты при этом не расходуются. Ферменты вступают в соединение с субстратом и участвуют в самом превращении вещества, но в конце реакции освобождаются в неизменном виде.
Первая группа непосредственно участвует в ферментной реакции. Коллоидный же белковый носитель увеличивает активность фермента, определяет специфичность его действия. Простетическая группа обычно содержит те или иные витамины или металлы (железо, медь, магний и др.).
Ферменты снижают энергию активизации, осуществляющую химическую реакцию, направляя ее обходным путем через промежуточные реакции, требующие значительно меньшей активизации. В условиях организма почти всегда действует целая группа ферментов, разбивающих процесс превращения вещества на большое число ступеней, так, например, превращение сахара в спирт проводится десятью последовательно действующими ферментами. Каждый фермент вызывает определенное изменение одного вещества. Продукт одной ферментативной реакции служит субстратом для последующей ферментативной реакции. Образованное новое вещество подвергается последовательно действию следующего фермента. Последовательность действия ферментов обеспечивается тем, что ферменты строго локализованы на определенных структурах клетки. Благодаря этому наблюдается необычайная согласованность действия отдельных ферментов, приводящих к поразительной слаженности всех обменных реакций.
Микробы имеют те же ферменты, что и растения. Но есть ряд ферментов, встречающихся только у микробов, например целлюлаза, гидролизирующая клетчатку корма в желудке жвачных, фиксация атмосферного азота происходит в результате действия специфических ферментных систем, которых нет у животных и высших растений.
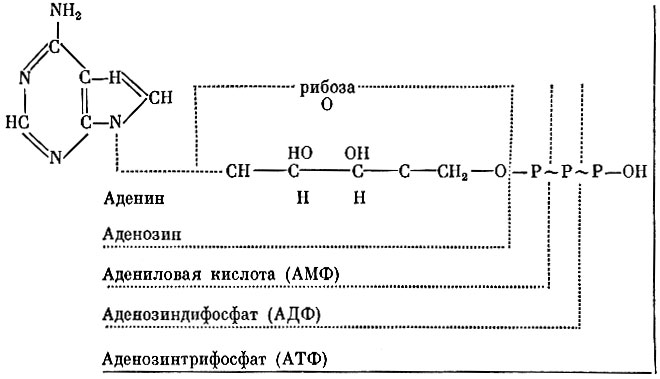
Из химических соединений, входящих в коферменты, наиболее важное значение имеют гемин, тимин, флавин, аденин, пиридин. Но эти соединения в коферменте должны находиться в нуклеотидной форме, т. е. соединены с азотистым основанием рибозой и фосфорной кислотой. В этой форме происходит взаимодействие между коферментом и специфическим белком. Так, в состав анаэробных дегидраз входит кофермент ди- или трифосфопиридиннуклеотид (НАД или НАДФ), действующее начало в нем витамин никотинамид (ниацин). В аэробной дегидразе коферментом является флавинадениннуклеотид (ФАД), он содержит витамин флавин (В2). Имеется много других подобных коферментов.
Коферменты, участвующие в аккумуляции и переносе энергии, представляют адениловую систему, строение ее показано на схеме ниже. В составе аденозинтрифосфорной кислоты имеются две макроэргические фосфатные связи (обозначенные знаком
), каждая по 10-16 тысяч калорий, тогда как в обычных эфирных связях содержится всего по 2-3 тысячи калорий.
Схема
Макроэргическую связь в 8 тысяч калорий содержит кофермент А, но не с фосфором, а с серой. Кофермент содержит витамин пантотеновую кислоту. Он служит переносчиком остатков уксусной и других кислот, конденсирует уксусную кислоту со щавелевоуксусной кислотой, в результате чего образуется лимонная кислота.
Ферменты синтеза называются синтетазами и литазами. Академик А. И. Опарин показал, что гидролитическое действие ферментов осуществляется в гомогенном растворе.
Ферментативная деятельность микробов имеет огромное практическое значение в промышленной технологии виноделия, пивоварения, хлебопечения, в получении спиртов, щавелевой, молочной кислот, глицерина и пр. Многие ферменты применяются как лечебные средства.
Таблица 3. Ферменты микроорганизмов, имеющие важное значение в промышленности (по Фробишеру)
Определение ферментативных свойств используется в систематике микробов при определении видов микроорганизмов.
Подробные сведения о ферментах можно найти в руководствах по биологической химии.