Доп трабекула левого желудочка что это
Основные малые аномалии сердца
К малым аномалиям развития сердца (сокращённо МАРС) относят ряд патологических изменений, наблюдающихся в анатомической структуре сердца и сосудов у детей. В некоторых случаях МАРС могут приводить к серьёзным последствиям для кровообращения, поэтому нуждаются в постоянном наблюдении и серьёзном подходе при проведении клинического обследования.
Благодаря современным диагностическим подходам (эхокардиография и УЗИ сердечных сосудов), выявить подобные отклонения и принять меры медикам гораздо проще, чем раньше.
В данном материале будут рассмотрены основные патологии, с которыми может столкнуться медицинский специалист в ходе своей профессиональной деятельности.
Пролапс митрального клапана
Под пролапсом понимают анатомический дефект в митральном сердечном клапане. Он расположен между левым желудочком и предсердием. При сокращении предсердия он открывается, что обеспечивает свободное поступление крови в желудочек — и далее, по общему кровотоку. Если развивается серьёзная патология митрального клапана, происходит «прогибание» его створок. В худшем случае, кровь частично остаётся в левом предсердии, что чревато неприятной симптоматикой:
Обычно такие симптомы являются скорее исключением из правил, и незначительный пролапс митрального клапана не представляет угрозы для жизни и здоровья ребёнка. Опасен выраженный пролапс. Он проявляется сильным прогибанием створок и более серьёзными нарушениями сердечной деятельности (при второй и третьей степени).
Открытое овальное окно
Это отверстие, расположенное между двумя верхними камерами сердца (левым и правым предсердиями). Оно выполняет функции «дверцы» во время развития ребёнка в утробе матери. Через неё кровь сбрасывается у плода справа налево. Так происходит обмен кровотоком между малым и большим кругами кровообращения. Открытое овальное окно у ребёнка до рождения на свет играет большую роль, «помогая» неразвитым лёгким справляться с кровотоком. Именно оно обеспечивает проход крови к левому предсердию и аорте.
Когда ребёнок рождается и его лёгкие, расправляясь, начинают работать в полную силу, овальное окошко «автоматически» закрывается. На его месте остаётся маленькое углубление. Однако бывают случаи, когда овальное окно не закрывается после рождения малыша. Важно иметь в виду, что к порокам сердца такая аномалия не относится, а выявить её можно при проведении эхокардиографии. Обычно, для этого применяют методику пузырькового контраста, и если у малыша овальное окно не закрыто, воздушные пузырьки при обследовании станут перемещаться справа налево.
Аневризма межпредсердной перегородки
Стенка между левым и правым предсердием иногда может быть искривлена. Происходит её выпячивание в сторону – вправо либо влево. Чаще всего причиной её развития у детей выступает наследственный фактор. Спровоцировать развитие аневризмы межпредсердной перегородки могут и внутриутробные инфекции. В каждом возрасте можно выделить разные клинические проявления этой аномалии:
Во избежание разрыва аневризмы её следует регулярно наблюдать и проводить современные диагностические манипуляции.
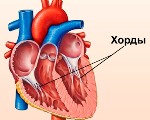
Ложные хорды
В нашем сердце есть так называемые «истинные хорды», состоящие из плотных мышц. Расположены они в обоих желудочках сердца и прикреплены своими окончаниями к двум клапанам — трискупидальному и митральному. Их функция состоит в том, чтобы держать створки клапанов в естественном положении и не давать им вывернуться в полость сердца, когда желудочки сокращаются.
К ложным хордам левого желудочка относят анатомические образования, которые не прикреплены к клапанным створкам и находятся в полости сердечной камеры. Патологические хорды могут быть продольными и поперечными, а когда происходит сокращение сердца, они дают сердечные шумы, иногда напоминающие звучание скрипки.
Бывают дополнительные хорды, которые не вызывают серьёзных патологических изменений. Выявить ложные хорды можно с помощью ЭхоКГ и ультразвукового исследования. Иногда выраженной симптоматики у ребёнка нет, кроме характерного шума при прослушивании сердца, но если ложных хорд слишком много и они находятся поперечно, это может приводить в аритмии и серьёзным нарушениям кровообращения.
МАРС не относят к порокам сердца, но иногда они могут представлять реальную опасность для здоровья и жизни ребёнка. Именно поэтому своевременное выявление таких патологий очень важно для работы врача-кардиолога, а также любого специалиста, занимающегося ультразвуковой и функциональной диагностикой.
Хотите знать больше?
При поддержке Современной научно-технологической академии 31 января 2020 года состоится бесплатный вебинар «Малые аномалии в эхокардиографии». В ходе вебинара будут разобраны все малые сердечные аномалии, их причины, клиническое течение и современные способы диагностики.
Для того, чтобы стать участником образовательного мероприятия необходимо пройти регистрацию.
Что такое трабекула левого желудочка: причины, симптомы, лечение патологии
Кардиомиопатия может быть различных форм, среди которых самой редко встречающейся считается гипертрабекулярность левого желудочка. Заболевание в основном определяется у детей, хотя иногда встречается среди взрослых. В тяжелых случаях может потребоваться даже пересадка сердца.
Гипертрабекулярность левого желудочка (ГТЛЖ, некомпактный миокард, губчатая кардиомиопатия) — это состояние, при котором мышечная стенка левого желудочка сердца становится как бы “губчатой”. Это может повлиять на способность сердца эффективно работать и на электрическую проводимость миокарда.
Гипертрабекулярность левого желудочка (ЛЖ) не может быть полностью вылечена, но медикаментозное воздействие помогает больным уменьшить выраженность симптомов.
Заболевание возникает редко и считается врожденной патологией. Во время эмбриологического развития сердца формируется два слоя: нормальный и патологический (губчатый). Развитие клиники и дальнейшее обследование больного позволяет поставить диагноз и назначить симптоматическое лечение.
Видео: Noncompaction myocardium (NCM) — Некомпактный («губчатый») миокард (НКМ)или Губчатая кардиомиопатия
Описание
Гипертрабекулярность левого желудочка — это состояние сердца, при котором стенки левого желудочка (нижняя камера левой стороны сердца) не настолько уплотнена, как это должно быть в норме. Это приводит к образованию в сердечной мышце каналов, называемых трабекулами. Левый желудочек принимает характерный “губчатый” вид, немного похожий на соты. Хотя в основном поражается левый желудочек, в некоторых случаях также определяется гипертрабекулярность правого желудочка.
Первое описание болезни датируется 1926 г. после обследования больного ребенка.
ГТЛЖ описывается Американской кардиологической ассоциацией как тип генетической кардиомиопатии (болезнь сердечной мышцы, вызванная изменением генетического состава человека). Однако Всемирная организация здравоохранения (ВОЗ) описывает ее как “неклассифицированный” тип кардиомиопатии. Патология может также быть связана с расширенной или гипертрофической кардиомиопатией. В настоящее время нет универсально согласованных диагностических критериев для состояния.
Развиваться патология может в любом возрасте. В одних случаях определяется сочетание ГТЛЖ с другими врожденными заболеваниями, в других развивается изолированная форма болезни.
Лекарства от расстройства кишечника: список эффективных препаратов
Обсуждение: 2 комментария
Неужели от Аспаркама трабекула исчезнет из сердца? Скорее всего, нет. Непонятно как настойками трав и диетами, можно убрать из сердца трабекулу?
Неужели от Аспаркама трабекула исчезнет из сердца? Скорее всего, нет. Непонятно, как настойками трав и диетами, можно убрать из сердца трабекулу? Здесь, без какой-либо операции, наверное, не обойтись?
Механизм развития
ГТЛЖ — эта патология обычно образовывается, когда ребенок еще является эмбрионом, развивающимся в утробе матери. Это означает, что человек рождается с этим заболеванием. Однако у некоторых людей патологическое состояние может формироваться после рождения, при этом его называют “приобретенной” ГТЛЖ.
Сердце состоит из толстого слоя мышечных клеток (называемого миокардом). В нормальном состоянии мышечные клетки в миокарде плотно связаны друг с другом, поэтому считаются “уплотненными”.
Во время развития сердца эмбриона волокна сердечной мышцы поначалу являются “не уплотненными”, не способными нормально сжиматься. Это нужно для формирования толстой мышечной стенки. ГТЛЖ возникает тогда, когда эта часть нормального развития сердца (называемая “фазой ремоделирования”) прерывается, в результате чего часть миокарда не формируется компактной, а остается не уплотненной.
Причины и распространенность
ГТЛЖ в основном является генетическим заболевание, вызванным измененным или “мутированным” геном. Если болезнь генетическая, она может быть унаследована (передана от родителя к ребенку) и поэтому нередко бывает распространена в определенных семьях. По этой причине рекомендуется провести скрининг членов семьи первой линии (родителей, братьев и сестер), если у кого-то из близких ранее определилась ГТЛЖ.
Распространенность ГТЛЖ на самом деле не известна, хотя, по некоторым предположениям, болезнь чаще затрагивает мужчин, чем женщин. В настоящее время у большого количества людей диагностируется ГТЛЖ, потому что кардиография сейчас более развита, так что неуплотненные области можно довольно точно увидеть и диагностировать.
ГТЛЖ иногда диагностируется у больных с расширенной или гипертрофической кардиомиопатией.
Немного статистики:
Вспомогательные народные средства
При комплексном лечении трабекулы рекомендуется принимать внутрь отвары из таких лекарственных трав:
Отвары из них можно готовить из отдельного растения или сбора трав. Для этого столовую ложку сырья необходимо залить кипятком и настаивать в течение двадцати минут.
Важно помнить, что употребление народных средств должно быть одобрено лечащим врачом. Самолечение может только еще более навредить здоровью больного.
Симптомы
Хотя болезнь может быть диагностирована в любом возрасте, в основном первые симптомы начинают появляться в младенчестве. У части больных может быть недиагностированная форма ГТЛЖ, в таких случаях симптомы практически отсутствуют.
Проявления ГТЛЖ варьируются от одного человека к другому в зависимости от величины и расположения миокарда без уплотнения. Симптомы не являются строго специфическими для ГТЛЖ, поскольку они нередко определяются при других типах кардиомиопатии и заболеваниях сердечно-сосудистой системы, что нередко затрудняет диагностику.
Клинические проявления обычно возникают потому, что:
Симптомы ГТЛЖ включают:
Диагностика
При подозрении на гипертрабекулярность левого желудочка или наличии симптомов, которые могут указывать на сердечное заболевание, проводятся различные исследования. Чаще всего диагностика ГТЛЖ включает следующее:
Критерии постановки диагноза ГТЛЖ по МРТ:
При ошибочной диагностике ГТЛЖ может быть принята за гипертрофическую кардиомиопатию, фиброэластоз и эндомиокардиальный фиброз. Также вместо ГТЛЖ нередко ставится диагноз миокардита, рестриктивной, дилатационной кардиомиопатии и пр.
Больная П., 1956 г. р., поступила с жалобами на перебои в работе сердца, приступы учащенного сердцебиения вне связи с физической нагрузкой, сопровождающиеся одышкой, головокружением, однократно – потерей сознания.
Вышеперечисленные жалобы стали беспокоить около 5 лет назад. Тогда же при плановой диспансеризации на ЭКГ выявлена частая желудочковая экстрасистолия (ЖЭС). Выполнено холтеровское мониторирование, выявлено 23 тысячи ЖЭС, эпизоды бигеминии, тригеминии, пароксизмы неустойчивой желудочковой тахикардии (ЖТ). Назначен соталол, который из-за отсутствия должного антиаритмического эффекта заменен на амиодарон. На фоне лечения число ЖЭС уменьшилось до 6–7 тыс., однако сохранялись короткие пароксизмы ЖТ. В июне 2012 г. у пациентки развился длительный приступ учащенного сердцебиения с последующей потерей сознания. Бригадой скорой медицинской помощи на ЭКГ зарегистрирован пароксизм устойчивой ЖТ с частотой 204 уд/мин, который купирован внутривенным введением амиодарона. Была консультирована хирургом-аритмологом по месту жительства, рекомендовано ЭФИ с последующей аблацией очагов желудочковых аритмий.
Наследственность со стороны сердечно-сосудистой системы не отягощена, случаев внезапной смерти у ближайших родственников не отмечает.
Состояние при поступлении в НЦССХ им. А.Н. Бакулева РАМН удовлетворительное. Гиперстеническое телосложение, рост – 170 см, масса тела – 110 кг. Индекс массы тела – 38 кг/м2 (экзогенно-конституциональное ожирение 2-й степени). Кожные покровы обычной окраски, нормальной влажности. Периферические отеки отсутствуют. Дыхание в легких везикулярное, проводится во все отделы. Частота дыхания – 17 в мин. Тоны сердца приглушены, аритмичные, ЧСС – 75 уд/мин, АД – 125/80 мм рт. ст. Печень не увеличена, при пальпации безболезненна, по средне-ключичной линии ее край на уровне реберной дуги.
ЭКГ: ритм синусовый, правильный; ЧСС – 61 уд/мин, ЭОС отклонена влево. P – 100 мс, PQ – 140 мс, QRS – 100 мс, QTc – 450 мс. Морфология rS в отведениях II, III, AVF, V1–V4. Единичная желудочковая экстрасистолия. Заключение: блокада передней ветви левой ножки пучка Гиса, единичная желудочковая экстрасистолия.

Холтеровское мониторирование: за весь период наблюдения регистрировался синусовый ритм. Средняя ЧСС за сутки – 75 в мин (минимальная – 53, максимальная – 106 в мин). Наджелудочковая эктопическая активность представлена 46 экстрасистолами, желудочковая – 7478 одиночными ЖЭС трех морфологий – 4992 днем и 2486 ночью, по типу бигеминии – 2485, по типу тригеминии – 1776. ПарныхЖЭС – 94, групповых – 138. Зарегистрировано 57 пароксизмов неустойчивой желудочковой тахикардии, максимально из 10 комплексов. Пауз ритма, изменений сегмента ST–T, интервала Q–T не выявлено.
На рисунках фрагменты холтеровского мониторирования пациентки П.: групповые желудочковые экстрасистолы (слева), пароксизм неустойчивой ЖТ (справа).

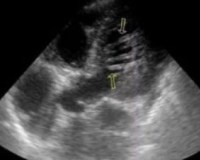
Трансторакальная эхокардиограмма. Апикальная четырехкамерная позиция: повышенная трабекулярность миокарда левого желудочка с межтрабекулярными лакунами (указано стрелками).
Эхокардиография: Левое предсердие – 4,8 см. Левый желужочек: КСР – 3,9 см, КДР – 5,8 см, КСО – 66 мл, КДО – 167 мл, ФВ ЛЖ – 61%. Аорта восходящая – 33 мм, аортальный клапан 3-створчатый, раскрытие полное, регургитации нет. ФК АоК – 21 мм, пиковый градиент – 8 мм рт. ст., кровоток не изменен. Митральный клапан: створки немного уплотнены, движение разнонаправленное. Недостаточность митрального клапана II ст. ФК МК – 31 мм. Правые отделы умеренно расширены. Трикуспидальный клапан: створки тонкие, подвижные. ФК ТК – 31 мм. Недостаточность до II ст. Расчетное давление в ПЖ – 25 мм рт. ст. Толщина МЖП в диастолу – 11 мм, ЗСЛЖ – 11 мм. В области верхушки ЛЖ с переходом на боковую стенку отмечается зона утолщенного «губчатого» слоя миокарда с неоднородным эхосигналом, его повышенная трабекулярность с наличием глубоких межтрабекулярных щелей. Толщина компактного слоя в области верхушки ЛЖ – 5, некомпактного – 13 мм.
Заключение: кардиомиопатия, некомпактный миокард левого желудочка, сократительная способность ЛЖ удовлетворительная., ФВ ЛЖ – 61%, недостаточность МК II ст., недостаточность ТК до II ст., умеренное расширение полостей сердца.

Чреспищеводная эхокардиограмма. Среднепищеводная 4-камерная позиция: зоны некомпактного миокарда в области верхушки левого желудочка с переходом на боковую стенку (указано стрелками).

Чреспищеводная эхокардиограмма. Среднепищеводная 2-камерная позиция, режим цветного допплеровского картирования: межтрабекулярные пространства, сообщающиеся с полостью левого желудочка (указано стрелками)
Для исключения сопутствующей патологии и тромбоза полостей сердца выполнена чреспищеводная ЭхоКГ: КСО – 68 мл, КДО – 158 мл, ФВ ЛЖ – 57%. Недостаточность митрального и трикуспидального клапанов II ст. В области верхушки ЛЖ с переходом на его переднебоковую стенку визуализируется двухслойная структура миокарда с истонченным компактным и утолщенным некомпактным слоем, его повышенная трабекулярность с наличием межтрабекулярных щелей, свободно сообщающихся с полостью ЛЖ. Данных о тромбозе полостей сердца не получено.
Коронарография: правый тип кровоснабжения миокарда, гемодинамически значимых сужений коронарных артерий не выявлено.
По лабораторным данным изменений не выявлено.
Диагноз: кардиомиопатия; изолированная некомпактность миокарда левого желудочка; умеренная дилатация камер сердца; недостаточность митрального клапана II ст.; недостаточность трикуспидального клапана II ст.; нарушения ритма сердца: желудочковая экстрасистолия 5-й градации по Ryan, пароксизмальная желудочковая тахикардия; синкопальное состояние от июня 2012 г.; артериальная гипертензия II ст.; риск 3; НК II ст. по NYHA; экзогенно-конституциональное ожирение I ст.
Для подтверждения диагноза и определения тактики лечения пациентке выполнено инвазивное ЭФИ и МРТ сердца.
Электрофизиологическое исследование: ретроградного проведения нет; РЭРП ПЖ – 220 мс. При программируемой стимуляции ПЖ тремя стимулами (450–250–300 мс) индуцирован неустойчивый пароксизм полиморфной ЖТ, самостоятельно купировавшийся.

Магнитно-резонансные томограммы сердца. Повышенная трабекулярность миокарда левого желудочка (указано стрелками).

Магнитно-резонансные томограммы сердца. Измерение толщины компактного и некомпактного слоя миокарда левого желудочка. Сокращения: Н – некомпактный слой, К – компактный слой миокарда.
Соотношение компактной / некомпактной зон – более 1/2, истончение компактного слоя миокарда в области верхушки до 4–5 мм. Толщина некомпактной зоны – до 11–13 мм. Общая масса миокарда ЛЖ – 114 г, масса патологической части – 23 г (20%). Трабекулярность в полости ПЖ также повышена с сохранением хода хорд. В раннюю (3 мин) и позднюю (20 мин) отсроченные фазы контрастирования о субэпикардиальные участки накопления контрастного вещества (КВ) по переднеперегородочной стенке на уровне базальных и средних сегментов, по переднебоковой стенке ЛЖ на уровне средних сегментов (неишемического генеза); участки накопления КВ по передней стенке ПЖ, больше в области верхушки.
Заключение: умеренное увеличение полостей сердца, повышенная трабекулярность миокарда ЛЖ и ПЖ, неинтенсивные фиброзные изменения миокарда ЛЖ и ПЖ (преимущественно в области верхушки).
Таким образом, в результате обследования у пациентки выявлены диагностические критерии кардиомиопатии некомпактного миокарда левого желудочка: – двухслойная структура миокарда с истонченным компактным и утолщенным некомпактным слоем в соотношении более 1/2; – повышенная трабекулярность миокарда левого желудочка; – глубокие межтрабекулярных щели, сообщающиеся, по данным ЦДК, с полостью левого желудочка при отсутствии иной кардиальной патологии. Примечательно, что желудочковые нарушения ритма явились единственным клиническим проявлением заболевания.
При выборе тактики лечения от операции РЧА было решено воздержаться ввиду отсутствия убедительных данных об эффективности и безопасности процедуры у пациентов с НМЛЖ. С целью профилактики внезапной сердечной смерти пациентке был имплантирован автоматический кардиовертер-дефибриллятор Biotronik Lumax 340 VR-T с первичной эндокардиальной системой.
Послеоперационный период протекал без осложнений. Помимо амиодарона, к антиаритмической терапии был добавлен бисопролол в дозе 2,5 мг/сут. Пациентка отмечала улучшение самочувствия, отсутствие приступов сердцебиения. Положительная динамика была также по данным ЭКГ и холтеровского мониторирования (желудочковая эктопическая активность представлена 4303 ЖЭС, двух морфологий, из них 2623 одиночных, по типу бигеминии – 6, по типу тригеминии – 315, ранних – 20, вставочных – 1036, парных – 31, триплетов – 2. За время пребывания в стационаре разрядов дефибриллятора не зафиксировано. Пациентка выписана на 8-е сутки под наблюдение кардиолога по месту жительства.
Представленный клинический случай редкой формы кардиомиопатии – некомпактного миокарда левого желудочка – демонстрирует, что пациенты с некоронарогенными желудочковыми нарушениями ритма требуют тщательного обследования с применением современных методов, которые могут менять наше представление о диагнозе и тактике лечения.
Подробнее о генетических аспектах, патогенезе, клиники и возможных методах лечения некомпактного миокарда левого желудочка в журнале «Креативная кардиология».
Лечение
Отсутствие симптомов у больного позволяет не проводить специфического лечения. Если же определяется клиника хронической сердечной недостаточности или возникают проблемы с электрической проводимостью сердца, тогда проводится соответствующая патогенетическая и симптоматическая терапия.
Лечение направлено на то, чтобы улучшить функцию сердца и уменьшить вероятность развития любых осложнений. План лечения основан на результатах диагностических тестов и клинических проявлений, поэтому индивидуализируется с потребностями конкретного больного и симптомами, которые он испытывает.
Схема медикаментозного лечения может включать любые препараты из следующих фармакологических групп:
Хирургические методы лечения
При наличии сопутствующих заболеваний проводиться их соответствующее лечение. В противном случае будет сложно контролировать течение ГТЛЖ. Обследоваться больные должны как минимум два раза в год.
Дополнительная хорда сердца у ребенка
Дополнительная хорда сердца у ребенка — это малая аномалия развития, которая представляет собой тяж, расположенный внутри желудочка. Возникает из-за наследственной или впервые возникшей генетической мутации, нарушающей дифференцировку кардиальных тканей во внутриутробном периоде. Протекает бессимптомно либо проявляется кардиалгиями, перебоями в работе сердца, повышенной утомляемостью. План диагностических мероприятий включает ЭхоКГ, ЭКГ, постановку функциональных нагрузочных тестов. Лечение бессимптомных хорд не проводится, при развитии осложнений назначают патогенетические препараты, иногда требуется помощь детских кардиохирургов.
МКБ-10
Общие сведения
Впервые патология была описана в 1893 г. и носила название «мышечный тяж». Современный термин появился позднее благодаря расположению образования, фактически пересекающего полость желудочка. По данным эхокардиографии, частота обнаружения хорд колеблется от 0,5% до 68% в популяции, что обусловлено отсутствием единых критериев диагностики. У мальчиков аномалия встречается в 2-3 раза чаще. Поскольку формирование дополнительной хорды у детей происходит во время внутриутробного развития, тяжи могут выявляться в любом возрасте. Пики заболеваемости отсутствуют.
Причины
Аномальные тяжи являются одной из разновидностей дисплазии соединительной ткани сердца (ДСТС), поэтому четкие этиологические факторы их появления не установлены. В современной педиатрии считается, что возникновение малых аномалий связано с действием неблагоприятных факторов в раннем внутриутробном периоде развития плода. Среди основных причин патологии можно выделить следующие:
Патогенез
Основная теория заключается в том, что образование дополнительной мышечной трабекулы происходит в процессе эмбрионального развития ребенка. Тяжи формируются из внутреннего слоя миокарда при отшнуровке сосочковых мышц. При нарушении дифференцировки клеток часть из них идет на создание папиллярных структур, а оставшиеся клетки организуются в добавочные хорды и располагаются внутри полости желудочка.
Морфологические изменения при дисплазии характеризуются изменениями структуры коллагеновых и эластиновых волокон, нарушением нормального соотношения гликопротеидов, протеогликанов и фибробластов. При этом наблюдается патология пространственной организации белков и белково-углеводных комплексов. Ряд авторов отводят важную роль гипомагниемии в патогенезе хорд и вызываемых ими симптомов.
Классификация
Выделение вариантов внутрисердечных хорд — дискутабельный научный вопрос, поскольку на сегодняшний день существует несколько классификаций. Гистологические исследования секционного материала дают возможность разделить тяжи в сердце на 3 вида:
Среди фиброзно-мышечных до 4,7% составляют образования, которые содержат проводящие кардиомиоциты.
А.А. Корженков предложил разделить хорды на 5 вариантов по локализации. Самые частые из них: поперечные (до 60% случаев) и диагональные (30-35%). К редким разновидностям внутрисердечных тяжей относят продольные (2-3%), множественные (1-2%), с тремя и более точками прикрепления (до 1%). Дополнения классификации включают определение длины и толщины образования, его расположения относительно основных анатомических ориентиров.
Симптомы
Для добавочных хорд сердца у детей характерна вариабельность течения: от бессимптомных вариантов, выявляющихся при инструментальной диагностике по другому поводу, до явных признаков нарушений сердечной деятельности и общего состояния. По наблюдениям врачей, малые аномалии являются основной причиной наличия функциональных сердечных шумов, которые хотя бы раз в жизни диагностируются у каждого второго-третьего ребенка.
Около 50% больных с дополнительными хордами иногда испытывают боли в сердце. Ребенок жалуется на покалывание, ноющие или давящие ощущения, которые не имеют четкой связи с физическими или эмоциональными нагрузками. Примерно с такой же частотой возникают аритмии, которые ощущаются как сильное сердцебиение или, наоборот, замирание сердца на несколько секунд, что сопровождается ухудшением самочувствия.
У многих детей наблюдается плохая переносимость физических нагрузок, утомляемость после коротких спортивных занятий в школе. При интенсивных тренировках возможны обмороки, длительное усиленное сердцебиение, повышенный прилив крови и жара к голове. Иногда ребенок ощущает нехватку воздуха, вследствие чего он начинает делать быстрые и глубокие вдохи. Среди атипичных эквивалентов одышки называют частую зевоту, покашливание, першение в горле.
Поскольку ДСТС обычно комбинируется с другими стигмами дизэмбриогенеза, у ребенка могут быть нарушения формы черепа и лица, неправильный разрез глаз, асимметрия туловища и конечностей. Изредка добавочные хорды выступают одним из проявлений синдрома Марфана: в таком случае ребенок имеет характерное астеническое телосложение, обвисшую истонченную кожу и другие патогномоничные симптомы.
Осложнения
Дополнительные хорды в 73% случаев ассоциированы с синдромом ранней реполяризации желудочков, что повышает риск развития пароксизмальной наджелудочковой тахикардии. При наличии ДСТС в 4-6 раз чаще встречается феномен предвозбуждения желудочков (Вольфа-Паркинсона-Уайта), который провоцирует тяжелые аритмии. Прослеживается четкая закономерность: чем ближе к базальной части межжелудочковой перегородки расположен тяж, тем выше его аритмогенность.
Ребенка с дополнительной хордой в сердце намного чаще беспокоят синкопальные состояния, обусловленные пароксизмами нарушений сердечного ритма и расстройствами регуляции сосудистого тонуса. У 30% обнаруживают геморрагический синдром, который развивается на фоне мезенхимальной дисплазии. Он проявляется кровоточивостью десен, частыми носовыми кровотечениями, у девочек-подростков дополнительной жалобой становятся длительные и обильные менструации.
Диагностика
При стандартном клиническом обследовании у детского кардиолога обнаруживаются неспецифические признаки кардиопатологии. Пальпация и перкуссия не дают ценных сведений, а при аускультации врач зачастую выявляет у ребенка функциональные систолические шумы. Для визуализации малых аномалий и детальной оценки сердечной деятельности эффективны следующие диагностические методы:
Лечение дополнительной хорды сердца у ребенка
Если дополнительная хорда не сопровождается нарушениями работы сердца, в детской кардиологии придерживаются выжидательной тактики, периодически проводят повторные обследования. Большинству пациентов с дополнительной сердечной хордой не требуется специальное лечение. Наличие кардиалгий, аритмий и других симптомов — показание к назначению патогенетической и симптоматической терапии. При комбинированных дисплазиях сердечной ткани требуется консультация кардиохирурга.
Прогноз и профилактика
В большинстве случаев хорды существуют бессимптомно или малосимптомно, не влияют на повседневную жизнь пациента. Прогноз благоприятный, если у ребенка отсутствуют другие дисплазии или пороки сердца. При наследственных или мультифакторных нарушениях соединительной ткани прогноз ухудшается. Учитывая неясность этиопатогенетических особенностей ДСТС, меры профилактики не разработаны.