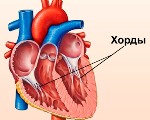
Дополнительная хорда левого желудочка у ребенка что это значит и чем лечить
Дополнительная хорда сердца у ребенка
Дополнительная хорда сердца у ребенка — это малая аномалия развития, которая представляет собой тяж, расположенный внутри желудочка. Возникает из-за наследственной или впервые возникшей генетической мутации, нарушающей дифференцировку кардиальных тканей во внутриутробном периоде. Протекает бессимптомно либо проявляется кардиалгиями, перебоями в работе сердца, повышенной утомляемостью. План диагностических мероприятий включает ЭхоКГ, ЭКГ, постановку функциональных нагрузочных тестов. Лечение бессимптомных хорд не проводится, при развитии осложнений назначают патогенетические препараты, иногда требуется помощь детских кардиохирургов.
МКБ-10
Общие сведения
Впервые патология была описана в 1893 г. и носила название «мышечный тяж». Современный термин появился позднее благодаря расположению образования, фактически пересекающего полость желудочка. По данным эхокардиографии, частота обнаружения хорд колеблется от 0,5% до 68% в популяции, что обусловлено отсутствием единых критериев диагностики. У мальчиков аномалия встречается в 2-3 раза чаще. Поскольку формирование дополнительной хорды у детей происходит во время внутриутробного развития, тяжи могут выявляться в любом возрасте. Пики заболеваемости отсутствуют.
Причины
Аномальные тяжи являются одной из разновидностей дисплазии соединительной ткани сердца (ДСТС), поэтому четкие этиологические факторы их появления не установлены. В современной педиатрии считается, что возникновение малых аномалий связано с действием неблагоприятных факторов в раннем внутриутробном периоде развития плода. Среди основных причин патологии можно выделить следующие:
Патогенез
Основная теория заключается в том, что образование дополнительной мышечной трабекулы происходит в процессе эмбрионального развития ребенка. Тяжи формируются из внутреннего слоя миокарда при отшнуровке сосочковых мышц. При нарушении дифференцировки клеток часть из них идет на создание папиллярных структур, а оставшиеся клетки организуются в добавочные хорды и располагаются внутри полости желудочка.
Морфологические изменения при дисплазии характеризуются изменениями структуры коллагеновых и эластиновых волокон, нарушением нормального соотношения гликопротеидов, протеогликанов и фибробластов. При этом наблюдается патология пространственной организации белков и белково-углеводных комплексов. Ряд авторов отводят важную роль гипомагниемии в патогенезе хорд и вызываемых ими симптомов.
Классификация
Выделение вариантов внутрисердечных хорд — дискутабельный научный вопрос, поскольку на сегодняшний день существует несколько классификаций. Гистологические исследования секционного материала дают возможность разделить тяжи в сердце на 3 вида:
Среди фиброзно-мышечных до 4,7% составляют образования, которые содержат проводящие кардиомиоциты.
А.А. Корженков предложил разделить хорды на 5 вариантов по локализации. Самые частые из них: поперечные (до 60% случаев) и диагональные (30-35%). К редким разновидностям внутрисердечных тяжей относят продольные (2-3%), множественные (1-2%), с тремя и более точками прикрепления (до 1%). Дополнения классификации включают определение длины и толщины образования, его расположения относительно основных анатомических ориентиров.
Симптомы
Для добавочных хорд сердца у детей характерна вариабельность течения: от бессимптомных вариантов, выявляющихся при инструментальной диагностике по другому поводу, до явных признаков нарушений сердечной деятельности и общего состояния. По наблюдениям врачей, малые аномалии являются основной причиной наличия функциональных сердечных шумов, которые хотя бы раз в жизни диагностируются у каждого второго-третьего ребенка.
Около 50% больных с дополнительными хордами иногда испытывают боли в сердце. Ребенок жалуется на покалывание, ноющие или давящие ощущения, которые не имеют четкой связи с физическими или эмоциональными нагрузками. Примерно с такой же частотой возникают аритмии, которые ощущаются как сильное сердцебиение или, наоборот, замирание сердца на несколько секунд, что сопровождается ухудшением самочувствия.
У многих детей наблюдается плохая переносимость физических нагрузок, утомляемость после коротких спортивных занятий в школе. При интенсивных тренировках возможны обмороки, длительное усиленное сердцебиение, повышенный прилив крови и жара к голове. Иногда ребенок ощущает нехватку воздуха, вследствие чего он начинает делать быстрые и глубокие вдохи. Среди атипичных эквивалентов одышки называют частую зевоту, покашливание, першение в горле.
Поскольку ДСТС обычно комбинируется с другими стигмами дизэмбриогенеза, у ребенка могут быть нарушения формы черепа и лица, неправильный разрез глаз, асимметрия туловища и конечностей. Изредка добавочные хорды выступают одним из проявлений синдрома Марфана: в таком случае ребенок имеет характерное астеническое телосложение, обвисшую истонченную кожу и другие патогномоничные симптомы.
Осложнения
Дополнительные хорды в 73% случаев ассоциированы с синдромом ранней реполяризации желудочков, что повышает риск развития пароксизмальной наджелудочковой тахикардии. При наличии ДСТС в 4-6 раз чаще встречается феномен предвозбуждения желудочков (Вольфа-Паркинсона-Уайта), который провоцирует тяжелые аритмии. Прослеживается четкая закономерность: чем ближе к базальной части межжелудочковой перегородки расположен тяж, тем выше его аритмогенность.
Ребенка с дополнительной хордой в сердце намного чаще беспокоят синкопальные состояния, обусловленные пароксизмами нарушений сердечного ритма и расстройствами регуляции сосудистого тонуса. У 30% обнаруживают геморрагический синдром, который развивается на фоне мезенхимальной дисплазии. Он проявляется кровоточивостью десен, частыми носовыми кровотечениями, у девочек-подростков дополнительной жалобой становятся длительные и обильные менструации.
Диагностика
При стандартном клиническом обследовании у детского кардиолога обнаруживаются неспецифические признаки кардиопатологии. Пальпация и перкуссия не дают ценных сведений, а при аускультации врач зачастую выявляет у ребенка функциональные систолические шумы. Для визуализации малых аномалий и детальной оценки сердечной деятельности эффективны следующие диагностические методы:
Лечение дополнительной хорды сердца у ребенка
Если дополнительная хорда не сопровождается нарушениями работы сердца, в детской кардиологии придерживаются выжидательной тактики, периодически проводят повторные обследования. Большинству пациентов с дополнительной сердечной хордой не требуется специальное лечение. Наличие кардиалгий, аритмий и других симптомов — показание к назначению патогенетической и симптоматической терапии. При комбинированных дисплазиях сердечной ткани требуется консультация кардиохирурга.
Прогноз и профилактика
В большинстве случаев хорды существуют бессимптомно или малосимптомно, не влияют на повседневную жизнь пациента. Прогноз благоприятный, если у ребенка отсутствуют другие дисплазии или пороки сердца. При наследственных или мультифакторных нарушениях соединительной ткани прогноз ухудшается. Учитывая неясность этиопатогенетических особенностей ДСТС, меры профилактики не разработаны.
Университет
Сыну 36 лет. Недавно на УЗИ выяснилось, что у него множественные дополнительные хорды левого желудочка. Это хорошо или плохо? В поликлинике ничего определенного не сказали… Семья Рыбаковых, Витебская обл.
Работаю в райцентре кардиологом. Хотелось бы прочитать в «Медицинском вестнике» об аномальных хордах сердца: как выявлять, а затем вести таких пациентов? Для врачей из глубинки статья будет полезной…
Светлана Н., Витебская обл.

— Евгения Леонидовна, как специалисты объясняют появление дополнительных хорд в сердце?
— Сразу отмечу, что прижизненное исследование внутренней структуры сердца стало возможным благодаря изобретению аппаратов для визуализации и развитию УЗИ. В 1981 году, почти через 100 лет после упоминания об аномальной хорде, было опубликовано первое прижизненное описание аномальных хорд сердца по результатам двухмерной эхокардиографии.
Аномальными (ложными) называют хорды, которые прикреплены не к створкам клапанов, а к стенкам желудочков. Согласно одной гипотезе, это производное внутреннего мышечного слоя примитивного сердца, возникающее в эмбриональном периоде при отшнуровке папиллярных мышц. По другому предположению, аномальные хорды — мышечные трабекулы, втягивающиеся в полость желудочка при его дилатации или образовании аневризмы.
Название «хорда» отражает положение аномального тяжа как геометрического тела, пересекающего камеру сердца. Истинные хорды — фиброзные тяжи, состоящие из коллагеновых волокон. Они получают кровоснабжение и иннервацию из головок сосочковых мышц, питающихся и иннервируемых через мышечные трабекулы, расположенные в основании тех же сосочковых мышц.
Аномальные хорды возникают из-за наследственных дефектов метаболизма коллагена; влияния факторов, нарушающих эмбриогенез при генетической предрасположенности и вызывающих семейные ненаследственные формы.
Аномально расположенная хорда (АРХ), названная moderator band, впервые описана при посмертном исследовании в 1893 г. В дальнейшем дополнительные тяжи в полости левого и правого желудочка обозначали по-разному: false tendon, ложные связки, добавочные хорды, мышечные тяжи. В современных источниках используется термин «аномально расположенная хорда» и false tendon.
— Насколько это распространенная аномалия?
— При ультразвуковом исследовании сердца у детей частота аномальных хорд колеблется в пределах 0,2–21,7%. Андрей Корженков, научный сотрудник Новосибирского НИИ терапии, изучал с коллегами распространенность аномальных хорд сердца у взрослых. В 1991 г. провели УЗИ 859 мужчинам 25–64 лет; признаки аномальных хорд сердца оказались у 17,1%. По результатам нашего эхокардиографического исследования (2002–2004 гг., 2 401 человек) у мужчин 18–25 лет, здоровых или госпитализированных по поводу заболеваний внутренних органов, аномальные хорды сердца встречались в 8,3% случаев.
Интересны результаты посмертного изучения. Татьяна Домницкая, профессор кафедры функциональной диагностики факультета повышения квалификации медработников Российского университета дружбы народов, исследовала сердца людей, умерших от различных заболеваний. Это были 41 мужчина и 46 женщин 57–87 лет. При макроскопическом изучении в 14% случаев выявлены аномальные хорды сердца. Другие авторы указывали на встречаемость таких хорд в 17–39% случаев у женщин и намного чаще (61%) у мужчин.
В нашей работе (Е. Л. Трисветова, О. А. Юдина, 2006 г. — Прим. авт.) аномальные хорды сердца выявлены в 12,1% случаев (578 умерших 15–91 года (средний возраст 63,1±1,08), в т. ч. 295 (51%) мужчин и 283 (49%) женщин). В группе умерших с малыми аномалиями сердца (n=98) эти хорды диагностировали в 71,4% и 2,08±0,59 случая на 100 обследованных. Соотношение мужчин и женщин с аномальными хордами сердца составило 1:0,64.
— Какие отделы сердца «предпочитают» аномальные хорды?
— А. Корженков и соавторы предложили определять отношение хорды к конкретному топографическому варианту, используя деление стенок левого желудочка на 10 сегментов. Согласно классификации Ж. Ботти, встречаются поперечные, базальные и продольные хорды — в 3 отделах левого желудочка: верхушечном, среднежелудочковом и базальном. Наиболее распространены АРХ левого желудочка — в 95% случаев, в то время как в правом их распознают всего в 5% случаев; очень редко выявляют аномальные хорды правого предсердия. Поперечные встречаются в 68%, диагональные — в 30%, продольные — в 2% случаев.
АРХ бывают одиночными (81,6%) и множественными. При УЗИ у молодых мужчин мы определяли АРХ в 8,3% случаев. Причем в 99,2% случаев АРХ обнаруживались в левом желудочке. Посмертное изучение распространенности АРХ показало, что в 17–39% случаев они встречаются у женщин и значительно чаще (61%) — у мужчин. Возраст не влияет на частоту АРХ.
— Как специалисту обнаружить аномальные хорды?
— Наиболее информативен для прижизненного выявления АРХ эхокардиографический метод. Используют трансторакальный и чреспищеводный доступы визуализации сердца. Чувствительность трансторакальной ЭхоКГ в диагностике АРХ — 72–87%. Значение имеют качество аппаратуры, квалификация специалиста, выполняющего исследование. В практике наблюдается и гипер-, и гиподиагностика АРХ.
Для визуализации АРХ двухмерную ЭхоКГ проводят из 3 ортогональных проекций (сагиттальной, горизонтальной, фронтальной), используя проекции длинной оси левого желудочка, продольной оси 2, 4, 5 камер и проекции короткой оси. Применяют парастернальный, верхушечный, субксифоидный доступы, позволяющие увидеть все структуры сердца в реальном времени.
Кроме продольных и поперечных сечений для поиска АРХ необходимо применять нестандартные доступы и проекции. Критерий АРХ — выявление эхоплотного линейного дополнительного образования в полости желудочка в 2 взаимно перпендикулярных плоскостях в режиме секторального сканирования с подтверждением результатов на М-эхокардиограмме в фазах систолы и диастолы. Необходимо осмотреть папиллярные мышцы и участки прикрепления хорды к свободным стенкам желудочков. Точки прикрепления хорды обнаруживают в режиме секторального сканирования и подтверждают результаты на М-эхокардиограмме. Разработано дополнение к протоколу стандартной ЭхоКГ — необходимо указывать основные характеристики АРХ (локализацию, топографический вариант, эхоплотность в участках прикрепления тяжа, наличие/отсутствие тракции папиллярных мышц в систолу, толщину и длину, изменение геометрии левого желудочка, скорость укорочения волокон миокарда в местах прикрепления хорды) и другие особенности.
Подробная оценка морфометрических, топографических и функциональных признаков АРХ проводится для дифференциальной диагностики эхокардиографических либо клинических проявлений отклонения.
Аномальные хорды располагаются между следующими внутрисердечными образованиями: заднемедиальная папиллярная мышца и стенка левого желудочка либо межжелудочковая перегородка; переднелатеральная папиллярная мышца и межжелудочковая перегородка; папиллярные мышцы; стенки левого желудочка и межжелудочковая перегородка; стенки левого желудочка. Иногда аномальные хорды прикрепляются в 3 и более точках, образуя перепончатую структуру.
— Как врачу относиться к аномальной находке? Наблюдать пациента, лечить.
— Клиническое значение аномальных хорд пока не определено. Известно, что для людей с наследственными и многофакторными нарушениями соединительной ткани характерны одиночные и множественные аномальные хорды, которые диагностируют наряду с другими малыми аномалиями сердца. В этом случае клинические проявления могут быть обусловлены полисистемными нарушениями строения соединительной ткани, включающими скелетно-мышечные, кожные, глазные, сердечно-сосудистые и другие висцеральные признаки дисморфогенеза, вегетативные расстройства.
Собственно наличие аномальных хорд сердца может не влиять на субъективные ощущения пациента и не беспокоить. Однако при исключении других причин они могут обусловить проявление патологических признаков. Поперечное положение аномальной хорды в средней трети левого желудочка вызывает систолический шум, он выслушивается при аускультации сердца. Длинная аномальная хорда, достигающая выходного тракта левого желудочка, сопряжена с локальной гипертрофией противолежащей стенки левого желудочка.
Аритмии сердца (желудочковая экстрасистолия, наджелудочковая/желудочковая пароксизмальная тахикардия) могут возникать из-за наличия в аномальной хорде клеток проводящей системы или изменений миокарда в местах прикрепления аномального тяжа и появления эктопических очагов возбуждения в миокарде. На ЭКГ при аномальных хордах левого желудочка описывают нарушения реполяризации желудочков (синдром ранней реполяризации, неишемическая депрессия сегмента ST, сглаженность или слабо отрицательный зубец T), синдром WPW и укорочение интервала PQ.
Короткие аномальные хорды при поперечном положении в полости левого желудочка могут травмироваться потоком крови или надрываться/разрываться во время диастолы желудочка. В этих местах определяют тромбы, представляющие вероятный источник эмболии сосудов большого круга кровообращения. Описаны случаи инфекционного эндокардита, развившегося в результате инфицирования области надрыва аномальной хорды. Изменения геометрии левого желудочка из-за поперечной аномальной хорды в полости встречаются редко и носят компенсаторный характер, препятствуя расширению камеры сердца.
Обычно аномальные хорды не влияют на прогноз жизни, не требуют специального лечения. В случае эхокардиографической «находки» надо обследовать пациента, чтобы выявить, нет ли наследственных или многофакторных нарушений соединительной ткани, врожденных пороков сердца.
— Людям с аномальными хордами можно ли заниматься спортом, рожать детей? Нужно ли наблюдаться у кардиолога?
— При исключении заболеваний и отсутствии клинических симптомов к аномальной хорде относятся как к незначимым особенностям развития сердца. Человек ведет обычный образ жизни, не ограничивает себя в физических нагрузках; женщины планируют беременность и роды. Другое дело, если врач диагностировал симптомы наследственного или многофакторного нарушения соединительной ткани. Тогда конкретные рекомендации нужно получить от лечащего доктора и следовать его советам. При появлении неприятных ощущений, одышки, боли в сердце, а также при нарушениях ритма, нужно обратиться к специалисту для дополнительного обследования и получения медпомощи.
Татьяна Скибицкая
Медицинский вестник, 13 февраля 2015
Синдром соединительнотканной дисплазии сердца у детей
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки.
В последние годы отмечается увеличение числа врожденных пороков развития и наследственных заболеваний, а также нарастание распространенности различных вариантов соединительнотканной дисплазии из-за ухудшения экологической обстановки. По современным представлениям синдром соединительнотканной дисплазии определяют как самостоятельный синдром полигенно-мультифакториальной природы, проявляющийся внешними фенотипическими признаками в сочетании с диспластическими изменениями соединительной ткани и клинически значимой дисфункцией одного или нескольких внутренних органов (В. А. Гаврилова, 2002).
Высокая частота синдрома ДСТС при различных заболеваниях свидетельствует о системности поражения, что связано с «вездесущностью» соединительной ткани, составляющей строму всех органов и тканей.
Диспластическое сердце — сочетание конституциональных, топографических, анатомических и функциональных особенностей сердца у человека с дисплазией соединительной ткани (ДСТ). В западной литературе используется термин «миксоидная болезнь сердца» (Morales A. B., Romanelli B. E. A., 1992), однако эта формулировка используется преимущественно зарубежными авторами.
Частота диспластического сердца составляет 86% среди лиц с первичной недифференцированной ДСТ (Г. Н. Верещагина, 2008).
По современным представлениям к синдрому ДСТС относят пролапсы клапанов сердца, аневризмы межпредсердной перегородки и синусов Вальсальвы, эктопически крепящиеся хорды митрального клапана и многие другие.
В основе патологии лежит неполноценность внеклеточного матрикса, его коллагеновых структур.
Диспластическое сердце формируют:
I. Конституциональные особенности — «капельное», «висячее» сердце, поворот его вокруг сагиттальной и продольной оси.
II. Костно-вертебральные дисплазии и деформации со сдавлением, ротацией, смещением сердца и перекрутом крупных сосудов: по данным Урмонаса В. К. и др. (1983). Деформации грудной клетки и позвоночника приводят к развитию торако-диафрагмального синдрома, ограничивающего работу всех органов грудной клетки.
III. Особенности строения сердца и сосудов:
IV. Патология органов дыхания со снижением жизненной емкости легких:
Миксоматозная дегенерация створок, хорд, подклапанных структур — генетически детерминированный процесс разрушения и утраты архитектоники коллагеновых и эластических структур соединительной ткани с накоплением в рыхлом фиброзном слое кислых мукополисахаридов. При этом признаки воспаления отсутствуют. В основе — дефект синтеза коллагена III типа, что приводит к истончению фиброзного слоя, створки увеличены, рыхлые, избыточные, края закручены, иногда определяется бахрома. Первичный локус аутосомно-доминантного миксоматоза при ПМК локализован в хромосоме 16. Morales A. B. (1992) выделяет миксоидную болезнь сердца.
В популяционных исследованиях феномен ПМК выявлен у 22,5% детей в возрасте до 12 лет. У детей с ДСТ ПМК обнаруживается значительно чаще — у 45–68%.
Клинические проявления ПМК у детей варьируют от минимальных до значительных и определяются степенью соединительнотканной дисплазии сердца, вегетативными и психоневрологическими отклонениями.
Большинство детей старшего возраста жалуются на кратковременные боли в грудной клетке, сердцебиение, одышку, ощущение перебоев в сердце, головокружение, слабость, головные боли. Боли в сердце дети характеризуют как колющие, давящие, ноющие и ощущают в левой половине грудной клетки без какой-либо иррадиации. Они возникают в связи с эмоциональным напряжением и сопровождаются, как правило, вегетативными нарушениями: неустойчивым настроением, похолоданием конечностей, сердцебиением, потливостью, проходят самопроизвольно или после приема седативных средств. Отсутствие в большинстве случаев ишемических изменений в миокарде по данным комплексного обследования позволяет расценить кардиалгии как проявление симпаталгии, связанной с психоэмоциональными особенностями детей с ПМК. Кардиалгии при ПМК могут быть связаны с региональной ишемией папиллярных мышц при их чрезмерном натяжении. С нейровегетативными нарушениями также связаны сердцебиение, ощущение «перебоев» в работе сердца, «покалывание», «замирание» сердца. Головные боли чаще возникают при переутомлении, переживаниях, в утренние часы перед началом занятий в школе и сочетаются с раздражительностью, нарушением сна, тревогой, головокружением.
При аускультации характерными признаками пролапса митрального клапана являются изолированные щелчки (клики), сочетание щелчков с позднесистолическим шумом, изолированный позднесистолический шум, голосистолический шум.
Происхождение шума связано с турбулентным током крови, связанным с выбуханием створок и вибрацией натянутых хорд. Позднесистолический шум выслушивается лучше в положении лежа на левом боку, усиливается при проведении пробы Вальсальвы. Характер шума может меняться при глубоком дыхании. На выдохе шум усиливается и иногда приобретает музыкальный оттенок. Нередко сочетание систолических щелчков и позднего шума наиболее отчетливо выявляется в вертикальном положении после физической нагрузки. Иногда при сочетании систолических щелчков с поздним шумом в вертикальном положении может регистрироваться голосистолический шум.
Голосистолический шум при первичном пролапсе митрального клапана наблюдается редко и свидетельствует о наличии митральной регургитации. Этот шум занимает всю систолу и практически не меняется по интенсивности при перемене положения тела, проводится в подмышечную область, усиливается при проведении пробы Вальсальвы.
Основными методами диагностики ПМК являются двухмерная Эхо-КГ и допплерография. ПМК диагностируют при максимальном систолическом смещении створок митрального клапана за линию кольца митрального клапана в парастернальной продольной позиции на 3 мм и более. Наличия изолированного смещения передней створки за линию кольца митрального клапана в четырехкамерной верхушечной позиции недостаточно для диагностики ПМК, это служит основной причиной его гипердиагностики.
Эхо-КГ-классификация миксоматозной дегенерации (МД) (Г. И. Сторожаков, 2004):
Степень регургитации при ПМК зависит от наличия и выраженности миксоматозной дегенерации, количества пролабирующих створок и глубины пролабирования.
В состоянии покоя митральная регургитация (МР) первой степени диагностируется у 16–20%, вторая степень — у 7–10% и третья степень — у 3–5% детей с ПМК.
Прогноз больного с ПМК определяет степень митральной регургитации. При этом любая степень пролабирования приводит к изменениям перфузии миокарда, изменениям чаще в области передней стенки ЛЖ и межжелудочковой перегородки (Нечаева Г. И., Викторова И. А., 2007)).
Острая митральная недостаточность возникает из-за отрыва сухожильных нитей от створок митрального клапана (синдром «болтающегося» клапана — loppy mitral valve), в детском возрасте наблюдается казуистически редко и в основном связана с травмой грудной клетки у больных на фоне миксоматозной дегенерации хорд. Основным патогенетическим механизмом острой митральной недостаточности является легочная венозная гипертензия, возникающая из-за большого объема регургитации в недостаточно растяжимое левое предсердие. Клиническая симптоматика проявляется внезапным развитием отека легких.
У детей митральная недостаточность при ПМК протекает чаще всего бессимптомно и диагностируется при допплерэхокардиографическом исследовании. В последующем при прогрессировании регургитации появляются жалобы на одышку при физической нагрузке, снижение физической работоспособности, слабость, отставание в физическом развитии.
Факторами риска развития «чистой» (не воспалительной) митральной недостаточности при синдроме пролабирования по данным двухмерной эхокардиографии являются:
ПМК является высоким фактором риска возникновения инфекционного эндокардита. Абсолютный риск возникновения заболевания выше, чем в популяции, в 4,4 раза.
Диагностика инфекционного эндокардита при ПМК представляет определенные трудности. Поскольку створки при пролапсе избыточно фестончатые, это не позволяет выявить начало формирования бактериальных вегетаций по данным эхокардиографии. Поэтому основное значение в диагностике эндокардита играют: 1) клиническая симптоматика инфекционного процесса (лихорадка, ознобы, сыпь, и другие симптомы), 2) появление шума митральной регургитации и факт обнаружения возбудителя при повторных высевах крови.
Частота внезапной смерти при синдроме ПМК зависит от многих факторов, основными из которых являются электрическая нестабильность миокарда при наличии синдрома удлиненного интервала QT, желудочковых аритмий, сопутствующая митральная недостаточность, нейрогуморальный дисбаланс.
Риск внезапной смерти при отсутствии митральной регургитации низкий и не превышает 2:10 000 в год, в то время как при сопутствующей митральной регургитации увеличивается в 50–100 раз.
В редких случаях в основе внезапной сердечной смерти у больных с ПМК может лежать врожденная аномалия коронарных артерий (аномальное отхождение правой или левой коронарной артерии), приводящая к острой ишемии миокарда и его некрозу.
Таким образом, основными факторами риска внезапной смерти у детей с синдромом ПМК являются: желудочковые аритмии III–V градации по Lown; удлинение корригированного интервала QT более 440 мс; появление ишемических изменений на ЭКГ во время физической нагрузки; кардиогенные обморочные состояния в анамнезе.
ДСТС являются одними из неблагоприятных факторов, предрасполагающих к развитию аритмических осложнений в детском и подростковом возрасте, в том числе гемодинамически значимых. В структуре нарушений ритма у детей с ДСТС чаще выявляются наджелудочковая экстрасистолия в патологическом количестве и желудочковая экстрасистолия, взаимосвязанные со степенью кардиальной дисплазии (Гнусаев С. Ф., соавт., 2006).
Морфологическими проявлениями синдрома ДСТС у детей с сопутствующей патологией почек, по данным Домницкой Т. М., Гавриловой В. А. (2000), являются: шаровидная или треугольная форма сердца, закругление верхушки сердца, увеличение массы сердца в 1,4–2,5 раза, утолщение и укорочение хорд митрального клапана, отхождение хорд в виде веера, гипертрофия сосочковых мышц, воронкообразная форма митрального клапана, открытое овальное окно. Миксоматозная дегенерация створок атриовентрикулярных клапанов наблюдалась у большинства больных с синдромом ДСТС и заболеваниями органов мочевой системы (частота ее колебалась от 66,7% до 77%). Фиброэластоз эндокарда был выявлен у 10 детей анализируемой группы.
В популяции детей наиболее часто выявлялись смещение септальной створки трехстворчатого клапана в полость желудочка в пределах 10 мм, нарушенное распределение хорд передней створки митрального клапана, дилятация синусов Вальсальвы, увеличенная евстахиева заслонка более 1 см, дилятация ствола легочной артерии, ПМК, диагонально расположенные трабекулы в полости левого желудочка.
Тактика ведения детей с первичным ПМК различается в зависимости от степени выраженности пролабирования створок, характера вегетативных и сердечно-сосудистых изменений. Основными принципами лечения являются: 1) комплексность; 2) длительность; 3) учет направленности функционирования вегетативной нервной системы.
Обязательным является нормализация труда, отдыха, распорядка дня, соблюдение правильного режима с достаточным по продолжительности сном.
Вопрос о занятиях физкультурой и спортом решается индивидуально после оценки врачом показателей физической работоспособности и адаптивности к физической нагрузке. Большинство детей при отсутствии митральной регургитации, выраженных нарушений процесса реполяризации и желудочковых аритмий удовлетворительно переносят физическую нагрузку. При наличии врачебного контроля им можно вести активный образ жизни без каких-либо ограничений физической активности. Детям можно рекомендовать плавание, лыжи, коньки, катание на велосипеде. Не рекомендуются спортивные занятия, связанные с толчкообразным характером движений (прыжки, борьба каратэ и др.). Обнаружение у ребенка митральной регургитации, желудочковых аритмий, изменений обменных процессов в миокарде, удлинения интервала QT диктует необходимость ограничения физической активности и занятий спортом. Этим детям разрешается занятие лечебной физкультурой под контролем врача.
Лечение строится по принципу общеукрепляющей и вегетотропной терапии. Весь комплекс терапевтических мероприятий должен строиться с учетом индивидуальных особенностей личности больного и функционального состояния вегетативной нервной системы.
Важной частью комплексного лечения детей с ДСТС является немедикаментозная терапия: психотерапия, аутотренинг, физиотерапия (электрофорез с магнием, бромом в области верхнешейного отдела позвоночника), водные процедуры, иглорефлексотерапия, массаж позвоночника. Внимание врача должно быть направлено на санацию хронических очагов инфекции, по показаниям проводится тонзиллэктомия.
Медикаментозная терапия должна быть направлена на: 1) лечение вегетативно-сосудистой дистонии; 2) предупреждение возникновения нейродистрофии миокарда; 3) психотерапию; 4) антибактериальную профилактику инфекционного эндокардита.
При умеренных проявлениях симпатикотонии назначается фитотерапия седативными травами, настойка валерианы, пустырника, сбор трав (шалфей, багульник, зверобой, пустырник, валериана, боярышник), обладающий одновременно легким дегидратационным эффектом. При наличии изменений процесса реполяризации на ЭКГ, нарушениях ритма проводятся курсы лечения препаратами, улучшающими обменные процессы в миокарде (панангин, карнитин, Кудесан, витамины). Карнитин назначают в дозе 50 мг/кг в сутки на 2–3 мес. Карнитин выполняет центральную роль в липидном и энергетическом обмене.
Являясь кофактором бета-окисления жирных кислот, он переносит ацильные соединения (жирные кислоты) через митохондриальные мембраны, предупреждает развитие нейродистрофии миокарда, улучшает его энергетический обмен. В наших исследованиях 35 детям с экстрасистолией (более 15 в одну минуту) в состав комплексной терапии был включен карнитин. По окончании лечения у 25 детей экстрасистолия значительно уменьшилась, у 10 детей — не определялась.
Отмечен благоприятный эффект от применения препарата Коэнзим Q10®, который значительно улучшает биоэнергетические процессы в миокарде и особенно эффективен при вторичной митохондриальной недостаточности.
Ранняя диагностика ДСТ у детей позволяет осуществлять соответствующую реабилитационную терапию и предотвращать прогрессирование заболевания. Одним из наиболее ярких терапевтических результатов является эффективное лечение детей с ДСТ (главным образом с ПМК) при помощи магнийсодержащего препарата магния оротата — Магнерот®. Выбор препарата был обусловлен известными свойствами иона магния, отмечающимися у антиаритмических препаратов I и IV класса (мембраностабилизирующие и антагонисты кальция), а также отсутствием побочных эффектов, которые могут появляться при применении традиционной антиаритмической терапии. Учитывалось также и то, что действующим веществом препарата является магния оротат, который, индуцируя синтез протеинов, участвуя в обмене фосфолипидов, являющихся составной частью клеточных мембран, необходим для фиксации внутриклеточного магния (Громова О. А., 2007).
Препарат Магнерот® применялся в виде монотерапии в дозе 40 мг/кг в сутки в течение первых 7 дней приема, затем по 20 мг/кг в сутки в течение 6 месяцев. Результатом лечения явилось уменьшение на 20–25% глубины пролабирования створок митрального клапана и уменьшение степени регургитации на 15–17%. Терапия препаратом Магнерот® не влияла на размеры левых отделов сердца и сократимость миокарда, показатели которых до лечения находились в пределах нормы.
В исследованиях, проведенных Е. Н. Басаргиной (2008), выявлен антиаритмический эффект препарата Магнерот®. При проведении суточного мониторирования ЭКГ у детей 2-й и 3-й групп было отмечено уменьшение количества желудочковых комплексов на 50% и более у 18 (27,7%) больных. Причем у 6 детей отмечено исчезновение желудочковой аритмии или уменьшение количества желудочковых комплексов до 30–312 за сутки. У 14 (21,5%) детей количество желудочковых комплексов уменьшилось не менее чем на 30%. У двух больных отмечено увеличение количества желудочковых экстрасистол до 30% от исходного уровня. Таким образом, антиаритмическая эффективность препарата Магнерот® составила 27,7%. Подобные результаты ранее получены и в других исследованиях (Домницкая Т. М. и соавт., 2005).
В то же время редкие суправентрикулярные и желудочковые экстрасистолы, если не сочетаются с синдромом удлиненного интервала QT, как правило, не требуют назначения каких-либо антиаритмических препаратов.
Таким образом, дети с синдромом ДСТС нуждаются в своевременной диагностике с использованием допплерэхокардиографии, электрокардиографии, в ряде случаев суточного мониторирования ЭКГ, назначении индивидуальной терапии и наблюдении детским кардиологом.
Терапия препаратом Магнерот® у детей с синдромом ДСТС приводит к уменьшению признаков пролапса клапанов, частоты выявления митральной регургитации, уменьшению выраженности клинических проявлений вегетативной дисфунуции, частоты желудочковых аритмий, сопровождается повышением уровня внутриэритроцитарного магния.