Дсд что это в медицине
Сосудистая мозговая недостаточность: клиника, диагностика и терапия
Инсульт и хронические формы сосудистой мозговой недостаточности представляют собой одну из наиболее актуальных проблем современной неврологии. По эпидемиологическим данным, заболеваемость инсультом в мире составляет 150 случаев на 100 тыс. населения в го
Инсульт и хронические формы сосудистой мозговой недостаточности представляют собой одну из наиболее актуальных проблем современной неврологии. По эпидемиологическим данным, заболеваемость инсультом в мире составляет 150 случаев на 100 тыс. населения в год. Весьма широко распространена также хроническая недостаточность кровоснабжения головного мозга.
В отечественной литературе для обозначения клинического синдрома поражения головного мозга в результате недостаточности кровоснабжения мозга обычно используется термин «дисциркуляторная энцефалопатия» (ДЭ). Согласно классификации сосудистых заболеваний головного мозга, предложенной Е. В. Шмидтом (1985), дисциркуляторная энцефалопатия относится к хроническим нарушениям мозгового кровообращения.
Сосудистые заболевания головного мозга (Е. В. Шмидт и соавт., 1985)
– Ишемический инсульт (тромботический, эмболический, гемодинамический, лакунарный)
– Геморрагический инсульт (паренхиматозное кровоизлияние, субарахноидальное кровоизлияние)
*Преходящие нарушения мозгового кровообращения
– Транзиторные ишемические атаки
– Гипертонические церебральные кризы
*Начальные проявления недостаточности кровоснабжения мозга
Однако, как показывают современные исследования, разнообразные сердечно-сосудистые заболевания, как правило, приводят одновременно и к хронической ишемии головного мозга, и к повторным острым нарушениям мозгового кровообращения. Поэтому правильнее было бы определить дисциркуляторную энцефалопатию как синдром хронического прогрессирующего поражения головного мозга, в основе которого лежат повторные инсульты и/или хроническая недостаточность кровоснабжения головного мозга (Н. Н. Яхно, И. В. Дамулин, 2001).
Этиология и патогенез ДЭ
Наиболее частыми причинами нарушения кровоснабжения головного мозга являются атеросклероз магистральных артерий головы, заболевания сердца с высоким риском тромбоэмболии в головном мозге и гипертоническая болезнь. Реже нарушения мозгового кровообращения развиваются в результате воспалительных изменений сосудов (васкулитов), нарушений свертывающей системы крови, аномалий развития сосудов и т. д. В подавляющем большинстве случаев сосудистая мозговая недостаточность развивается у лиц пожилого возраста, страдающих указанными выше сердечно-сосудистыми заболеваниями.
Как следует из определения ДЭ, в формировании данного синдрома играют роль 2 основных патогенетических механизма: инсульт и хроническая ишемия головного мозга. Ишемические инсульты головного мозга развиваются в результате тромбоза церебральных артерий, тромбоэмболии в головной части мозга, артериолосклероза, реологических и гемодинамических нарушений.
В основе хронической ишемии головного мозга лежат структурные изменения сосудистой стенки, которые возникают как следствие длительной артериальной гипертензии или атеросклеротического процесса. Установлено, что липогиалиноз сосудов небольшого калибра, пенетрирующих вещество головного мозга, может приводить к хронической ишемии глубинных отделов белого вещества. Отражением этого процесса являются изменения белого вещества (лейкоареоз), которые определяются как очаговые или диффузные изменения интенсивности сигнала от глубинных церебральных структур на Т2-взвешенных изображениях при магнитно-резонансной томографии головного мозга. Данные нарушения рассматриваются как типичные нейровизуализационные симптомы, развивающиеся у пациентов с длительной неконтролируемой артериальной гипертензией.
Клинические проявления ДЭ
Клиническая картина ДЭ весьма вариабельна. Как уже указывалось выше, большинство пациентов с хроническими сосудистыми заболеваниями головного мозга в анамнезе имеют инсульты, нередко неоднократные. Локализация перенесенных инсультов, несомненно, во многом определяет особенности клиники. Однако в подавляющем числе случаев при цереброваскулярной патологии, наряду с последствиями перенесенных инсультов, присутствуют также неврологические, эмоциональные и когнитивные симптомы дисфункции лобных долей головного мозга. Данная симптоматика развивается в результате нарушения связей между лобной корой и подкорковыми базальными ганглиями (феномен «разобщения»). Причина «разобщения» заключается в диффузных изменениях белого вещества головного мозга, которые, как говорилось выше, являются следствием патологии церебральных сосудов небольшого калибра.
В зависимости от выраженности нарушений, принято выделять 3 стадии дисциркуляторной энцефалопатии. Первая стадия характеризуется преимущественно субъективной неврологической симптоматикой. Пациенты жалуются на головную боль, головокружение, тяжесть или шум в голове, расстройства сна, повышенную утомляемость при физических и умственных нагрузках. В основе указанных симптомов лежит легкое или умеренное снижение фона настроения, связанное с дисфункцией лобных долей головного мозга. Объективно выявляются легкие нарушения памяти и внимания, а также, возможно, других когнитивных функций. Могут отмечаться асимметричное повышение сухожильных рефлексов, неуверенность при выполнении координаторных проб, легкие изменения походки. Важное значение в диагностике сосудистой мозговой недостаточности на данном этапе патологического процесса имеют инструментальные методы исследования, которые позволяют обнаружить патологию церебральных сосудов.
О второй стадии дисциркуляторной энцефалопатии говорят в тех случаях, когда неврологические или психические нарушения формируют клинически очерченный синдром. Например, речь может идти о синдроме умеренных когнитивных расстройств. Данный диагноз правомерен в тех случаях, когда нарушения памяти и других когнитивных функций явно выходят за рамки возрастной нормы, но не достигают выраженности деменции. На второй стадии ДЭ могут развиваться также такие неврологические нарушения, как псевдобульбарный синдром, центральный тетрапарез, как правило, асимметричный, экстрапирамидные расстройства в виде гипокинезии, легкого или умеренного повышения мышечного тонуса по пластическому типу, атактический синдром, неврологические расстройства мочеиспускания и др.
На третьей стадии дисциркуляторной энцефалопатии отмечается сочетание нескольких из указанных выше неврологических синдромов и, как правило, присутствует сосудистая деменция. Сосудистая деменция является одним из наиболее тяжелых осложнений, развивающихся при неблагоприятном течении сосудистой мозговой недостаточности. По статистике сосудистая этиология лежит в основе не менее 10–15% деменций в пожилом возрасте.
Сосудистая деменция, как и ДЭ в целом, является патогенетически разнородным состоянием. Сосудистая деменция возможна после единичного инсульта в стратегической для когнитивной деятельности зоне головного мозга. Так, например, деменция может развиваться остро в результате инфаркта или кровоизлияния в таламус. Однако значительно чаще сосудистая деменция вызвана повторными инсультами (так называемая мультиинфарктная деменция). Другой патогенетический механизм сосудистой деменции — хроническая ишемия головного мозга, отражением которой являются изменения белого вещества головного мозга. Наконец, помимо ишемии и гипоксии головного мозга в патогенезе деменции при сосудистой мозговой недостаточности, по крайней мере у части пациентов с ДЭ, важную роль играют вторичные нейродегенеративные изменения. Современные исследования убедительно доказали, что недостаточность кровоснабжения головного мозга — значимый фактор риска развития дегенеративных заболеваний центральной нервной системы, в частности болезни Альцгеймера. Присоединение вторичных нейродегенеративных изменений, несомненно, усугубляет и модифицирует когнитивные расстройства при сосудистой мозговой недостаточности. В таких случаях правомерен диагноз смешанной (сосудисто-дегенеративной) деменции.
Клинические проявления сосудистой деменции в каждом конкретном случае зависят от определяющих заболевание патогенетических механизмов. При постинсультной и мультиинфарктной деменции особенности клиники зависят от локализации инсультов. Изменения белого вещества глубинных долей головного мозга в результате хронической ишемии приводят к когнитивным нарушениям по «лобному» типу. Для данных нарушений типичны эмоциональные расстройства в виде снижения фона настроения, подавленности или апатии, утраты интереса к окружающему. Весьма характерна также эмоциональная лабильность, которая представляет собой быструю, иногда беспричинную смену настроения, плаксивость или повышенную раздражительность. В когнитивной сфере определяются нарушения памяти и внимания, замедленность мышления, снижение интеллектуальной гибкости, трудности, связанные с переключением от одного вида деятельности к другому. Изменяется поведение больных: снижаются способность к самокритике и чувство дистанции, отмечаются повышенная импульсивность и отвлекаемость, могут присутствовать такие симптомы, как пренебрежение принятыми в обществе правилами поведения, асоциальность, дурашливость, плоский и неуместный юмор и т. д.
Наличие вторичных нейродегенеративных изменений при сосудистой деменции проявляется прежде всего прогрессирующими нарушениями памяти. При этом в большей степени пациент забывает то, что случилось недавно, в то время как воспоминания об отдаленных событиях сохраняются достаточно долго. Для нейродегенеративного процесса весьма характерны также нарушения пространственной ориентировки и речи.
Диагностика дисциркуляторной энцефалопатии
Для диагностики синдрома дисциркуляторной энцефалопатии необходимо тщательное изучение анамнеза заболевания, оценка неврологического статуса, применение нейропсихологических и инструментальных методов исследования. Важно подчеркнуть, что присутствие сердечно-сосудистых заболеваний у пожилого человека само по себе еще не служит доказательством наличия сосудистой мозговой недостаточности. Необходимым условием правильной диагностики является получение убедительных доказательств наличия причинно-следственной связи между неврологическими и когнитивными симптомами и цереброваскулярной патологией, что нашло отражение в принятых сегодня диагностических критериях ДЭ.
Диагностические критерии ДЭ (Н. Н. Яхно, И. В. Дамулин, 2001)
Подтверждениями сосудистой этиологии симптомов будут наличие очаговой неврологической симптоматики, инсульт в анамнезе, характерные изменения при нейровизуализации, такие, как постишемические кисты или выраженные изменения белого вещества.
Лечение сосудистой мозговой недостаточности
Недостаточность мозгового кровообращения представляет собой осложнение различных сердечно-сосудистых заболеваний. Поэтому этиотропная терапия ДЭ должна быть, в первую очередь, направлена на лежащие в основе сосудистой мозговой недостаточности патологические процессы, такие, как артериальная гипертензия, атеросклероз магистральных артерий головы, заболевания сердца и др.
Проведение антигипертензивной терапии является существенным фактором вторичной профилактики нарастания психических и двигательных симптомов сосудистой мозговой недостаточности. До настоящего времени, однако, не решен вопрос о том, каких показателей артериального давления следует добиваться при лечении гипертензии. Большинство неврологов полагают, что полная нормализация артериального давления у пожилых пациентов с длительным анамнезом гипертензии, уменьшая риск острых сосудистых эпизодов, может одновременно способствовать усугублению хронической ишемии мозга и нарастанию выраженности нарушений когнитивных функций по «лобному» типу.
Наличие гемодинамически значимого атеросклероза магистральных артерий головы требует назначения антиагрегантов. К препаратам с доказанной антиагрегатной активностью относятся ацетилсалициловая кислота вдозах 75-300 мг в сутки и клопидогрель (плавикс) в дозе 75 мг в сутки. Исследование показали, что назначение данных препаратов снижает риск развития ишемических событий (инфаркт миокарда, ишемический инсульт, периферические тромбозы) на 20-25%. В настоящее время доказанавозможность одновременного применения указанных препаратов. К лекарственным средствам, обладающим антиагрегантными свойствами, относится также дипиридамол (курантил), который применяется в дозах 25 мг три раза в день. Монотерапия данным препаратом не обеспечивает профилактики церебральной или иной ишемии, однако при сочетанном применении дипиридамол достоверно увеличивает профилактический эффект ацетилсалициловой кислоты. Помимо назначения антиагрегантов наличие атеросклеротического стеноза магистральных артерий головы требует направления больного на консультацию к сосудистому хирургу для решения вопроса о целесообразности хирургического вмешательства.
При наличии высокого риска тромбоэмболии в головной части мозга, например в случаях мерцательной аритмии предсердий и клапанных пороков, антиагреганты могут быть малоэффективны. Перечисленные состояния служат показанием к назначению непрямых антикоагулянтов. Препаратом выбора является варфарин. Терапию непрямыми антикоагулянтами следует проводить под строгим контролем показателей коагулограммы.
Наличие гиперлипидемии, не корригируемой соблюдением диеты, требует назначения гиполипидемических препаратов. Наиболее перспективны препараты из группы статинов (зокор, симвор, симгал, ровакор, медостатин, мевакор и др.). По некоторым данным, терапия этими средствами не только нормализует липидный обмен, но и, возможно, обладает профилактическим эффектом в отношении развития вторичного нейродегенеративного процесса на фоне сосудистой мозговой недостаточности.
Важным патогенетическим мероприятием является также воздействие на другие известные факторы риска ишемии головного мозга. К ним относятся курение, сахарный диабет, ожирение, гиподинамия и др.
При наличии сосудистой мозговой недостаточности патогенетически обосновано назначение препаратов, воздействующих преимущественно на микроциркуляторное русло. К их числу относятся:
Вазоактивные препараты являются одними из наиболее часто назначаемых препаратов в неврологической практике. Помимо сосудорасширяющего действия многие из них обладают также положительными метаболическими эффектами, что позволяет использовать данные препараты в качестве симптоматической ноотропной терапии. Экспериментальные данные свидетельствуют о наличии у вазоактивного препарата танакан способности дезактивировать свободные радикалы, уменьшая тем самым процессы перекисного окисления липидов. Антиоксидантные свойства данного препарата позволяют использовать его также для вторичной профилактики нарастания нарушений памяти и других когнитивных функций в случаях присоединения вторичных нейродегенеративных изменений.
В отечественной практике вазоактивные препараты принято назначать курсами по 2-3 мес 1-2 раза в год.
Широко применяется при сосудистой мозговой недостаточности метаболическая терапия, целью которой является стимуляция репаративных процессов головного мозга, связанных с нейрональной пластичностью. Кроме того, метаболические препараты оказывают симптоматический ноотропный эффект.
Пирацетам был первым препаратом, специально синтезированным для воздействия на память и другие высшие мозговые функции. В последние годы, однако, удалось доказать, что в принятых ранее дозах данный препарат оказывает относительно небольшой клинический эффект. Поэтому в настоящее время рекомендуется использование пирацетама в дозировках не менее 4–12 г/сут. Более целесообразны внутривенные введения данного препарата на физиологическом растворе: 20–60 мл пирацетама на 200 мл физиологического раствора внутривенно капельно, 10–20 вливаний на курс.
Пептидергический препарат церебролизин не менее успешно применяется при сосудистой мозговой недостаточности, а также сосудистой и дегенеративной деменции. Как и в случае с пирацетамом, в последние годы существенно изменились взгляды на режим дозирования данного препарата. Согласно современным представлениям, клинический эффект наступает в случае внутривенных введений церебролизина в дозах 30–60 мл внутривенно капельно на 200 мл физиологического раствора, 10–20 вливаний на курс.
К пептидергическим препаратам, благоприятно влияющим на церебральный метаболизм, относится также актовегин. Актовегин применяется в виде внутривенных инфузий (250–500 мл на инфузию, 10–20 инфузий на курс), либо в виде внутривенных или внутримышечных инъекций по 2–5 мл 10 — 20 инъекций, либо внутрь по 200 — 400 мг 3 раза в сутки в течение 2-3 мес.
Как и вазоактивные препараты, метаболическая терапия проводится курсами 1-2 раза в год. Патогенетически оправданным и целесообразным является сочетанное проведение вазоактивной и метаболической терапии. В настоящее время в распоряжении врача имеется несколько комбинированных лекарственных форм, в состав которых входят действующие вещества с вазоактивным и метаболическим эффектами. К числу таких препаратов относятся инстенон, винпотропил, фезам и некоторые другие.
Развитие синдрома сосудистой деменции требует проведения более интенсивной ноотропной терапии. Из современных ноотропных препаратов наиболее мощным клиническим эффектом в отношении когнитивных функций обладают ингибиторы ацетилхолинэстеразы. Первоначально препараты данной группы использовались в лечении легкой и умеренной деменции при болезни Альцгеймера. Сегодня доказано, что ацетилхолинергическая недостаточность играет важную патогенетическую роль не только при этом заболевании, но также при сосудистой и смешанной деменции. Поэтому когнитивные расстройства сосудистой и смешанной этиологии все чаще фигурируют среди показаний к назначению ингибиторов ацетилхолинэстеразы.
В России на сегодняшний день доступны 2 препарата из группы ингибиторов ацетилхолинэстеразы последнего поколения: экселон и реминил. Экселон назначается в начальной дозе 1,5 мг 2 раза в день, далее разовая доза увеличивается на 1,5 мг каждые 2 нед. до 6,0 мг 2 раза в день или до возникновения побочных эффектов. Частыми побочными эффектами при использовании экселона являются тошнота и рвота. Данные явления не представляют угрозы для жизни или здоровья пациента, но могут препятствовать достижению терапевтического эффекта. Реминил назначается по 4 мг 2 раза в день в течение первых 4 нед, а затем по 8 мг 2 раза в день. Данный препарат реже вызывает нежелательные явления.
К ингибиторам ацетилхолинэстеразы первого поколения относится нейромидин. По некоторым данным, этот препарат оказывает положительный ноотропный эффект как при сосудистой, так и при первично-дегенеративной и смешанной деменции. Он назначается в дозе 20–40 мг 2 раза в день.
Терапия ингибиторами ацетилхолинэстеразы должна проводиться постоянно. При этом необходимо 1 раз в 3–6 мес контролировать уровень печеночных ферментов в крови.
Патогенетически обосновано при сосудистой деменции также назначение акатинола мемантина. Данный препарат является ингибитором NMDA-рецепторов к глютамату. Постоянный прием акатинола мемантина оказывает симптоматический ноотропный эффект, а также, возможно, замедляет темпы нарастания когнитивных расстройств. Действие препарата проявлялось как при легкой и умеренной, так и при тяжелой деменции. Следует отметить, что акатинол мемантин — это единственный препарат, эффективный на стадии тяжелой деменции. Он назначается в течение первой недели по 5 мг 1 раз в день, в течение второй недели — по 5 мг 2 раза в день, начиная с третьей недели и далее постоянно — по 10 мг 2 раза в день.
В заключение следует подчеркнуть, что всесторонняя оценка состояния сердечно-сосудистой системы пациентов с сосудистой мозговой недостаточностью, а также воздействие как на причину нарушений, так и на основные симптомы ДЭ, несомненно, способствуют повышению качества жизни пациентов и предотвращению тяжелых осложнений сосудистой мозговой недостаточности, таких, как сосудистая деменция и двигательные расстройства.
В. В. Захаров, доктор медицинских наук
Клиника нервных болезней им. А. Я. Кожевникова, Москва
Хроническая недостаточность мозгового кровообращения
Хроническая недостаточность мозгового кровообращения — медленно прогрессирующая дисфункция мозга, возникшая вследствие общего и/или мелкоочагового повреждения мозговой ткани на фоне длительно существующей недостаточности мозгового кровоснабжения.
Синонимы:
Наиболее широко в отечественную неврологическую практику вошёл термин «дисциркуляторная энцефалопатия», сохраняющий своё значение и на сегодняшний день.
Причины хронической недостаточности мозгового кровообращения:
Основные:
Дополнительные:
Для адекватной работы мозга необходим высокий уровень кровоснабжения. Головной мозг, масса которого составляет 2,0-2,5% массы тела, потребляет 20% циркулирующей в организме крови. Величина мозгового кровотока в полушариях составляет 50 мл на 100 грамм в минуту, потребление глюкозы составляет 30 мкмоль на 100 грамм в минуту, а в сером веществе эти величины в 3-4 раза выше, чем в белом. В условиях покоя потребление мозгом кислорода составляет 4 мл на 100 грамм в минуту, что соответствует 20% всего кислорода, поступающего в организм. С возрастом и при наличии патологических изменений величина мозгового кровотока снижается, что играет решающую роль в развитии и нарастании хронической недостаточности мозгового кровообращения.
Наличие головной боли, головокружения, снижения памяти, нарушения сна, появление шума в голове, звона в ушах, нечёткости зрения, общей слабости, повышенной утомляемости, снижения работоспособности и эмоциональной лабильности – эти симптомы чаще всего просто «информируют» человека об усталости. Только при подтверждении сосудистого генеза «астенического синдрома» и выявлении очаговой неврологической симптоматики устанавливают диагноз «дисциркуляторная энцефалопатия».
Основой клинической картины дисциркуляторной энцефалопатии в настоящее время признаны когнитивные (познавательные) нарушения. При хроническом нарушении мозгового кровообращения следует отметить обратную зависимость между наличием жалоб, особенно отражающих способность к познавательной деятельности (память, внимание), и степенью выраженности хронической недостаточности: чем больше страдают когнитивные (познавательные) функции, тем меньше жалоб. Параллельно развиваются эмоциональные расстройства (эмоциональная лабильность, инертность, отсутствие эмоциональной реакции, потеря интересов), разнообразные «двигательные нарушения» (расстройства ходьбы и равновесия).
Неврологические синдромы при дисциркуляторной энцефалопатии:
— паркинсонический синдром характерен замедленными движениями, гипомимией, негрубой мышечной ригидностью, тремор отсутствует, нарушения походки характеризуются замедлением скорости ходьбы, уменьшением длины шага, «скользящим», шаркающим шагом, мелким и быстрым топтанием на месте, поворачиванием всем корпусом с нарушением равновесия, что иногда сопровождается падением. При хронической недостаточности мозгового кровообращения двигательные нарушения проявляются, прежде всего, расстройствами ходьбы и равновесия;
— психоорганический синдром может проявляться эмоционально-аффективными расстройствами (астено- депрессивными и тревожно-депрессивными), когнитивными (познавательными) нарушениями;
В основе всех синдромов, свойственных дисциркуляторной энцефалопатии, лежит разобщение внутримозговых связей вследствие диффузного повреждения белого вещества мозга.
Лечение функциональных нарушений опорожнения мочевого пузыря
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных
Лечение больных с функциональными нарушениями опорожнения мочевого пузыря является насущной проблемой нейроурологии. Это связано с тем, что до настоящего времени не разработано эффективных и этиопатогенетически обоснованных методов лечения таких больных.
Выделяют нейрогенные, миогенные (миопатии) и психогенные (неврозы, шизофрения, истерия и др.) факторы, лежащие в основе функциональных нарушений опорожнения мочевого пузыря. Нейрогенные нарушения и повреждения — основная причина таких нарушений. В отсутствие причины функциональных нарушений опорожнения мочевого пузыря следует думать об идиопатических формах заболевания.
Согласно классификации Международного общества по удержанию мочи, функциональные нарушения опорожнения мочевого пузыря — это результат недостаточной функции мочевого пузыря, гиперактивности уретры или следствие комплексного воздействия обоих нарушений [1]. Недостаточная функция мочевого пузыря возникает вследствие снижения или отсутствия сократительной способности детрузора (арефлексия), которые встречаются при локализации повреждения или неврологического поражения в области фронтальных долей и моста головного мозга, сакрального отдела спинного мозга, при повреждении волокон конского хвоста, тазового сплетения и нервов мочевого пузыря, а также при рассеянном склерозе. Гиперактивность уретры — это следствие наружной детрузорно-сфинктерной диссинергии (ДСД) или нерасслабляющегося (спастического) поперечно-полосатого (п/п) сфинктера уретры, также может проявиться как вариант синдрома Фоулера у женщин. При этом наружная ДСД наблюдается при супрасакральном уровне поражения спинного мозга.
В литературе имеются лишь единичные сообщения о распространенности функциональных нарушений опорожнения мочевого пузыря. Так, P. Klarskov и соавт., оценивая обращаемость в лечебные учреждения Копенгагена, выявили, что ненейрогенные формы нарушения опорожнения мочевого пузыря встречаются в среднем у 7 женщин на 100 000 населения [2]. По данным T. Tammela и соавт., после оперативных вмешательств на органах брюшной полости нарушения опорожнения мочевого пузыря встречаются у 2,9 % пациентов, а после проктологических операций — у 25% больных [3]. Многие авторы считают данную проблему особенно значимой у неврологических больных.
Клиническим проявлением снижения сократительной способности детрузора и нерасслабляющегося п/п сфинктера уретры являются симптомы нарушения опорожнения мочевого пузыря, к которым относятся затрудненное мочеиспускание тонкой, вялой струей, прерывистое мочеиспускание, необходимость прилагать усилия и натуживаться, чтобы начать мочеиспускание, ощущение неполного опорожнения мочевого пузыря.
При отсутствии сократительной способности детрузора в сочетании с паралитическим состоянием п/п сфинктера уретры больные опорожняют мочевой пузырь, искусственно увеличивая внутрибрюшное давление, что клинически проявляется мочеиспусканием слабой струей мочи. При отсутствии сократительной способности детрузора в сочетании со спастическим состоянием наружного сфинктера уретры в большинстве случаев самостоятельное мочеиспускание невозможно и отмечается хроническая задержка мочи.
Нерасслабляющийся п/п сфинктер уретры приводит к инфравезикальной обструкции с симптомами нарушения опорожнения мочевого пузыря.
Клинические проявления наружной ДСД (непроизвольное сокращение п/п сфинктера уретры во время мочеиспускания или непроизвольного сокращения детрузора) включают два вида симптомов, а именно: нарушения опорожнения и накопления мочи в мочевом пузыре. Последние включают учащенное и ургентное мочеиспускание нередко в сочетании с ургентным недержанием мочи и никтурией. Для наружной ДСД характерно неполное опорожнение мочевого пузыря и развитие пузырно-мочеточникового рефлюкса.
Таким образом, различные формы нарушения опорожнения мочевого пузыря могут иметь во многом сходную клиническую картину. В связи с этим правильная и своевременная диагностика функциональных нарушений опорожнения мочевого пузыря является залогом успешного лечения.
Диагностика функциональных нарушений опорожнения мочевого пузыря складывается из сбора жалоб и анамнеза, урологического и неврологического обследования, а также дополнительных методов обследования, среди которых основное место занимает уродинамическое исследование. На начальном этапе обследования обязательна оценка симптомов нижних мочевых путей на основании вопросника I-PSS (Internanional Prostate Symptom Score). Вопросник I-PSS был предложен для оценки нарушений акта мочеиспускания вследствие заболеваний предстательной железы, однако в настоящее время он с успехом применяется и в случаях проявления симптомов заболеваний нижних мочевых путей, вызванных различными факторами, в том числе и неврологического характера.
Для уточнения поведения детрузора и его сфинктеров в фазу опорожнения мочевого пузыря наиболее информативным методом исследования больных является комплексное уродинамическое исследование.
Уродинамическими признаками наружной ДСД, характерной для надкрестцовой локализации патологического процесса, особенно в шейном отделе спинного мозга, являются регистрируемые с помощью электромиографии во время мочеиспускания «всплески» сократительной активности п/п сфинктера уретры и мышц тазового дна. Сокращение мышц тазового дна затрудняет или полностью прерывает поток мочи. Для нерасслабляющегося сфинктера уретры характерно отсутствие снижения электромиографической активности п/п сфинктера уретры во время мочеиспускания. Снижение или отсутствие сократительной способности детрузора уродинамически проявляется отсутствием плавного повышения детрузорного давления в ходе цистометрии или отсутствием позыва к акту мочеиспускания.
Следует подчеркнуть, что только уродинамическое обследование дает возможность достоверно установить форму нарушения функции нижних мочевых путей, приводящих к нарушению опорожнения мочевого пузыря, и во многом определить выбор метода лечения.
Ультразвуковое исследование почек и мочевого пузыря, также как и экскреторная урография, позволяет уточнить анатомическое состояние верхних мочевых путей и количество остаточной мочи в мочевом пузыре. По количеству остаточной мочи в мочевом пузыре после акта мочеиспускания (в норме до 50 мл) можно косвенно судить о функциональном состоянии детрузора и наличии инфравезикальной обструкции.
В таблице перечислены методы лечения больных с функциональными нарушениями опорожнения мочевого пузыря, из которых только медикаментозная терапия и дорзальная ризотомия с электростимуляцией передних корешков могут действительно считаться методами лечения, тогда как другие скорее являются способами опорожнения мочевого пузыря. При этом даже медикаментозная терапия во многом является симптоматическим методом лечения. Несмотря на это, назначение лекарственных средств представляет собой первый этап лечения больных с функциональными нарушениями опорожнения мочевого пузыря. Выбор медикаментов зависит от вида нарушения функции нижних мочевых путей. Так, в случае нарушения сократительной способности детрузора применяют антихолинэстеразные средства и М-холиномиметики, а при гиперактивности уретры — центральные миорелаксанты и α-блокаторы.
У 22 больных со сниженной сократительной способностью детрузора использовали дистигмина бромид (убретид) в дозе 5 мг через день за 30 мин до завтрака в течение 2 мес. При этом через каждые 2 нед делали 7-дневный перерыв в приеме препарата. Механизм действия дистигмина бромида заключается в блокировании ацетилхолинэстеразы, что сопровождается увеличением концентрации ацетилхолина в синаптической щели и соответственно приводит к облегчению передачи нервного импульса.
У всех больных терапевтический эффект развивался в первую неделю приема препарата и выражался в снижении среднего балла I-PSS c 15,9 до 11,3, а количества остаточной мочи — с 82,6 до 54,3 мл. Субъективно пациенты отмечали усиление ощущения позыва и облегчение начала акта мочеиспускания.
Следует отметить, что до настоящего времени остается открытым вопрос о продолжительности лечения антихолинэстеразными средствами. По нашим данным, у 82% больных в разные сроки после окончания 2-месячного курса лечения отмечалось возобновление симптомов, потребовавшее повторного назначения препарата.
К сожалению, мы не накопили собственного опыта применения бетанехола у больных со сниженной сократительной способностью детрузора, так как данный препарат не зарегистрирован для клинического применения в нашей стране и соответственно отсутствует в аптечной сети. Механизм действия бетанехола аналогичен действию ацетилхолина на гладкие миоциты. Данные других авторов показывают, что бетанехол может применяться при лечении больных с легкой степенью нарушения сократительной способности детрузора [4, 5].
α1-адреноблокатор доксазозин (кардура) использовали в ходе лечения 30 больных с гиперактивностью уретры, в том числе 14 пациентов с наружной ДСД и 16 с нарушением произвольного расслабления п/п сфинктера уретры. Доксазозин назначали в дозе 2 мг/сут на ночь.
Через 6 мес средний балл по шкале I-PSS у больных с наружной ДСД снизился с 22,6 до 11,4, количество остаточной мочи уменьшилось с 92,6 до 32,4 мл, а максимальная скорость потока мочи увеличилась с 12,4 до 16,0 мл/сек.
Кроме того, через 6 мес у больных с нарушением произвольного расслабления п/п сфинктера уретры средний балл I-PSS снизился с 14,6 до 11,2, количество остаточной мочи — с 73,5 до 46,2 мл, а максимальная скорость потока мочи увеличилась с 15,7 до 18,4 мл/сек.
Баклофен и тизанидин (сирдалуд) являются центральными миорелаксантами. Они снижают возбуждение моторных нейронов и интернейронов и могут ингибировать передачу нервного импульса в спинном мозге, уменьшая спастичность п/п мышц. По нашим данным, после применения баклофена в дозе 20 мг/сут и тизанидина в дозе 4 мг/сут не было выявлено существенной динамики субъективных и объективных симптомов как у больных с наружной ДСД, так и у пациентов с нарушением расслабления п/п сфинктера уретры. Выраженная слабость мускулатуры конечностей на фоне приема этих препаратов не позволяет увеличивать дозу препаратов, что существенно ограничивает их применение в клинической практике.
Следует отметить, что медикаментозная терапия эффективна у больных с начальными и легкими формами нарушения опорожнения мочевого пузыря. Тем не менее ее целесообразно использовать в качестве первого этапа лечения. В случае недостаточной эффективности медикаментозной терапии необходимо искать новые пути решения проблемы адекватного опорожнения мочевого пузыря.
Предложенная Lapides и соавт. в 80-е гг. прошлого столетия интермиттирующая аутокатетеризация мочевого пузыря до настоящего времени остается одним из основных методов опорожнения мочевого пузыря [6]. Однако этот метод имеет ряд осложнений, к которым относятся инфекции нижних мочевых путей, стриктуры уретры и, самое главное, значительное снижение качества жизни. При невозможности выполнения (неврологические больные с тетраплегией, больные с ожирением) или отказе пациента от аутокатетеризации, у лиц с наружной ДСД и нерасслабляющимся сфинктером уретры, а также со сниженной сократительной способностью детрузора для адекватного опорожнения мочевого пузыря применяют в последние годы имплантацию специальных стентов (производства фирм Balton, Mentor, МедCил) и инъекции ботулинического токсина в зону п/п сфинктера уретры.
 |
| Рисунок 1. Временный уретральный стент |
Временные уретральные стенты имеют форму цилиндра, выполненного из проволочной спирали толщиной 1,1 мм, изготовлены они на основе полимолочной и полигликоликовой кислот с различным периодом разрушения (от 3 до 9 мес) посредством гидролиза (рис. 1). Механические свойства и время разрушения временных стентов зависят от степени поляризации, места и формы зоны имплантации.
Мы имеем опыт применения временных уретральных стентов у семи мужчин с наружной ДСД и у четырех пациентов, у которых отсутствовала сократительная способность детрузора. Временный уретральный стент устанавливали при уретроцистоскопии таким образом, чтобы он «шинировал» как простатический, так и мембранозный отделы уретры. Такое положение стента обеспечивает адекватное опорожнение мочевого пузыря.
У всех больных отмечалось восстановление самостоятельного мочеиспускания сразу после имплантации уретрального стента. Пациенты с наружной ДСД осуществляли мочеиспускание по позыву, а больные с отсутствием сократительной способности детрузора с интервалом 4 ч (6 раз в сутки) с использованием приема Креда. По данным ультразвукового сканирования, через 10 нед после установки стента у больных с наружной ДСД не отмечалось остаточной мочи, а у больных с отсутствием сократительной способности детрузора среднее количество остаточной мочи составило 48 мл и зависело от адекватности выполнения приема Креда. Очень важно, что у больных с наружной ДСД было выявлено снижение максимального детрузорного давления во время мочеиспускания в среднем с 72 до 35 см вод. ст. (профилактика развития пузырно-мочеточникового рефлюкса).
Мы считаем, что временные уретральные стенты обеспечивают адекватное опорожнение мочевого пузыря и показаны тем больным с нарушением опорожнения мочевого пузыря, которым не может быть выполнена интермиттирующая катетеризация мочевого пузыря или которые воздерживаются от нее по различным причинам. Временные стенты могут являться методом отбора больных для установки постоянных (металлических) стентов.
В последние годы в литературе появились сообщения об успешном использовании ботулинического токсина у больных с функциональными нарушениями опорожнения мочевого пузыря. В нашей клинике ботулинический токсин применялся у 16 больных с нарушением опорожнения мочевого пузыря, в том числе у девяти с наружной ДСД, у трех с нерасслабляющимся п/п сфинктером уретры и у четырех с нарушением сократительной способности детрузора. Мы использовали ботулинический токсин типа А фармацевтической фирмы Allergan. Коммерческое название препарата — ботокс (Botox), он представляет собой лиофилизированный порошок белого цвета в вакуумных стеклянных флаконах объемом 10 мл, закрытых резиновой пробкой и герметичным алюминиевым затвором. В одном флаконе содержится 100 ЕД ботулинического токсина типа А.
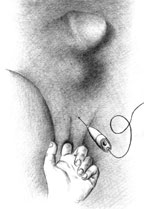 |
| Рисунок 2. Введение ботулинического токсина у мужчин |
Механизм действия ботокса заключается в блокировании выброса ацетилхолина из пресинаптической мембраны в нервно-мышечном синапсе. Фармакологическим эффектом этого процесса является стойкая хемоденервация, а клиническим проявлением — расслабление мышечных структур.
Согласно рекомендациям фирмы-производителя, лиофилизированный порошок разводили 8 мл стерильного 0,9% раствора натрия хлорида без консервантов (1 мл полученного раствора содержит 12,5 ЕД ботокса). Использовали трансперинеальную методику введения препарата. У мужчин под контролем указательного пальца, введенного в прямую кишку, специальную иглу с изоляционным покрытием вводили в точку, находящуюся на 2 см латеральнее и выше анального отверстия (рис. 2). У женщин иглу под контролем указательного пальца, введенного во влагалище, вводили в точку на 1 см латеральнее и выше наружного отверстия уретры на глубину 1,5–2,0 см (рис. 3). Во всех случаях положение иглы контролировали электромиографически по характерному звуку динамика электромиографа. В каждую точку вводили по 50 ЕД ботокса.
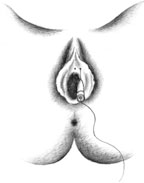 |
| Рисунок 3. Введение ботулинического токсина у женщин |
У всех больных через 10 дней после введения ботулинического токсина исчезла остаточная моча и было отмечено увеличение максимальной скорости потока мочи. Важно, что хемоденервация сфинктера уретры после инъекции ботокса у всех пациентов с нерасслабляющимся п/п сфинктером и наружной ДСД приводила к снижению детрузорного давления, а у больных с нарушением сократительной способности детрузора — к снижению максимального абдоминального давления, вызывающего выделение мочи из наружного отверстия уретры. Это наблюдение представляется крайне важным в отношении профилактики развития пузырно-мочеточникового рефлюкса и сохранения функциональной способности почек. Только у одного больного клинический эффект после инъекции ботокса продолжал сохраняться на протяжении 16 мес, остальным пациентам потребовались повторные инъекции препарата с периодичностью 3–8 мес.
В отдельных случаях, при выраженной инвалидизации больных с нарушением опорожнения мочевого пузыря, используют трансуретральную инцизию или резекцию наружного сфинктера уретры, дренируют мочевой пузырь постоянным уретральным катетером или выполняют цистостомию.
Таким образом, нарушение опорожнения мочевого пузыря может быть следствием различных форм дисфункции нижних мочевых путей. Требуются проведение комплексного уродинамического обследования для уточнения функционального состояния мочевого пузыря и его сфинктеров и выбор адекватного метода опорожнения мочевого пузыря. Отсутствие высокоэффективных и универсальных способов лечения больных с функциональными нарушениями опорожнения мочевого пузыря диктует необходимость поиска новых методов терапии таких больных.
Г. Г. Кривобородов, доктор медицинских наук
М. Е. Школьников, кандидат медицинских наук
РГМУ, Москва