Двухфазный инсулин что это
Новорапид пенфилл : инструкция по применению
Состав
В 1 мл препарата содержится:
активное вещество: инсулин аспарт 100 ЕД (3,5 мг);
вспомогательные вещества: глицерол 16 мг, фенол 1,5 мг. метакрезол 1,72 мг, цинка хлорид 19,6 мкг, натрия хлорид 0,58 мг, натрия гидрофосфата дигидрат 1,25 мг, натрия гидроксид 2М около 2,2 мг, кислота хлористоводородная 2М около 1,7 мг, вода для инъекций до 1 мл.
Один картридж содержит 3 мл раствора, эквивалентного 300 ЕД.
Описание
Прозрачный, бесцветный раствор.
Фармакологическое действие
Взаимодействует со специфическим рецептором внешней цитоплазматической мембраны клеток и образует инсулин-рецепторный комплекс, стимулирующий внутриклеточные процессы, в т. ч. синтез ряда ключевых ферментов (гексокиназа, пируваткиназа, гликогенсинтаза и др.). Снижение содержания глюкозы в крови обусловлено повышением ее внутриклеточного транспорта, усилением усвоения тканями, стимуляцией липогенеза, гликогеногенеза, снижением скорости продукции глюкозы печенью и др.
Замещение аминокислоты пролин в положении В28 на аспарагиновую кислоту в инсулине аспарт снижает тенденцию молекул к образованию гексамеров, которая наблюдается в растворе обычного инсулина. В связи с этим инсулин аспарт гораздо быстрее всасывается из подкожно-жировой клетчатки и начинает действовать быстрее, чем растворимый человеческий инсулин. Инсулин аспарт сильнее снижает содержание глюкозы крови в первые 4 часа после приема пищи, чем растворимый человеческий инсулин. Продолжительность действия инсулина аспарт после подкожного введения короче, чем растворимого человеческого инсулина.
После подкожного введения действие препарата начинается в течение 10-20 минут после введения. Максимальный эффект наблюдается через 1-3 часа после инъекции. Продолжительность действия препарата составляет 3-5 часов. Клинические исследования с участием пациентов с сахарным диабетом 1 типа продемонстрировали снижение риска ночной гипогликемии при использовании инсулина аспарт по сравнению с растворимым человеческим инсулином. Риск дневной гипогликемии достоверно не повышался.
Инсулин аспарт является эквипотенциальным растворимому человеческому инсулину на основании показателей молярности.
Взрослые. Клинические исследования с участием пациентов с сахарным диабетом 1 типа демонстрируют более низкую постпрандиальную концентрацию глюкозы крови при введении инсулина аспарт, по сравнению с растворимым человеческим инсулином.
Пожилые: Было проведено рандомизированное двойное слепое перекрестное исследование фармакокинетики и фармакодинамики (ФК/ФД) инсулина аспарт и растворимого человеческого инсулина у пожилых больных сахарным диабетом 2 типа (19 больных в возрасте 65-83 лет, средний возраст 70 лет). Относительные отличия фармакодинамических свойств между инсулином аспарт и человеческим инсулином у пожилых пациентов были схожи с таковыми у здоровых добровольцев и у более молодых больных сахарным диабетом.
Дети и подростки. Применение инсулина аспарт у детей показало схожие результаты длительного гликемического контроля при сравнении с растворимым человеческим инсулином.
Фармакокинетика
у детей (6-12 лет) и подростков (13-17 лет) с сахарным диабетом
1 типа. Абсорбция инсулина аспарт происходит быстро в обеих возрастных группах, с tmax, аналогичным таковому у взрослых. Однако, имеются отличия Стах в двух возрастных группах, что подчеркивает важность индивидуального дозирования препарата.
Пожилые: Относительные различия фармакокинетики между инсулином аспарт и растворимым человеческим инсулином у пожилых больных (65-83 лет, средний возраст 70 лет) сахарным диабетом 2 типа были схожи с таковыми у здоровых добровольцев и у более молодых больных сахарным диабетом. У пожилых пациентов наблюдалось уменьшение скорости абсорбции, что приводило к замедлению tmax (82 (вариабельность: 60-120) минут), тогда как Стах была одинаковой с таковой, наблюдаемой у более молодых больных сахарным диабетом 2 типа и немного меньше, чем у больных сахарным диабетом 1 типа. Недостаточность функции печени: Было проведено исследование фармакокинетики при введении однократной дозы инсулина аспарт 24 пациентам, функция печени которых находится в диапазоне от нормальной до тяжелой формы нарушения. У лиц с нарушением функции печени скорость абсорбции инсулина аспарт была снижена и более непостоянной, результатом чего было замедление tmax с примерно 50 минут у лиц с нормальной функцией печени до примерно 85 минут у лиц с нарушением функции печени средней и тяжелой степени тяжести. Площадь под кривой «концентрация-время», максимальная концентрация в плазме и общий клиренс препарата (AUC, Стах и CL/F) были схожими у лиц со сниженной и нормальной функцией печени.
Недостаточность функции почек. Было проведено исследование фармакокинетики инсулина аспарт у 18 пациентов, функция почек которых колебалась от нормальной до тяжелой формы нарушения. Не было обнаружено явного влияния величины клиренса креатинина на AUC, Cmax, tmax инсулина аспарт. Данные ограничивались показателями для лиц с нарушениями функции почек средней и тяжелой формы. Лица с почечной недостаточностью, требующей проведения диализа, не были включены в исследование.
Доклинические данные по безопасности:
В ходе доклинических испытаний не было выявлено какой-либо опасности для людей, исходя из данных общепринятых исследований фармакологической безопасности, токсичности повторного применения, генотоксичности и репродуктивной токсичности.
В тестах in vitro, включая связывание с рецепторами инсулина и инсулиноподобного фактора роста-1, а также влияние на рост клеток, характер поведения инсулина аспарт очень схож с таковым человеческого инсулина. Результаты исследований таюке показали, что диссоциация связывания инсулина аспарт с рецептором инсулина эквивалентна таковой для человеческого инсулина.
Показания к применению
Сахарный диабет у взрослых, подростков и детей старше 2 лет.
Двухфазный инсулин что это
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва
Двухфазные инсулиновые аналоги: на что они способны при терапии пациентов с сахарным диабетом 2-го типа
Журнал: Проблемы эндокринологии. 2011;57(4): 48-55
Оранская А. Н. Двухфазные инсулиновые аналоги: на что они способны при терапии пациентов с сахарным диабетом 2-го типа. Проблемы эндокринологии. 2011;57(4):48-55.
Oranskaya A N. Biphasic insulin analogs: their potential in the management of type 2 diabetes mellitus. Problemy Endokrinologii. 2011;57(4):48-55.
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва
«Инсулиновая эра» началась чуть меньше ста лет назад, когда в августе 1921 г. появилось сообщение об открытии румынского ученого Н. Паулеску. Он был первым, кто получил водный экстракт из поджелудочной железы собак и крупного рогатого скота, при введении которого в кровь животным отмечалось снижение гликемии, глюкозурии, вплоть до развития гипогликемии. Первое применение инсулина для снижения гликемии у человека — 1922 г. Был применен экстракт из поджелудочных желез крупного рогатого скота, полученный Ч. Бестом и Ф. Бантингом и приготовленный по особой технологии, разработанной Дж. Коллипом. Начиная с этого периода времени в терапии сахарного диабета (СД) применяли естественные препараты инсулинов. В 1936 г. в лабораториях компании «Ново Нордиск» (Дания) проф. Х.С. Хагедорном впервые в мире был создан нейтральный инсулин средней продолжительности действия. «Нейтральный инсулин Хагедорна» стал прототипом протафана. «Первые» препараты инсулина позволяли продлить жизнь пациентов, страдающих СД, но имели достаточно много побочных эффектов, не могли поддерживать нормальный уровень гликемии на протяжении целых суток. В 1946 г. разработан первый нейтральный инсулин продленного действия изофан-инсулин (NPH), но и его продолжительность действия была недостаточной. Исследования продолжались, и в 1951 г. появились разработки по пролонгации действия инсулина при помощи цинка. Так, с 1953 г. начато применение суспензии цинк-инсулина продленного действия. Однако это все равно были инсулины на «чужеродном» белке, что увеличивало количество и частоту побочных явлений. В 1953 г. Сангером была расшифрована химическая структура инсулина, это позволило улучшить качество применяемых препаратов инсулина. Началось время активного научного поиска для решения проблемы высокой очистки гормона. Высокоэффективная хроматография позволила получать монокомпонентные инсулины, практически лишенные дополнительных примесей. Данная технология позволила избавиться от многих побочных реакций при инсулинотерапии, отсрочить развитие поздних осложнений СД и установить новые стандарты степени очистки инсулина. Но, по-настоящему, эра фармакологической «гонки» за лучший препарат инсулина началась только в 1977 г. с открытия структуры ДНК и внедрения рекомбинантных технологий. Это позволило определить индивидуальные последовательности аминокислот в белках, изменять их и оценивать биологические эффекты полученных продуктов, что в свою очередь привело к возникновению в фармакологии нового направления по синтезу новых молекул с улучшением свойств ранее изученных веществ, лекарственных препаратов. В 1981 г. впервые в мире был получен рекомбинантный человеческий инсулин. Так закончилась эра инсулинов животного происхождения, для коррекции гликемии стали применять генно-инженерные инсулины, абсолютно идентичные тому, который вырабатывается поджелудочной железой человека. В компании «Ново Нордиск» получают их путем сложной биотехнологической «перестройки» ДНК обычных пекарских дрожжей — продукта, применяемого человечеством на протяжении тысячелетий. Со временем оказалось, что, несмотря на «абсолютную идентичность», человеческие генно-инженерные инсулины отличались от собственного инсулина по фармакодинамике и фармакокинетике. Пролонгированные инсулины имеют пики действия, что увеличивает риск развития гипогликемических состояний. Короткие инсулины имеют максимальную активность действия, не позволяющую иметь стойкую постпрандиальную нормогликемию, да и начало действия достаточно отсрочено от момента введения препарата, что неудобно пациентам. Работа над улучшением свойств инсулинов была продолжена. И в 1999 г. появился первый инсулиновый аналог короткого действия компании «Ново Нордиск» – НовоРапид, а чуть позже и пролонгированный инсулин Детемир. В сравнении с человеческими инсулинами длительного действия (НПХ) аналоги инсулина продленного действия обладают более продолжительным действием, у них отсутствует пик действия и как следствие снижется риск гипогликемий. К особым преимуществам пролонгированного инсулина Детемир относятся низкая интраиндивидуальная вариабельность и меньшее увеличение массы тела, при равном и даже превосходящем НПХ сахарснижающем эффекте. Таким образом, начиная с прошлого столетия, фармакологический рынок препаратов инсулина значительно изменился — от бычьих-свиных через человеческие генно-инженерные, к аналоговым инсулинам. Препараты инсулина, применяемые в настоящее время, различаются в основном по четырем основным признакам: по происхождению; по скорости наступления эффектов и его продолжительности; по способу очистки и степени чистоты препаратов, а также концентрации и процентному соотношению инсулина. Не так давно, в практику врачей вошли микст-инсулины, т.е. комбинированные в одном растворе и инсулин короткого действия, и пролонгированная форма инсулина. Эта статья будет посвящена применению именно таких аналогов инсулина.
СД относится к хроническим заболеваниям с неуклонным прогрессивным ростом. Ежегодно увеличивается число пациентов как с СД 1-го типа, так и с СД 2-го типа. СД недаром называют «эпидемией и пандемией». Предполагается, что к 2030 г. общее число больных СД увеличится до 438 млн человек, т.е. им будет страдать каждый 19-й человек на планете. Численность больных СД в Российской Федерации составляет около 9 млн; только за последние 10 лет она возросла в 2 раза [1]. По данным Минздравсоцразвития России, в 2000 г. СД страдали 162 тыс. человек, а в 2009 г. этот показатель увеличился до 308,6 тыс. человек [заболеваемость населения социальнозначимыми болезнями (зарегистрированы больные с диагнозом, установленным впервые в жизни) данные Минздравсоцразвития России, расчет Росстата]. По прогнозам ВОЗ, к 2030 г. в России будет 13,8 млн больных СД. Тяжесть заболевания формируют его осложнения, они же приводят к гибели пациентов. По статистическим данным, каждые 6—7 пациентов из 10 погибают от макроангиопатических осложнений диабета. Причем наряду с распространенностью СД нарастают и социально-экономические потери, связанные с развитием тяжелых инвалидизирующих осложнений. Отмечено, что через 20 лет после установления диагноза СД приблизительно у 2 /3 больных развивается ретинопатия, а у 30% в течение оставшейся жизни — нефропатия [2, 3]. Во всем мире признано, что нормализация уровня гликемии способствует снижению скорости развития и тяжести диабетических осложнений.
Представительные исследования (UKPDS, Steno-2, DCCT/EDIC) доказывают, что нормализация уровня гликемии при СД снижает риск развития микро- и макрососудистых осложнений [4—6]. В связи с этим национальные и международные организации установили целевые уровни гликемии, достижение которых является первостепенной задачей пациентов и врачей. Для снижения риска микрососудистых и макрососудистых осложнений целевой уровень HbA1c несколько отличается в разных странах (ADA/EASD, 2009), но он не должен превышать 7% [7, 8].
Патогномоничным лечением СД 1-го типа является постоянная заместительная инсулинотерапия, так как ведущим механизмом развития СД 1-го типа является аутоиммунное поражение β-клеток с последующей их деструкцией и развитием абсолютного дефицита инсулина. Создание аналоговых инсулинов с максимально приближенными к физиологическим потребностям человека свойствами значительно улучшило качество жизни наших пациентов.
В настоящее время рассматривают две основные теории патогенеза формирования СД 2-го типа: снижение чувствительности периферических инсулинзависимых тканей к действию инсулина или инсулинорезистентность (ИР) и недостаточная (неадекватная) секреция инсулина. В последние годы доказано, что ИР является генетически детерминированным процессом, который усугубляется по мере прогрессирования ожирения. Именно поэтому большое внимание уделяется контролю массы тела на фоне проведения инсулинотерапии, ведь инсулин — основной гормон, способствующий увеличению жировой массы. Неспособность инсулярного аппарата поджелудочной железы к адекватной продукции инсулина для преодоления ИР развивается постепенно. По данным лабораторных исследований у пациентов формируется сначала недостаточность, а позже отсутствие 1-й фазы секреции инсулина, физиологическая роль которой состоит в регуляции посталиментарной гипергликемии. Формируется так называемый «порочный круг»: снижение чувствительности периферических тканей к инсулину, с одной стороны, стимулирует его секрецию, а с другой — за счет нарастания постпрандиальной гипергликемии появляется феномен «глюкозотоксичности», приводящий к снижению секреторных возможностей β-клеток. При манифестации СД 2-го типа в среднем секреция инсулина снижается на 50%, продолжая снижаться на 4—6% в год [9], а через 10 лет от момента дебюта СД 2-го типа у 50—60% пациентов снижается инсулинсекреторная функция β-клеток поджелудочной железы более чем на 75% от нормальных значений, что приводит к необходимости проведения заместительной терапии инсулином [6, 10]. Гиперинсулинизм, направленный на преодоление гипергликемии, приводит к повышению аппетита, следовательно, к нарастанию массы тела, что усугубляет ИР и повышает потребность в секреции инсулина. Короткие курсы инсулинотерапии показаны пациентам с СД 2-го типа, имеющим нормальную массу тела, с учетом положительного влияния данной терапии на функциональное состояние островкового аппарата поджелудочной железы. В последнее время все чаще для достижения компенсации углеводного обмена, уменьшения осложнений СД в лечении пациентов с СД 2-го типа применяют инсулинотерапию. Данный вид терапии при СД 2-го типа в США составляет приблизительно 40%, в России 5 лет назад составлял только 10%, в настоящее время уже более 20% пациентов РФ с СД 2-го типа находятся на инсулинотерапии.
Когда же необходимо назначать инсулинотерапию пациентам с СД 2-го типа? Ответ на этот вопрос дает один из выводов исследования UKPDS, который гласит: «Мы не начинаем инсулинотерапию так рано и так агрессивно, как это необходимо» [10]. Боязнь начала инсулинотерапии из-за возможного развития гипогликемических состояний, прироста веса и т.д. приводит к формированию тяжелых осложнений у достаточно молодых людей трудоспособного возраста. Применение инсулинотерапии позволяет адекватно контролировать не только гликемию натощак (ГКН), но и постпрандиальный уровень гликемии (ППГ). Именно ППГ приводит к повышению риска формирования сердечно-сосудистых осложнений [11] и вносит существенный вклад в повышенный уровень НbА1с [12, 13]. Использование двухфазных аналогов инсулина позволяет добиться улучшения контроля ППГ с одновременным поддержанием ГКН в пределах рекомендуемых значений у пациентов с СД 2-го типа при невозможности достичь нормогликемии на фоне терапии ПССП.
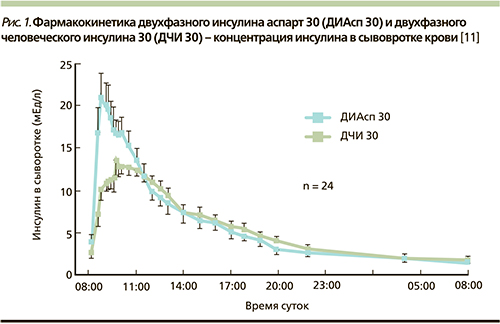
Рассмотрим отличительные особенности современного двухфазного аналогового инсулина НовоМикс 30. Необходимо отметить, что аспарт, главный компонент данного инсулина, имеет in vitro доказанные данные о безопасности, идентичные данным по безопасности для человеческого инсулина [14, 15]. НовоМикс 30 представляет собой суспензию из 30% растворимого инсулина аспарт и 70% протаминкристаллизованного инсулина аспарт. Фармакокинетические свойства аналога инсулина аспарт обеспечивают активное всасывание растворимого компонента, быстрое начало его действия и быстрое выведение из организма [16]. Именно эти особенности НовоМикс 30 способствуют оптимальному контролю ППГ у пациентов СД 2-го типа. При этом более медленное всасывание протаминированной составляющей обеспечивает базальный компонент инсулинотерапии и имеет такой же профиль абсорбции, как НПХ-инсулин [17] (рис. 1). 
Оптимизированная современная инсулинотерапия предполагает соответствие уровня инсулина в плазме колеблющимся в зависимости от приема пищи показателям глюкозы в крови. После приема пищи, при повышении уровня гликемии, необходим соответствующий пик инсулинемии. В этой ситуации быстрый компонент инсулина НовоМикс 30 — аспарт позволяет добиться соответствия пиков постпрандиальной гликемии и инсулинемии, что дает возможность улучшить контроль ППГ в сравнении с человеческим инсулином короткого действия. Быстрая элиминация действия инсулина аспарт по сравнению с отсроченной по времени элиминацией ЧИ позволяет минимизировать риск поздней постпрандиальной гипогликемии.
Хотя препарат и является двухфазным инсулином, профиль его действия характеризуется одним пиком, что позволяет воспроизвести профиль физиологической секреции инсулина. Сравнение фармакодинамики и фармакокинетики НовоМикс 30 и базис-болюсной терапии инсулинами гларгин и глюлизин было проведено в 2009 г. группой ученых под руководством T. Heise. В результате исследования было доказано, что двухфазный аналоговый инсулин аспарт имеет совпадающий с базис-болюсной терапией профиль [18]. Этот двухфазный инсулиновый аналог может использоваться как в виде монотерапии, так и в комбинации с ПССП.
Разработано несколько схем терапии инсулином НовоМикс 30. Он может быть использован от одного до трех раз в день [19] (рис. 2). 
J. Garber и соавт. получили следующие результаты: в режиме одной инъекции 41% пациентов достигли целей контроля по рекомендациям ADA (HbA1c
Двухфазный инсулин что это
ФГБУ «Эндокринологический научный центр», Москва
Препарат двухфазного инсулина аспарт 30/70 (инсулин НовоМикс 30, Novo Nordisk, Дания) относится к двухфазным инсулиновым препаратам, содержащим фиксированные пропорции инсулина короткого (ультракороткого) и пролонгированного действий. Их также называют предварительно смешанными препаратами, или готовыми инсулиновыми смесями. Препарат НовоМикс 30 (двухфазный инсулин аспарт, ДИАсп) применяется в мировой клинической практике уже более 10 лет, в т.ч. и в России [1, 2]. Данная двухфазная смесь состоит из двух компонентов: биосинтетического аналога человеческого инсулина аспарт (30 %), обладающего ультракоротким действием, и кристаллов протаминированных комплексов того же инсулина аспарт, оказывающего гипогликемизирующее действие средней продолжительности (70 %). Первая из составляющих действует преимущественно в постпрандиальном (после приема пищи) периоде, вторая контролирует базальный уровень гликемии. Смесь аспарта и его протаминированной формы устойчива, в то время как инсулин аспарт и человеческий инсулин НПХ (нейтральный протамин Хагедорна) при длительном контакте разлагаются. Кроме того, в смеси с протаминированным аспартом полностью сохраняется ультракороткое действие аспарта [3]. Сейчас можно смело сказать, что НовоМикс 30 – один из наиболее изученных препаратов инсулина, продемонстрировавший высокую эффективность и безопасность как в многочисленных рандомизированных клинических исследованиях, так и в крупных наблюдательных программах.
Двухфазные препараты инсулина создавались прежде всего для лечения сахарного диабета 2 типа (СД2), хотя имеется опыт применения НовоМикс 30 и при СД1 [4].
Именно СД2 составляет стремительно растущую когорту пациентов, заставившую мировое сообщество говорить об «эпидемии неинфекционного заболевания», что отражено в Резолюции ООН, принятой на 61-й Генеральной ассамблее этой организации в 2006 г.
Эффективное лечение СД заключается прежде всего в поддержании целевых уровней гликемии на протяжении многих лет, точнее – на протяжении всей жизни пациента. Для большинства больных СД2 это серьезный вызов, если учесть сопутствующую патологию: артериальную гипертензию, дислипидемию, проявления атеросклероза и т.д., – также требующую контроля и лечения и нередко приводящую к феномену полифармации. Серьезным фактором, усложняющим управление заболеванием, является также возраст большинства пациентов с СД2, затрудняющий выполнение мероприятий по лечению и контролю в силу снижения зрения, двигательных, а порой и когнитивных нарушений. Не секрет, что такие пациенты представляют большую проблему в практике врача-эндокринолога, терапевта, других специалистов, вследствие чего СД часто остается недостаточно компенсированным.
Разумеется, наиболее близок к физиологической секреции инсулина базис-болюсный режим, представляющий собой раздельное введение инсулина короткого и пролонгированного действий, который позволяет варьировать дозу каждой инъекции с учетом всех факторов влияния (актуальные показатели гликемии, содержание углеводов в пище и т.д.). Однако в связи с большим числом инъекций и сложностью комплекса мероприятий по управлению терапевтическим процессом применение базис-болюсного режима не представляется возможным для всех больных СД2, нуждающихся в инсулинотерапии. В связи с этим применение двухфазных препаратов инсулина приобрело широкое распространение и стало высокоэффективной альтернативой базис-болюсному режиму для больных СД2. Соединение двух препаратов с разной продолжительностью действия в одном обеспечивает удобство применения, позволяет избегать ошибок при введении, о которых нередко сообщают пациенты: введение препарата короткого действия вместо продленного, и наоборот. Требуется также меньшее число инъекций в течение дня – 1–3 вместо 4 и более при базис-болюсном режиме.
Однако двухфазные человеческие инсулины (ДЧИ) имеют ряд фармакокинетических и фармакодинамических ограничений, которые могут приводить как к гипергликемии в раннем постпрандиальном периоде, так и к поздней постпрандиальной гипогликемии. Они также требуют примерно 30-минутной паузы между инъекцией и началом приема пищи, которая не всегда выдерживается пациентами. Предварительно смешанные инсулиновые аналоги создавались с целью преодоления перечисленных ограничений в действии ДЧИ. В ряде исследований продемонстрированы лучшие постпрандиальные показатели гликемии при терапии двухфазным аналоговым препаратом инсулина НовоМикс 30 по сравнению с ДЧИ [5], меньший риск гипогликемий, особенно ночных [6, 7] и тяжелых [8, 9]. Эти преимущества обусловлены фармакокинетикой и фармакодинамикой НовоМикс 30, близких к таковым при эндогенной инсулиновой секреции у здоровых людей. В исследовании T. Heise и соавт. продемонстрированы фармакологические преимущества НовоМикс 30 перед ДЧИ с тем же соотношением фракций короткого и продленного действий, выявленных в ходе процедуры 24-часового эугликемического клэмпа [10]. В числе этих преимуществ более высокая концентрация инсулина в крови (73,1–100,4 ЕД/л на НовоМикс 30 против 46,7 –на ДЧИ) 1; более короткое время достижения максимальной концентрации (2,1–2,6 часа на НовоМикс 30 против 3,2 на ДЧИ). Фармакокинетические профили инсулина НовоМикс 30 и ДЧИ представлены на рис. 1.
Стоит также отметить сопоставимую эффективность терапии инсулином НовоМикс 30 при введении препарата 3 раза в сутки в сравнении с базис-болюсной терапией [4,12].
Поскольку двухфазные аналоговые смеси инсулина представлены и препаратами с другим соотношением короткой и продленной фракций (25/75 и 50/50), их сравнение особенно интересно. При сравнении НовоМикс 30 и двухфазного инсулина лизпро микс 25 в рамках международного открытого перекрестного исследования 137 пациентов с СД2 [13] оба инсулина привели к сопоставимому снижению уровней гликированного гемоглобина (HbA1c) и гликемии. Частота эпизодов гипогликемий (0,69 и 0,62 эпизода в месяц для НовоМикс 30 и лизпро микс 25 соответственно; p = 0,29) также оказалась близкой.
В исследовании Hermansen и соавт. [14] сравнивали постпрандиальные показатели глюкозы крови на фоне применения инсулина НовоМикс 30, лизпро микс 25 и ДЧИ. НовоМикс 30 продемонстрировал наилучшие показатели постпрандиального контроля, представленные как экскурсия уровня глюкозы в интервале 0–5 часов после еды. Этот показатель на инсулине НовоМикс 30 был на 17 % ниже по сравнению с ДЧИ (p