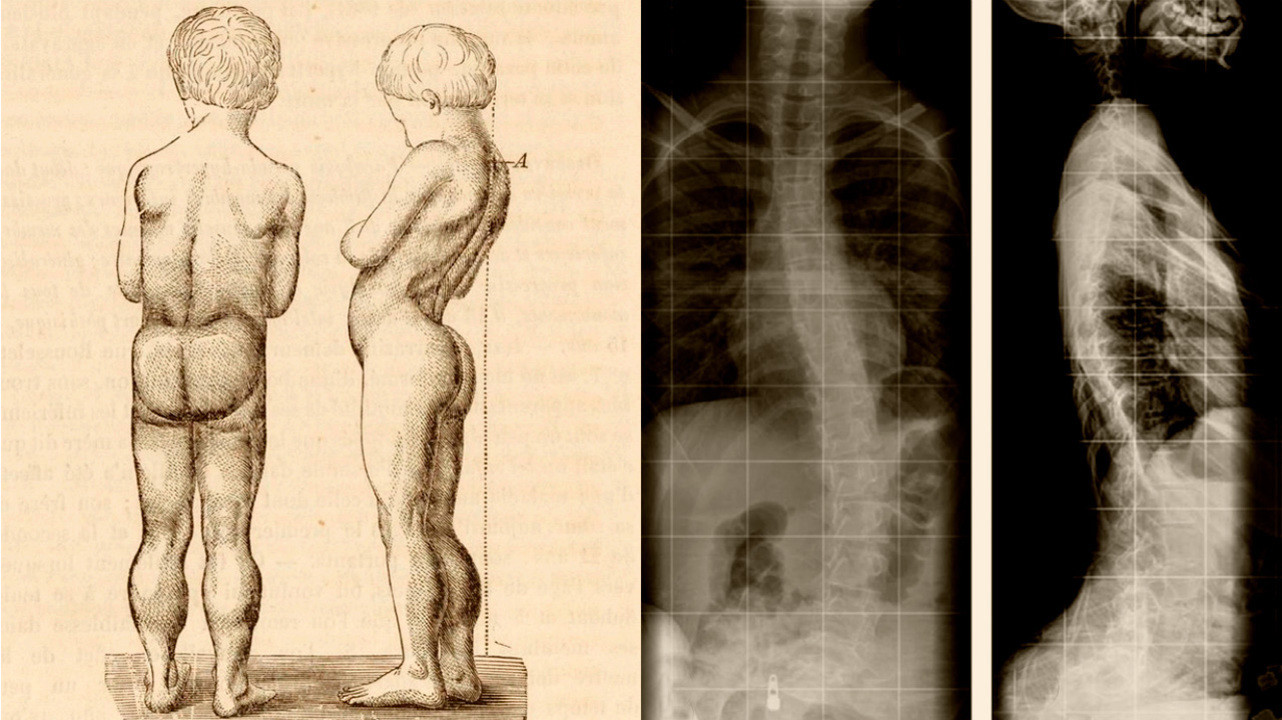
Дюшенна болезнь у детей что это
Мышечная дистрофия Дюшенна
Этот тип мышечной дистрофии относится к прогрессирующим генетическим заболеваниям и характеризируется патогенными поражениями, некрозом мышечных волокон, замещением их жировой и соединительной тканью.
Симптоматика мышечной дистрофии Дюшенна
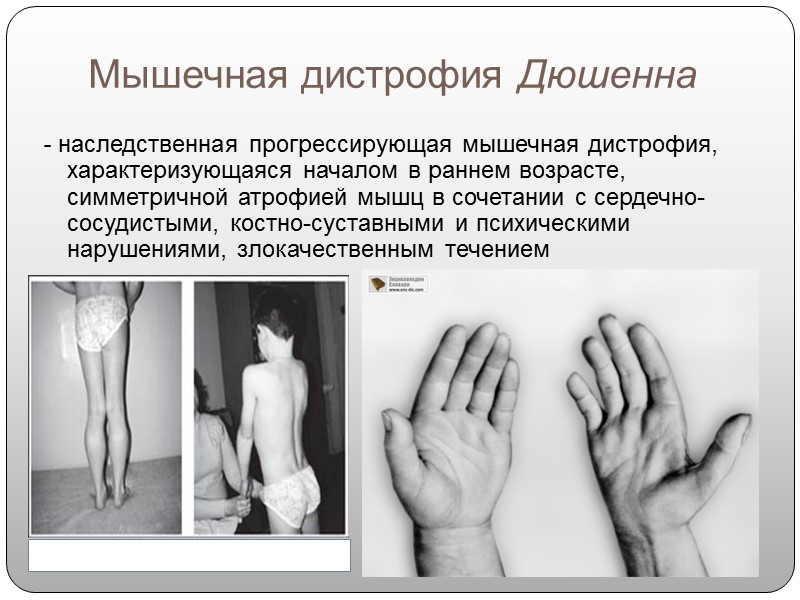
До 2-3 лет ребенок может не отставать в развитии от сверстников, первые симптомы проявляются на 3-5 году жизни, когда возникает мышечная слабость и утомляемость после физических нагрузок.
Отчетливое прогрессирование симптомов особенно заметно к 7-8 годам: меняется походка, а ослабленные мышцы начинают ограничивать самостоятельное передвижение больных. К 14-15 годам двигательная активность полностью ограничивается.
Характерными клиническими признаками мышечной дистрофии Дюшенна являются:
Этиология мышечной дистрофии Дюшенна
Возникновение и развитие патологии провоцирует генетическое поражение Х-хромосомы: нарушается синтез белка дистрофина, являющегося основой мышечных волокон и обеспечивающего их сокращение, пребывание в неактивном состоянии. При мышечной дистрофии этот белок не вырабатывается или продуцируется дефективным, что приводит к перерождению мышц и прогрессирующему ограничению двигательной активности.
Миодистрофия Дюшенна наследуется по рецессивному, сцепленному с Х-хромосомой типу. При этом девочки являются носителями патологии, а развивается заболевание только у лиц мужского пола (так как рецессивный аллель у них не подавляется доминантной парной генетически нормальной Х-хромосомой).
Диагностика мышечной дистрофии
Но наиболее показательными и информативными являются генетические молекулярные исследования (панель «Нервно-мышечные заболевания», микроматричный анализ – ХМА), которые точно определяют нозологическую форму мышечной дистрофии.
Кроме того, около трети диагностируемых случаев миодистрофии Дюшенна имеют спорадический характер. Возникновение 6-7% спонтанных мутаций обусловлено органным гонадным мозаицизмом – наличием у матери генетически здоровых и мутантных первичных половых клеток.
Поэтому пренатальная молекулярная диагностика позволяет идентифицировать, какой именно структурный вариант гена (аллель) получил ребенок. Даже если установлен мужской пол эмбриона, вероятность передачи от матери мутантной популяции гамет не оценивается в 100%, как и генетический риск наследования идентичной мутации братьями (сестрами) больного со спорадической миодистрофией.
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик
Принцип генной терапии миодистрофии Дюшенна/Беккера. Миодистрофию Дюшенна (МДД) вызывают мутации гена дистрофина (DMD), приводящие к сдвигу рамки считывания, а более мягкую миодистрофию Беккера (МДБ) — мутации без смещения рамки считывания. Лечения этой болезни пока нет. Генная терапия поможет улучшить или даже восстановить функции мышц.
Автор
Редакторы
Мышечная дистрофия Дюшенна — тяжелейшее Х-связанное заболевание, эффективного лечения которого до сих пор нет. В одном из последних номеров Science вышли целых три статьи об успешном тестировании на мышиных моделях технологии CRISPR/Cas9 для лечения этой болезни. Может быть, у этого подхода есть шанс добраться и до клиник?
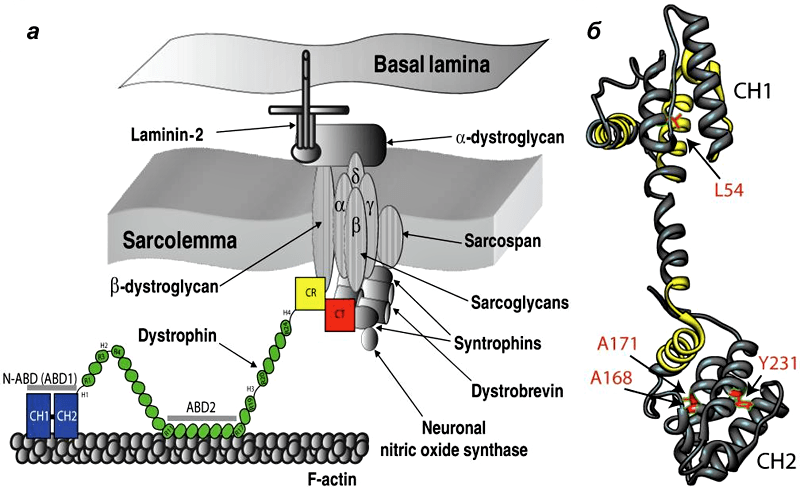
Дистрофин находится на внутриклеточной поверхности сарколеммы вдоль всей длины мышечных волокон и входит в состав дистрофин-ассоциированного гликопротеинового комплекса (ДАГК, DGC). Он связывается одним концом с F-актином цитоскелета, а другим — с β-дистрогликаном, что стабилизирует волокна во время сокращения. Ген дистрофина — один из самых длинных у человека.
Излечивать мышечную дистрофию Дюшенна пока не умеют, а сегодняшняя терапия направлена на замедление прогрессирования болезни и лечение осложнений [4], [5]. «Золотой стандарт» — это кортикостероиды, которые были предложены в качестве лечения еще несколько десятилетий назад. Однако их применение вызывает множество побочных эффектов.
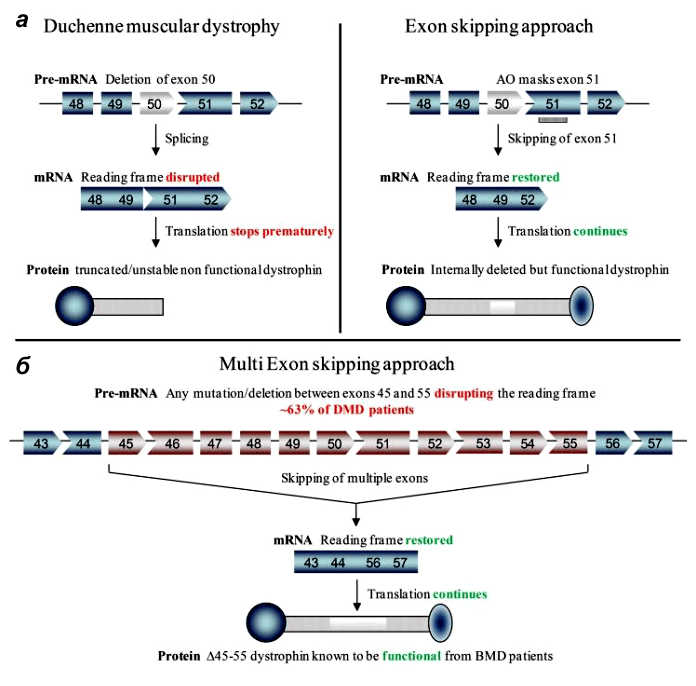
Неудивительно, что многие группы генетиков и молекулярщиков занимаются разработкой пре- и постнатального лечения миодистрофии Дюшенна. Болезнь в основном изучают на различных линиях мышей. В одном из последних номеров Science опубликовали сразу три независимых работы по методам лечения мышечной дистрофии Дюшенна [6–8]. Исследовательские группы возглавили Эрик Олсон (Eric Olson) из Техасского университета, Эми Уаджерс (Amy Wagers) из Гарвардского университета и Чарльз Герсбах (Charles Gersbach) из Университета Дьюка. Все группы для восстановления функции мышц использовали методику пропуска экзонов, при которой один или несколько экзонов удаляются из мРНК (рис. 2). В таком случае белок получается короче, но всё же может выполнять свою поддерживающую и заякоривающую функции в мышечном волокне, а «досадное обстоятельство» — лишний стоп-кодон — тоже оказывается «пропущенным».
Рисунок 2. Пропуск экзонов в гене дистрофина при миодистрофии Дюшенна. а — У пациентов с МДД в гене DMD присутствуют мутации, нарушающие рамку считывания при синтезе белка. Например, при делеции экзона 50 появляется «внерамочная» мРНК, что приводит к синтезу усеченного нефункционального или нестабильного дистрофина (слева). В одном из терапевтических подходов антисмысловой олигонуклеотид «маскирует» экзон 51, и он «пропускается» при сплайсинге, рамка считывания восстанавливается. В результате получается более короткий, но частично функциональный дистрофин (справа). В новых работах «лишние» экзоны просто вырезают из генома с помощью CRISPR/Cas9. б — Мультиэкзонный пропуск в терапии МДД. Если осуществить пропуск экзонов 45–55, мутации которых встречаются примерно у 63% пациентов, то образовавшийся короткий дистрофин приведёт к трансформации стандартного МДД-фенотипа в бессимптомный или более мягкий МДБ-фенотип.
У стратегии удаления экзонов есть даже преимущества перед воссозданием полной длины гена: ее проще разработать, чем восстановить индивидуальные делеции каждого пациента [7].
Для вырезания «лишних» нуклеотидных последовательностей исследователи воспользовались технологией редактирования генома CRISPR (clustered regularly interspaced short palindromic repeats) / Cas9 (CRISPR-associated protein 9) [9], которую, между прочим, только что разрешили применить в опытах на эмбрионах одному лондонскому институту [10].
Конкурирующие лаборатории: кто первым воплотит технологию в терапию для человека?
Ученые трех лабораторий успешно применили технологию пропуска экзонов in vivo на стандартном объекте — мышах — и показали, что их метод помогает восстановить рамку считывания и частично восстановить синтез дистрофина. Поскольку даже невысокий его уровень (3–15% от нормального) приносит терапевтическую пользу, результаты работ можно назвать успешными.
Группа Эрика Олсона уже не в первый раз использует метод CRISPR/Cas9 в своих работах по мышечной дистрофии Дюшенна. В 2014 году ученые исправили мутацию в зародышевой линии мышей и предотвратили развитие болезни. Однако, поскольку пренатальное редактирование генома на человеческих эмбрионах (пока?) запрещено, исследователям пришлось придумать способ постнатального применения технологии.
В их последней работе для доставки необходимых для редактирования компонентов в ткани использовался аденоассоциированный вирус-9 (AAV9, adeno-associated virus-9) [6]. Исследователи испытали несколько способов введения AAV9 в различные дни после рождения мышат. Во всех случаях экспрессия гена дистрофина в сердечной и скелетных мышцах восстановилась, но в разной степени. Более того, продукция белка увеличивалась с 3 до 12 недель после инъекций, а через 4 недели после инъекций улучшилась функция скелетных мышц. «Сейчас задача для исследователей из центра Уэллстоун заключается в том, чтобы перенести открытия с мышиной модели на пациентов с миодистрофией», — говорит Прадип Маммен (Pradeep Mammen), содиректор центра Уэллстоун.
Группа Эми Уаджерс провела во многом похожий эксперимент [8]. После множества подготовительных этапов работы по редактированию генома и пропуску экзона на клетках и животных их опыт тоже увенчался успехом: программируемые CRISPR-комплексы в составе аденоассоциированного вируса (AAV) были доставлены с помощью локального и системного введения к дифференцированным скелетным волокнам, кардиомиоцитам и сателлитным мышечным клеткам новорожденных и взрослых мышей. Если редактирование направлено только на мышечные волокна, то эффект со временем может сойти на нет. Однако, как отмечает Уаджерс, редактирование генов в сателлитных клетках может обеспечить гораздо более длительный результат. Оно способно привести к созданию пула регенеративных клеток, несущих отредактированный ген дистрофина, и в результате обычной репарации мышц отредактированный ген окажется и в мышечных волокнах.
Наконец, как все уже догадались, ученые под руководством Чарльза Герсбаха тоже обнаружили терапевтический эффект применения AAV-CRISPR/Cas9 в мышиной модели [7]. Внутрибрюшинное введение вирусного вектора новорожденным мышам привело к восстановлению синтеза дистрофина в абдоминальных мышцах (мышцах живота), диафрагме и сердце через семь недель после инъекции. Как отмечают авторы, терапия сердечной и легочной мышц крайне важна, поскольку именно их отказ зачастую приводит к смерти пациентов с болезнью Дюшенна. Внутривенное введение AAV-векторов шестинедельным мышам тоже привело к значительному восстановлению продукции дистрофина в сердечной мышце. «Остается еще много работы по переделке [технологии] в терапию для человека и подтверждения ее безопасности, — говорит Герсбах. — Но результаты наших первых экспериментов уже весьма воодушевляющие». Группа собирается оптимизировать систему доставки и оценивать эффективность и безопасность стратегии на более крупных животных (рис. 3). Какая же из трех лабораторий обгонит других и первой сможет провести испытания на человеке?
Терапия миодистрофии Дюшенна: старые и новые подходы
По словам Олсона, главное отличие новой стратегии с использованием вектора, вмещающего в себя компоненты для редактирования генома, от других терапевтических методов в том, что она устраняет причину болезни. А какие еще подходы разрабатывают ученые?
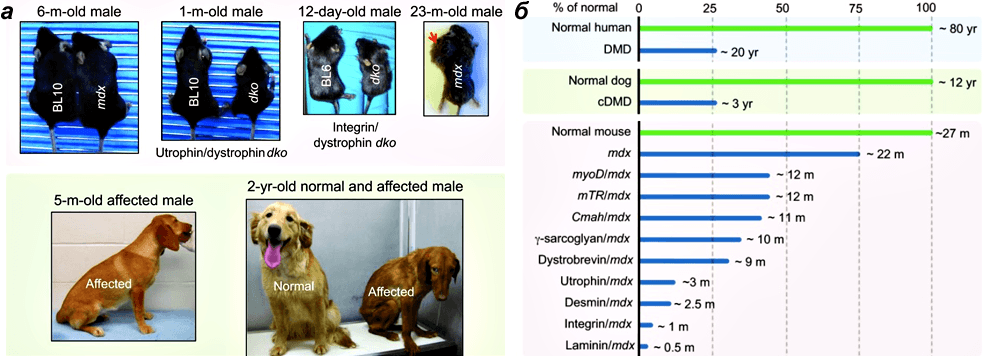
Рисунок 3. Животные модели миодистрофии Дюшенна. а — Проявления миодистрофии Дюшенна у мышей и собак. Вверху: у мышей mdx симптомы проявляются только в старости, и они склонны к образованию рабдомиосарком — опухолей мышечного происхождения. Размер мышей с нокаутами генов атрофина/дистрофина и интегрина/дистрофина значительно меньше, чем их ровесников дикого типа (BL10 и BL6). Внизу: проявления болезни у пятимесячной больной собаки. Различия между здоровой и больной двухлетними собаками. б — Сравнение продолжительности жизни здоровых и больных людей, собак и различных линий мышей.
Один из многообещающих подходов — это клеточная терапия. Хотя опыты с внутримышечной инъекцией миобластов от здоровых доноров провалились, технологии с использованием стволовых клеток и индуцированных плюрипотентных стволовых клеток (ИПСК) пока успешно испытываются на моделях не только миодистрофии Дюшенна, но и болезни Альцгеймера, Паркинсона, Хантингтона, спинальной мышечной атрофии, бокового амиотрофического склероза, аутизма и шизофрении [14–16]. Например, в 2013 году исследователи из Бостонской детской больницы (Boston Children’s Hospital’s Stem Cell Program) с помощью смеси трех малых молекул (форсколина, основного фактора роста фибробластов bFGF и ингибитора гликогенсинтазы киназы-3) перепрограммировали ИПСК из кожи пациентов с миодистрофией Дюшенна в мышечные клетки, которые затем успешно прижились у мышей. Сейчас из ИПСК получены кардиомиобласты и нейроны [2].
Другие исследования показывают, что восстановление нормального уровня синтеза оксида азота (NO), который снижается у больных из-за нарушения активности NO-синтазы (nNOS), ослабляет воспаление, повышает активность собственных стволовых клеток и реконструирует морфологию и функции скелетных мышц [3].
Уже в фазе II клинических испытаний находится препарат Givinostat — ингибитор гистондеацетилаз, который замедляет прогрессирование болезни в мышиной модели.
Миодистрофия Дюшенна и пути реабилитации
Время чтения: 6 мин.
Развитие орфанного генетического заболевания миодистрофии Дюшенна проходит четыре стадии. В зависимости от них врачи назначают пациентам различные виды реабилитации. На что обратить внимание на разных стадиях течения болезни и как помочь пациенту читайте в руководстве, подготовленном по итогам первой всероссийской онлайн-конференции по миодистрофии Дюшенна. Это мероприятие организовал Благотворительный фонд «Гордей».
Важно провести тестирование ребенка по шкалам Бейли. Это поможет определить задержки в различных областях развития: физической, когнитивной, коммуникативной. Определив проблему, можно начать ранние корректирующие вмешательства. К ним относится не только физическая терапия, но и помощь логопеда или психолога.
В своем выступлении профессор и реабилитолог Имельда Де Грут (Нидерланды) отметила, что важно проверять на МДД и детей с задержками развития. Заболевание связано не только с мышцами, но и с мозгом. Связано это с определенной изоформой гена дистрофина в мозге. Если есть ее дефицит, то возможны интеллектуальные и когнитивные проблемы.
У мальчиков с Дюшенном уровень IQ в среднем на одно стандартное отклонение ниже нормы, 27% пациентов имеют сниженный IQ. У большей части мальчиков с Дюшенном — нормальный и высокий уровни IQ. Некоторые мальчики успешно заканчивают университеты и получают ученые степени. Поэтому нельзя по умолчанию воспринимать пациента с Дюшенном как человека с задержкой когнитивного развития.
В медицинском аспекте нужно обратить внимание:
В социальном аспекте на ранней амбулаторной фазе важно:
В медицинском аспекте нужно обратить внимание:
К каким изменениям нужно подготовиться в социальном аспекте:
На что важно обратить внимание в медицинском аспекте:
На что надо обратить внимание в медицинском аспекте:
Социальный аспект поздней неамбулаторной фазы:
Согласно опросу 213 пациентов до 35 лет, в поздней неамбулаторной стадии никто из них не работает, не занимается спортом, у них нет хобби. Только у нескольких опрошенных были романтические отношения. В Нидерландах есть несколько мужчин, которые женились и завели детей, но их процент среди всех пациентов — пока невелик.
При постановке диагноза ребенку у родителей рушится мир. Поэтому врачу важно подробно ещё раз всё разъяснить, ответить на все вопросы. Нужно акцентировать внимание родителей на том, как они смогут улучшить качество жизни ребенка, несмотря на то, что в будущем ему придется пользоваться инвалидным креслом.
Советы Джеймса Пойски (США), профессора, педиатра-нейропсихолога, эксперта по влиянию МДД на обучение, поведение и эмоциональную адаптацию, отца 18-летнего пациента с МДД:
Использовано стоковое изображение от Depositphotos.
5 фактов о болезни Дюшенна, которые должны знать родители мальчиков
7 сентября в разных странах мирах в небо запускают красные воздушные шары — так отмечают пациенты и их близкие Всемирные день распространения информации о мышечной дистрофии Дюшенна. Это тяжелое прогрессирующее заболевание встречается довольно редко, и родители и педиатры могут пропустить «тревожные звоночки». Рассказываем, что нужно знать об этом патологии.
Болезнь Дюшенна или мышечная дистрофия Дюшенна проявляется в раннем возрасте и характеризуется слабостью мышц, которая постоянно прогрессирует и к подростковому возрасту лишает способности самостоятельно передвигаться. Заболевание диагностируется приблизительно у 1 из 3,5 тысячи мальчиков, у девочек встречается крайне редко и проявляется более легкими симптомами.
Будущая мать может узнать о носительстве мутантного гена с помощью анализа
Болезнь Дюшенна вызвана мутацией в гене дистрофина, расположенного в Х-хромосоме. В 70% случаев мутировавший ген передается только от матерей-носителей. Если женщина планирует беременность, она может узнать о носительстве гена с помощью специального анализа, который можно сдать в частных лабораториях. В некоторых странах, например, в Израиле, такой тест входит в государственную систему здравоохранения и проводится бесплатно.
Но важно помнить, что анализ — это не гарантия того, что в семье не родится ребенок с болезнью Дюшенна. В 30% случаев заболевание становится результатом нового изменения гена у плода (De Novo).
Ходит на цыпочках, тяжело встает — первые симптомы болезни Дюшенна
Первые «красные флаги» появляются уже в возрасте 2-3 лет, которые большинство родителей не замечает, либо списывают их на возраст — например, когда ребенок неуклюжий по сравнению со сверстниками или часто падает. Более того, педиатры, которые никогда не сталкивались с мышечной дистрофией Дюшенна, могут не обратить внимание на эти симптомы и неверно поставить диагноз.
Вот как описывает типичные симптомы ранней стадии заболевания врач-педиатр Сергей Бутрий:
«Мать просит его лечь и встать — он делает это в очень странной манере, сперва избыточно опираясь на пол, потом и вовсе на собственные ноги»
По словам эксперта, повышение осведомленности врачей и родителей об этом заболевании может ускорить постановку диагноза таким детям, а значит, ускорить их попадание к профильным специалистам и улучшить прогноз болезни.
Бутрий советует родителям:
«Если подозрения вас не оставляют — покажите ребенка педиатру с прямым вопросом: «Это ведь не может быть дистрофией Дюшенна?»»
Это заболевание часто путают с гепатитом
Если есть сомнения по поводу здоровья мальчика, врач должен назначить анализ крови на активность креатинфосфокиназы (КФК). Это фермент, содержащийся в скелетных мышцах, маркер их распада. При мышечных дистрофиях, в том числе болезни Беккера, он выделяется в громадных количествах — в несколько десятков тысяч единиц при норме в сотню.
Но опять же, из-за низкой осведомленности о болезни Дюшенна, врачи ошибочно диагностируют гепатит у таких мальчиков. Все дело в том, что при этом этом заболевании в крови повышаются уровни трансаминаз, что также происходит при гепатите. Но при дистрофии Дюшенна эти ферменты мышечного происхождения, а не печеночного.
Поставить точный диагноз можно только с помощью специализированного генетического анализа, направить на который должен врач. Бесплатную диагностику проводит в ФГБНУ «Медико-генетический научный центр имени академика Н.П. Бочкова» при значениях КФК более 2000 ЕД\л.
Чтобы направить пациента на диагностику, специалист должен позвонить на горячую линию для врачей по телефону 8-800-100-17-60 и зарегистрировать ребенка в программе бесплатного генотипирования.
«Народные» методы лечения могут усугубить заболевание
Если диагноз подтвержден, врач назначит глюкокортикостероиды — на сегодняшний день это золотой стандарт лечения для замедления развития заболевания. Также показана специальная лечебная физкультура и комплексная реабилитация в разном возрасте. В 2020 году в России зарегистрирован первый препарат для лечения миодистрофии Дюшенна — Аталурен, но пока о его эффективности известно немного.
Создатели просветительского проекта Red Balloons для родителей детей с болезнью Дюшенна предупреждают об опасности различных методов «лечения» из Интернета, за которую отчаявшиеся мамы и папы хватаются как за соломинку. К сожалению, они не только не приносят пользу, но могут даже ускорить прогрессирование заболевания.
Заболевание нельзя вылечить, но можно продлить жизнь
В этом году темой Всемирный день распространения информации о мышечной дистрофии Дюшенна была выбрана взрослая жизнь. Врачи и пациенты призывают не ограничивать свои перспективы «жизнь до 20 лет», а улучшить качество тех молодых людей, которые решили быть самостоятельными, учиться, работать и открывать мир.
Лечится ли миодистрофия Дюшенна?
Время чтения: 5 мин.
Лечится ли миодистрофия Дюшенна?
Миодистрофия Дюшенна встречается так же часто, как СМА (спинальная мышечная атрофия), но болеют практически только мальчики. Согласно статистике, один из 3500-5000 мальчиков в мире рождается с мышечной дистрофией Дюшенна.
Терапия СМА и Дюшенна: в чем разница?
При всей катастрофичности СМА молекулярная и клеточная основа этого заболевания проще и понятнее, чем у миодистрофии Дюшенна.
Лекарство можно ввести в спинной мозг, оно не размывается по всему организму, не метаболизируется печенью и не выводится почками. Создается его локальная высокая концентрация. Одной инъекции хватает на несколько месяцев. А если это генотерапия, то полноценный замещающий генетический материал, однажды попав в больную нервную клетку, вылечивает ее, остается там надолго, если не на всю жизнь.
В случае миодистрофии Дюшенна все сложнее: ген дистрофина — один из самых больших. Он больше гена СМА почти в полторы тысячи раз, и в нем тысячи разных мутаций (делеции, дупликации, нонсенс и т.д.) в разных местах.
Ген не помещается целиком в вирус, поэтому используют только кусочки гена — мини- и микродистрофин, которые могут ограниченно восстановить функциональность мышечных клеток, перевести «Дюшенн в Беккер» — более легкую форму миодистрофии, при которой человек может прожить до 60 лет, сохранять дееспособность, работать.
Мышечные клетки составляют 40% от всех клеток тела, они активно работают и постоянно заменяются. Доставить лекарство в мышечные клетки – трудная задача: оно должно с кровью попасть во все клетки, а раз с кровью, то с лекарством борется печень, и оно выводится через почки. Итог – низкая концентрация и ограниченное время действия.
Генотерапия мини- и микродистрофином – подводные камни на каждом этапе. У ребенка может быть имеющийся иммунитет к вирусу-переносчику гена, таких детей примерно 30%. Компании сейчас работают над тем, как убрать антитела к вирусу из крови. И пока пациентам доступна только одна попытка генотерапии в жизни, потому что после инфузии уже точно будет выраженный противовирусный иммунитет.
Но результат стоит того, тем более с осложнениями врачи научились бороться. И, конечно, будут другие технологии, лучше и безопаснее, которые смогут преодолеть существующие проблемы.
Больные МДД как снежинки: все разные
Сделать лекарство для МДД сложно, один препарат не вылечит всех, как при СМА.
Больные МДД как снежинки: все разные, нет одинаковых, уже описано около десяти тысяч мутаций гена. Имеет значение и вся генетика ребенка. Поэтому болезнь проявляется по-разному, даже в одной семье у двух братьев с одной мутацией.
| Препарат | Одобрено международными регуляторами | Ожидаемая дата регистрации в РФ | Возраст начала терапии |
|---|---|---|---|
| Аталурен | EMA 2012 | 24.11.2020 | 2 года |
| Экзондис 51 | FDA 2016 | 2021-22 | С момента постановки диагноза |
| Вайондис, Вилтепсо 53 | FDA 2020, Япония | 2021-22 | 4(NS) 0 (S) |
| Амондис | FDA 2021 | 2022 | С момента постановки диагноза |
| Мини/микродистрофин AAV вектор (4) | 2021-22 | 2 года | |
| Гивиностат | 2021-22 | ||
| Ваморолон | 2021-22 | 2 года | |
| Тамоксифен | Off-label | 2022 | |
| ГКСФ (гранулоцитарный колониестимулирующий фактор) | Off-label | 2022 |
Мы живем во время орфанной революции, когда многие редкие генетические неизлечимые заболевания получают патогенетической лечение, и больные обретают возможность жить долгой полноценной жизнью. Новые лекарства могут превратить фатальную болезнь в хроническую, хоть и тяжелую, как, например, диабет.
Как получить лекарства?
Если у вашего ребенка выявили миодистрофию Дюшенна, и вы хотите получить терапию для него, нужно прежде всего иметь подтвержденный генетический диагноз с определением мутации, которая вызвала заболевание. Примерно в 1% случаев не удается выяснить тип мутации. В таком случае делают биопсию мышцы и определяют количество синтезируемого мышцами дистрофина.
Как участвовать в клинических исследованиях?
Сейчас активно проводятся клинические исследования нескольких лекарственных препаратов. О том, какие из них исследуются в России, можно узнать на сайте Минздрава РФ. Заполнив форму, введя название препарата (Аталурен), можно узнать, в каком учреждении проводится исследование. Родителям необходимо самостоятельно связаться с учреждением, чтобы попробовать попасть в число участников.
Информацию о новых препаратах и клинических исследований в области миодистрофии Дюшенна можно найти и в пациентских сообществах, например, ProДюшенн.
Материал подготовлен с использованиюем гранта Президента Российской Федерации, предоставленного Фондом президентских грантов.
Использовано стоковое изображение от Depositphotos.