E coli m17 что это
Escherichia coli (кишечная палочка)

Вид эшерихия коли (E. coli) включён в род эшерихии (лат. Escherichia), семейство энтеробактерии (лат. Enterobacteriaceae), порядок энтеробактерии (лат. Enterobacteriales), класс гамма-протеобактерии (лат. γ proteobacteria), тип протеобактерии (лат. Proteobacteria), царство бактерии.
Существует большое число разновидностей кишечной палочки (Escherichia coli), в том числе, более 100 патогенных («энтеровирулентных») типов, объединенных в четыре класса: энтеропатогенные, энтеротоксигенные, энтероинвазивные и энтерогеморрагические. Морфологические различия между патогенными и непатогенными эшерихиями отсутствуют.
Кишечные палочки. Общие сведения
Кишечные палочки (Escherichia coli) устойчивы во внешней среде, длительное время сохраняются в почве, воде, фекалиях. Хорошо переносят высушивание. Кишечные палочки обладают способностью к размножению в пищевых продуктах, особенно в молоке. Быстро погибают при кипячении и воздействии дезинфицирующих средств (хлорной извести, формалина, фенола, сулемы, едкого натра и др.). 
Часть кишечных палочек имеет жгутики и подвижны. У других кишечных палочек жгутики и способность к движению отсутствуют.
Escherichia coli в кишечнике и кале человека
Число кишечных палочек Escherichia coli среди других представителей микрофлоры кишечника не превышает 1%, но они играют важнейшую роль в функционировании желудочно-кишечного тракта. Кишечные палочки E. coli являются основными конкурентами условно-патогенной микрофлоры в отношении заселения ими кишечника. Кишечные палочки E.coli забирают из просвета кишечника кислород, который вреден для полезных для человека бифидо- и лактобактерий. Кишечные палочки E. coli вырабатывают ряд необходимых для человека витаминов: В1, В2, В3, В5, В6, биотин, В9, B12, К, жирные кислоты (уксусную, муравьиную, а ряд штаммов также молочную, янтарную и другие), участвует в обмене холестерина, билирубина, холина, желчных кислот, оказывает влияние на всасывание железа и кальция.
При избыточном росте кишечной палочки, как следствии дисбактериоза, кроме бактериофагов, при медикаментозной терапии применяются различные пробиотки (Бифидумбактерин, Лактобактерин, Ацилакт, Аципол и др.) и/или адекватные конкретному штамму e. coli и причине дисбактериоза антибиотики (у взрослых).
На сайте GastroScan.ru в разделе «Литература» имеется подраздел «Микрофлора, микробиоценоз, дисбиоз (дисбактериоз)», содержащий статьи для профессионалов здравоохранения, затрагивающие проблемы микробиоценоза и дисбиоза отделов ЖКТ человека.
Эшерихиозы
Патогенные серотипы кишечных палочек могут быть причиной эшерихиозов — различных инфекционных заболеваний, протекающих с интоксикацией, лихорадкой, обычно с поражением желудочно-кишечного тракта, реже — мочевыводящих, желчевыводящих путей, других органов или с развитием сепсиса. Эшерихиозы чаще встречаются у детей раннего возраста. Механизм распространения эшерихиозов ЖКТ — фекально-оральный. Чаще всего заражение происходит через загрязнённую пищу или воду.
Escherichia coli (кишечная палочка) — наиболее часто встречающийся возбудитель спонтанного бактериального перитонита — воспаления брюшной полости при отсутствие очевидного источника инфекции.
Энтеропатогенная кишечная палочка

Энтеротоксигенная кишечная палочка
Энтерогеморрагическая кишечная палочка
Энтерогеморрагические кишечные палочки (EHEC) являются причиной геморрагического колита, а также тяжелого заболевания — гемолитико-уремического синдрома (микроангиопатической гемолитической анемии, сочетающейся с почечной недостаточностью; аббревиатура ГУС или HUS).
Для геморрагического колита характерно острое начало в виде сильных спастических болей в животе и водной диареи, которая вскоре становится кровавой. Лихорадка обычно отсутствует, но у некоторых температура тела может достигать 39 °С. В легких случаях геморрагический колит продолжается 7–10 дней. Приблизительно в 5 % случаев геморрагический колит осложняется геморрагическим синдромом, острой почечной недостаточностью и гемолитической анемией.

Установлено, что возбудителем европейской инфекции мая 2011 года является кишечная палочка серологической группы E. coli O104 (серотип E. coli O104:H4), имеющая в своем геноме ген, ответственный за продукцию шига-подобного токсина 2-го типа. В отличие от классических энтерогеморрагических кишечных палочек (E. coli О157:Н7), штаммы E.coli O104:H4 не имеют еае-гена, ответственного за продукцию белка интимина, который является фактором адгезии.
Штаммы E. coli O104:H4, выделенные от пациентов, характеризовались резистентностью к бета-лактамным антибиотикам за счет продукции бета-лактамазы расширенного спектра, но оставались чувствительными к группе аминогликозидов (гентамицин) и фторхинолонам.
После заражения энтерогеморрагической кишечной палочкой инкубационный период длится чаще всего от 48 до 72 часов, но может быть и от 1 до 10 дней. Симптомы заражения включают схваткообразные боли в животе и диарею, нередко с кровью. Могут наблюдаться лихорадка и рвота. Большинство больных выздоравливают в течение 10 дней. Иногда инфекция может приводить к опасным для жизни состояниям, таким как гемолитико-уремический синдром.
Энтероинвазивная кишечная палочка
Escherichia coli — возбудитель заболеваний мочеполовых органов
При наличии симптомов или при заборе мочи катетером диагностический порог может быть значительно уменьшен. В частности, при наличии клинической симптоматики (лихорадка, озноб, тошнота, рвота, боли в поясничной области, дизурия) и выделении не менее 10 лейкоцитов в 1 мкл мочи, критерием для диагностики острого пиелонефрита является наличие не менее 10 4 кишечных палочек (или других патогенных энтеробактерий) в 1 мл свежевыпущенной мочи. Острый цистит диагностируется при наличии соответствующей клинической симптоматики, выделении не менее 10 лейкоцитов в 1 мкл мочи и обнаружении не менее 10 2 кишечных палочек (или других колиформных бактерий) в 1 мл мочи.
Штаммы Escherichia coli — пробиотики и компоненты лекарств

Специально подобранные штаммы эшерихии коли входят в состав лекарств: Хилак форте (штамм DSM 4087), Бификол (штамм М-17), Колибактерин (штамм М-17) и других.
Антибиотики, активные в отношении кишечной палочки
Антибактериальные средства (из имеющих описание в данном справочнике), активные в отношении кишечной палочки: амоксициллин, левофлоксацин, нифурател, нифуроксазид, рифаксимин, фуразолидон, ципрофлоксацин, норфлоксацин, офлаксацин, моксифлоксацин, доксициклин (не все штаммы).
Escherichia coli устойчива к клотримазолу.
E coli m17 что это
E. coli M-17 имеет долгую историю использования в качестве продуцента пробиотического препарата «Колибактерин сухой», на протяжении которой штамм неоднократно подвергался многочисленным исследованиям с целью определения способности к продукции колицинов и уровня антагонистической активности, антибиотикорезистентности, биохимической активности и т.д. Безвредность штамма была подтверждена эмпирическим путем. В начале использования данного штамма в качестве продуцента пробиотика важное диагностическое значение имел его серотип (О2:Н6), так как штамм периодически проводили через организм здоровых добровольцев для сохранения его антагонистических свойств [4].
Согласно требованиям современных нормативных документов производственные пробиотические штаммы должны быть изучены по множеству признаков, в том числе подтверждающих их безвредность, апатогенность и авирулентность [1; 2]. Существующие в настоящее время наукоемкие технологии позволяют провести анализ полного генома штаммов микроорганизмов и подтвердить их безвредность на генетическом уровне.
Целью нашей работы было углубленное исследование биологических свойств штамма E. coli М-17, использующегося для производства пробиотика «Колибактерин сухой» с использованием наукоемких методов – современных биохимических тест-систем, MALDI TOF масс-спектрометрии, полногеномного секвенирования и биоинформатического анализа данных.
Материалы и методы исследования. Восстановление лиофильно высушенного штамма проводили с использованием мясо-пептонного бульона (Nutrient Broth, HiMedia), подращённую культуру титровали в диапазоне разведений 10-1 – 10-7 и проводили высевы по 0,05 мл на среду Эндо (Питательная среда для выделения энтеробактерий – агар Эндо ГРМ, Оболенск), далее инкубировали при 37 °С 24 часа. Выросшие колонии микроорганизмов оценивали по морфологии, по 10 колоний каждого морфологического вида отбирали для следующего этапа исследования – масс-спектрометрии.
Масс-спектрометрический анализ осуществляли с помощью времяпролетного MALDI масс-спектрометра Autoflex (Bruker Daltonics, Германия), пробоподготовка суточных культур исследуемых микроорганизмов проводилась методом прямого нанесения по стандартному протоколу, представленному в руководстве пользователя. Идентификация, запись, обработка и анализ масс-спектров проводилась с помощью программы BioTyper RTC.
Остаток колонии засевали на мясо-пептонный бульон для наращивания биомассы и последующей биохимической идентификации. Для биохимической идентификации отбирали культуры, по результатам масс-спектрометрии имевшие значения Score 2,100 и более.
В работу по полногеномному секвенированию была отобрана культура E. coli M-17 с изученным профилем рибосомальных белков с максимально высоким Score, известной биохимической активностью. Геномную ДНК выделяли с использованием коммерческого набора QIAamp DNA Mini Kit (QIAGEN, Германия), подготовку библиотек производили с помощью набора TrueSeq (Illumina Inc, США), секвенирование выполняли на платформе MiSeq (Illumina). Аннотация генома производилась с помощью утилиты Prokka v. 1.11 [17] и геномного сервера RAST [16]. Для подробного изучения генома использовали специализированные программные продукты, доступные на сайте Центра геномной эпидемиологии: изучение CRISPR-региона проводили с использованием программы CrisprFinder [10], поиск детерминант антибиотикорезистентности и патогенности с использованием ResFinder 2.1 и PathogenFinder [9; 18]. Для поиска детерминант вирулентности применяли программу VirulenceFinder [11], для обнаружения интегрированных плазмид – PlasmidFinder 1.3. [8]. MLST типирование проводили с использованием программы MLST-1.8 Server [13], для установления серотипа использовали программу SerotypeFinder 1.1 [12].
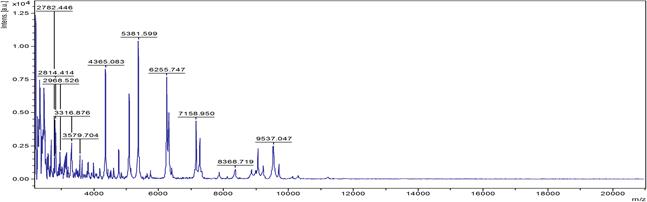
Результаты исследования и их обсуждение. Для идентификации методом масс-спектрометрии были выбраны характерные крупные малиновые колонии с металлическим блеском в S-форме. В результате идентификации микроорганизмов в автоматическом режиме получен ряд масс-спектров со Score от 2,05 до 2,56. Характерный масс-спектр представлен на рис. 1.
Рис. 1. MALDI масс-спектр штамма E. coli M-17 при использовании α-CHCA матрицы
Установлено, что масс-спектр штамма E. coli М-17 составляют 85 пиков, 62 из которых воспроизводимы. При анализе ряда полученных масс-спектров обнаружено, что для изучаемого штамма характерно наличие следующих масс ионизированных белков (m/z): 2329, 2569, 2940, 3168, 3638, 5340, 6243, 6255, 6276, 8875, 9713.
В результате исследования биохимических с помощью стандартных тест-систем ПБДЭ и СИБ, а также дополнительных тестов (ксилоза, рамноза, дульцит и тест на желатиназную активность) с использованием сред HiMedia выявлено, что данный штамм обладает способностью ферментировать сахарозу, мальтозу, сорбит, глюкозу, лактозу, арабинозу, маннит, ксилозу, рамнозу, образует индол, обладает β-галактозидазной активностью, утилизирует цитрат натрия с глюкозой, образует лизин- и орнитиндекарбоксилазу. Штамм неспособен разжижать желатин, утилизировать цитрат и малонат натрия, не обладает аргининдегидролазой, фенилаланиндезаминазой, не образует ацетилметилкарбинол, не ферментирует инозит, дульцит, не гидролизует мочевину, не образует сероводород. Именно такой биохимический профиль характерен для классического штамма E. coli M-17, предложенного Л.Г. Перетцем в 1930 году [4].
Далее было проведено полногеномное секвенирование генома штамма и установлены его основные характеристики (табл. 1).
Основные характеристики генома E. coli M-17
Избыточный бактериальный рост в кишечнике: патогенетические особенности и лечебные подходы
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
В желудочно–кишечном тракте человека обитает множество бактерий, которые, по сути, являются симбионтами своего «хозяина». Как это ни парадоксально звучит, организм «хозяина» так же нуждается в микробных обитателях, как и они в его поддержке.
Основная часть микроорганизмов поступает в просвет желудочно–кишечного тракта из ротоглотки и с пищей.
В составе нормальной микрофлоры желудочно–кишечного тракта выделено более 400 видов непатогенных аэробных и факультативно анаэробных бактерий.
Состав микрофлоры неодинаков на всем протяжении желудочно–кишечного тракта. В верхнем и среднем отделах тонкой кишки популяция микроорганизмов сравнительно небольшая (в начале тощей кишки их содержание не более 100 микроорганизмов на 1 мл содержимого) и включает преимущественно грамположительные факультативные аэробы, небольшое количество анаэробов, дрожжей и грибов.
По мере приближения к илеоцекальному клапану состав микролоры начинает все более походить на популяцию толстой кишки. В дистальном отделе подвздошной кишки содержание микробов составляет 10 5 –10 8 /г кишечного содержимого.
Наибольшее содержание микроорганизмов наблюдается в толстой кишке. Здесь их концентрация достигает 10 10 –10 11 и более на 1 г содержимого.
В толстой кишке обитает основная масса анаэробных микроорганизмов. «Главную популяцию» (около 70%) составляют анаэробы – бифидобактерии и бактероиды. В качестве «сопутствующей популяции» выступают лактобациллы, кишечная палочка, энтерококки.
Бактерии, населяющие просвет желудочно–кишечного тракта, выполняют ряд функций, имеющих весьма важное значение для организма «хозяина».
Микробная популяция играет важнейшую роль во внутрипросветном пищеварении, в частности, участвует в переваривании пищевых волокон (целлюлозы), ферментативном расщеплении белков, высокомолекулярных углеводов, жиров и в процессе метаболизма вырабатывает ряд полезных для организма веществ.
Главный представитель анаэробной кишечной микрофлоры – бифидобактерии – синтезируют аминокислоты, белки, витамины В1, В2, В6, В12, викасол, никотиновую и фолиевую кислоты. Выдвинуто предположение, что некоторые вещества, вырабатываемые бифидобактериями, обладают антиоксидантными свойствами и способствуют снижению риска заболеваемости раком толстой кишки.
Среди аэробных микроорганизмов важнейшая роль в метаболических процессах принадлежит кишечной палочке, обладающей большим спектром функциональных свойств. E.coli вырабатывает несколько витаминов (тиамин, рибофлавин, пиридоксин, витамины В12, К, никотиновую, фолиевую, пантотеновую кислоты), участвует в обмене холестерина, билирубина, холина, желчных и жирных кислот, и, опосредованно влияет на всасывание железа и кальция.
Образующиеся под влиянием микрофоры продукты метаболизма белка (индол, фенол, скатол) оказывают регулирующее воздействие на перистальтическую активность кишечника.
В последнее время интенсивно изучается роль кишечной микрофлоры в формировании иммунологической реактивности и иммунологической толерантности организма.
Представители нормальной кишечной микрофлоры вырабатывают вещества с антибактериальной активностью (такие как бактериокины и короткоцепочечные жирные кислоты, лактоферрин, лизоцим), которые предотвращают внедрение патогенных микроорганизмов и подавляют избыточное размножение условно–патогенной флоры. Кишечные палочки, энтерококки, бифидобактерии и лактобациллы обладают наиболее выраженными антагонистическими свойствами в отношении патогенных штаммов.
Продуктами метаболизма молочнокислых бактерий (бифидобактерий, лактобацилл) и бактероидов являются молочная, уксусная, янтарная, муравьиная кислоты. Это обеспечивает поддержание показателя рН внутрикишечного содержимого на уровне 4,0–3,8, благодаря чему тормозится рост и размножение патогенных и гнилостных микроорганизмов в ЖКТ.
Ограниченные первоначально представления о «местной» защитной роли кишечных микроорганизмов существенно расширились за последние годы. Микробиологами и иммунологами подчеркивается важность непрерывного «общения» оганизма «хозяина» со своими симбионтами. Путем контакта с микробной популяцией через слизистую оболочку и постоянного проникновения небольшого количества бактерий, их антигенов и продуктов метаболизма в кровоток поддерживается необходимая напряженность иммунитета, в том числе, вероятно, поддерживается «тонус» противоопухолевой защиты.
Микрофлора желудочно–кишечного тракта активно участвует в химических превращениях многих веществ эндогенного и экзогенного происхождения, в частности, лекарств. В процессе кишечно–печеночной циркуляции вещества, поступающие из просвета кишечника в печень, подвергаются конъюгации с глюкуронатом, сульфатом и другими молекулярными остатками, и многие из них затем вновь выделяются с желчью. В просвете кишечника под действием ферментов кишечной микрофлоры они подвергаются деконъюгации и другим изменениям, после чего вновь всасываются и возвращаются в печень по воротной вене.
Механизмы поддержания нормального «микробного равновесия» в просвете желудочно–кишечного тракта и сдерживания микробного роста включают защитные факторы слизистой оболочки (бактерицидные свойства соляной кислоты желудка, выработка слизи и антител, главным образом, принадлежащих к классам иммуноглобулинов А и М), а также нормальную перистальтическую активность кишечника, в процессе которой часть бактерий регулярно удаляется во внешнюю среду. Целостность щеточной каёмки энтероцитов также выступает как важное звено защиты, поскольку выполняет роль «бактериального фильтра», препятствующего контакту бактерий с клетками слизистой оболочки.
Количественный и качественный состав кишечной микрофлоры может изменяться под воздействием различных факторов эндогенного или экзогенного происхождения. Однако это изменение следует рассматривать как вторичное по отношению к первопричинному фактору.
Избыточный бактериальный рост в кишечнике (в англоязычной литературе – bacterial overgrowth) – обусловлен нарушением качественного и количественного состава микробного биоценоза кишечника, размножением условно–патогенных бактерий в количестве, не свойственном здоровому человеку. Нельзя забывать, что избыточный бактериальный рост в кишечнике и связанные с ним клинические проявления представляет собой не самостоятельную нозологическую форму, а синдром.
Устаревший термин «дисбактериоз» использовать не совсем корректно, поскольку это название не в полной мере отражает сущность развивающихся нарушений.
С точки зрения микробиологии, избыточный бактериальный рост проявляется значительным уменьшением количества анаэробных представителей (особенно бифидобактерий), увеличением общего количества функционально неполноценных кишечных палочек («лактозо»–, «маннит»–, «индолоотрицательных»), содержанием гемолитических форм E.coli, созданием условий для размножения кандид.
Фоном для развития синдрома избыточного бактериального роста служат различные состояния, сопровождающиеся нарушением переваривания пищи, пассажа внутрипросветного содержимого; изменением иммунологической реактивности организма, ятрогенные воздействия на микрофлору кишечника.
При различных состояниях, сопровождающихся нарушением переваривания и всасывания пищи (врожденный дефицит ферментов, панкреатит, глютеновая энтеропатия, энтериты), невсосавшиеся питательные вещества служат питательной средой для избыточного размножения бактерий.
Нарушение пассажа внутрипросветного содержимого наблюдается при формировании межкишечных свищей, оперативных вмешательствах с формированием «слепых петель» кишечника, развитии дивертикулов, нарушении двигательной активности кишечника (запоры или поносы), кишечной непроходимости (обструктивной или паралитической). В этих условиях также создаются благоприятные условия для нарушения «бактериального равновесия».
При анацидных состояниях и иммунодефицитах утрачивается регулирующее влияние со стороны организма на поддержание состава кишечной микрофлоры.
Применение антибиотиков, кортикостероидов, цитостатиков, особенно у ослабленных и пожилых пациентов, сопровождаются вмешательством во взаимоотношения микрофлоры и макроорганизма.
Пожалуй, в качестве единственной самостоятельной нозологической формы избыточного бактериального роста в кишечнике выступает псевдомембранозный колит, который обусловлен избыточным размножением Clostridium difficile – облигатно–анаэробной грамположительной спорообразующей бактерии, обладающей природной устойчивостью к большинству широко применяемых антибиотиков. Популяция C.difficile в составе нормальной микрофлоры кишечника составляет примерно 0,01–0,001%; она существенно возрастает (до 15–40%) при приеме антибиотиков, угнетающих рост штаммов кишечной флоры, которые в норме подавляют жизнедеятельность C.difficile (в первую очередь, клиндамицина, ампициллина, цефалоспоринов).
Синдром избыточного бактериального роста характеризуется различными клиническими проявлениями, «наслаивающимися» на проявления основного заболевания.
Избыточное размножение бактерий в тонкой кишке является дополнительным фактором, поддерживающим воспаление слизистой оболочки, снижающим продукцию ферментов (в наибольшей степени – лактазы) и усугубляющим нарушение переваривания и всасывания. Эти изменения обусловливают развитие таких симптомов, как коликообразные боли в околопупочной области, метеоризм, диарея, похудание.
При преимущественном вовлечении в процесс толстой кишки пациенты предъявляют жалобы на неоформленный стул, метеоризм, ноющие боли в животе.
Выраженные нарушения равновесия в составе кишечной микрофлоры могут сопровождаться признаками гиповитаминоза В12, В1, В2, В3 (РР). У пациента выявляются трещины в углах рта, глоссит, хейлит, поражения кожи (дерматит, нейродермит), железо– и В12–дефицитная анемия. Поскольку микрофлора кишечника служит важным источником викасола, могут наблюдаться нарушения свертывания крови. В ряде случаев в результате нарушения обмена желчных кислот развиваются симптомы гипокальциемии (онемение губ, пальцев, остеопороз). Ряд авторов связывает нарушения обмена холестерина с нарушением «микробного баланса» желудочно–кишечного тракта.
Диагностика синдрома избыточного бактериального роста подразумевает анализ картины основного заболевания, с выявлением возможной причины нарушения микробного биоценоза кишечника. Проводится дополнительное обследование, которое может включать эндоскопическое, рентгенологическое исследование кишечника для выявления нарушений анатомического строения, оценки перистальтики желудочно–кишечного тракта; биопсию тонкой кишки – для установления диагноза энтерита, энтеропатии, диагностики ферментопатий (к сожалению, возможности проведения этого исследования в нашей стране ограничены) и др. Мало доступными на сегодняшний день, но точными методами диагностики избыточного бактериального роста являются аспирация содержимого тонкой кишки с немедленным посевом аспирата на питательную среду, а также неинвазивный дыхательный водородный тест с лактулозой. Посев кала, ранее использовавшийся в нашей стране как метод оценки микробного биоценоза кишечника, признан неинформативным, поскольку даже при максимальном приближении к правилам проведения микробиологических исследований может дать представление лишь о микробном составе дистального отдела толстой кишки.
Перед тем как непосредственно приступить к лечению синдрома избыточного бактериального роста, необходимо определить причину развития нарушений микробного биоценоза и, по возможности, устранить влияние данного фактора. Например, назначить пациенту противовоспалительную, заместительную ферментную терапию, использовать возможности по нормализации перистальтической активности кишечника.
Изменение характера питания позволяет воздействовать на микрофлору физиологическим путем. Однако диетические предписания необходимо давать с учетом основного заболевания. В любом случае, при избыточном бактериальном росте в кишечнике показано ограничение потребления легкоусвояемых углеводов и исключение потребления молока (особенно пресного). При отсутствии противопоказаний целесообразно потребление овощей, фруктов и ягод, обладающих бактерицидным действием (редька, редис, лук, чеснок, хрен, морковь, малина, клубника, земляника, черника, абрикосы, яблоки, черноплодная рябина, сок граната, гвоздика, корица, лавровый лист).
Устаревший подход «санировать – и вновь заселить кишечник» не соответствует современным представлениям о патогенезе избыточного бактериального роста.
Однако при тяжелых формах избыточного бактериального роста в кишечнике показана антибактериальная терапия (назначение метронидазола по 400 мг 3 раза в день в течение недели; при неэффективности метронидазола к лечению целесообразно добавить тетрациклин по 250 мг 4 раза в день в течение 2 недель). Антибиотики резерва – ципрофлоксацин (по 500 мг 2 раза в день) и ванкомицин (по 125 мг 4 раза в день). Лечение псевдомембранозного колита проводится по определенным схемам и не рассматривается в данной статье вследствие обособленности этого заболевания.
В ряде случаев для подавления условно-патогенных микроорганизмов используются бактериофаги (стафилококковый и коли–протейный) по 50 мл 2 раза в день за час до еды в течение 3–4 дней, проводится 2–3 курса с 3–дневным перерывом.
Не менее важным и, зачастую, основным направлением лечения является воссоздание условий, благоприятных для восстановления нормальной микрофлоры. Лекарственные препараты, обладающие подобными свойствами, носят название пробиотиков.
Некоторое время назад в качестве пробиотиков особенно широко использовались биологические препараты для перорального приема, содержащие в своем составе бифидобактерии, лактобациллы, кишечные палочки с полезными сойствами. Необходимо учитывать, что микробы, вводимые в составе лекарственных препаратов, сами по себе надолго не приживаются в кишечнике и элиминируются спустя 2–3 недели. Основой лечебного действия подобных препаратов является их способность временно поддерживать ферментативную активность и защитные свойства (колициногенность) собственной микрофлоры кишечника. Ниже охарактеризованы некоторые из наиболее известных препаратов.
«Колибактерин» содержит взвесь живых бактерий штамма E.coli M–17, обладающего антагонизмом по отношению к условно–патогенной и патогенной микрофлоре. Назначают по 6–10 доз в 1–2 приема за 40 мин до еды в течение 3–4 недель.
«Бифидумбактерин» содержит штамм бифидобактерий, устойчивых к антибиотикам. Назначают по 5–10 доз в сутки в 1–2 приема в течение 2–3 недель. «Бифидумбактерин» наиболее благоприятно действует при наличии у пациента запоров.
«Бификол» – сочетание совместно выращенных культур E.coli M–17 и бифидумбактерий. В сутки назначают 6–10 доз.
«Лактобактерин» приготовлен из молочнокислых бактерий. Микробы, входящие в состав этого препарата характеризуются высокой устойчивостью к антибиотикам. Лактобактерии эффетивно угнетают рост протея, гемолитических штаммов стафилококка и поддерживают рост популяции E.coli. Применяют по 3–6 доз в сутки. Лечебной и профилактической активностью обладают также молочные продукты, содержащие культуру молочнокислых бактерий, аналогичную входящей в состав «Лактобактерина» – ацидофильный дрожжевой творог и ацидофильное молоко, а также биомасса ацидофильных лактобактерий, носящая название «Наринэ».
В настоящее время широко применяется препарат «Энтерол», содержащий в составе лиофилизированные лечебные дрожжи Saccharomyces boulardii, обладающие природной устойчивостью к антибиотикам. S. boulardii не колонизируют пищеварительный тракт и элиминируются с калом в течение нескольких дней после завершения курса терапии. Они вырабатывают белки, препятствующие связыванию патогенных микроорганизмов и их токсинов со слизистой оболочкой кишечника; стимулируют защитные свойства слизистой оболочки.
Благоприятные условия для размножения бифидобактерий создает дисахарид лактулоза, обладающий также слабительными и аммонийсвязывающими свойствами. Он служит питательной средой для размножения молочнокислых бактерий и источником выработки ими молочной кислоты, снижающей рН кишечного содержимого. К существенным недостаткам лактулозы относятся нередко развивающиеся вздутие живота и диарея с потерей электролитов (поэтому назначение лактулозы предпочтительно пациентам, страдающим запором). Лактулоза противопоказана при галактоземии. Доза сиропа лактулозы для взрослых варьирует от 15 до 45 мл в сутки (в 2–3 приема).
Существует и другой, совершенно оригинальный, подход к нормализации среды в просвете кишечника, что способствует восстановлению нормальной популяции его «обитателей». Данное направление фармакологической коррекции избыточного бактериального роста представлено препаратом «Хилак–форте».
Препарат «Хилак–форте» представляет собой стерильный концентрат биологически активных веществ, вырабатываемых нормальной микрофлорой кишечника (как грамположительной, так и грамотрицательной). Среди них – молочная кислота и короткоцепочечные летучие жирные кислоты (обладающие антибактериальными свойствами в отношении условно–патогенной и патогенной флоры), молочно–солевой буфер, лактоза, аминокислоты. Всего в одной капле концентрата содержатся продукты биосинтеза 100 миллиардов кишечных бактерий.
«Хилак–форте» позволяет создать благоприятные условия для размножения молочно–кислых бактерий (за счет снижения рН, восстановления водно–электролитного баланса в просвете кишечника и подавления конкурентной флоры). Интересно, что действие препарата не ограничивается влиянием на бактериальный состав, отмечено, что «Хилак–форте» также стимулирует регенерацию эпителия слизистой оболочки кишечника.
«Хилак–форте» показан при самых разнообразных состояниях, сопровождающихся нарушением «микробного баланса»: нарушениях мальдигестии и мальабсорбции различного происхождения, нарушении перистальтической активности кишечника, в периоде выздоровления после острых инфекционных энетроколитов и т.д. Назначение «Хилак–форте» целесообразно во время лечения антибиотиками и некоторое время после их отмены для профилактики нарушений в составе кишечной микрофлоры.
«Хилак–форте» характеризуется высокой эффективностью и хорошей переносимостью. Противопоказаний к назначению препарата и побочных действий не выявлено. его можно назначать не только взрослым, но и детям грудного возраста.
«Хилак–форте» принимают внутрь до или во время еды, разбавив небольшим количеством жидкости (не щелочной реакции!).
Начальная доза для взрослых составляет по 40–60 капель 3 раза в день; для детей – по 20–40 капель 3 раза в день; для детей грудного возраста – по 15–30 капель 3 раза в день. По мере клинического улучшения доза может быть уменьшена наполовину.
«Хилак–форте» нельзя принимать в одно время суток с антацидными препаратами и адсорбентами, поскольку антациды нейтрализуют, а адсорбенты – снижают биодоступность кислот, входящих в состав препарата.
Диагностируя у пациента синдром избыточного бактериального роста, необходимо понимать главное в коррекции этого состояния – не агрессивно вмешиваться в микробный биценоз, а «протянуть руку помощи» микробам, обеспечивающим наше здоровье и благополучие.
1. Вудли М., Уэлан А., ред. Терапевтический справочник Вашингтонского университета. Пер. с англ. – М.: Практика, 1995г.
2. Гребенев А.Л., Мягкова Л.П. Болезни кишечника. – М.: Медицина, 1994 г.
3. Денисов И.Н., Кулаков В.И., Хаитов Р.М., гл. ред. Клинические рекомендации для практикующих врачей, основанные на доказательной медицине. – М.: ГЭОТАР–МЕД, 2001г.
4. Ивашкин В.Т., Комаров Ф.И., Рапопорт С.И., ред. Краткое руководство по гастроэнтерологии. – М.: Издательский дом «М–Вести», 2001 г.
5. Котельников Г.П., Яковлев О.Г., ред. Практическая гериатрия: Руководство для врачей. – Самара: Самарский Дом печати, 1995г.