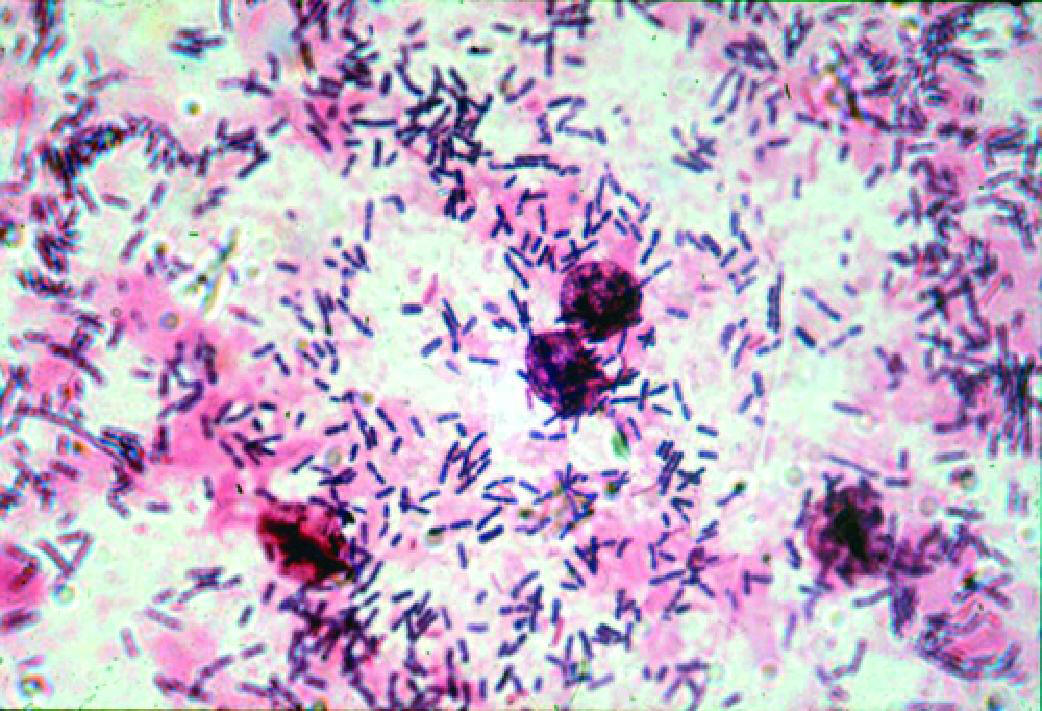
Escherichia coli 10 7 кое мл что это значит в мазке
Кишечная палочка в мазке
У некоторых женщин и мужчин определяется кишечная палочка в мазке.
Поговорим о том, насколько опасен этот микроорганизм, и что делать при его обнаружении.
Что такое эшерихия коли?
Эшерихия коли (кишечная палочка) – это бактерия из семейства энтеробактерий.
Она в норме обитает в организме человека, в основном в кишечнике.
Так как выход из него (анальное отверстие) находится совсем рядом с мочеполовыми органами, бактерии могут колонизировать их.
Обычно это не сопровождается симптомами.
Но иногда эшерихия коли способна вызывать воспалительные процессы:
При наличии эшерихий во влагалище или уретре они могут определяться в мазке.
Кишечная палочка в мазке: причины
Причиной обнаружения кишечной палочки в мазке является чрезмерное увеличение количества этого микроорганизма в структурах мочеполовой системы.
В норме их должно быть очень мало.
В малых концентрациях они в мазке не обнаруживаются.
Причины, по которой может определяться кишечная палочка в мазке у женщин:
Причины, по которой может определяться кишечная палочка в мазке у мужчин:
Кишечная палочка в мазке у женщин: симптомы
В большинстве случаев кишечная палочка в мазке симптомы не вызывает.
Она становится случайной находкой при плановом обследовании женщины.
Но при избыточном росте кишечной палочки могут воспаляться органы мочевыделительной или половой системы.
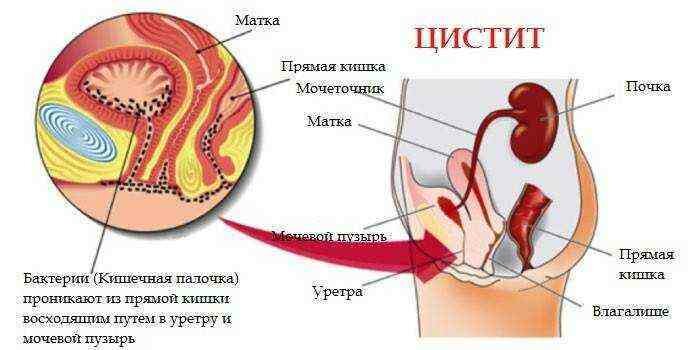
Эта бактерия – самый частый возбудитель цистита у женщин.
В таком случае она определяется в моче и уретре.
Симптомы острого цистита:
Во влагалище кишечная палочка может вызывать вагинит.
Он проявляется такими симптомами:
Может наблюдаться выделение крови из влагалища после полового акта.
Вследствие воспалительного процесса слизистая оболочка разрыхляется и легко травмируется.
Кишечная палочка может стать возбудителем неспецифических воспалительных процессов в малом тазу.
Эти заболевания проявляются:
В самых тяжелых случаях такие патологии сопровождаются гнойным процессом и требуют хирургического лечения.
Кроме того, кишечная палочка – это самый частый возбудитель пиелонефрита.
Пиелонефрит – это воспаление канальцевой системы почки.
Он несет угрозу для жизни женщины и иногда требует хирургического лечения.
Кишечная палочка в мазке у мужчин: симптомы
У мужчин кишечная палочка чаще всего вызывает уретрит.
У мужчин уретра имеют большую длину, чем у женщин.
Поэтому на мочевой пузырь инфекция обычно не распространяется.
Но в редких случаях это возможно.
Симптомы цистита у мужчин такие же, как у женщин.
Кишечная палочка в мазке рассказывает подполковник медицинской службы, врач Ленкин Сергей Геннадьевич
Содержание данной статьи проверено и подтверждено на соответствие медицинским
стандартам врачем дерматовенерологом, урологом, к.м.н.
Ленкиным Сергеем Геннадьевичем
| Наименование | Срок | Цена |
|---|---|---|
| Прием уролога | 900.00 руб. | |
| Посев на флору с определением чувствительности к основному спектру антибиотиков | 7 д. | 940.00 руб. |
Что делать, если нашли кишечную палочку в мазке?
Если обнаружена кишечная палочка в мазке, врач может назначить дополнительные исследования.
Это может быть ПЦР или бак посев мазка на кишечную палочку.
Данные методы диагностики позволяют определить концентрацию возбудителя в клиническом материале.
Если высеялась кишечная палочка в мазке, норма её составляет до 10 4 КОЕ/мл.
В зависимости от клинической ситуации, врач может назначить и другие исследования:
Кишечная палочка в мазке у женщин: лечение
При большой концентрации бактерий в мазке лечить кишечную палочку приходится антибактериальными препаратами.
Они также требуются в случае наличия клинической симптоматики воспалительного процесса, даже если концентрация микроорганизмов в пределах нормы.
Женщинам могут назначаться:
Антибиотики могут назначаться разные.
Препарат врач выбирает на основании антибиотикограммы.
Она составляется в процессе культуральной диагностики инфекции.
После бак посева определяется чувствительность кишечной палочки к разным антибиотикам.
Женщине назначаются препараты, к которым эшерихия наиболее чувствительна.
Обычно это цефалоспорины третьего поколения или защищенные полусинтетические пенициллины.
Могут применяться и фторхинолоны.
Они наиболее предпочтительны при поражении мочевыделительной системы (цистит, пиелонефрит).
Прием таблеток внутрь может дополняться использованием препаратов локального действия.
Им отдают предпочтение при вагините.
Часто воспалительный процесс в половых органах вызывают одновременно несколько возбудителей.
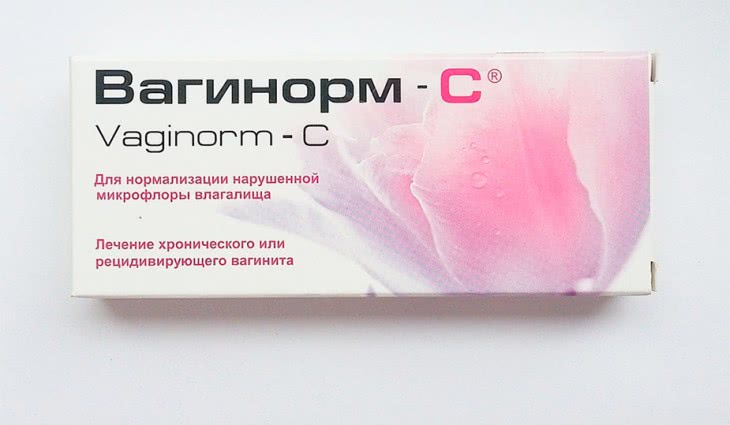
Поэтому весьма популярными лекарствами среди врачей и пациентов остаются свечи или вагинальные таблетки, которые содержат в составе одновременно:
Кроме антибактериальной терапии, лечение кишечной палочки в мазке может включать:
Кишечная палочка в мазке при беременности
Выявление кишечной палочке в мазке при беременности не всегда требует лечения.
Необходимость и целесообразность проведения терапии определяется врачом-гинекологом.
Если риск, который несет в себе кишечная палочка, превышает риск назначения антибиотиков, то лечение проводится.
Оно позволяет предотвратить осложнения (распространение инфекции) и инфицирование плода во время родов.
Выраженный воспалительный процесс непосредственно перед родоразрешением может стать показанием к проведению кесарева сечения.
Если у вас обнаружена кишечная палочка в мазке, обращайтесь в нашу клинику.
Опытный врач проведет расшифровку анализов и назначит лечение.
При выявлении кишечной палочки в мазке обращайтесь к автору этой статьи – венерологу в Москве с 15 летним опытом работы.
Кишечная палочка — Escherichia coli (эшерихия коли). Две стороны одной медали
Кишечная палочка (Escherichia coli, E. coli, эшерихия коли)
Наряду с большим количеством полезных для организма сероваров Escherichia coli существует около полутора сотен патогенных, которые могут вызывать заболевания. Мы говорим, что они «могут вызывать», поскольку их вредное влияние нейтрализуется иммунной системой и микрофлорой, если эти патогенные эшерихии находятся в кишечнике в небольших количествах. Человек может быть носителем патогенных эшерихий и даже не подозревать об этом, «награждая» инфекцией окружающих. Поэтому у нас принято перед приемом на работу и после приема, с определенной периодичностью, проверять работников отдельных коммунальных сфер на патогенные энтеробактерии, в том числе и на кишечную палочку. Делается это в целях профилактики вспышек эшерихиозов.
Патогенные E. coli подразделяют на 4 группы: энтеропатогенные (английское сокращение –EPEC), энетротоксигенные (ETEC), энтероинвазивные (EIEC) и энтерогеморрагические (EHECилиVTEC).
Энтеротоксигенные эшерихии колонизируют тонкий кишечник и вызывают холероподобные заболевания. Носительство после выздоровления не формируется. Чаще всего встречаются в Индии. У нас – в южных регионах. Источники заражения – пища и вода. Пик заболеваемости приходится на детей от года до трех лет. Заражающая доза – 10 8 — 10 9 бактерий, или иначе — колониеобразующих единиц (КОЕ), в 1г кала.

Энтероинвазивные Escherichia coli, такие как О136, О159, О167, О28, О29, О112, О124 : Н30, О124 : Н32, имеют такой же фактор патогенности как у шигелл — бактерий, вызывающих дизентерию. Поэтому симптоматика заболевания напоминает дизентерию. У больного наблюдается непродолжительная водянистая диарея, которая к концу первых суток заканчивается «дизентерийным плевком» — комком слизи. В отличие от предыдущей группы, заболевание, вызванное энтероинвазивными E. coli характеризуется очень высокой температурой и продолжительностью (острый период – до двух недель). Встречаются EIEC повсеместно, заражение происходит также в основном через пищу и воду. Колонизируют толстый кишечник. Чаще всего болеют дети до 2-ух лет. Заражающая доза – 10 5 КОЕ в 1г кала.
Энтеропатогенные эшерихии вызывают инфекции, по симптоматике заболевания сходные с сальмонеллезом. Заражающая концентрация – от 10 5 до 10 10 КОЕ/г. Дети чаще всего получают внутрибольничные штаммы EPEC, либо заражаются контактно-бытовым путем (полотенца, постельное белье). Взрослые приобретают энтеропатогенных эшерихий через продукты. В Соединенных Штатах Америки энтеропатогенные E. Coli стоят на первом месте среди кишечных заболеваний детей. Симптомы: водянистая диарея, тошнота, рвота. Заболевание длительное – до 15 дней. Может формироваться носительство после выздоровления.
Самая опасная, но, к счастью, наиболее редкая группа – энтерогеморрагические или веротоксические эшерихии. К ним относится пока одна серогруппа – О157:Н7. Открыты они были впервые в 80-ых годах и первая вспышка произошла в США (в доме престарелых, через плохо прожаренные гамбургеры). Потом – в Японии. Причем в одном офисном здании заболели практически 1000 человек (ели каракатиц, которые были выловлены в прибрежной зоне). На 30 лет человечество забыло об этом кошмаре, но в 2011 году Европу всколыхнула весть об эпидемии энтерогеморрагической Escherichia coli. Ходят слухи, что происхождение EHEC имеет искусственный характер (бакоружие или неудачные опыты по генной модификации), но это – всего лишь предположение. Фактор патогенности – шигеллоподобный токсин, который превосходит по токсичности шигеллезный в сотни раз. «Ареал обитания» — толстый кишечник. Клиническая картина при заболевании следующая: боли в животе, холероподобная диарея, которая в течение нескольких часов переходит в кровавый понос. Если нет острой почечной недостаточности, в комплексе с низким содержанием тромбоцитов и анемией (все это называется гемолитико-уремическим синдромом, или ГУС), то в течение одной — двух недель больного лечат детоксическими препаратами. Лечение антибиотиками категорически не рекомендуется!
Профилактика всех эшерихиозов: соблюдение гигиенических норм, таких как мытье рук, овощей и фруктов, причем желательно их термически обрабатывать (хотя бы ошпаривать); не есть из одной посуды с несколькими людьми; иметь личные предметы гигиены. Желательно также периодически принимать пробиотики (с предварительной консультацией у врача-гастроэнтеролога) для укрепления защитных сил организма.
Вагиниты, вызванные условно-патогенной микрофлорой: рекомендации для практикующих врачей
Сведения об авторе:
Пустотина Ольга Анатольевна, доктор медицинских наук, профессор кафедры акушерства, гинекологии и репродуктивной медицины ФПК МР РУДН Адрес: 117198 Москва, ул. Миклухо-Маклая д. 6, телефон 8 (495) 787-38-27, email: rudn@rudn.ru Pustotina Olga Anatolievna, Doctor of Medicine, Professor of The department of Obstetrics, Gynecology and Reproductive Health, Peoples’ Friendship University of Russia. Address: 117198 Moscow, Mikluho-Maklaya str, 6. Phone 8(495)7873827
Нормальная микрофлора женских половых органов
Таким образом, во влагалище здоровых женщин репродуктивного возраста общая численность бактерий составляет 105-106 КОЕ/мл выделений, 95% которых представлены лактобактериями и только 5% формируется представителями других видов аэробных и анаэробных УПМ.
Вагиниты, вызванные УПМ
Вагиниты бывают воспалительного и невоспалительного характера. Воспалительные вагиниты в зависимости от вида возбудителя разделяют на неспецифические и специфические. К специфическим относятся трихомонадный, хламидийный, гонококковый и грибковый вагинит (вагинальный кандидоз), при обнаружении любых других УПМ вагинит является неспецифическим. Невоспалительный вагинит называется бактериальным вагинозом. Бактериальный ваги- ноз, неспецифический вагинит и вагинальный кандидоз объединяют вагиниты, вызванные УПМ.
Бактериальный вагиноз не относится к инфекциям, передаваемым половым путем (ИППП), но связан с сексуальной активностью женщины и может вызывать симптомы уретрита у мужчин. Происходящие во влагалищном биотопе изменения облегчают восходящее инфицирование ИППП: гонококками, хламидиями, трихо- монадами, ВИЧ-инфекцией и др. Кроме того, накапливаясь в большом количестве, УПМ проникают в полость матки, вызывая хроническую воспалительную реакцию, приводя к бесплодию, невынашиванию беременности и снижению эффективности программ ЭКО [7, 8].
Вагинальный кандидоз-это воспаление слизистой оболочки влагалища, вызванное дрожжевыми грибами рода СапсНс1а, которое встречается у 5-10% женщин репродуктивного периода. Развитие кандидоза в основном расценивают как вторичную эндогенную инфекцию, резервуаром которой является желудочно-кишечный тракт. Основными причинами, способствующими проникновению грибов из аногенитальной области во влагалище и их интенсивному размножению, является прием антибиотиков, глюкокортикоидов, потребление пищи с большим количеством углеводов. Предрасполагающими к заболеванию факторами служат ожирение, сахарный диабет и нарушение правил личной гигиены 9.
Факторы риска вагинитов, вызванных УПМ
Устойчивость экосистемы влагалища определяется факторами эндогенного и экзогенного происхождения. К развитию дисбиотических процессов в вагинальном микроценозе наиболее часто приводят: стресс, лечение антибиотиками, гормональная терапия, эндокринные и аллергические заболевания, снижение иммунной защиты организма, хронические запоры, инфекция мочевых путей. Уменьшение доли лактобацилл и повышение рН в содержимом влагалища происходит при повреждениях эпителиального покрова в результате полового акта, трещин, расчесов, при чрезмерной гигиене наружных половых органов. Нередко женщины при появлении неприятного запаха из половых путей прибегают к спринцеванию. Спринцевание не имеет ни гигиенического, ни профилактического, ни лечебного эффекта, а усугубляет дис- биоз и является фактором риска воспалительных заболеваний органов малого таза. Нарушение экосистемы влагалища может возникать после полового акта вследствие действия спермы с высоким уровнем рН, при частой смене половых партнеров, во время аногенитальных контактов, при использовании некоторых спермицидов. Длительное маточное кровотечение, инородные тела во влагалище (тампоны, пессарии, швы при истмико-цервикальной недостаточности) нередко также сопровождаются патологическими выделениями из половых путей [4, 6, 7, 9].
Клиника и диагностика вагинитов, вызванных УПМ
В основе вагинитов, вызванных УПМ, лежит уменьшение колоний лактобактерий, в результате которого изменяется рН вагинальной среды с кислой на щелочную и создаются условия для разрастания УПМ и их адгезии на освобождающийся эпителий слизистой оболочки влагалища.
Все происходящие изменения вагинального биотопа объединяются диагностическими критериями Амселя: появление специфических белей из половых путей, увеличение рН вагинального отделяемого, «рыбный» запах и наличие «ключевых клеток», представляющих собой эпителиальные клетки, порытые сплошным слоем различных микроорганизмов. По последним данным, даже наличие двух критериев из четырех позволяет установить нарушение вагинального микробиоценоза [5].
Кроме того, возбудители ИППП, такие как хламидии, трихомонады, гонококк и Мусор1а5та депйаПит, также могут колонизировать генитальный тракт, не нарушая нормальный рост лактобактерий и не изменяя рН влагалищного содержимого, в следствие чего до 90% случаев инфицирования ИППП протекают бессимптомно. Поэтому международные и отечественные эксперты 15 рекомендуют дополнительно к микроскопическому исследованию, обладающему низкими диагностическими возможностями в отношении облигатных патогенов, использовать метод полимеразной цепной реакции (ПЦР) для выявления антигенов хламидий, трихо- монад, гонококка и Мусор1а5та депИаИит в отделяемом половых путей.
Таким образом, окончательный диагноз вагинитов, вызванных УПМ, устанавливается при наличии у женщины жалоб на патологические вагинальных выделения и данных микроскопического исследования, и только после исключения ИППП методом ПЦР.
Лечение вагинитов, вызванных УПМ
Первый этап: Противомикробная терапия.
Препаратами выбора для лечения бактериального вагиноза являются производные нитроимидазола и линкозамиды, которые наиболее активно подавляют размножение анаэробной микрофлоры:
Исследования показали, что ни у одной из схем нет преимуществ в эффективности терапии [7], однако при местном использовании значительно реже возникают побочные эффекты [16].
Для лечения неспецифического вагинита рекомендуется использовать клин- дамицин (300 мг 2 р/сут 7 дней, вагинальный крем 2% 5г 7 дней, свечи 100 мг вагинально 3 дня). В сравнении с производными нитроимидазола (метронидазол, тинидазол, орнидазол), он имеет более широкий спектр действия, включающий не только анаэробные, но и аэробные грамположительные и грамотрицательные бактерии [3, 12, 13, 17, 18].
В последние годы опубликованы результаты крупных рандомизированных контролируемых исследований, показавших высокую эффективность лечения нарушений вагинального микробиоценоза еще двумя антибиотиками широкого спектра действия: рифаксимина (250 мг вагинально 5 сут) [19] и нифуратела (250 мг вагинально 10 сут) [20].
Следует отметить, что все выше представленные антибактериальные средства, обладая выраженной подавляющей активностью в отношении УПМ, не влияют на жизнедеятельность полезных молочно-кислых бактерий [15, 19, 20].
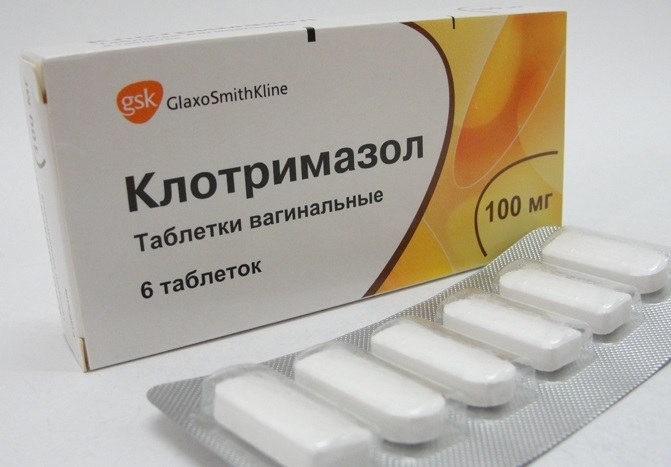
Терапия вагинального кандидоза проводится антимикотиками, среди которых препаратами первой линии являются азолы для интравагинального применения (имидазолы):
и азолы для приема внутрь (триазолы):
При остром неосложненном вагинальном кандидозе, вызванном СапсМс1а а1Ысап5, все препараты местного и системного действия одинаково эффективны.
В случаях рецидивирования процесса длительность и количество курсов увеличивается, при этом необходимо идентифицировать вид кандидозной инфекции и исключить возможные факторы риска [10,12-14].
Антисептики:
В настоящее время получено множество доказательств эффективности терапии вагинитов, вызванных УПМ, различными антисептическими средствами, такими как:
Все антисептики обладают широким неспецифическим спектром действия и подавляют рост аэробных и анаэробных микроорганизмов, а также грибов рода СапсМс1а, при этом не влияя на жизнедеятельность колонии лактобактерий [15].
Наибольшая доказательная база (уровень доказательности 1А) продемонстрирована для деквалиния хлорида (флуомизина). В крупномасштабных многоцентровых рандомизированных зарубежных [21 ] и отечественных исследованиях (БИОС-1/М) [18, 22, 24] с участием 321 и 640 пациенток, соответственно, деквалиния хлорид показал сопоставимую эффективность с действием клиндамицина при лечении вагинитов, вызванный УПМ, при значительно лучшей переносимости и меньшей частоте развития кандидоза. Кроме того, вагинальные таблетки деквалиния хлорида обладают хорошей всасываемостью и меньшей текучестью в сравнении с хлоргексидином, поэтому назначаются один раз в сутки, не вызывая аллергических и других побочных эффектов, характерных для повидон-йода, при этом более эффективно уменьшая количество «ключевых клеток» и ПЯЛ в вагинальном мазке [18, 22].
Второй этап: восстановление микробиоценоза
Одной из причин хронизации процесса являются бактериальные пленки, формирующие невосприимчивость микроорганизмов к действию антибактериальных и антисептических средств [23]. В результате уровень излеченности через 3 мес составляет 60-70% и еще ниже через 6 мес [6]. Значительное повышение эффективности терапии вагинитов происходит после проведения второго этапа, направленного на восстановление нормального микробиоценоза [22, 23, 25].
Наилучшие результаты продемонстрировало применение пробиотиков, содержащих живые лактобактерии. Они не только подавляют рост УПМ, ассоциированных с бактериальным вагинозом и неспецифическим вагинитом, за счет образования молочной кислоты, перекиси водорода и бактериоцинов, но и способны разрушать образованные ими биопленки, а также модулируют иммунный ответ и способствуют размножению колоний эндогенных лактобактерий [4, 12, 19, 24, 26, 27].
В качестве дополнительного фактора, улучшающего состояние вагинального микробиоценоза после антимикробной терапии, является применение вагинальных таблеток аскорбиновой кислоты. [28]. В то же время, применение исключительно пробиотиков и/или закисления вагинальной среды без предшествующей антимикробной терапии для лечения вагинитов, вызванных УПМ, недостаточно [7].
Лечение вагинитов, вызванных УПМ, у беременных
Нарушение вагинального микробиоценоза у беременных достоверно сопряжено с повышенным риском преждевременных родов, восходящего инфицирования плода и послеродовых гнойно-септических осложнений [1,8, 29-31 ].
Согласно зарубежным рекомендациям [12, 13] терапия бактериального вагино- за и неспецифического вагинита у беременных женщин не отличается от таковой у небеременных. Препаратом первой линии считается метронидазол для системного и местного применения. При осложненном течении беременности и высоком риске преждевременных родов более эффективным считается назначение клиндамицина, обладающего более широким спектром активности 32. При этом терапию нарушений биоценоза влагалища необходимо проводить с самых ранних сроков беременности [36].
В отечественных рекомендациях [14] антибиотики из группы нитроимидазола и линкозамидов противопоказаны в первом триместре, их применение возможно только местно после 12 нед беременности. Поэтому препаратами выбора для беременных являются вагинальные антисептики широкого спектра действия. Среди антисептических средств только у деквалиния хлорида безопасность применения на любом сроке беременности и в период грудного вскармливания подтверждена в масштабных многоцентровых исследованиях [18, 21, 22, 24]. Беременным с вагинальным кандидозом показано местное применение азолов (клотримазол, миконазол, терканозол и др.) 14. В случаях неэффективности терапии предусмотрено интравагинальное назначение полиенов (натамицин, нистатин) 15. В дальнейшем для профилактики рецидивов вагинальных выделений беременным назначаются пробиотики и средства, подкисляющие вагинальную среду [28, 36].
В заключение хочется отметить, что вагинальный микробиоценоз напрямую связан с состоянием здоровья женщины. Любые нарушения гомеостаза могут сопровождаться патологическими выделениями из половых путей, которые нередко бывают кратковременными, и после нормализации общего состояния самостоятельно проходят. В случаях рецидивирования процесса основной задачей врача является не поиск и идентификация возможных возбудителей, которых при вагинитах, вызванных УПМ, как правило множество, а выяснение причин, приведших к длительному течению заболевания. Для постановки правильного диагноза достаточно простой микроскопии вагинального мазка и метода ПЦР для исключения строгих патогенов. При рецидивирующих патологических вагинальных выделениях необходим также тщательный сбор анамнеза для выявления всех возможных факторов риска, только после устранения которых достигается полноценное восстановление вагинального микробиоценоза.
Список использованной литературы
1. Гуртовой Б.Л., Кулаков В.И., Воропаева С.Д. Применение антибиотиков в акушерстве и гинекологии. – М.: Триада-Х, 2004. – 176с.
2. Sweet RL, Gibbs RS. Infectious diseases of the female genital tract. – 5th ed. Lippincott Williams Wilkins, 2009. 469p.
4. Радзинский В.Е. Бактериальный вагиноз. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Издат журнала StatusPraesens, 2014. – С.249-280.
5. Mittal V, Jain A, Pradeep Y. Development of modified diagnostic criteria for bacterial vaginosis at peripheral health centres in developing countries/ J Infect Dev Ctries. 2012; 6(5): 373-377.
6. Verstraelen H, Verhelst R. Bacterial vaginosis: an update on diagnosis and treatment/ Expert Rev Anti Infect Ther. 2009;7:1109–1124.
7. Donders GG, Zodzika J, Rezeberga D. Treatment of bacterial vaginosis: what we have and what we miss/ Expert Opin Pharmacother. 2014;15(5): 645-657.
8. Leitich H, Bodner-Adler B, Brunbauer M. et al. Bacterial vaginosis as a risk factor for preterm delivery: a meta-analysis/ Am J Obstet Gynecol. 2003;189: 139–147.
9. Filler SG. Insights from human studies into the host defense against candidiasis/ Cytokine. 2012; 58(1): 129-132.
10. Байрамова Г.Р. Рецидивирующий вульвовагинальный кандидоз: автореф. дис. докт.мед.наук.– М., 2013.
11. Роговская С.И., Липова Е.В., Яковлева А.Б. Вульвовагинальные микозы. В кн. Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция: руководство для практикующих врачей / Под ред. С.И. Роговской, Е.В. Липовой. – М.: Изд-во журнала StatusPraesens, 2014. – С.281-308.
12. CDC. Sexually Transmitted Diseases Treatment Guidelines 2010. http://www.cdc.gov/std/treatment/2010/pid.htm
13. Sherrard J, Donders G, White D. European (IUSTI/WHO) Guideline on the management of vaginal discharge in women reproductive age. 2011.
14. Клинические рекомендации РОАГ. Акушерство и гинекология. – 4-е изд./ под ред. В.Н. Серова, Г.Т. Сухих. – М.: ГЭОТАР-Медиа, 2014. – 1024с.
15. Профилактика, диагностика и лечение инфекций, передаваемых половым путем: рук-во для дерматовенерологов, акушеров-гинекологов, урологов и семейных врачей. – М.:Институт здоровья семьи, 2008.
16. Mikamo H, Kawazoe K, Izumi K, et al. Comparative study on vaginal or oral treatment of bacterial vaginosis / Chemotherapy. 1997; 43:60-68.
17. Практическое руководство по антиинфекционной химиотерапии// Под ред. Л.С. Страчунского, Ю.А. Белоусова, С.Н. Козлова. – М., 2007. – 462с.
18. Подзолкова Н.М., Никитина Т.И. Сравнительная оценка различных схем лечения больных с бактериальным вагинозом и неспецифическим вульвовагинитом // Рос вестник акуш гинекол, 2012.- №4. – С.75-81.
19. Donders GG, Guaschino S, Peters K, et al. A multicenter, double-blind, randomized, placebocontroled study of rifaximin for the treatment of bacterial vaginosis/ Int J Gynaecol Obstet. 2013; 120:131-136.
21. Weissenbacher ER, Donders G, Unzeitig V. et al. Fluomizin Study Group. A comparison of dequalinium chloride vaginal tablets (Fluomizin®) and clindamycin vaginal cream in the treatment of bacterial vaginosis: a single-blind, randomized clinical trial of efficacy and safety. Gynecol Obstet Invest.
2012; 73: 8–15.
23. Swidsinski A, Verstraelen H, Loening-Baucke V. et al. Presence of a polymicrobial endometrial biofilm in patients with bacterial vaginosis/ PLoS One. 2013;8:e53997.
25. McMillan A, et al. Disruption of urogenital biofilms by lactobacilli / Colloids Surf B Biointerfase,2011; 86(1): 58-64.
26. Larsson PG, Stray-Pedersen B, Ryttig KR, Larsen S. Human lactobacilli as supplementation of clindamycin to patients with bacterial vaginosis reduce the recurrence rate; a 6-month, double-blind, randomized, placebo-controlled study./ BMC Women Health, 2008;15(8):3.
27. Ya W, Reifer C, Miller L E. Efficacy of vaginal probiotic capsules for recurrent bacterial vaginosis: a double blind, randomized, placebo-controlled study. Am J Obstet Gynecol. 2010; 203:1200–1208.
28. Zodzika J, Rezerberga D, Donders G. et al. Impact of vaginal ascorbic acid on abnormal vaginal microflora / Arch Gynecol Obstet 2013; 288: 1039-1044.
29. Bothuyne-Queste E, et al. Is the bacterial vaginosis risk factor of prematurity? Study of a cohort of 1336 patients in the hospital of Arras/ J Gynecol Obstet Biol Reprod. 2012; 41(3): 262-270.
30. Pustotina OA, Bubnova NI, Yezhova LS. Pathogenesis of hydramnios and oligohydramnios in placental infection and neonatal prognosis /J mat-fetal&neonat med. 2008; 21(1): 267-271.
31. Pustotina OA. Urogenital infection in pregnant women: clinical signs and outcome /J Perinat Med, 2013; 41:135.
32. Simcox R, Sin WT, Seed PT, et al. Prophylactic antibiotics for the prevention of preterm birth in women at rick: a meta-analysis/ Aust N-Z J Obstet Gynaecol. 2007; 47: 368-377.
33. McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy/Cochr Database Syst Rev. 2007. N1.P.CD000262.
34. Lamont RF, Duncan SLB, Mandal D, et al. Intravaginal clindamycin to reduce preterm birth in women with abnormal genital tract flora/ Obstet Gynecol. 2003;101:516–522.